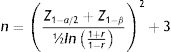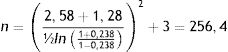La diabetes mellitus tipo 2 (DM2) se relaciona con afectaciones en la tasa de filtración glomerular (TFG) que es una de las principales causas de enfermedad renal crónica. El objetivo de este trabajo fue identificar los factores de riesgo relacionados con la TFG en adultos mexicanos con DM2, mediante un modelo de regresión lineal múltiple (RLM) validado, con énfasis en la adiposidad corporal, el control glucémico, el tiempo de evolución de la diabetes y otros factores de riesgo relevantes.
Materiales y métodosSe realizó un estudio transversal, analítico y observacional en 252 adultos con diagnóstico previo de DM2. Se determinó el índice de masa corporal (IMC) y la circunferencia de cintura (CC) y se colectó una muestra sanguínea en ayuno para la determinación de glucosa, creatinina y HbA1c. La TFG se calculó con la ecuación Cockcroft-Gault (C-G) ajustada por superficie corporal. Se realizaron cuatro modelos de RLM para determinar los factores relacionados con la TFG; se evaluó si estos modelos cumplían con los supuestos estadísticos de la RLM.
ResultadosLa edad promedio de los participantes fue de 60±12 años, 62,3% de ellos fueron mujeres. La TFG correlacionó de manera directa con el IMC y la CC. La edad y el tiempo de evolución de la diabetes se asociaron de manera inversa. El modelo 4 de la RLM reportó un coeficiente de determinación de 53,5% en donde las variables IMC (β=1,31), sexo masculino (β=-6,01), tiempo de evolución DM2 (β=-0,57), hipertensión arterial (HTA) (β=-6,53) y edad (β=-1,45) se relacionaron de manera simultánea y significativa con la TFG.
ConclusionesEl incremento de la edad, el sexo masculino, el mayor tiempo de evolución de la DM2 y la presencia HTA se asociaron con una disminución en la TFG; el IMC y la CC se relacionaron de manera directa. No se observó ningún efecto de los niveles de glucosa y HbA1c sobre la TFG.
Type 2 diabetes mellitus (T2DM) is related to glomerular filtration rate (GFR) impairment, which is one of the main causes of chronic kidney disease. The objective of this study was to identify the risk factors related to GFR in Mexican adults with T2DM, using a validated multiple linear regression model (MLRM), with emphasis in body adiposity, glycemic control, duration of the diabetes and other relevant risk factors.
Materials and methodsA cross-sectional, analytical, and observational study was carried out in 252 adults with a previous diagnosis of T2DM. Body mass index (BMI) and waist circumference (WC) were determined and a fasting blood sample was collected for glucose, creatinine and HbA1c determinations. GFR was calculated with the Cockcroft-Gault equation adjusted for body surface area. Four MLRM were performed to determine the factors related to the GFR; it was evaluated whether these models complied with the statistical assumptions
of the linear regression model.
ResultsThe average age of the participants was 60±12 years, 62.3% of them were women. GFR correlated with BMI and WC; age and duration of the diabetes were associated inversely. Model 4 of the MLRM reported a coefficient of determination of 53.5% where the variables BMI (β=1.31), male sex (β=-6.01), duration of T2DM (β=-0.57), arterial hypertension (β=-6.53) and age (β=-1.45) were simultaneously and significantly related to the GFR.
ConclusionsOlder age, male sex, longer duration of T2DM and the presence of arterial hypertension were associated with a decrease in the GFR; BMI and WC were directly associated. No effect of glucose and HbA1c on GFR was observed.
La enfermedad renal crónica (ERC) se define como la pérdida permanente de la funcionalidad de los riñones y se caracteriza por una tasa de filtración glomerular (TFG) por debajo de 60 mL/min/1,73 m21. Esta patología afecta aproximadamente a 10% de la población adulta mundial, por lo que se considera un problema serio de salud pública2. Se prevé que para el año 2040, la ERC se convierta en la quinta causa de muerte a nivel mundial. De acuerdo con el Atlas Mundial de Salud Renal de 2021, la prevalencia de ERC en América Latina fue de 9,9% (IC 95%=8,75-11,1%). El país con la prevalencia más elevada fue Puerto Rico (15,4%); México se ubicó en la cuarta posición con una cifra de 11,8%3. El costo anual estimado para la atención de la ERC en México fue de 9.000 dólares americanos por paciente. Este gasto situó a la ERC como la enfermedad crónica más costosa para el sistema público de salud mexicano4.
La obesidad es uno de los principales factores de riesgo modificables para el desarrollo de la ERC5,6. Un metaanálisis realizado en cohortes de 40 países con datos recopilados entre 1970 y 2017, demostró que el índice de masa corporal (IMC), la circunferencia de cintura (CC) y la relación cintura-estatura elevados, son factores de riesgo independientes que afectan la TFG7. Después de ajustar por edad, sexo, raza y tabaquismo, los índices de riesgo obtenidos en este estudio al comparar diferentes índices (30, 35 y 40 kg/m2) contra uno de 25 kg/m2, fueron estadísticamente significativos con valores de 1, 18, 1,69 y 2,02, respectivamente7. Estudios recientes han demostrado que la distribución de la adiposidad corporal es relevante para la función renal. La obesidad central o abdominal se ha asociado con un mayor riesgo en la disminución de TFG. Un estudio retrospectivo realizado en 14.529 hombres y 10.561 mujeres de China, reclutados entre el 2013 y 2015, mostró que la obesidad visceral se asoció de forma independiente con el deterioro de la función renal en hombres y mujeres de todas las edades, excepto en los hombres menores de 45 años de edad8.
Por otra parte, la obesidad puede conducir a un síndrome de hiperfiltración (≥130 mL/min/1,73 m2), derivado de las alteraciones hemodinámicas provocadas por el aumento del volumen corporal que genera un incremento de la función y actividad renal9. Asimismo, el aumento de tejido adiposo en la cavidad abdominal ejerce en los riñones una presión constante que activa al sistema nervioso simpático y estimula al sistema renina-angiotensina-aldosterona (SRAA), lo que incrementa la reabsorción de sodio alterando la natriuresis y expandiendo el volumen extracelular que en el largo plazo deriva en una disminución de la TFG6,9,10.
Además de la obesidad, la diabetes mellitus tipo 2 (DM2) y la hipertensión arterial (HTA) se relacionan estrechamente con la presencia de ERC11–13. Se estima que, en México, tres de cada 10 personas con DM2 o HTA, tienen alguna afectación de la función renal14. Por lo que el objetivo de este trabajo fue identificar los factores de riesgo relacionados con la disminución o el aumento de la TFG en adultos mexicanos con DM2, mediante un modelo de regresión lineal múltiple (RLM) validado, con énfasis en la adiposidad corporal, el control glucémico, el tiempo de evolución de la diabetes y otros factores de riesgo relevantes.
Material y métodosPara la realización de esta investigación se reclutaron derechohabientes de la consulta externa de la Unidad de Medicina Familiar (UMF) No.77 del Instituto Mexicano del Seguro Social (IMSS), ubicada en el municipio de Ecatepec de Morelos, México y correspondiente al primer nivel de atención. Se reclutaron un total de 252 adultos hombres y mujeres con diagnóstico previo de diabetes mellitus. Se excluyeron a los pacientes con diagnóstico previo de daño renal, con amputación de alguna extremidad, distrofia muscular, sarcopenia o que consumieran suplementos alimenticios proteicos o fármacos que incrementan los niveles de creatinina sérica, como sulfas y fibratos. No se colectaron datos de actividad física ni hábitos de tabaquismo. La presente investigación fue aprobada por el Comité Local de Investigación en Salud No. 1401 del IMSS con folio de registro y aprobación R-2021-1401-039.
Cálculo de tamaño de muestraPara el cálculo del tamaño de muestra se utilizó una fórmula para determinar el coeficiente de correlación de Pearson de acuerdo con los datos publicados por Kim et al. que reportó un coeficiente de correlación (r) de 0,23815. Este cálculo se realizó con un nivel de confianza de 99% y un poder estadístico de 90% de acuerdo con la siguiente ecuación:
Sustituyendo:
Mediciones antropométricas y estado nutricionalA los participantes del estudio se les solicitó que permanecieran sin zapatos y con ropa ligera previo a la toma de medidas antropométricas. El peso (kg) se determinó con una báscula mecánica de columna SECA 711 y la talla (m) con un estadímetro SECA 220. Se calculó el índice de masa corporal con la fórmula (IMC=peso/talla2) y se clasificó el estado nutricional de acuerdo con los criterios propuestos por la OMS16. Asimismo, se midió el perímetro abdominal con una cinta milimétrica de uso clínico SECA 200 y los pacientes fueron clasificados con obesidad abdominal cuando la CC fue mayor a 88 cm en mujeres y 102 cm en hombres17. Para determinar la presencia de HTA se les preguntó a los pacientes si tenían un diagnóstico previo realizado por el médico que los atiende en la UMF No. 77, o bien, si consumían algún medicamento para tratarla.
Determinación de creatinina y tasa de filtración glomerularLos parámetros bioquímicos se realizaron al día siguiente de la toma de medidas antropométricas y en ayuno de ocho a 10 horas. Los niveles de creatinina se consideraron normales <1,1 mg/dL en mujeres y <1,3 mg/dL en hombres18. La TFG se calculó mediante la ecuación Cockcroft-Gault (C-G) ajustada por la superficie corporal18,19. Para la clasificación del grado de daño renal se utilizaron los criterios propuestos por las guías Kidney disease: Improving Global Outcomes (KDIGO)20 de acuerdo con los valores de la TFG expresada en mL/min/1,73 m2: G1 ≥90, G2=60-89, G3a=45-59, G3b=30-44, G4=15-29 y G5 <15. Se agregó un estadio adicional nombrado «hiperfiltración» cuando la TFG fue mayor a 130 mL/min/1,73 m213.
Tiempo de evolución y control de diabetesLos participantes incluidos en este estudio tenían un diagnóstico previo de DM2. Mediante la entrevista realizada a cada paciente, se colectó el tiempo de evolución de su enfermedad (años) y se midieron los niveles de glucosa plasmática (mg/dL) y hemoglobina glicosilada (HbA1c). Se consideró un buen control de la enfermedad cuando los niveles de HbA1c fueron menores a 7%21.
Análisis estadísticoEl análisis estadístico se realizó con el programa estadístico SPSS V25 (IBM SPSS Statistics software). Los datos cualitativos se expresaron en porcentaje. En el caso de los datos cuantitativos se determinó si tenían una distribución normal mediante la prueba de Kolmogórov-Smirnov, el coeficiente de asimetría (-0,5 a 0,5) y coeficiente de curtosis (-2 a 2). Los datos con distribución normal se reportaron como media±desviación estándar, o como mediana (percentiles 25-75) en caso contrario. Para correlacionar la TFG con parámetros antropométricos y bioquímicos se utilizó la prueba de correlación de Pearson (r) para datos con distribución normal o Spearman (rho) para datos con distribución libre. Por otro lado, se utilizó la prueba ANOVA para comparar la TFG por estado nutricional y la prueba t de Student para muestras independientes al compararla por diagnóstico HTA.
Finalmente se realizaron cuatro modelos de RLM para determinar los factores relevantes que se relacionan con la TFG en pacientes diabéticos. Se realizó el diagnóstico de los modelos de regresión y se consideró que el modelo era válido al cumplir el supuesto de normalidad de residuos (Prueba de normalidad Kolmogórov-Smirnov, coeficiente de asimetría y coeficiente de curtosis), independencia de residuos (Test de Durbin-Watson, 1,5-2,5), homocedasticidad de residuos y no colinealidad entre las variables independientes (Factor de inflación de varianza <10)22.
ResultadosLa edad promedio de los participantes fue de 60±12 años; 157 (62,3%) fueron mujeres y 95 (37,7%) hombres. En la tabla 1 se muestran las características generales de los sujetos de estudio. De acuerdo con el IMC, 206 sujetos (81,7%) presentaron sobrepeso u obesidad; 168 (66,7%) tuvieron obesidad central. Los pacientes incluidos en este estudio no tenían un diagnóstico previo de enfermedad renal, no obstante, se observó que más de 40% de ellos tuvieron algún grado de afectación de acuerdo con la clasificación propuesta por las guías KDIGO (tabla 1). La mediana de los niveles de creatinina fue de 0,76 (0,66 – 0,91) mg/dL. Solo 15 sujetos (6,0%) tuvieron niveles de creatinina elevados. De acuerdo con los criterios de la Asociación Americana de Diabetes, 153 sujetos (60,7%) tuvieron un buen control glucémico con niveles de HbA1c <7%. Se observó que los niveles de HbA1c correlacionaron significativamente con la glucosa sanguínea (rho=0,537, p <0,001).
Características antropométricas y clínicas de los adultos mexicanos con diabetes mellitus tipo 2 (n=252)
| Parámetro | |
|---|---|
| Edad (años) | 60,3±12 |
| IMC (kg/m2) | 29,2 (25,9-33,3) |
| Circunferencia de cintura (cm) | 98,9±12,5 |
| Tiempo de evolución enfermedad (años) | 6 (2-15) |
| HbA1c (%) | 6,7 (6-7,9) |
| Glucosa (mg/dL) | 121 (104-160,5) |
| Creatinina (mg/dL) | 0,76 (0,66-0,91) |
| Tasa de filtración glomerular (mL/min/1,73 m2) | 95,1±31,8 |
| Estadios de daño renal | n (%) |
| G1 Normal o elevado | 78 (31) |
| G2 Ligeramente disminuido | 93 (36,9) |
| G3a Ligera a moderadamente disminuido | 18 (7,1) |
| G3b Moderada a gravemente disminuido | 8 (3,2) |
| G4 Gravemente disminuido | 1 (0,4) |
| Hiperfiltración | 54 (21,4) |
| Hipertensión arterial | n (%) |
| Sí | 101 (40,1) |
| No | 151 (59,9) |
Los datos cuantitativos se presentan como media±desviación estándar o mediana (percentiles 25-75). Los datos cualitativos como frecuencia (porcentaje). Estadios de daño renal de acuerdo con lo establecido por las guías KDIGO22.
Por otra parte, en la figura 1, se resumen las correlaciones obtenidas entre la TFG y los diferentes parámetros evaluados. Se observaron correlaciones directas y significativas con el IMC (rho=0,391, p<0,001) y la CC (rho=0,182, p=0,004). De manera interesante no hubo asociaciones significativas con los niveles de glucosa en sangre ni de HbA1c, pero sí con el tiempo de evolución de la diabetes (rho=-0,398, p<0,001). La edad de los pacientes se asoció de manera fuerte con la TFG (r=-0,668, p<0,001).
Como se muestra en la figura 2a, cuando los sujetos fueron estratificados de acuerdo con su IMC, se observó un incremento progresivo en la TFG, que declinó en los pacientes con obesidad grado 3. Con respecto al grupo de sujetos con peso normal, se obtuvieron diferencias significativas en la TFG, al compararlos con los sujetos con diferentes estadios de obesidad. Por otra parte, en la figura 2b, se observa que los pacientes con HTA tuvieron una TFG menor (88,5±30,7) que los pacientes sin HTA (105±31, p<0,001).
Finalmente, en la tabla 2 se resumen los resultados de cuatro modelos de RLM en los que la TFG fue la variable dependiente. Los modelos 1 y 2 se ajustaron por CC (cm) como variable antropométrica; los modelos 3 y 4 fueron ajustados por el IMC (kg/m2). En todos los modelos se observó claramente que el incremento de la edad, el mayor tiempo de evolución de la diabetes y la variable sexo (género masculino) se relacionaron significativamente con una disminución en la TFG; en promedio los hombres tuvieron 6,51 mL/min/1,73 m2 menos que las mujeres (p<0,05). La HTA solo alcanzó significancia estadística en los modelos 3 y 4; en los modelos 1 y 2 los coeficientes beta reportaron una tendencia a la significancia estadística (p ∼ 0,08). De manera interesante, la HbA1c no fue significativa en ninguno de los modelos ensayados, lo que muestra que el control glucémico no se relacionó con la TFG en los pacientes estudiados. Por otro lado, la adiposidad corporal determinada por el IMC y la CC, fueron estadísticamente significativos en sus modelos correspondientes. El IMC obtuvo un coeficiente β de mayor magnitud1,23 que la CC (0,43). El modelo 4 obtuvo el coeficiente de determinación más alto; este incluyó las variables edad, tiempo de evolución de diabetes, HTA, sexo e IMC, explicando 53,5% de la variabilidad de la TFG (p<0,001). Todos los modelos que se presentan en la tabla 2 fueron validados. En todos los casos se cumplió con los supuestos de normalidad, homocedasticidad e independencia de residuos; ninguna de las variables independientes incluidas en los modelos ensayados, mostraron colinealidad.
Modelos de regresión lineal múltiple
| Mod1a (β) | Mod2b (β) | Mod3c (β) | Mod4d (β) | |
|---|---|---|---|---|
| Edad (años) | -1,515* | -1,509* | -1,448* | -1,453* |
| Tiempo de evolución de diabetes (años) | -0,681* | -0,687* | -0,573* | -0,567* |
| Hipertensión arterial+ | -5,268e | -5,261e | -6,528* | -6,534* |
| Sexo++ | 7,383* | 7,428* | 6,051* | 6,008* |
| HbA1c (%) | -0,108 | - | 0,112 | - |
| Circunferencia de cintura (cm) | 0,427* | 0,427* | - | - |
| IMC (kg/m2) | - | - | 1,314* | 1,312* |
| R2ajustado | 0,507* | 0,519* | 0,533* | 0,535* |
Variable dependiente: TFG (mL/min/1,73 m2). Referencia: +Sin hipertensión arterial; ++Hombre.
Los resultados de esta investigación demuestran que diversos factores se asociaron de manera simultánea y significativa con la TFG (tabla 2). Las variables relacionadas con una disminución de esta, fueron la edad, el tiempo de evolución de la diabetes y la presencia de HTA; con respecto a las mujeres, los hombres tuvieron una menor TFG. De manera interesante, la adiposidad corporal determinada por el IMC y la CC, se relacionaron con un aumento en la TFG; la magnitud de asociación fue mayor con el IMC. Hasta donde sabemos, solo un estudio realizado en población coreana con DM2 ha sido consistente con nuestros hallazgos; en esta población se observó que un IMC mayor a 30 kg/m2 y la CC elevada, aumentan el riesgo de hiperfiltración 3,46 y 1,42 veces, respectivamente24. Si bien, la obesidad se ha relacionado con la disminución de la TFG tanto en sujetos metabólicamente sanos, como en pacientes con DM2, también se sabe que esta tiene repercusiones en los mecanismos hemodinámicos de los riñones, lo que favorece el aumento de la TFG9.
Algunos estudios previos han reportado que el mal control de la glucemia en personas con DM2 está relacionada con afectaciones en la TFG24–27. Un estudio muy interesante realizado en 15.918 adultos coreanos, reportó que los sujetos con niveles de glucosa mayores a 140 mg/dL tuvieron un mayor riesgo de hiperfiltración (odds ratio=1,7, p=0,033)24. Por otra parte, en el trabajo de Weil et al., se observaron coeficientes beta significativos para la HbA1c y la glucosa en ayuno, en distintos modelos para estimar la TFG. No obstante, en el trabajo de Weil et al., la media de las concentraciones de glucosa y HbA1c fueron de 202,6 mg/dL y de 9,4%, respectivamente25. Finalmente, en un trabajo publicado por Sun et al., que incluyó 8.444 adultos con niveles normales de glucosa, 2.831 con intolerancia a la glucosa (ayuno y postprandial) y 840 con diagnóstico nuevo de diabetes, se observaron coeficientes beta modestos, pero significativos, relacionados con la TFG: glucosa en ayuno (por cada 10 mg/dL, β=0,17, p<0,001) y HbA1c (por unidad de %, β=0,61, p<0,001)26. En este trabajo los niveles de glucosa sanguínea (toma casual) y de HbA1c no se correlacionaron con la TFG, ni tampoco se observó un efecto significativo de la variable HbA1c en ninguno de los modelos de RLM. Probablemente, este resultado puede explicarse por las cifras de HbA1c observadas en nuestra población (mediana=6,7%), que sugieren que el control metabólico es adecuado en una proporción mayoritaria de pacientes (HbA1c<7%: n=153, 60,7%). De manera interesante, al comparar la media de los valores de la TFG estratificando por buen control (HbA1c <7%) y mal control de la glucemia (HbA1c ≥7%, n=99), se observó una mayor de TFG el grupo con mal control que tendió a la significancia estadística (92,2±30,7 vs. 99,7±33,1; p=0,071, dato no mostrado). Estos resultados sugieren que un buen control de la glucemia en pacientes con DM2 es favorable para la salud renal. De manera interesante, el tiempo de evolución de la DM2 sí se relacionó significativamente con una disminución de la TFG, que fue independiente de la edad de los pacientes en todos los modelos ensayados, con una disminución promedio de 0,627 mL/min/1,73 m2 por año de enfermedad. Este resultado es consistente con el reportado previamente por Le et al., en donde se observó un incremento gradual y significativo en el porcentaje de sujetos con una TFG<60 mL/min/1,73 m2 estratificados por tiempo de evolución de la diabetes: <10 años=5,5%, de 10 a 20 años=10,4% y ≥20 años=18,2%28.
Otro factor relacionado con la disminución de la TFG fue la presencia de HTA. En los modelos de RLM 3 y 4 se obtuvieron coeficientes beta significativos de -6,5 mL/min/1,73 m2 promedio, en los pacientes con hipertensión. Estos resultados también son consistentes con reportes previos que relacionan la HTA con la salud renal29,30. En el trabajo de Mousavi-Movahed et al. realizado en 903 choferes varones, la presencia de HTA se relacionó con un riesgo mayor (odds ratio=2,5; p<0,05) de tener una TFG disminuida [< 60 mL/min/1,73 m2])29.
Con respecto a la edad, observamos una disminución promedio de 1,5 mL/min/1,73 m2 en la TFG por año de vida. De todas las variables analizadas en la figura 1, la edad reportó la mayor magnitud de asociación (r=-0,668) contra la TFG. Jamshidi et al. reportaron resultados similares a los nuestros en una población de 8.927 adultos del oeste de Irán, particularmente en lo que se refiere a la edad y la presencia de HTA23. Mur Martí T. et al. también reportaron resultados similares en un estudio retrospectivo realizado en 500 adultos con DM2 de Barcelona, España que acudieron a atención primaria. En este trabajo se observó que el sexo femenino, mayor edad, las cardiopatías isquémicas y las dislipidemias se relacionaron con un riesgo significativo de alteraciones en la TFG31. Por otra parte, en un trabajo publicado por Abdulkader et al., en 1.253 individuos mayores de 60 años de la ciudad de San Paulo, Brasil, se determinó el efecto fisiológico de la edad sobre la TFG. De manera interesante se observó que solo 0,7% de toda la población estudiada tenía un TFG<60 mL/min/1,73 m2 sin la presencia de otras comorbilidades ni de daño renal. Por lo que los autores concluyen que si bien, la disminución de la TFG es muy prevalente en la población geriátrica, esta se presentó de manera poco frecuente en ausencia de otras enfermedades crónicas32. Actualmente se sabe que el envejecimiento natural trae consigo un deterioro estructural y funcional de los riñones que se traduce en una disminución de la TFG33; en este sentido, nuestros resultados son concordantes puesto que la disminución de la TFG atribuible a la edad, se mantuvo como un factor de riesgo independiente, después de ajustar por sexo, adiposidad corporal, HTA y tiempo de evolución de la DM2. La evaluación de los modelos de RLM, no reportó un efecto de colinealidad con las otras variables ensayadas.
Finalmente, el sexo masculino se asoció significativamente con un descenso en la TFG en los cuatro modelos de RLM que se realizaron, con respecto a las mujeres. Las diversas investigaciones que han analizado el efecto de la variable sexo sobre la función renal no son consistentes en sus hallazgos. Existe evidencia de que las mujeres tienen mayor prevalencia del deterioro de esta función, sin embargo, se ha considerado que el mal uso de las ecuaciones subestima la TFG en mujeres, así mismo, se sugiere que su mayor esperanza de vida conlleva a la disminución natural de la TFG y la presencia de comorbilidades características de la edad avanzada34. A este respecto, Swartling et al., publicó un estudio de cohorte realizado en 26.279 adultos suecos, en donde se evaluó el efecto de la variable sexo sobre la mortalidad y progresión de la ERC. De manera interesante se observó que, en comparación con las mujeres, los hombres tenían una tasa más alta de mortalidad cardiovascular y un mayor riesgo de progresión de la ERC35.
Dentro de las limitaciones y debilidades de nuestro estudio, consideramos la falta de medición de otros parámetros bioquímicos (como nitrógeno ureico en sangre o albúmina en orina) que nos permitiera realizar un diagnóstico más sensible de la funcionalidad renal de los pacientes. Además del tamaño de muestra relativamente pequeño de nuestro estudio, consideramos que la falta de información sobre la actividad física y los hábitos de tabaquismo en los pacientes estudiados pudiera considerarse una debilidad, dado que estos factores se han relacionado con una disminución en la TFG. No obstante, consideramos que una fortaleza de este trabajo fue la validación estadística de los modelos de RLM, que fortalecen las predicciones estimadas sobre la TFG.
ConclusiónLos factores relacionados con una disminución de la TFG en adultos mexicanos con DM2 fueron la edad, el sexo masculino, el tiempo de evolución de la DM2 y la presencia de HTA. El IMC y la CC se relacionaron con un aumento de la TFG. No se observó ningún efecto significativo de los niveles de glucosa y HbA1c sobre esta.
FinanciaciónLa realización de este documento no ha contado con ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses en relación con la elaboración de este documento.
Este trabajo de investigación es producto de la estrategia denominada «Fomento a la Vinculación entre Unidades de Investigación con las Unidades Médicas del IMSS». En este caso en particular, agradecemos el trabajo colaborativo entre la Unidad de Investigación Médica en Nutrición y la UMF No. 77, por su gran apoyo, compromiso y entusiasmo para fortalecer el desarrollo de la investigación clínica traslacional en beneficio del derechohabiente.