El síndrome del hueso hambriento (SHH) es una complicación tras la cirugía paratiroidea que puede causar una hipocalcemia grave y prolongada. El objetivo fue conocer los factores de riesgo de SHH después de la cirugía por hiperparatiroidismo primario y su relación con los niveles de calcio sérico y de hormona paratiroidea (PTH).
Materiales y métodosSe realizó un estudio analítico observacional de casos y controles en pacientes operados por hiperparatiroidismo primario en los últimos 10 años (2008-2017). Se estudió la evolución analítica del calcio, la PTH y las características generales de los pacientes.
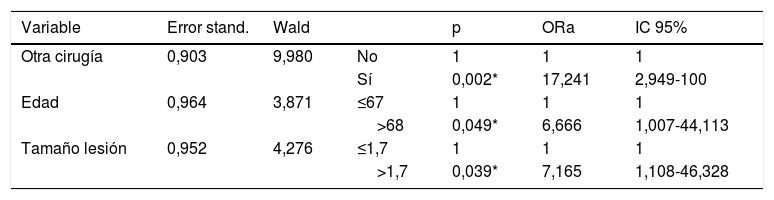
ResultadosLa incidencia de SHH en nuestra serie fue del 12,2%. Se encontró una asociación significativa de SHH con la cirugía tiroidea en el mismo acto quirúrgico (odds ratio ajustada [ORa]=17,241), con la edad mayor de 68 años (ORa=6,666) y con el tamaño de la lesión mayor a 1,7cm (ORa=7.165). Observamos una relación estadísticamente significativa entre presentar SHH con un valor mayor a la media de calcio sérico corregido el día después de la cirugía, a la semana y a los 3 meses, así como con un valor mayor de la media de PTH preoperatoria, en la cirugía y un día después de la cirugía.
ConclusiónLos factores de riesgo independientes para el desarrollo de SHH en nuestra serie fueron la edad del paciente, el tamaño de la lesión y si la intervención se acompaña de cirugía tiroidea, lo que obliga a una monitorización más estrecha del metabolismo mineral durante el perioperatorio.
Hungry bone syndrome (HBS) is a complication occurring after parathyroid surgery that can cause severe and prolonged hypocalcemia. The study objective was to know the risk factors for HBS after surgery for primary hyperparathyroidism and its relationship with serum calcium and parathyroid hormone levels.
Material and methodsA case-control, observational, analytical study was conducted in patients who had undergone surgery for primary hyperparathyroidism in the past 10 years (2007-2016). Changes over time in serum calcium and PTH levels and the general characteristics of patients were analyzed.
ResultsThe incidence rate of HBS in our series was 12.2%. HBS was found to be significantly associated to thyroid surgery during the surgical procedure itself (adjusted odds ratio [aOR]=17.241), to age older than 68 years (aOR=6.666), and to lesions greater than 1.7cm (aOR=7.165). A statistically significant relationship was seen between presence of HBS and corrected serum calcium levels higher than the mean the day after surgery and one week and 3 months later, and also with PTH levels higher than the mean before, during, and one day after surgery.
ConclusionIn our series, independent risk factors for development of HBS included patient age, lesion size, and whether or not the procedure was accompanied by thyroid surgery, which requires closer monitoring of mineral metabolism during the perioperative period.
Una de las complicaciones que puede ocurrir después de la cirugía paratiroidea es el llamado síndrome de hueso hambriento (SHH). Se produce cuando la corrección del hiperparatiroidismo primario (HPP) se asocia con una rápida remineralización ósea, causando hipocalcemia severa y prolongada1. La caída del calcio sérico se debe fundamentalmente al hipoparatiroidismo funcional o relativo ocasionado tras la cirugía y secundariamente al aumento de la captación de calcio por el hueso, a la excreción urinaria de calcio (en pacientes sin insuficiencia renal) y a la disminución de la absorción intestinal de calcio ocasionado por la reducción de 1-25-dihidroxicolecalciferol mediada por la hormona paratiroidea (PTH)1. Es decir que, tras la paratiroidectomía, el estímulo de la PTH se retira bruscamente, la actividad osteoclástica excesiva se detiene, pero la actividad osteoblástica continúa, dando como resultado un marcado aumento en la captación ósea de calcio para facilitar la formación de hueso, lo que predispone al paciente a una hipocalcemia sintomática presentando el llamado SHH2.
En algunos pacientes con SHH, sobre todo en los que han desarrollado enfermedad ósea preoperatoria, la hipocalcemia postoperatoria es grave y prolongada, a pesar de mantener niveles normales o incluso elevados de PTH tras la cirugía. Además de la disminución de calcio sérico, se puede producir la disminución del fosfato sérico y el aumento de los niveles séricos de potasio3.
Según la literatura, el SHH se produce alrededor de un 12-30% de los pacientes tras una cirugía paratiroidea, siendo la causa más frecuente un adenoma que ocasiona un HPP-.
La falta de criterios clínicos bien definidos para el diagnóstico del SHH hace difícil determinar su verdadera incidencia ya que la hipocalcemia es generalmente transitoria, el grado de enfermedad ósea suele ser leve y el tejido paratiroideo normal recupera la función rápidamente (generalmente en una semana), incluso después de la supresión prolongada4.
Determinar cuáles son los valores bioquímicos para diagnosticar un SHH y conocer los posibles factores de riesgo nos ayudaría a no sobretratar a pacientes en el postoperatorio y predecir aquellos que pueden desarrollar la enfermedad. Por lo tanto, el objetivo de este trabajo es conocer cuáles son los pacientes en riesgo de desarrollar SHH posquirúrgico en nuestro medio, estudiando las características clínicas y bioquímicas y su evolución.
Material y métodoSe realizó un estudio analítico observacional de casos y controles de los pacientes tratados mediante cirugía de paratiroides por hiperparatiroidismo primario en 10 años (2008-2017).
La cirugía del hiperparatiroidismo primario se realizó en pacientes sintomáticos (nefrolitiasis o síntomas relacionados con la hipercalcemia) y pacientes asintomáticos si cumplían uno de los siguientes criterios: concentración de calcio sérico mayor de 11,5mg/dl, afectación esquelética con fracturas vertebrales asintomáticas o alteraciones de la densidad ósea si esta se realizó, afectación renal valorada por una TFG estimada<60ml/min o un calcio en orina de 24h>400mg/día y una edad menor de 50 años.
Se definieron los casos como aquellos pacientes que habían presentado SHH por criterios clínicos y bioquímicos justo a los 7 días de la intervención. La hipocalcemia se definió como la concentración sérica de calcio corregido inferior a 8,5mg/dl. Además de la hipocalcemia, el paciente debía presentar niveles de fosfato sérico inferiores a 3,0mg/dl. La hipomagnesemia y la hiperpotasemia también podían estar presentes pero no fueron considerados criterios estrictos de diagnóstico.
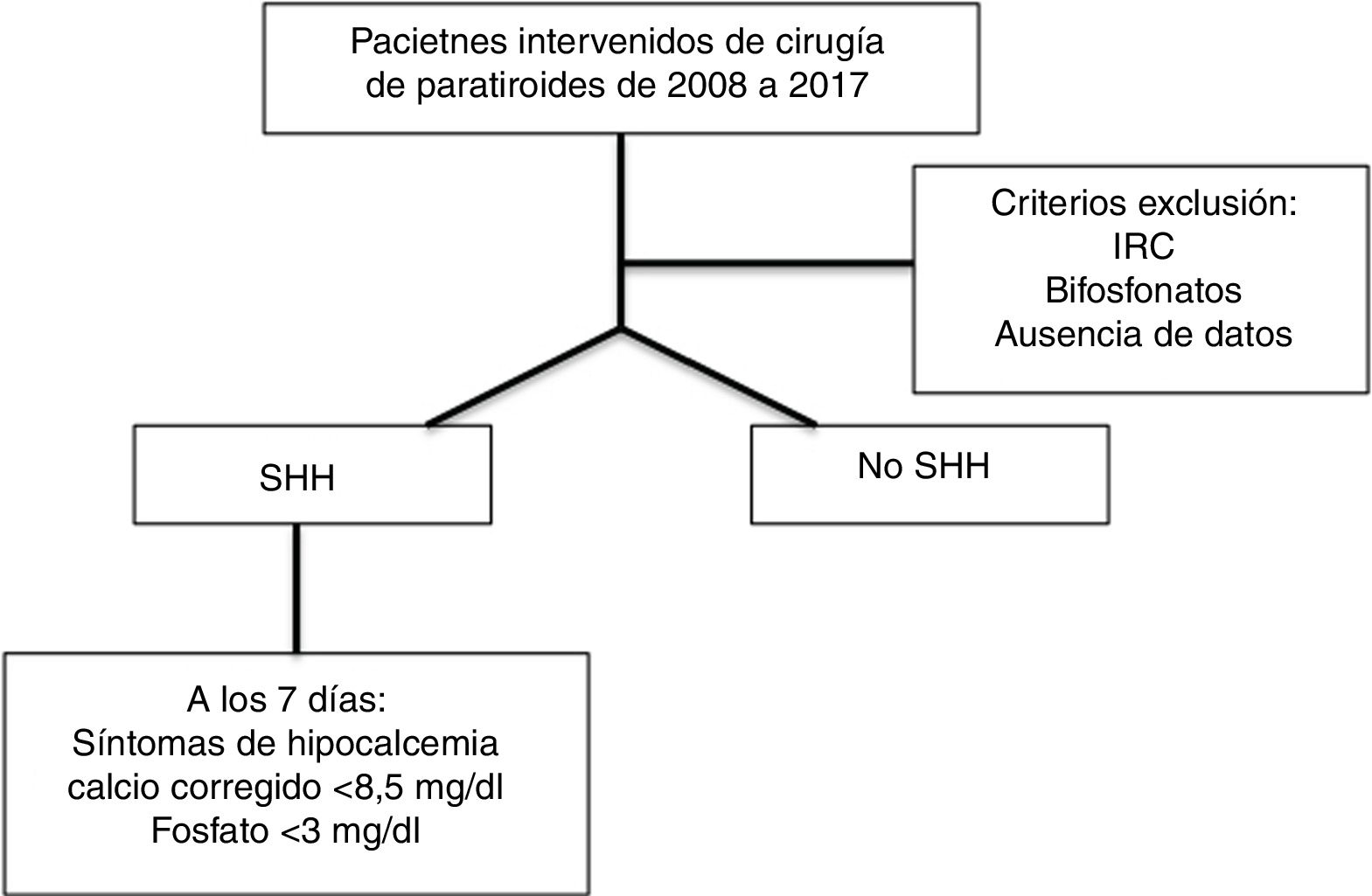
Los criterios de exclusión fueron: presentar insuficiencia renal crónica en cualquier estadio, estar en tratamiento con bifosfonatos previo a la cirugía y la ausencia de alguno de los datos bioquímicos durante el seguimiento en relación al calcio, fósforo y la PTH. Las variaciones anatómicas, otras cirugías simultáneas o comorbilidades del paciente no fueron criterios de exclusión (fig. 1).
La recogida de datos clínicos y bioquímicos se realizó a través de la Historia Clínica Electrónica. Las variables recogidas fueron la edad y el sexo del paciente, la localización de la glándula afectada, el diagnóstico anatomopatológico, el tamaño y el peso de la lesión, el diagnóstico de SHH, los valores de calcio, PTH, fósforo, magnesio y potasio en el preoperatorio, al día siguiente de la intervención, a la semana, a los tres meses y a los seis meses de la misma y si requirieron tratamiento sustitutivo con calcio y vitamina D en el postoperatorio.
En los pacientes con SHH y calcio corregido ≤7,5mg/dl se empleó calcio intravenoso en infusión lenta (6 ampollas de 10ml de gluconato cálcico al 10% en 500ml de suero salino fisiológico a una velocidad de 50ml/h). Se realizó control analítico diario y cuando la calcemia alcanzó niveles de 7,5-8mg/dl comenzamos a tratar con calcio oral y vitamina D con control posterior en la consulta de endocrinología hasta normalización.
En pacientes sin SHH con síntomas leves y/o calcemias de 7,5-8,5mg/dl, se trató con calcio oral y vitamina D hasta su normalización.
En todos los pacientes tratados con calcio y vitamina D se pautó carbonato cálcico 1250mg cada 8 horas (1500mg de calcio elemental al día) y calcitriol 0,25μg al día.
La base de datos fue analizada en el programa IBM© Statistical Package for the Social Sciences (SPSS) © versión 22 para OS X©. Se realizó un análisis descriptivo atendiendo principalmente a la distribución de frecuencias y a las medidas básicas de resumen con sus medidas de dispersión, un análisis bivariante mediante la prueba χy de Pearson y una comparación de medias mediante el test U de Mann-Whitney, comprobando previamente que las variables cuantitativas no seguían una distribución normal mediante el test de Kolmogoroff-Smirnov. Por último, se realizó un análisis mediante regresión logística múltiple siendo la variable dependiente el diagnóstico de SHH y las variables independientes o predictoras las que habían sido significativas en los análisis bivariantes.
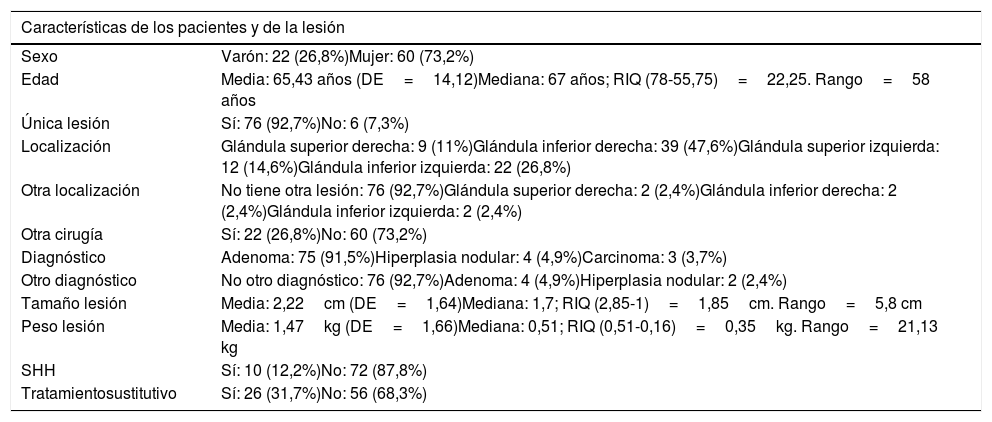
ResultadosSe estudiaron 82 pacientes intervenidos de paratiroidectomía por hiperparatiroidismo primario, siendo 22 varones (26,8%) y 60 mujeres (73,2%). La edad media fue de 65,15 años (DE=14,12) y la mediana de 67 años con un rango intercuantílico (RIQ) de 22,25 años. Seis pacientes (7,6%) presentaron más de una glándula paratiroidea afectada. La localización más frecuente del tumor tuvo lugar en la glándula inferior derecha (47,6%) seguida de la glándula inferior izquierda (26,8%). A 22 pacientes (26,8%) se les realizó simultáneamente otra cirugía, siendo esta una hemitiroidectomía o una tiroidectomía total (tabla 1).
Características generales de los pacientes del estudio
| Características de los pacientes y de la lesión | |
|---|---|
| Sexo | Varón: 22 (26,8%)Mujer: 60 (73,2%) |
| Edad | Media: 65,43 años (DE=14,12)Mediana: 67 años; RIQ (78-55,75)=22,25. Rango=58 años |
| Única lesión | Sí: 76 (92,7%)No: 6 (7,3%) |
| Localización | Glándula superior derecha: 9 (11%)Glándula inferior derecha: 39 (47,6%)Glándula superior izquierda: 12 (14,6%)Glándula inferior izquierda: 22 (26,8%) |
| Otra localización | No tiene otra lesión: 76 (92,7%)Glándula superior derecha: 2 (2,4%)Glándula inferior derecha: 2 (2,4%)Glándula inferior izquierda: 2 (2,4%) |
| Otra cirugía | Sí: 22 (26,8%)No: 60 (73,2%) |
| Diagnóstico | Adenoma: 75 (91,5%)Hiperplasia nodular: 4 (4,9%)Carcinoma: 3 (3,7%) |
| Otro diagnóstico | No otro diagnóstico: 76 (92,7%)Adenoma: 4 (4,9%)Hiperplasia nodular: 2 (2,4%) |
| Tamaño lesión | Media: 2,22cm (DE=1,64)Mediana: 1,7; RIQ (2,85-1)=1,85cm. Rango=5,8 cm |
| Peso lesión | Media: 1,47kg (DE=1,66)Mediana: 0,51; RIQ (0,51-0,16)=0,35kg. Rango=21,13 kg |
| SHH | Sí: 10 (12,2%)No: 72 (87,8%) |
| Tratamientosustitutivo | Sí: 26 (31,7%)No: 56 (68,3%) |
Fueron diagnosticados de SHH 10 pacientes (12,2%). Del total de los pacientes del estudio, 27 (32,9%) recibieron tratamiento con calcio y vitamina D en el postoperatorio, siendo el tratamiento en los pacientes con SHH por vía intravenosa (tabla 1).
El diagnóstico anatomopatológico postoperatorio más frecuente fue el adenoma de paratiroides en 75 pacientes (91,5%), la hiperplasia nodular se observó en 4 pacientes (4,9%) y el carcinoma de paratiroides en 3 (3,7%). El peso medio de la lesión fue de 1,47 g (DE=3,90) y la mediana de 0,51 con un RIQ de 0,35 g. El tamaño medio de la lesión fue de 2,22cm (DE=1,64) y la mediana de 1,7cm con un RIQ de 1,85cm (tabla 1).
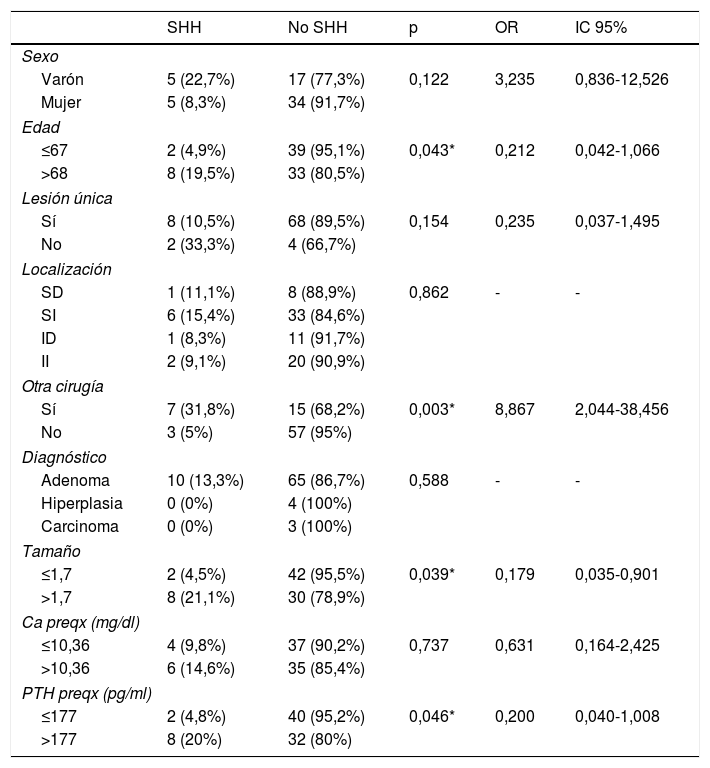
Se observó que 5 varones (22,7%) presentaron SHH frente a 5 mujeres (8,3%), sin una diferencia estadísticamente significativa (tabla 2).
Relación entre el sexo, la edad, las características anatómicas y bioquímicas con el SHH
| SHH | No SHH | p | OR | IC 95% | |
|---|---|---|---|---|---|
| Sexo | |||||
| Varón | 5 (22,7%) | 17 (77,3%) | 0,122 | 3,235 | 0,836-12,526 |
| Mujer | 5 (8,3%) | 34 (91,7%) | |||
| Edad | |||||
| ≤67 | 2 (4,9%) | 39 (95,1%) | 0,043* | 0,212 | 0,042-1,066 |
| >68 | 8 (19,5%) | 33 (80,5%) | |||
| Lesión única | |||||
| Sí | 8 (10,5%) | 68 (89,5%) | 0,154 | 0,235 | 0,037-1,495 |
| No | 2 (33,3%) | 4 (66,7%) | |||
| Localización | |||||
| SD | 1 (11,1%) | 8 (88,9%) | 0,862 | - | - |
| SI | 6 (15,4%) | 33 (84,6%) | |||
| ID | 1 (8,3%) | 11 (91,7%) | |||
| II | 2 (9,1%) | 20 (90,9%) | |||
| Otra cirugía | |||||
| Sí | 7 (31,8%) | 15 (68,2%) | 0,003* | 8,867 | 2,044-38,456 |
| No | 3 (5%) | 57 (95%) | |||
| Diagnóstico | |||||
| Adenoma | 10 (13,3%) | 65 (86,7%) | 0,588 | - | - |
| Hiperplasia | 0 (0%) | 4 (100%) | |||
| Carcinoma | 0 (0%) | 3 (100%) | |||
| Tamaño | |||||
| ≤1,7 | 2 (4,5%) | 42 (95,5%) | 0,039* | 0,179 | 0,035-0,901 |
| >1,7 | 8 (21,1%) | 30 (78,9%) | |||
| Ca preqx (mg/dl) | |||||
| ≤10,36 | 4 (9,8%) | 37 (90,2%) | 0,737 | 0,631 | 0,164-2,425 |
| >10,36 | 6 (14,6%) | 35 (85,4%) | |||
| PTH preqx (pg/ml) | |||||
| ≤177 | 2 (4,8%) | 40 (95,2%) | 0,046* | 0,200 | 0,040-1,008 |
| >177 | 8 (20%) | 32 (80%) | |||
Ca preqx: calcio prequirúrgico; ID: inferior derecha; II: inferior izquierda; PTH prex: PTH prequirúrgica; SD: superior derecha; SHH: síndrome de hueso hambriento; SI: superior izquierda.
El rango promedio de edad de los pacientes con SHH fue mayor que los que no lo tuvieron, sin diferencias estadísticamente significativas. Se agrupó la variable edad, según su mediana, en dos grupos. Un grupo menor o igual a 67 años y otro mayor de 68 años. Se observó que 2 pacientes (4,9%) de los menores o igual a 67 años presentaron SHH frente a 8 (19,5%) mayores de 68 años, encontrando una diferencia estadísticamente significativa (p=0,042) con una OR de 0,212 y un IC del 95% entre 0,042 y 1,066 (tabla 2).
De los pacientes que tenían una lesión en una sola glándula, 8 (10,5%) presentaron SHH frente a 2 (33,3%) que tenían más de una glándula afectada, sin encontrar una diferencia estadísticamente significativa (tabla 2).
No se encontraron diferencias estadísticamente significativas entre la localización de la lesión principal y el tipo de diagnóstico definitivo de la pieza con el diagnóstico de SHH (tabla 2).
Entre los pacientes a los que se les realizó también cirugía tiroidea, 7 (31,8%) presentaron SHH frente a 3 (5%) a los que se les realizó únicamente la cirugía paratiroidea, encontrando una diferencia estadísticamente significativa (p=0,003) con una OR de 8,867 y un IC del 95% entre 2,044 y 38,456 (tabla 2).
Se observó una diferencia estadísticamente significativa entre el tamaño de la lesión y el SHH, sin embargo, no se encontró una relación con el peso de la lesión. Al agrupar la variable tamaño según su mediana en dos grupos, se observó que dos pacientes (4,5%) que tenían una lesión igual o menor de 1,7cm presentaron SHH frente a 8 (21,1%) que tenían una lesión mayor a 1,7cm con una diferencia estadísticamente significativa (p=0,039) y una OR de 0,179 con un IC del 95% entre 0,035 y 0,901 (tabla 2).
No se encontró una diferencia estadísticamente significativa entre el calcio sérico prequirúrgico y el SHH, sin embargo sí se encontró una diferencia estadísticamente significativa entre la PTH prequirúrgica y el SHH. Al agrupar la variable PTH según su mediana, se encontró que dos pacientes (4,8%) que tenían una PTH prequirúrgica menor o igual a 177 pg/ml desarrollaron SHH frente a 8 (20%) de los que tenían una PTH mayor a 177 pg/ml, con una diferencia estadísticamente significativa y una OR de 0,200 con un IC del 95% entre 0,040-1,008 (tabla 2).
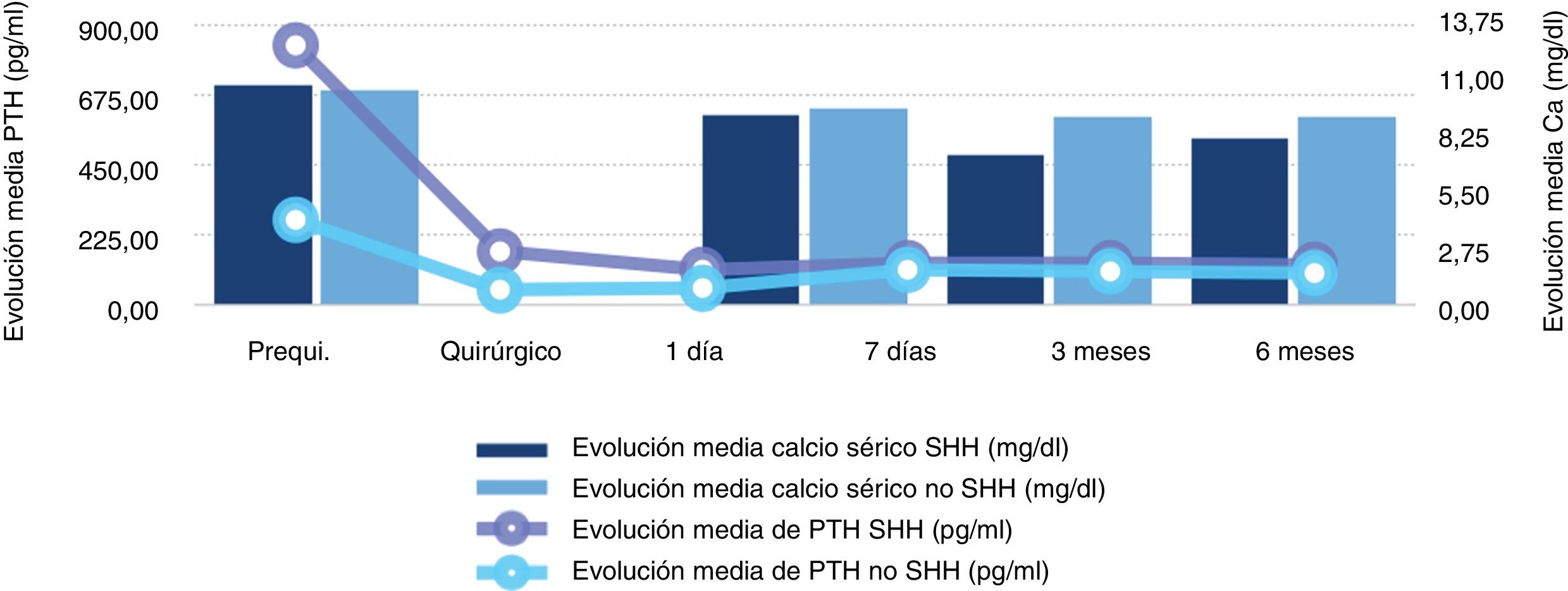
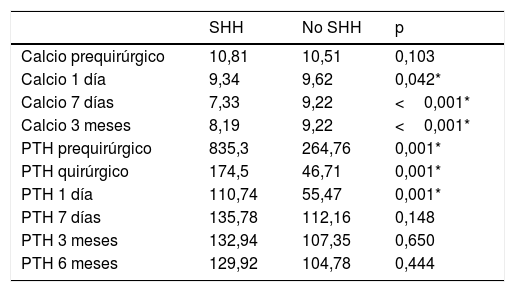
Evolución bioquímicaSe encontró una diferencia estadísticamente significativa entre los pacientes que tuvieron SHH y los que no lo presentaron en los valores de calcio sérico corregido al día siguiente de la cirugía, a la semana y a los 3 meses y con el valor de PTH prequirúrgico, quirúrgico y al día siguiente de la cirugía (tabla 3, fig. 2).
Evolución del calcio sérico medio (mg/dl) y PTH media (pg/ml)
| SHH | No SHH | p | |
|---|---|---|---|
| Calcio prequirúrgico | 10,81 | 10,51 | 0,103 |
| Calcio 1 día | 9,34 | 9,62 | 0,042* |
| Calcio 7 días | 7,33 | 9,22 | <0,001* |
| Calcio 3 meses | 8,19 | 9,22 | <0,001* |
| PTH prequirúrgico | 835,3 | 264,76 | 0,001* |
| PTH quirúrgico | 174,5 | 46,71 | 0,001* |
| PTH 1 día | 110,74 | 55,47 | 0,001* |
| PTH 7 días | 135,78 | 112,16 | 0,148 |
| PTH 3 meses | 132,94 | 107,35 | 0,650 |
| PTH 6 meses | 129,92 | 104,78 | 0,444 |
Todos los pacientes que presentaron SHH (12,2%) recibieron tratamiento sustitutivo tras ser diagnosticados.
Entre los pacientes que no cumplieron criterios de SHH (87,8%) se objetivó que 17 recibieron tratamiento sustitutivo con calcio y vitamina D oral durante la primera semana de la intervención.
En los pacientes no diagnosticados de SHH se observó que la media de calcio sérico corregido a la semana de la intervención fue de 8,49mg/dl siendo tratados con calcio y vitamina D durante la primera semana y de 9,44mg/dl en los no tratados, con una diferencia media de 0,95mg/dl entre ambos grupos, siendo esta diferencia estadísticamente significativa (p<0,001) en el test de contraste de hipótesis mediante la U de Mann Whitney.
Análisis multivariantePor último, en el análisis mediante regresión logística se encontró una asociación significativa con el haber sido intervenido de cirugía tiroidea en el mismo acto quirúrgico (con una ORa de 17,241 y un IC del 95% entre 2,949 y 100), con la edad mayor de 68 años (con una ORa 6,666 y un IC del 95% entre 1,007 y 44,113) y con el tamaño de la lesión mayor a 1,7cm (con una ORa de 7,165 y un IC del 95% entre 1,108 y 46,328) (tabla 4).
Modelo depurado de regresión logística siendo la variable dependiente el diagnóstico de SHH
El SHH es una complicación que puede tener lugar tras la cirugía de paratiroides por un HPP. Se produce por el alto recambio óseo que puede existir en el postoperatorio de estos pacientes1. Se caracteriza por una hipocalcemia rápida, profunda y persistente asociada a hipofosfatemia, hipomagnesemia y niveles suprimidos de PTH.
La prolongación en el tiempo del SHH está relacionada con la velocidad de la recuperación de la remineralización ósea. Este hecho se ve reflejado en la normalización de los marcadores de recambio óseo, en la mejora de las características radiológicas y en la ganancia significativa de la masa ósea4.
La evidencia encontrada en la literatura sobre el SHH es escasa, a pesar de ser un síndrome prevalente que asocia alteraciones clínicas y bioquímicas importantes y que suponen un desafío en su manejo.
Se estima una incidencia de SHH hasta de un 13% de los pacientes con HPP4-6. Sin embargo, existen series de casos en pacientes asiáticos con tasas más altas, entre un 24% y un 87%5,7, y otras con tasas mucho más bajas como la descrita en Arabia Saudí con una incidencia del 4%5,8. En nuestro estudio se obtuvo una incidencia de SHH de un 12,2%, valor acorde con la incidencia en la literatura actual.
No observamos una mayor afectación en mujeres respecto a hombres como se observa en otros trabajos donde existe un predominio femenino3-6.
La disminución de los niveles séricos de calcio se suele producir entre el 2.° y 4.° días postoperatorios y puede ser máxima a la semana de la intervención. Por este motivo, en nuestro estudio se consideró la evaluación de niveles de calcio sérico corregido a la semana de la cirugía. Es importante considerar que la hipocalcemia en los primeros 4 días postoperatorios puede deberse a la eliminación intencional o accidental de todas las glándulas paratiroides, a la interrupción de la vascularización, al traumatismo de las glándulas paratiroides residuales y a la supresión de las glándulas paratiroides no patológicas, sin llegar a desarrollarse un SHH1,5.
El tratamiento sustitutivo intravenoso con calcio y vitamina D se prescribió a todos los pacientes con SHH por vía intravenosa, una vez diagnosticados. Observamos que 17 pacientes tuvieron pautado un tratamiento sustitutivo por vía oral en la primera semana por niveles de calcio bajos o en el límite de la normalidad, sin cumplir criterios de SHH. Todos estos pacientes presentaron un valor de calcio corregido sérico de 1mg/dl menor que aquellos que no recibieron tratamiento. Desconocemos si los pacientes que iniciaron tratamiento con calcio y vitamina D oral en la primera semana posquirúrgica hubiesen desarrollado un SHH de no haber sido suplementados.
Existen diferentes factores que pueden actuar aumentando el riesgo de SHH. Brasier et al.4 identificaron los siguientes factores predictivos para el desarrollo del mismo (en orden descendente de importancia): volumen del adenoma resecado, concentración preoperatoria de nitrógeno ureico en la sangre, concentración de fosfatasa alcalina preoperatoria y la edad avanzada.
Mittendorf et al.9 detectaron además como factores de riesgo la presencia de niveles altos de calcio y de PTH preoperatoria, así como la presencia de una osteítis fibrosa quística.
En nuestro estudio encontramos que el tamaño de la glándula paratiroides extirpada fue un factor de riesgo, siendo de mayor tamaño la glándula en los pacientes con SHH frente a los que tuvieron un postoperatorio normal (4,08 frente a 1,96cm respectivamente). Zamboni et al.5 también observaron que 11 de 16 pacientes con un adenoma mayor a 2 g desarrollaron hipocalcemia transitoria postoperatoria frente a 3 de 21 pacientes con un adenoma menor de 1 g. La edad mayor a 68 años en el momento de la cirugía, que es la mediana de la edad y punto de corte de nuestra muestra por la asimetría de la variable, también fue un factor de riesgo para el SHH. La edad avanzada asocia una deficiencia de vitamina D, una disminución de la actividad de la 1α-hidroxilasa renal y una menor ingesta dietética de calcio, tres factores que pueden contribuir potencialmente a un balance negativo de calcio y a desarrollar una enfermedad ósea clínica5.
También observamos que la PTH media fue mayor en los pacientes con SHH que en los pacientes con postoperatorio normal siendo el valor de la PTH hasta cuatro veces superior en los primeros. No hubo datos disponibles sobre el valor de la fosfatasa alcalina preoperatoria ni de nitrógeno ureico para estudiar si valores elevados pueden influir en el desarrollo de SHH tal y como describen otros autores10.
Encontramos que los pacientes que habían sido intervenidos de cirugía tiroidea en el mismo acto quirúrgico presentaron un riesgo mayor que los pacientes con una cirugía exclusivamente paratiroidea tal y como describe Kaya et al.11, por lo que estos pacientes deberían tener una monitorización perioperatoria muy estricta. Si bien es cierto que el SHH se puede producir por daño de las restantes glándulas paratiroideas no patológicas, se ha descrito que puede existir un SHH después del tratamiento quirúrgico del hipertiroidismo12.
En la literatura se describe una disminución rápida de los niveles séricos de PTH hasta una media de más de 17 pg/ml tras la paratiroidectomía4. En nuestra serie observamos un descenso medio de la PTH en cada grupo de pacientes en el mismo momento de la extracción de la glándula afectada, siendo mayor el valor de la PTH en los pacientes con SHH que en los pacientes sin SHH. Sin embargo, la reducción media del valor de la PTH en cada grupo fue similar, siendo del 80% en los casos y del 82% en los controles. Los valores de PTH durante el seguimiento de los pacientes tendieron a igualarse.
No encontramos una diferencia significativa en los niveles séricos de calcio prequirúrgico con el desarrollo de SHH, al igual que se observó en el estudio realizado por Lee et al.13. Es sabido que en los pacientes con SHH los niveles de calcio sérico postoperatorio disminuyen por debajo de 8,5mg/dl en los primeros 3-4 días, descendiendo aún más después del 4.° día postoperatorio4,14-16. Observamos que durante el primer día posquirúrgico los niveles de calcio sérico fueron menores en el grupo con SHH frente al grupo con postoperatorio normal. A la semana esta diferencia fue mayor, disminuyendo esta diferencia con el tiempo.
A pesar de no disponer para analizar datos de marcadores de remodelado óseo, valores de densitometría, nitrógeno ureico y 25-OHvitamina D, nuestro estudio nos permite realizar una pequeña aproximación a lo que ha ocurrido con este tipo de pacientes en los últimos años en nuestro hospital y poder establecer las líneas a seguir en el futuro. Con todo ello, pretendemos poder valorar el posible efecto beneficioso del tratamiento preoperatorio con vitamina D y bisfosfonatos previo a la intervención17, ya que todavía no existen estudios prospectivos o ensayos clínicos aleatorizados que valoren el uso de medicación preoperatoria que prevenga o limiten la duración del SHH, medir la existencia de enfermedad ósea radiológica como un factor de riesgo de SHH18, y establecer en el futuro una escala predictora de riesgo de SHH para el paciente que va a ser intervenido de paratiroidectomía por HPP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.