Los carcinomas hipofisarios son raros y su manejo es difícil a pesar de un tratamiento intensivo y multimodal. La temozolomida, un quimioterápico oral aprobado para el tratamiento de los gliomas malignos, ha demostrado eficacia en los tumores hipofisarios agresivos y carcinomas hipofisarios.
Presentamos el caso de un varón de 66 años con un carcinoma hipofisario productor de prolactina y su respuesta al tratamiento con temozolomida. A los 58 años, tras consultar en otro centro por cefalea, se diagnosticó un macroadenoma hipofisario no funcionante de 22×19mm. Un mes después acudió al servicio de urgencias de nuestro hospital por cefalea incapacitante, diplopía por paresia del vi par derecho y hemianopsia bitemporal. En la RM se objetivó aumento del tamaño del adenoma hasta 33×26mm, que erosionaba el suelo de la silla turca, contactaba con el quiasma óptico en el lado derecho y con el trayecto proximal del nervio óptico derecho, e invadía el seno cavernoso del mismo lado. Además mostraba una zona de hiperseñal espontánea en T1 no modificada tras la inyección de gadolinio que parecía corresponder a metahemoglobina. Con la sospecha de apoplejía hipofisaria ingresó en el servicio de neurocirugía y fue intervenido por vía transesfenoidal, con exéresis parcial del tumor. El estudio histológico de la pieza quirúrgica demostró positividad para prolactina en la inmunohistoquímica, un KI 67 del 15% y positividad débil para p53. Tras la intervención, las analíticas seriadas realizadas durante el ingreso mostraron niveles de prolactina> 500 ng/ml (4-15,2), por lo que se inició tratamiento con cabergolina.
Al mes reingresó por cefalea; la RM objetivó un resto tumoral de 33×33mm, con importante ocupación de la cisterna supraselar, compresión de quiasma óptico y tronco cerebral, por lo que se ajustó la analgesia y se incrementó la dosis de cabergolina, sin poder alcanzar dosis>2mg a la semana por intolerancia digestiva.
A los 3 meses del inicio de la cabergolina el paciente reingresó por cefalea incapacitante y se le realizó una exéresis parcial con abordaje fronto-temporal, seguida de radioterapia externa conformada 3D, con acelerador lineal con haz de fotones hasta alcanzar una dosis total de 5040 cGY. Al mes de la radioterapia, y por mala tolerancia de la cabergolina, se cambió a bromocriptina, con buena respuesta bioquímica y radiológica (tabla 1). Al año de la radioterapia, los niveles de prolactina comenzaron a elevarse y se comprobó un incremento en el tamaño de la lesión hipofisaria de aproximadamente un 20%. Debido a elevación de transaminasas, se le realizó una tomografía computarizada de cuerpo entero, en el que se objetivaron metástasis hepáticas, linfáticas, pulmonares y vertebrales. Se realizó biopsia de las metástasis hepáticas que demostró una proliferación celular de tamaño moderado, con células ovaladas o poligonales, de núcleo redondeado y citoplasma eosinófilo denso, que expresan inmunorreactividad frente a prolactina, cromogranina y P53, y sin expresión de CK20 y CK7 de hepatocitos. Estos hallazgos confirmaron el diagnóstico de prolactinoma maligno.
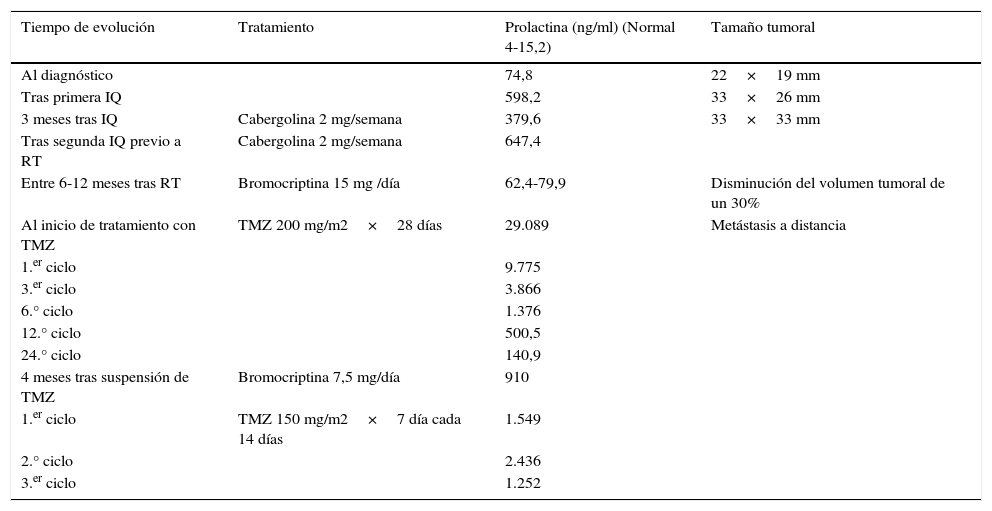
Evolución bioquímica y radiológica con las distintas modalidades de tratamiento
| Tiempo de evolución | Tratamiento | Prolactina (ng/ml) (Normal 4-15,2) | Tamaño tumoral |
|---|---|---|---|
| Al diagnóstico | 74,8 | 22×19 mm | |
| Tras primera IQ | 598,2 | 33×26 mm | |
| 3 meses tras IQ | Cabergolina 2 mg/semana | 379,6 | 33×33 mm |
| Tras segunda IQ previo a RT | Cabergolina 2 mg/semana | 647,4 | |
| Entre 6-12 meses tras RT | Bromocriptina 15 mg /día | 62,4-79,9 | Disminución del volumen tumoral de un 30% |
| Al inicio de tratamiento con TMZ | TMZ 200 mg/m2×28 días | 29.089 | Metástasis a distancia |
| 1.er ciclo | 9.775 | ||
| 3.er ciclo | 3.866 | ||
| 6.° ciclo | 1.376 | ||
| 12.° ciclo | 500,5 | ||
| 24.° ciclo | 140,9 | ||
| 4 meses tras suspensión de TMZ | Bromocriptina 7,5 mg/día | 910 | |
| 1.er ciclo | TMZ 150 mg/m2×7 día cada 14 días | 1.549 | |
| 2.° ciclo | 2.436 | ||
| 3.er ciclo | 1.252 |
IQ: intervención quirúrgica; RT: radioterapia; TMZ: temozolomida.
Se inició tratamiento con temozolomida a dosis de 200mg/m2 durante 5 días cada 28 días y radioterapia en las lesiones vertebrales. La disminución de los niveles de prolactina se apreció desde el primer ciclo y al cabo del tercero se confirmó la estabilidad radiológica de la lesión primaria y las metástasis. El tratamiento se mantuvo durante 24 ciclos, sin objetivar efectos secundarios importantes, excepto hiperglucemia, que requirió tratamiento con insulina.
A los 4 meses de la suspensión de la temozolomida los niveles de prolactina comenzaron a elevarse progresivamente; a los 10 meses de haber terminado el último ciclo se decidió reiniciar tratamiento con dosis más intensas de temozolomida (150mg/m2 durante 7 días cada 14 días) por progresión metastásica. El descenso de la prolactina fue más sutil y se constató progresión de las metástasis y crecimiento del tumor primario. El estado general del paciente se deterioró, pasando de ECOG 1 a 4, por lo que se decidió suspender tratamiento y garantizar el mayor bienestar posible con medidas paliativas. El paciente falleció a los 3 meses de suspender el tratamiento con temozolomida.
La identificación de los adenomas potencialmente más agresivos o que pueden metastatizar constituye un gran reto. Algunos biomarcadores, especialmente Ki 67, pueden ser de utilidad1,2, pero no siempre están disponibles o pueden no ser congruentes. Por ello, la evolución clínica será la herramienta más útil a pesar de que la latencia entre el diagnóstico del tumor hipofisario y el de las metástasis varía entre 4 meses y 18 años. La supervivencia tras identificarse metástasis suele ser inferior a 4 años. La quimioterapia convencional tiene poco valor en este contexto clínico, y la temozolomida parece ser una alternativa útil, aunque aún no se ha protocolizado la posología en este tipo de tumores3–5. Parece razonable iniciar tratamiento con 200mg/m2 durante 5 días cada 28 días, y si se obtiene respuesta tras el tercer ciclo, mantenerlo durante al menos 12 ciclos, independientemente del estatus de la enzima metilguanina-DNA metiltransferasa (MGMT) y de los genes que codifican para las proteínas de reparación de errores de replicación del DNA (MLH1, MSH2, MSH6). Los prolactinomas y los corticotropinomas son los que obtienen mayores tasas de respuesta, de hasta un 50% en un primer ciclo6, y aun superior en los casos en los que se asocia con radioterapia. A menudo se objetiva progresión del tumor tras el cese del tratamiento, con un periodo libre de progresión de 8 a 18 meses. En muchas ocasiones, un segundo tratamiento resulta en progresión tumoral a pesar de haber obtenido buena respuesta en un primer uso7,8. La alta tasa de recurrencia tras un segundo tratamiento confirma la necesidad de otras terapias más efectivas; la asociación con capecitabina podría ser más efectiva6,9. Habrá que valorar si en los pacientes con radioterapia concomitante el periodo de latencia resulta mayor; en la mayoría de los casos la temozolomida se había iniciado, como en nuestro caso, tras fracaso del resto de las medidas.
En espera de guías clínicas para el manejo de carcinomas hipofisarios, nuestra experiencia indica que una segunda tanda de temozolomida no resulta efectiva, por lo que parece más adecuado buscar terapias alternativas tras constatar la progresión tumoral.