El traumatismo craneoencefálico (TCE) se asocia con hipopituitarismo con una incidencia variable, dependiendo del momento y de los métodos diagnósticos utilizados y de factores relacionados con el traumatismo, como la gravedad, la localización anatómica y los fármacos utilizados en la fase aguda tras el mismo. La hipófisis puede dañarse de forma directa por el impacto o de forma secundaria a factores como la isquemia, la inflamación, la excitotoxicidad o la inmunidad. En fases agudas es vital detectar el déficit de ACTH. Además de las manifestaciones clínicas típicas del hipopituitarismo, se ha asociado con mayor deterioro cognitivo, peor perfil metabólico y mayor afectación de la calidad de vida. Uno de los retos clínicos es determinar qué pacientes se benefician de una evaluación hormonal sistemática tras sufrir un traumatismo, y por tanto de sustitución hormonal, y cuáles son el momento y el método diagnóstico apropiado para hacerlo.
Traumatic brain injury (TBI) is associated with hypopituitarism with a variable incidence, depending on the time and methods used to diagnosis, and on factors related to the trauma, such as its severity, its anatomical location and the drugs used in the acute phase. The pituitary gland can be damaged directly by the impact or secondary to factors such as ischemia, inflammation, excitotoxicity or immunity. In acute phases ACTH deficiency is the most relevant, since failure to detect and treat it can compromise the patient's life. Clinical manifestations are typical of each hormone deficient axes, although the combination hypopituitarism-trauma has been associated with cognitive deterioration, worse metabolic profile and greater impairment of quality of life. One of the clinical challenges is to determine which patients benefit from a systematic hormonal evaluation, and therefore from hormone replacement, and what is the appropriate time to do so and the most suitable diagnostic methods.
El traumatismo craneoencefálico (TCE) afecta a 69 millones de personas al año, con una incidencia en países industrializados de 200-235 casos/100.000 habitantes/año. Constituye la principal causa de muerte en jóvenes, y en aquellos casos no fatales asocia secuelas cognitivas, conductuales y sociales a medio y a largo plazo, además de disfunción neuroendocrina1,2.
Epidemiología del hipopituitarismo tras TCELa primera descripción de un hipopituitarismo tras un TCE data de 19183. Posteriormente, numerosos trabajos han evidenciado que los traumatismos craneales se asocian con disfunción hormonal hipofisaria. En una serie de pacientes adultos con hipopituitarismo, el TCE representó la causa en el 1,4% de los casos4, aunque su impacto actual es esperable que sea mayor, debido a un mayor reconocimiento y a una más profunda investigación del mismo.
Los estudios publicados sobre la prevalencia de hipopituitarismo tras un TCE presentan resultados variables, probablemente por su heterogeneidad en cuanto a la gravedad del traumatismo y la metodología diagnóstica5,6. En un metaanálisis del año 20077, la prevalencia global de hipopituitarismo tras un TCE fue del 27,5%, y varió según la gravedad del TCE, evaluada según la Glasgow Comma Scale (GCS), siendo del 35,3% en los casos graves (GCS≤8), del 10,9% en los moderados (GCS9-12) y del 16,8% en los leves (GCS≥13). La mayoría de los trabajos8,9, aunque no todos10,11, encontraron mayor prevalencia a mayor gravedad del traumatismo, y la mayoría de los casos considerados «leves» precisaron hospitalización y/o intervención neuroquirúrgica.
El tiempo transcurrido tras el TCE también condiciona la prevalencia de hipopituitarismo. En una revisión sistemática, con más de 5.000 pacientes, la prevalencia de hipopituitarismo tras TCE fue del 45% (<3meses), del 36% (3-12meses) y del 32% (>1año)12. Por el contrario, estudios prospectivos detectaron una prevalencia de hasta el 50,9% un año después del TCE8,13.
El déficit de hormona de crecimiento (GH), con frecuencia aislado, se detecta en el 22% de los casos, seguido del hipogonadismo (10,2%), del hipocortisolismo (10%) y del hipotiroidismo (6,2%)14. Cambios hormonales compatibles con déficit de GH, gonadotropinas o tirotropina (TSH) representan respuestas fisiológicas al estrés agudo que se resuelven en evaluaciones posteriores. Por el contrario, el déficit de hormona corticotropa (ACTH) sí es relevante y, de no ser tratado, puede comprometer la vida del paciente. En la fase aguda de un TCE existen cambios adaptativos al estrés que incluyen un aumento de cortisol sérico, pérdida del ritmo circadiano y ausencia de supresión tras 1mg de dexametasona. La reducción en la secreción de cortisol en fases agudas conlleva un aumento de la morbimortalidad. El déficit de hormona antidiurética, o vasopresina (ADH), es frecuente en la fase aguda y habitualmente transitorio11. Su aparición conlleva un pronóstico desfavorable15.
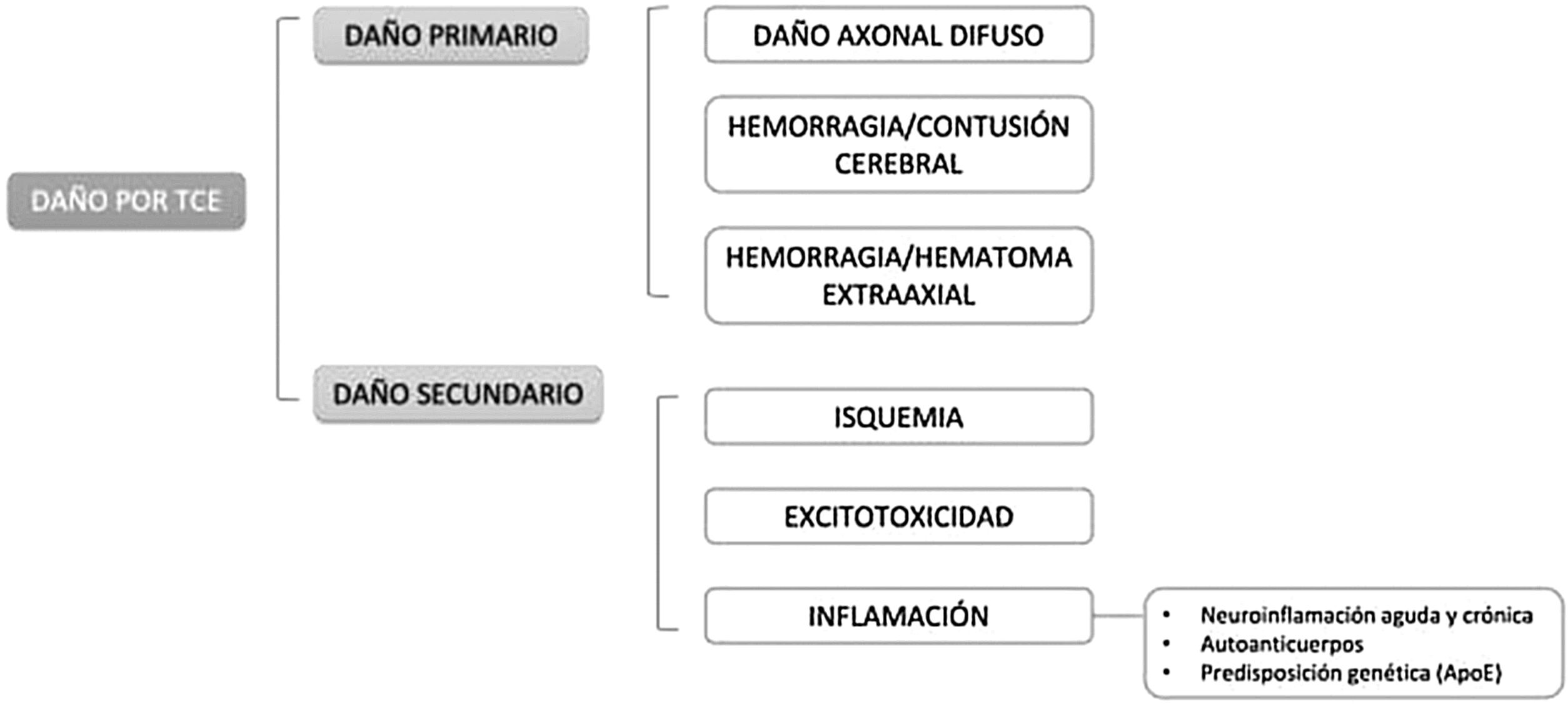
Fisiopatología del hipopituitarismo tras TCESe han descrito diversos mecanismos fisiopatológicos que intervienen en el desarrollo de hipopituitarismo tras un TCE. Su aparición vendrá condicionada por distintos factores (tabla 1). La fisiopatología del daño tras TCE se puede clasificar en daño primario y secundario.
Factores que se relacionan con aparición de hipopituitarismo tras un TCE
| Localización lesional | • Cápsula hipofisaria, lóbulo anterior o posterior hipofisario, tallo hipofisario, sistema vascular• Fracturas de la base del cráneo• Lesión visible en pruebas de imagen |
| Gravedad del TCE | • Según la puntuación en la GCS, leve: 13-15 puntos; moderado: 9-12 puntos; grave ≤ 8 puntos• Casi el 50% presentan insuficiencia adrenal tras TCE moderado-grave |
| Presencia de daño cerebral secundario | • Hipotensión, hipoxia, edema cerebral, hemorragia y alteraciones inflamatorias e inmunes (neuroinflamación persistente o autoinmunidad)• Daño axonal difuso |
| Fármacos en la enfermedad crítica | • Opioides, fenobarbital, heparina en altas dosis o etomidato se han relacionado con alteración del eje adrenal |
| Otros factores | • Edad avanzada• Estancia en UCI prolongada |
El daño primario se produce en el momento del TCE por efecto directo de las fuerzas externas transferidas al contenido intracraneal o por compresión por las estructuras circundantes. Puede inducir daño axonal difuso, hemorragia o contusión cerebral y hemorragias o hematomas extra-axiales. Las fracturas de la base craneal y las hemorragias hipofisarias son las más susceptibles de inducir daño hipofisario.
El daño secundario se relaciona con mecanismos desencadenados tras el TCE, como isquemia, excitotoxicidad e inflamación (fig. 1).
- 1.
Isquemia. Puede aparecer en el contexto de vasoespasmo, daño vascular u oclusión microvascular, y desencadenar hipoxia, edema, hipotensión o anemia. El riesgo de isquemia es mayor en la hipófisis anterior, cuyo aporte sanguíneo depende de vasos más largos, respecto al tallo y la hipófisis posterior, que se nutren de pequeños capilares portales, menos susceptibles de daño. Esto explica la mayor frecuencia de hipopituitarismo anterior. Dentro de este, los déficits de GH y de gonadotropinas son más frecuentes tras daño isquémico porque estas células se encuentran en los laterales de la hipófisis, nutridas por vasos mayores más susceptibles de daño. En cambio, los déficits de TSH-ACTH serían menos frecuentes porque las células tirotropas y corticotropas se encuentran en la parte central hipofisaria, vascularizadas por pequeños vasos menos expuestos.
- 2.
Excitotoxicidad. Está causada por una elevación anormal de neurotransmisores excitadores que se liberan incontroladamente tras un TCE. En altas concentraciones actúan sobre los canales iónicos, alterando la permeabilidad celular y produciendo un flujo anormal de electrolitos entre los espacios intra y extracelulares16.
- 3.
Inflamación. Tras un TCE se produce una reacción inflamatoria general aguda que posteriormente puede cronificarse. Así, los TCE leves pueden producir una alteración transitoria de la barrera hematoencefálica, permitiendo un flujo temporal de moléculas y células inflamatorias a través de esa barrera dañada hasta su recuperación. Sin embargo, los traumatismos graves o repetidos pueden causar inflamación crónica, que puede durar meses o años. Otro de los mecanismos relacionados con la inflamación tras TCE es la autoinmunidad. Tras un TCE hay pacientes que desarrollan una respuesta inmune (anticuerpos anti-hipofisarios o anti-hipotalámicos) tras disrupción de la barrera hematoencefálica y salida a circulación de proteínas cerebrales. Se han detectado incluso con trauma leve crónico (boxeadores), y pueden persistir hasta cinco años tras el diagnóstico. Los títulos altos de anticuerpos se han relacionado con mayor desarrollo de hipopituitarismo y menor recuperación del mismo, considerándose marcadores y factores de riesgo de daño hipofisario. Los anticuerpos anti-hipotalámicos se relacionan con déficit de GH y ACTH, sin déficit de ADH, sugiriendo que se dirigen principalmente hacia células somatotropas y corticotropas y no a la hipófisis posterior. No obstante, la mayor parte de la evidencia procede de un mismo grupo investigador, con muestras relativamente pequeñas, estudios no prospectivos y sin valoración precoz de la función hipofisaria tras el trauma. Por tanto, antes de incorporar la determinación de anticuerpos de rutina, precisaríamos más evidencia.
La predisposición genética también podría estar implicada en la disfunción hipofisaria tras TCE. La apolipoproteína E (ApoE) aumenta tras los traumatismos y reduce la neuroinflamación y repara las membranas celulares. Algunos polimorfismos de ApoE pueden tener implicaciones pronósticas. La ApoE3 tiene propiedades antinflamatorias más marcadas y reduce los niveles de citoquinas proinflamatorias a nivel sistémico y nervioso, presentando mejores resultados en daño hipofisario tras TCE, mientras que el polimorfismo ApoE4 se ha asociado a un peor pronóstico17.
Manifestaciones clínicasLas manifestaciones del hipopituitarismo tras TCE varían desde síntomas leves e inespecíficos (astenia, anorexia o cefalea) a graves que pueden poner en riesgo la vida del paciente y precisan tratamiento inmediato, como la crisis suprarrenal aguda o alteraciones hidroelectrolíticas graves. El número de deficiencias hormonales, su gravedad o el tiempo transcurrido hasta el tratamiento serán claves en la expresión clínica del hipopituitarismo.
Además de la clínica relacionada con los déficits hormonales, este hipopituitarismo puede asociar con mayor frecuencia alteraciones cognitivas, metabólicas y de calidad de vida (tabla 2).
Clínica del hipopituitarismo tras TCE
| Síntomas clásicos de cada déficit hormonal | • ACTH: astenia, anorexia, hipotensión, hipoglucemia, anemia, hiponatremia. Crisis adrenal• TSH: astenia, estreñimiento, aumento de peso, piel seca, caída de cabello• FSH/LH: disminución de la libido, cambios en el peso, osteoporosis, feminización y disminución del vello (varones), oligoamenorrea (mujeres)• GH: fatiga, pérdida de fuerza y masa muscular, redistribución central de la grasa, osteoporosis, disminución de la calidad de vida, deterioro en la memoria• ADH: diabetes insípida |
| Alteraciones neurocognitivas | • Alteraciones en la memoria, en la atención, en las funciones ejecutivas, en la velocidad de procesamiento o incluso en el lenguaje |
| Alteraciones metabólicas | • Aumento de peso y del IMC, distribución abdominal de la grasa, reducción de la densidad ósea, alteraciones glucémicas y del perfil lipídico |
| Empeoramiento en calidad de vida | • Peor puntuación en test de calidad de vida, mayor alteración en los dominios de salud física, energía, fatiga, bienestar emocional o dolor, así como salud general |
En la fase aguda (dos primeras semanas tras el TCE) hay dos situaciones clave por su riesgo vital y la necesidad de tratamiento inmediato: la crisis adrenal aguda y las alteraciones de la natremia15.
Los déficits de GH y gonadotropinas son clínicamente poco relevantes. El hipotiroidismo central puede contribuir a la clínica de astenia, letargia y confusión, pero es difícil de discriminar su efecto en fases tempranas. La hiperprolactinemia por compresión del tallo o por estrés puede causar alteraciones menstruales y disfunción sexual, junto con el hipogonadismo18.
Alteraciones neurocognitivasSon una secuela frecuente tras TCE y pueden afectar la atención, la memoria, la velocidad de procesamiento, las funciones ejecutivas o funciones más robustas, como el lenguaje y las habilidades de construcción, dificultando la reinserción sociolaboral de los pacientes.
El hipopituitarismo, el daño inducido por el traumatismo o el síndrome por estrés postraumático se relacionan con aparición de alteraciones cognitivas. Aunque existe una superposición clínica entre ellos, es importante hacer un correcto diagnóstico diferencial, puesto que los síntomas cognitivos relacionados con el hipopituitarismo pueden mejorar con reemplazo hormonal. Cada déficit hormonal hipofisario puede contribuir a la aparición de clínica neurocognitiva, pero es el de GH el que tiene más repercusión, relacionándose con afectación del crecimiento dendrítico, somático y neuronal, así como con alteraciones en la regulación del metabolismo de la glucosa cerebral en áreas corticales relacionadas con la memoria o con funciones ejecutivas e intelectuales. Algunos trabajos, aunque no todos, evidencian peores resultados cognitivos en presencia de déficit de GH.
El hipotiroidismo se asocia con retraso en el procesado de la información o alteraciones en la memoria a corto plazo. El hipogonadismo en varones se ha asociado con el riesgo de desarrollo de Alzheimer, y el tratamiento con testosterona mejora la memoria. En mujeres el reemplazo con estrógenos tiene un resultado más conflictivo en función cognitiva. El hipocortisolismo puede conllevar alteraciones en el ánimo, disminución de la memoria o incluso psicosis franca.
Alteraciones metabólicasLas más frecuentes incluyen alteraciones glucémicas, resistencia insulínica, dislipemia, aumento del peso e índice de masa corporal (IMC), cambios en la composición corporal con distribución abdominal de la grasa y disminución de la densidad mineral ósea (DMO)19.
Los factores que favorecen estos cambios metabólicos tras un TCE se resumen en la tabla 3. El hipotiroidismo reduce el gasto metabólico basal, el hipogonadismo se relaciona con pérdida de masa ósea y muscular, y el déficit de GH se asocia a alteraciones glucémicas y lipídicas, aumento del IMC y de la cintura y disminución de la DMO18. Todo ello puede empeorar o retrasar la capacidad de rehabilitación del paciente tras el TCE.
Factores que favorecen el cambio metabólico tras un TCE
| • Afectación de los centros hipotalámicos del apetito, la saciedad o la homeostasis energética |
| • Cambios en el ritmo circadiano, inactividad o menor capacidad de realizar actividad aeróbica (secuela del TCE) |
| • Necesidad de fármacos con efecto sobre el peso y el metabolismo para tratar complicaciones post-TCE (corticoides, antidepresivos, antiepilépticos, etc.) |
| • Hipopituitarismo |
Se han descrito fundamentalmente con el déficit de GH e incluyen niveles más altos de depresión, peores puntuaciones en los test de percepción de salud física, fatiga y niveles de energía, bienestar emocional, dolor y salud general.
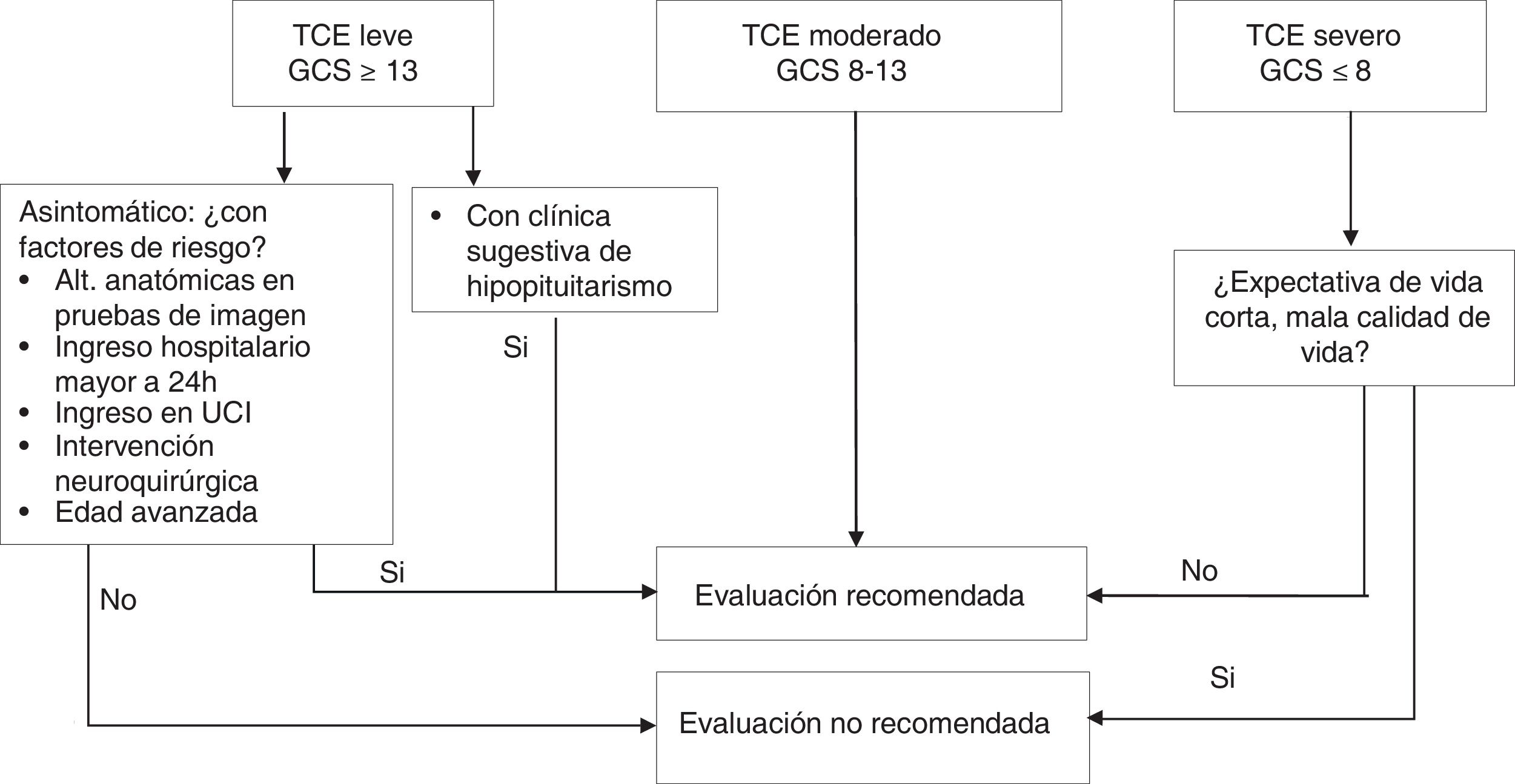
Diagnóstico¿A qué pacientes evaluar?Si el TCE es leve, la evaluación no se considera coste-efectiva, ya que la prevalencia de hipopituitarismo en casos leves que no necesitan ingreso o intervención posterior es <1%20. Sin embargo, en los casos leves «complicados» (ingreso hospitalario >24h, intervención neuroquirúrgica, monitorización en unidad de críticos o alteraciones anatómicas en pruebas de imagen)7, en aquellos con pérdida de conciencia o episodio de amnesia postraumática >30minutos y en los que desarrollen desequilibrio hidroelectrolítico o insuficiencia suprarrenal aguda, se recomienda la evaluación diagnóstica18,20.
Los casos graves, con secuelas y expectativa de vida reducida, no se benefician de tratamiento sustitutivo ni de cribado.
En los casos de gravedad moderada se recomienda cribado universal (fig. 2).
¿Cuándo realizar la evaluación?En fase aguda (14 días tras TCE), el único eje hormonal a evaluar sistemáticamente es el corticotropo, con determinación basal de cortisol entre el día1 y4 tras el TCE, que se repetirá entre los días 5 y 10 si se sospecha clínica de hipoadrenalismo. Ante hipernatremia y/o poliuria debe descartarse un déficit de ADH15. En el resto de ejes no se recomienda evaluación rutinaria.
A los 3-6 meses del TCE deben evaluarse los ejes tirotropo, gonadotropo y nuevamente el corticotropo. El déficit de GH se recomienda evaluarlo a partir del año, junto con una evaluación hormonal completa7 (tabla 4). Algunos casos seleccionados, con múltiples déficits hormonales, clínica compatible con déficit somatotropo o con factor de crecimiento similar a insulina tipo1 (IGF-I) ≤2 DE para edad y sexo, podrían beneficiarse de una evaluación temprana (a los 3-6meses).
¿Cuándo realizar la evaluación de un hipopituitarismo tras TCE?
| ACTH | TSH | FSH/LH | GH | ADH | |
|---|---|---|---|---|---|
| Fase aguda (días1-14) | Sí (día 1-4, repetir en día 5-10 si hay sospecha clínica)Hormonas basales | No recomendado | Sí, si hay sospecha clínicaIones y osmolaridades | ||
| Fase intermedia (3-6meses) | SíHormonas basales / test de estímulo | SíHormonas basales | NoSalvo déficit múltiple + sospecha clínica / IGF-I ≤2DE) | Sí, si hay sospecha clínica | |
| Fase crónica (12meses) | SíHormonas basales / test de estímulo | SíHormonas basales | SíHormonas basales / test de estímulo | SíClínica + iones + osmolaridades | |
| Evaluación de aparición de nuevos déficits (>1año) | Casos leves: anualmente cada 5 añosCasos moderados y graves: no es necesario seguimiento | ||||
Los métodos diagnósticos del hipopituitarismo tras TCE son los mismos que para otras causas, aunque la selección de los test o su interpretación varían.
El diagnóstico de insuficiencia adrenal en fase aguda se realiza mediante determinación basal de cortisol. En general, un valor de cortisol >15mg/dl excluye un déficit de ACTH, <3mg/dl lo confirma, y valores intermedios requieren un test de estímulo para confirmación. Sin embargo, en esta fase aguda estos puntos de corte no son aplicables, ya que se produce una elevación fisiológica de los niveles de cortisol. Se ha propuesto un punto de corte de 11mg/dl (300mmol/l), por debajo del cual se establecería el diagnóstico de insuficiencia adrenal y requeriría tratamiento sustitutivo15,21. Realizar test de estímulo en este contexto precoz no es clínicamente adecuado en la mayoría de los casos. La hipoglucemia insulínica es inadecuada por razones de seguridad, y el test de estimulación con ACTH no discriminaría los casos agudos en los que aún no diese tiempo a desarrollar insuficiencia. En fases tardías es preferible el test de estímulo con ACTH con dosis bajas (1-2mg) para evitar estímulos suprafisiológicos que enmascaren los resultados. Los nuevos inmunoensayos competitivos demostraron mayor sensibilidad y especificidad en la detección de insuficiencia adrenal con puntos de corte para cortisol más bajos. Valores de cortisol tras estímulo >18mg/dl (500nmol/l) según los inmunoensayos habituales, o >13,4mg/dl (374nmol/l) según los nuevos inmunoensayos, excluyen el déficit.
La evaluación del hipotiroidismo incluye determinaciones basales de T4 libre y TSH. El test de estimulación con hormona liberadora de tirotropina (TRH) no demostró mayor precisión diagnóstica.
Para el hipogonadismo, las determinaciones basales de gonadotropinas con esteroides sexuales y la historia menstrual en mujeres premenopáusicas son suficientes para establecer el diagnóstico.
En relación con el déficit de GH, los niveles de IGF-I suelen ser un marcador fiable de déficit. En presencia de deficiencia hipofisaria múltiple, una IGF-I disminuida será suficiente para el diagnóstico18. El resto de casos requieren test de confirmación, como hipoglucemia insulínica, test de glucagón o estímulo combinado con hormona liberadora de GH (GHRH) y arginina u otro secretagogo de GH como GHRH +hexapéptido liberador de hormona del crecimiento (GHRP-6). En déficits aislados se confirmará con un segundo test. La hipoglucemia insulínica en TCE presenta menor utilidad, al estar contraindicada por el riesgo de convulsión tras TCE, además de presentar una sensibilidad menor en este contexto. La determinación de GH tras estímulo con macimorelina (Ghryvelin®) ha demostrado su utilidad al no estar influida su precisión por factores que modifican la secreción de GH, como la obesidad, el sexo o la edad22. En el caso de que existan otros déficits hormonales, deben estar correctamente sustituidos al evaluar la reserva de GH.
El déficit de ADH debe sospecharse en presencia de poliuria (diuresis >40ml/kg/día). Una osmolalidad plasmática elevada con una ratio osmolalidad urinaria/plasmática <2 apoya el diagnóstico. La determinación de copeptina basal y estimulada puede ser de utilidad en el diagnóstico una vez superada la fase aguda del TCE.
En relación con el seguimiento, se ha detectado recuperación y aparición de nuevos déficits a los 3 y a los 5años del traumatismo, especialmente en los casos leves, por lo que se recomienda control clínico y bioquímico anual al menos 5años para detectar tanto posibles recuperaciones como nuevas deficiencias23. En los casos moderados y graves, debido a la escasa probabilidad de recuperación de déficits hormonales, debe realizarse control del tratamiento sustitutivo. Si a los 12meses no hay déficits hormonales, no es necesario el control posterior, salvo sospecha clínica (tabla 4).
TratamientoConsiste en la sustitución de los ejes hormonales deficitarios, al igual que en otros casos de hipopituitarismo, y difiere en fase aguda y crónica tras el TCE.
En la fase aguda debe realizarse sustitución del eje adrenal tras la confirmación del déficit mientras que no existe evidencia suficiente para recomendar la sustitución del eje tiroideo, somatotropo y gonadotropo7. Se recomienda tratar el hipocortisolismo con hidrocortisona (oral 30mg/día en pacientes estables e intravenosa 50-150mg/8horas o infusión continua a 15mg/hora en los pacientes críticos e inestables). La dosis se ajustará según la respuesta clínica y se mantendrá a dosis de estrés mientras el paciente precise tratamiento vasopresor. Posteriormente, se recomienda continuar con dosis fisiológicas (15-20mg/día) hasta que se pueda realizar la reevaluación del eje. El tratamiento de rutina con corticoesteroides en pacientes críticos tras un TCE no está indicado, al no haber demostrado beneficios. La GH juega un papel crucial en los mecanismos de proliferación celular y reparación neuronal, aunque no existen estudios clínicos que evalúen los efectos del tratamiento sustitutivo con GH en la fase aguda del TCE y, por tanto, no se recomienda. Tampoco existe evidencia para recomendar tratamiento sustitutivo tirotropo y gonadal. El tratamiento con hormona tiroidea en pacientes críticos por patologías distintas al TCE no ha demostrado mejoría.
Por el contrario, en fase crónica y con déficits hormonales establecidos el tratamiento es el recomendado para las deficiencias hormonales hipofisarias de cualquier etiología. El tratamiento sustitutivo con GH mejora la función cognitiva, incluyendo memoria, velocidad de procesamiento de la información, vocabulario, función ejecutiva o aprendizaje verbal, y se plantea como un tratamiento fundamental asociado a la rehabilitación al haber demostrado aumentar la fuerza muscular, la capacidad aeróbica y mejorar la composición corporal tras un año de tratamiento24, aunque no existen estudios en TCE. La afectación de la calidad de vida parece mayor en los casos de TCE respecto a otras causas, a pesar de tener déficits bioquímicos aparentemente más leves, pero consiguen mayor beneficio con tratamiento mantenido a largo plazo. La sustitución del resto de los ejes no fue evaluada de forma específica en TCE y debe seguir las indicaciones generales para el hipopituitarismo.
ConclusionesEl hipopituitarismo secundario al TCE es frecuente y conlleva un aumento en la morbilidad, así como una limitación en la capacidad funcional y en la recuperación tras el mismo. Más allá del daño directo por el TCE se han identificado complejos mecanismos de excitotoxicidad, isquemia, inflamación o inmunidad que explicarían la aparición del hipopituitarismo. Su diagnóstico exige criterios homogéneos de cribado, la selección de pacientes, el momento y los métodos diagnósticos. En fase aguda, detectar y tratar el hipocortisolismo es vital, mientras que el resto de los ejes no se benefician de intervenciones tempranas. En fases crónicas, el hipopituitarismo, además de las manifestaciones clásicas, cursa con afectación neurocognitiva y empeora la calidad de vida. El tratamiento de los déficits hormonales en estos casos ha demostrado mejorar la calidad de vida, las alteraciones metabólicas y la composición corporal, mejorando el pronóstico de estos pacientes.
FinanciaciónEste artículo no ha recibido ninguna financiación.
Contribución de los autoresTodos los autores contribuyeron a la redacción del documento, realizaron una revisión crítica de su contenido y aprobaron la versión final.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses con respecto al contenido de este artículo.
Este documento ha sido revisado por un comité científico externo y ha sido aprobado por la Junta directiva de la SEEN.
Los autores agradecen a los revisores designados por la Sociedad Española de Endocrinología y Nutrición sus sugerencias y correcciones, que han contribuido a la mejora del documento.
Este documento es el resumen ejecutivo del artículo completo que se encuentra disponible en la pagina web de la SEEN, en el enlace: https://www.seen.es/portal/documentos/hipopituitarismo-traumatismo-craneoencefálico