La hiperuricemia se asocia a enfermedad cardiovascular. Sin embargo, la contribución del ácido úrico (AU) sobre la mortalidad cardiovascular (MCV) en pacientes diabéticos es controvertida.
ObjetivoEvaluar la contribución del AU al riesgo de MCV en pacientes con diabetes de tipo 2 (DM2).
Pacientes y métodosSe incluyó a pacientes con DM2 atendidos en consultas externas hospitalarias. Se recogieron variables demográficas, clínicas y bioquímicas, incluidos niveles de AU, excreción de albúmina urinaria y tasa de filtración glomerular (TFG). La contribución independiente del AU a la MCV se evaluó con modelos de regresión de Cox con ajuste progresivo para potenciales factores de confusión.
ResultadosSe incluyó a 452 pacientes con edad media de 65,9 años (DE 9,5). La media de AU fue de 4,2mg/dl y los cuartiles (Q) de AU fueron: Q1<3,3; Q2: 3,3-4,2; Q3: 4,3-5,1; Q4>5,1mg/dl. La correlación entre AU y TFG fue significativa (Rho = −0,227; p<0,001). Durante una mediana de 13 años de seguimiento las tasas de MCV fueron más elevadas en el Q4 de la distribución de AU (Q1: 10,7; Q2: 11,7; Q3: 10,7 y Q4: 21,6 por cada 1.000 pacientes/año; p=0,027). El AU fue un factor predictor de MCV en análisis univariante (HR1mg/dl=1,30; p=0,002), pero no en multivariante ajustado para la excreción de albúmina urinaria y TFG (HR1mg/dl=1,20; p= 0,12).
Discusión y conclusionesLos niveles de AU se asocian a incremento de MCV en pacientes con DM2. No obstante, la asociación puede no ser causal, sino mediada por la afectación de la función renal en los pacientes con hiperuricemia.
Hyperuricemia is associated to cardiovascular disease. However, the contribution of uric acid (UA) to cardiovascular mortality in diabetic patients is controversial.
ObjectiveTo assess the impact of UA levels on the risk of cardiovascular mortality risk in a cohort of patients with type 2 diabetes mellitus (T2DM).
Patients and methodsA prospective cohort study on outpatients with T2DM. The clinical endpoint was cardiovascular death. Anthropometric, demographic, clinical, and biochemical variables were collected, including UA levels, urinary albumin excretion and estimated glomerular filtration rate. The independent contribution of UA levels to cardiovascular mortality was assessed using multivariate Cox regression models, progressively adjusted for potential confounders.
ResultsA total of 452 patients with a mean age of 65.9 (SD 9.5) years were enrolled. Mean UA level was 4.2mg/dL. Quartiles of UA levels were Q1 < 3.3; Q2: 3.3-4.2; Q3: 4.3-5.1; Q4 > 5.1mg/dL. UA levels significantly correlated with estimated glomerular filtration rate (Rho=−0.227; p<0.001). During a median follow-up time of 13 years, cardiovascular mortality rates were higher in Q4 of the UA distribution (Q1: 10.7; Q2: 11.7; Q3: 10.7; Q4: 21.6 per 1000 patient-years; p = 0.027). UA was a predictor of cardiovascular mortality in the univariate analysis (HR1mg/dL = 1.30; p=0.002), but not in a multivariate analysis adjusted for urinary albumin excretion and eGFR (HR1mg/dL=1.20; p=0.12).
Discussion and conclusionsHigh UA levels are associated to cardiovascular mortality in patients with T2DM. However, the role of UA may be mediated by impaired kidney function in patients with hyperuricemia.
La presencia de diabetes mellitus de tipo 2 (DM2) incrementa el riesgo cardiovascular de los pacientes y es considerada un equivalente de riesgo coronario1. No obstante, no todos los pacientes con DM2 tienen la misma probabilidad de experimentar eventos vasculares2, lo que hace necesaria la búsqueda de biomarcadores que puedan ayudar a discriminar el riesgo individual.
Está firmemente demostrada la relación causal entre hiperuricemia (HU) y la aparición de gota y nefrolitiasis. Por ello, las guías recomiendan la administración de fármacos con el objetivo de obtener niveles de ácido úrico (AU) < 5mg/dl en pacientes con ataques recurrentes de gota o con gota asociada a complicaciones (tofos, enfermedad renal crónica [ERC], urolitiasis)3,4.
Múltiples estudios epidemiológicos han encontrado, además, una relación entre AU y otras enfermedades: síndrome metabólico o de resistencia a la insulina (SM), DM2, enfermedad cardiovascular y ERC. No obstante el papel causal del AU en estas enfermedades no se ha demostrado de modo concluyente5. En pacientes con DM2 la contribución del AU al riesgo de mortalidad cardiovascular (MCV) es controvertido, con algunos estudios que han demostrado una asociación independiente6 y otros que no7,8. Las diferencias pueden justificarse por el perfil de los pacientes incluidos y por las diferentes variables de ajuste introducidas en los modelos de regresión. Específicamente, los principales factores de confusión pueden ser los hallazgos de SM y la presencia de ERC, ambos asociados a HU y a MCV9,10.
Especial importancia tiene la presencia de ERC, la cual incrementa los niveles de AU, al reducir su excreción renal, y también aumenta el riesgo de MCV tanto por la elevación de la excreción de albúmina urinaria (EAU) como por la reducción de la tasa de filtración glomerular (TFG)11. La EAU y la TFG proporcionan una información aditiva e independiente sobre el riesgo vascular de los pacientes12.
Los objetivos de nuestro trabajo, mediante el seguimiento a largo plazo de una cohorte de pacientes con DM2, fueron los siguientes:
- 1.
Determinar si los niveles de AU se asocian con el riesgo de MCV en pacientes con DM2.
- 2.
Evaluar si el eventual incremento de riesgo cardiovascular conferido por el AU puede ser mediado por la coexistencia de hallazgos de SM o por la presencia de ERC.
Estudio de cohortes prospectivo.
Población a estudioEntre el 1 de junio de 1994 y el 1 de junio de 1998 se seleccionó a 463 pacientes con DM2 atendidos en consultas externas de Endocrinología del Hospital Comarcal de Alcañiz. Dicho hospital tiene una población de referencia de 70.000 personas.
Los criterios de inclusión fueron: diabetes diagnosticada por las recomendaciones de la Organización Mundial de la Salud vigentes en ese momento13, edad superior a 35 años en el momento del diagnóstico de la DM2 y ausencia de tratamiento con insulina al menos durante un año tras el diagnóstico de la enfermedad. Los criterios de exclusión fueron enfermedad somática grave, gestación, situación de hipertiroidismo o hipotiroidismo no controlados, tratamiento con corticoides sistémicos e insuficiencia renal avanzada (creatinina superior a 3mg/dl). El diseño del estudio fue aprobado por el hospital y todos los pacientes dieron su consentimiento verbal antes de ser incluidos. Para el presente trabajo se excluyó a los pacientes que estaban tratados con alopurinol (n = 11).
Examen basalSe realizó una entrevista en el momento de la inclusión, con anotación de edad, sexo, tiempo de evolución conocido de la enfermedad, hábito tabáquico (fumadores activos, exfumadores y no fumadores), tratamiento de la DM2 (hipoglucemiantes orales o insulina) y cualquier manifestación de enfermedad vascular prevalente:
- •
Cardiopatía isquémica: antecedente de infarto de miocardio, revascularización coronaria o clínica de angina.
- •
Isquemia de extremidades inferiores: antecedente de amputación de origen vascular, revascularización arterial o clínica de claudicación.
- •
Enfermedad cerebrovascular: antecedente de ictus.
- •
Enfermedad vascular: cualquier manifestación de cardiopatía isquémica, isquemia de extremidades inferiores o enfermedad cerebrovascular.
En el examen físico se determinaron peso y talla (con cálculo del índice de masa corporal [IMC], definido como peso en kg/talla al cuadrado en metros), presión arterial sistólica y presión arterial diastólica. Se definió hipertensión arterial como presión arterial sistólica superior a 140mmHg o diastólica superior a 90mmHg o en tratamiento con hipotensores.
Métodos de laboratorioSe realizó extracción de muestra de sangre venosa, tras ayuno nocturno de 10 h, con determinación de hemoglobina glicosilada (HbA1c), creatinina, colesterol total, colesterol HDL, colesterol no HDL (colesterol total-colesterol HDL), triglicéridos y AU. Se recogió una muestra de orina de 24 h y, tras excluir infección urinaria, se determinó la tasa de EAU, con clasificación de las muestras en normoalbuminúricas (<30mg), microalbuminúricas (30-300mg) o macroalbuminúricas (>300mg). Las mediciones bioquímicas se realizaron mediante autoanalizador Shimadzu CL 7200. La HbA1c se midió en analizador automático Cobas Mira Plus, con un rango de normalidad entre 4,5 y 5,7%. La EAU se determinó con un método inmunoturbidimétrico en analizador Cobas Integra 700. El colesterol LDL se estimó con la fórmula de Friedewald cuando los triglicéridos fueron de menos de 300mg/dl.
Se calculó la TFG en ml/min por 1,73 m2 mediante la fórmula de CKD-EPI:
Mujeres:
Si creatinina ≤ 0,7mg/dl TFG = 144×(creatinina/0,7)−0,329×(0,993)edad
Si creatinina > 0,7mg/dl TFG = 144×(creatinina/0,7)−1,209×(0,993)edad
Varones:
Si creatinina ≤ 0,9mg/dl TFG = 141×(creatinina/0,9)−0,411×(0,993)edad
Si creatinina > 0,9mg/dl TFG = 141×(creatinina/0,9)−1,209×(0,993)edad
Se siguió de modo prospectivo a todos los pacientes hasta su fallecimiento o hasta el 1 de agosto de 2011. Las causas de muerte se obtuvieron a partir de la historia clínica hospitalaria o mediante contacto con el médico de atención primaria que firmó el certificado de defunción. Se consideraron como cardiovasculares las muertes súbitas (las que se producían de manera inesperada dentro de la primera hora desde el inicio de los síntomas), las debidas a enfermedad coronaria y las debidas a ictus. Se definió como infarto de miocardio la constatación en la historia clínica de ingreso por dolor torácico con cambios electrocardiográficos típicos o elevación característica y descenso progresivo de las cifras de CPK-MB o troponina i (disponible esta última desde febrero del año 2000 en el hospital). Un ictus fue definido como un déficit neurológico que persistía más de 24 h. En 4 pacientes (0,9%) no se pudo determinar su estatus vital y fueron considerados pérdidas en el seguimiento.
Métodos estadísticosLas variables cuantitativas se describen con su media y desviación estándar (DE) o con su mediana y rango intercuartil, mientras que las cualitativas se expresan con su distribución de frecuencias. Las variables cuantitativas se comparan con ANOVA o prueba no paramétrica de Kruskal-Wallis. Para la comparación de variables cualitativas se utilizó el test de χ2 con evaluación de tendencia lineal en variables con categorías ordenadas.
El grado de asociación lineal entre valores de AU y TFG se evaluó con el coeficiente de correlación de Spearman.
Como variable primaria de resultado se consideró la MCV. El principal factor predictivo analizado fue el AU, expresado como una variable cuantitativa o como una variable cualitativa codificada en 4 categorías (cuartiles [Q]).
Se realizó seguimiento de los pacientes desde su inclusión hasta su salida del estudio por alcanzar la fecha de cierre, por muerte o por pérdida de contacto. Las tasas de MCV se expresan por cada 1.000 pacientes/año. La comparación de tasas entre los Q de AU se realizó mediante análisis de Kaplan-Meier y log rank test.
La evaluación de la contribución independiente de los niveles de AU a la aparición de MCV se llevó a cabo en modelos de regresión de Cox, con estimación de las hazard ratios (HR) y sus intervalos de confianza (IC) del 95%. El AU se introdujo como variable cualitativa codificado en 4 categorías (Q). El componente lineal, evaluado mediante polinomios ortogonales, fue significativo (p = 0,032), por lo que el AU también se introdujo en los modelos como variable cuantitativa. Se realizaron modelos univariante y multivariante con ajuste progresivo para variables según su sentido clínico:
Modelo 1: edad, sexo y presencia de enfermedad cardiovascular inicial.
Modelo 2: modelo 1 + tabaquismo, hipertensión arterial, colesterol total, HbA1c y tiempo de evolución de la DM.
Modelo 3: modelo 2 + IMC, colesterol HDL y triglicéridos.
Modelo 4: modelo 3 + TFG y EAU.
Las asociaciones con p < 0,05 fueron consideradas significativas. Se utilizó como programa informático SPSS versión 15.0.
ResultadosSe incluyó a 452 pacientes, 178 (39,4%) varones, con edad media de 65,9 años (DE 9,5) y tiempo de evolución medio de la DM2 de 10,4 años (DE 7,5). En el momento de la inclusión 191 pacientes (42,4%) llevaban tratamiento con insulina y 98 (21,7%) tenían enfermedad vascular prevalente.
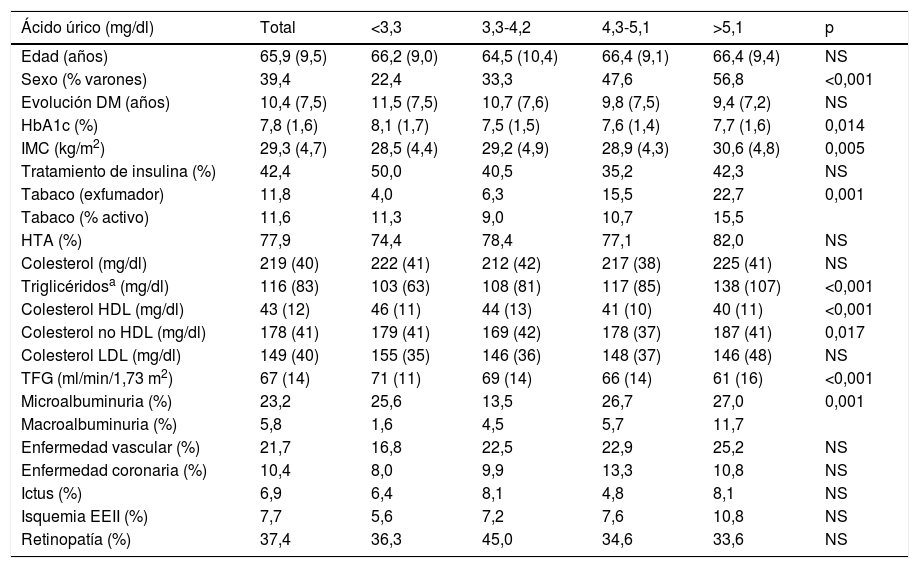
La media de AU fue de 4,2mg/dl y la mediana de 4,2mg/dl. Los puntos de corte de los Q de AU fueron: Q1 < 3,3; Q2: 3,3-4,2; Q3: 4,3-5,1; Q4 > 5,1mg/dl. En la tabla 1 se describen las características de los pacientes en dependencia de los Q de AU. Los pacientes en los Q superiores de AU se caracterizaban por ser con mayor frecuencia varones, tener mayor prevalencia de tabaquismo, tener mejor control glucémico, presentar más rasgos característicos de SM (mayor IMC, cifras más elevadas de triglicéridos y colesterol no HDL y valores más bajos de colesterol HDL) y tener peor función renal (menor TFG y mayor prevalencia de albuminuria). Aunque hubo una tendencia a presentar mayor prevalencia inicial de enfermedad cardiovascular, no alcanzó la significación estadística.
Características de los pacientes en dependencia de los cuartiles de ácido único
| Ácido úrico (mg/dl) | Total | <3,3 | 3,3-4,2 | 4,3-5,1 | >5,1 | p |
|---|---|---|---|---|---|---|
| Edad (años) | 65,9 (9,5) | 66,2 (9,0) | 64,5 (10,4) | 66,4 (9,1) | 66,4 (9,4) | NS |
| Sexo (% varones) | 39,4 | 22,4 | 33,3 | 47,6 | 56,8 | <0,001 |
| Evolución DM (años) | 10,4 (7,5) | 11,5 (7,5) | 10,7 (7,6) | 9,8 (7,5) | 9,4 (7,2) | NS |
| HbA1c (%) | 7,8 (1,6) | 8,1 (1,7) | 7,5 (1,5) | 7,6 (1,4) | 7,7 (1,6) | 0,014 |
| IMC (kg/m2) | 29,3 (4,7) | 28,5 (4,4) | 29,2 (4,9) | 28,9 (4,3) | 30,6 (4,8) | 0,005 |
| Tratamiento de insulina (%) | 42,4 | 50,0 | 40,5 | 35,2 | 42,3 | NS |
| Tabaco (exfumador) | 11,8 | 4,0 | 6,3 | 15,5 | 22,7 | 0,001 |
| Tabaco (% activo) | 11,6 | 11,3 | 9,0 | 10,7 | 15,5 | |
| HTA (%) | 77,9 | 74,4 | 78,4 | 77,1 | 82,0 | NS |
| Colesterol (mg/dl) | 219 (40) | 222 (41) | 212 (42) | 217 (38) | 225 (41) | NS |
| Triglicéridosa (mg/dl) | 116 (83) | 103 (63) | 108 (81) | 117 (85) | 138 (107) | <0,001 |
| Colesterol HDL (mg/dl) | 43 (12) | 46 (11) | 44 (13) | 41 (10) | 40 (11) | <0,001 |
| Colesterol no HDL (mg/dl) | 178 (41) | 179 (41) | 169 (42) | 178 (37) | 187 (41) | 0,017 |
| Colesterol LDL (mg/dl) | 149 (40) | 155 (35) | 146 (36) | 148 (37) | 146 (48) | NS |
| TFG (ml/min/1,73 m2) | 67 (14) | 71 (11) | 69 (14) | 66 (14) | 61 (16) | <0,001 |
| Microalbuminuria (%) | 23,2 | 25,6 | 13,5 | 26,7 | 27,0 | 0,001 |
| Macroalbuminuria (%) | 5,8 | 1,6 | 4,5 | 5,7 | 11,7 | |
| Enfermedad vascular (%) | 21,7 | 16,8 | 22,5 | 22,9 | 25,2 | NS |
| Enfermedad coronaria (%) | 10,4 | 8,0 | 9,9 | 13,3 | 10,8 | NS |
| Ictus (%) | 6,9 | 6,4 | 8,1 | 4,8 | 8,1 | NS |
| Isquemia EEII (%) | 7,7 | 5,6 | 7,2 | 7,6 | 10,8 | NS |
| Retinopatía (%) | 37,4 | 36,3 | 45,0 | 34,6 | 33,6 | NS |
DM: diabetes mellitus; EEII: extremidades inferiores; HTA: hipertensión arterial; IMC: índice de masa corporal; TFG: tasa de filtración glomerular.
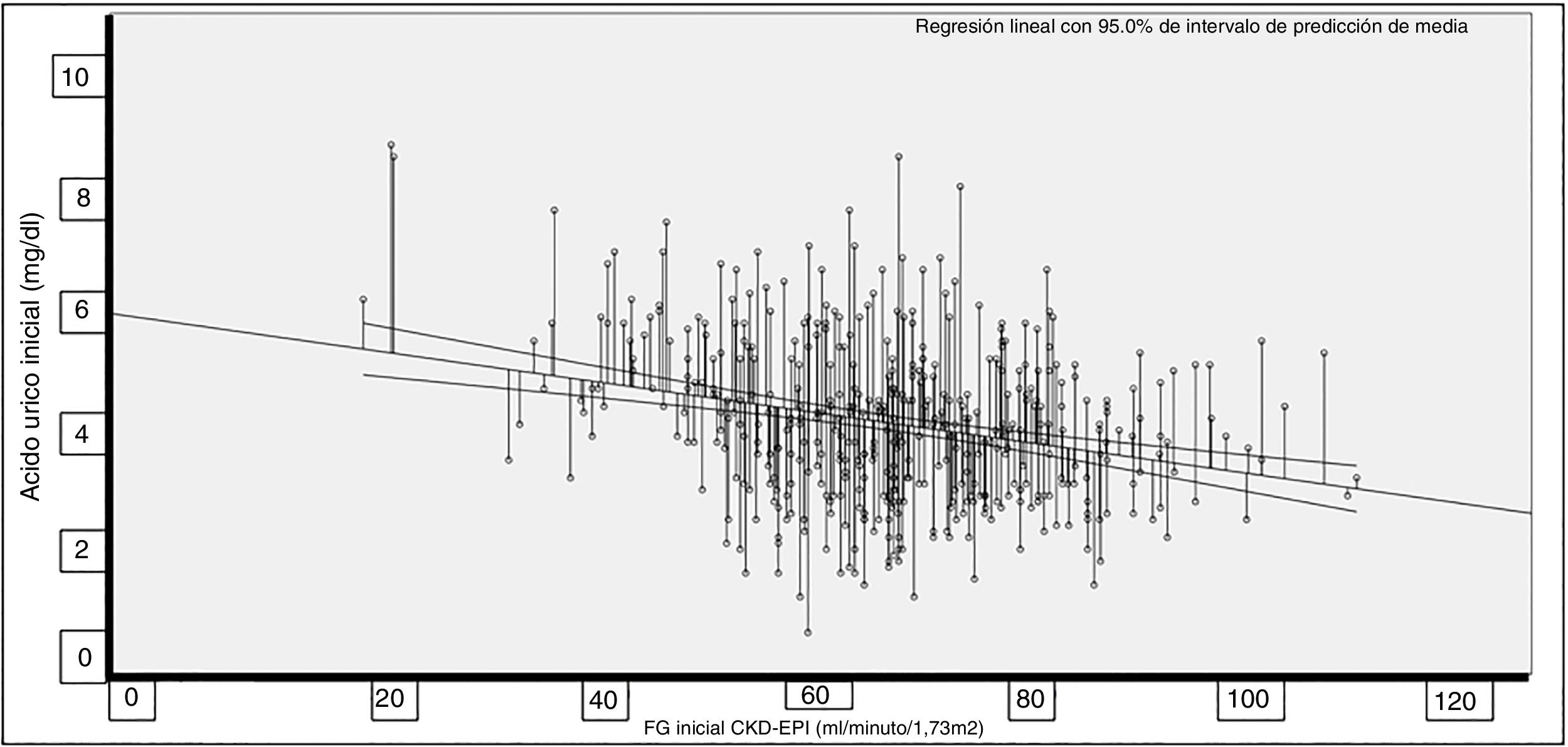
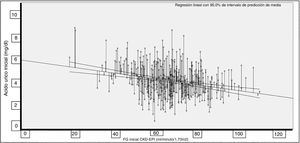
La correlación entre AU y TFG fue significativa (Rho = −0,227; p < 0,001; fig. 1).
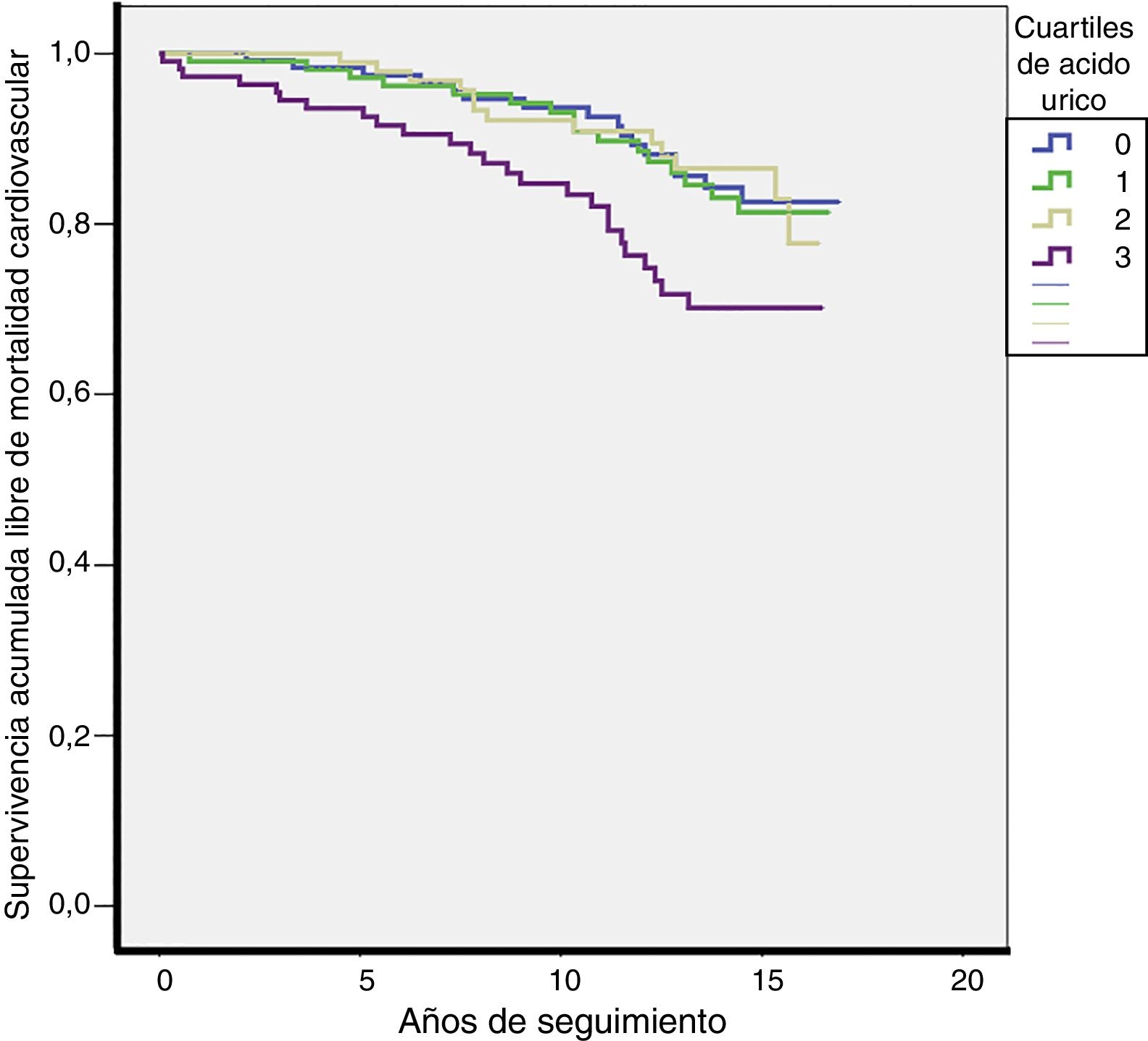
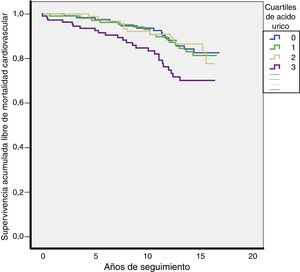
Durante una mediana de 13 años de seguimiento se produjeron 70 muertes cardiovasculares (tasa 13,4/1.000) y 206 muertes totales (tasa 39,3/1.000). Las tasas de MCV fueron más elevadas en el Q4 de la distribución de AU (Q1: 10,7; Q2: 11,7; Q3: 10,7; Q4: 21,6 por cada 1.000 pacientes/año; p = 0,027). Las tasas de mortalidad total también fueron más elevadas en el Q4 de la distribución de AU (Q1: 39; Q2: 29,3; Q3: 36,1; Q4: 55,4 por cada 1.000 pacientes/año; p = 0,003). Las curvas de supervivencia para MCV según los cuartiles de AU se plasman en la figura 2.
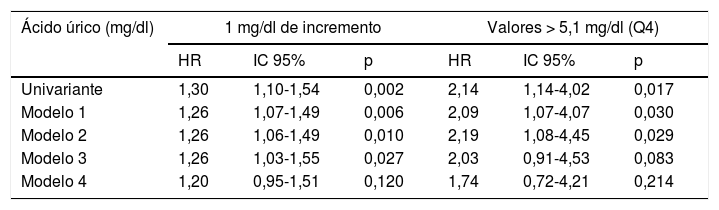
En el análisis univariante hubo un incremento del riesgo de MCV de un 30% por cada 1mg/dl de elevación de los niveles de AU (HR = 1,30; IC 95%: 1,10-1,54; p = 0,002), mientras que la presencia de cifras de AU > 5,1mg/dl duplicaron el riesgo de MCV (HR = 2,14; IC 95%: 1,14-4,02; p = 0,017). El análisis multivariante con ajuste progresivo en los sucesivos modelos queda reflejado en la tabla 2. El ajuste en el modelo 4 para parámetros de función renal atenuó de forma clínicamente importante el riesgo de MCV producido por los niveles de AU e hizo que perdiera la significación estadística.
Riesgo de mortalidad cardiovascular asociado a los niveles de ácido úrico con ajuste progresivo para factores de confusión
| Ácido úrico (mg/dl) | 1 mg/dl de incremento | Valores > 5,1 mg/dl (Q4) | ||||
|---|---|---|---|---|---|---|
| HR | IC 95% | p | HR | IC 95% | p | |
| Univariante | 1,30 | 1,10-1,54 | 0,002 | 2,14 | 1,14-4,02 | 0,017 |
| Modelo 1 | 1,26 | 1,07-1,49 | 0,006 | 2,09 | 1,07-4,07 | 0,030 |
| Modelo 2 | 1,26 | 1,06-1,49 | 0,010 | 2,19 | 1,08-4,45 | 0,029 |
| Modelo 3 | 1,26 | 1,03-1,55 | 0,027 | 2,03 | 0,91-4,53 | 0,083 |
| Modelo 4 | 1,20 | 0,95-1,51 | 0,120 | 1,74 | 0,72-4,21 | 0,214 |
Modelo 1: ajuste para edad, sexo y presencia de enfermedad cardiovascular inicial.
Modelo 2: ajuste adicional para factores de riesgo clásicos y variables relacionadas con la diabetes.
Modelo 3: ajuste adicional para variables relacionadas con síndrome metabólico.
Modelo 4: ajuste adicional para parámetros de función renal. Más información en el texto (material y métodos).
En la tabla 3 se recogen los modelos de riesgo para mortalidad total. La asociación de AU con mortalidad total fue de menor magnitud que con MCV. El riesgo conferido por los niveles de AU desapareció completamente en los modelos que ajustaron para TFG y EAU.
Riesgo de mortalidad total asociado a los niveles de ácido úrico con ajuste progresivo para factores de confusión
| Ácido úrico (mg/dl) | 1 mg/dl de incremento | Valores > 5,1 mg/dl (Q4) | ||||
|---|---|---|---|---|---|---|
| HR | IC 95% | p | HR | IC 95% | p | |
| Univariante | 1,14 | 1,03-1,27 | 0,011 | 1,49 | 1,04-2,13 | 0,028 |
| Modelo 1 | 1,11 | 1,00-1,23 | 0,047 | 1,38 | 0,95-2,02 | 0,094 |
| Modelo 2 | 1,14 | 1,02-1,27 | 0,017 | 1,50 | 1,01-2,23 | 0,046 |
| Modelo 3 | 1,11 | 0,98-1,25 | 0,106 | 1,37 | 0,87-2,15 | 0,170 |
| Modelo 4 | 1,01 | 0,88-1,16 | 0,847 | 1,03 | 0,62-1,70 | 0,908 |
Modelo 1: ajuste para edad, sexo y presencia de enfermedad cardiovascular inicial.
Modelo 2: ajuste adicional para factores de riesgo clásicos y variables relacionadas con la diabetes.
Modelo 3: ajuste adicional para variables relacionadas con síndrome metabólico.
Modelo 4: ajuste adicional para parámetros de función renal. Más información en el texto (material y métodos).
Hubo 36 pacientes con datos perdidos de colesterol LDL. La sustitución del colesterol total por el colesterol LDL no produjo una modificación clínicamente relevante de la estimación del riesgo conferido por el AU sobre el riesgo de MCV o de mortalidad total (datos no mostrados).
DiscusiónMediante un seguimiento prospectivo durante una mediana de 13 años de una cohorte de pacientes con DM2, hemos podido comprobar que los niveles elevados de AU indican un incremento del riesgo de MCV y, en menor medida, un incremento del riesgo de mortalidad total. No obstante, el efecto no es independiente, sino que parece mediado al menos en parte por la asociación entre niveles elevados de AU y alteración de los parámetros de la función renal.
La consideración del AU como un marcador de enfermedad cardiovascular procede de estudios observacionales en población general iniciados en la segunda mitad del siglo xx. En el estudio NHANES I (1971-1992) se demostró que por cada 1mg/dl de incremento de AU se producía un aumento de MCV de un 9% en varones y de un 26% en mujeres14. No obstante, en la población de Framingham los niveles de AU no predijeron el riesgo de MCV tras ajuste para otros factores de riesgo, especialmente el tratamiento diurético para la hipertensión arterial15. En estudios de aleatorización mendeliana16,17 se ha comprobado que los polimorfismos genéticos ligados a elevación de los niveles de AU se correlacionan con valores más elevados de presión arterial, IMC y triglicéridos; tras corregir para estos efectos pleiotrópicos, la asociación causal de AU con enfermedad coronaria no alcanza la significación estadística. Así pues, el AU podría ser más un marcador que un factor de riesgo, al agruparse con otros factores de riesgo vascular establecidos, especialmente hallazgos definitorios de SM y ERC10.
La coexistencia de HU con hallazgos de SM está firmemente establecida. En un reciente metaanálisis de 11 estudios prospectivos9 hubo un incremento de un 30% en el riesgo de SM por cada 1mg/dl de elevación de los valores de AU. Los mecanismos que podrían mediar esta asociación son bidireccionales: la resistencia insulínica disminuye la excreción renal de AU y la HU induce resistencia insulínica por producir disfunción endotelial, estrés oxidativo y cambios inflamatorios. No obstante, la HU no parece ser un factor causal en la inducción de DM2 en estudios de aleatorización mendeliana18.
Finalmente, hay que tener en cuenta la intrincada relación entre HU y ERC. Los sujetos hipertensos con HU y SM tienen multiplicado por 5 el riesgo de ERC19. En un análisis más reciente del NHANES20 se demostró una correlación significativa entre AU y TFG de −0,29 (similar a la de −0,23 hallada en nuestra cohorte); los valores de AU por encima del percentil 75 inducían un aumento del riesgo de MCV del 77%, que se atenuaba (perdiendo la significación estadística) hasta un 25% tras ajuste para TFG y EAU. En nuestro trabajo también se atenuó el riesgo producido por el Q4 de AU de forma clínicamente relevante (de 2,14 a 1,74), haciendo que perdiera la significación estadística tras ajuste para TFG y EAU.
Los hallazgos en pacientes con DM2 refuerzan la hipótesis de que la presencia de ERC puede confundir la asociación causal entre AU y MCV. En la cohorte de Verona6 se incluyó a pacientes con DM2 y se demostró que hubo una mayor mortalidad total y cardiovascular entre los pacientes con HU. En este estudio, el ajuste para TFG y EAU hizo perder la significación de la asociación entre HU y mortalidad total, pero no la de la HU con MCV. No obstante, hubo diferencias respecto a nuestro trabajo, al excluirse pacientes con enfermedad cardiovascular prevalente y al tener un seguimiento de solo 5 años. En la cohorte de Fremantle7, con un seguimiento de más de 10 años y sin excluir sujetos con enfermedad cardiovascular inicial, al igual que en nuestro estudio, la significación estadística de la HU para predecir MCV y mortalidad total se perdió en un modelo multivariante que ajustaba para ERC.
La relación entre HU y ERC también puede ser bidireccional: la excreción de AU está comprometida ante la pérdida de filtrado glomerular y la propia HU puede favorecer el desarrollo de ERC, debido a la aparición de estrés oxidativo y disfunción endotelial, que favorecería la hipertensión sistémica y glomerular. De hecho, hay datos que señalan que la reducción del AU puede enlentecer el deterioro de la función renal21.
Respecto a la asociación entre HU y MCV, los hallazgos de nuestro trabajo indican que el AU y la TFG pueden estar reflejando los mismos mecanismos causales en la inducción de MCV, o bien que la ERC es el mediador del incremento del riesgo de MCV en pacientes con HU. La mayor fortaleza de nuestro estudio es el haber podido mantener un seguimiento durante más de 10 años de los pacientes, con escasas pérdidas, lo que permite una estimación fiable de las tasas de MCV y refuerza la validez interna. También pudimos ajustar para los potenciales mediadores de la relación entre AU y MCV, específicamente, hallazgos de SM y ERC. En cuanto a las debilidades, hay que señalar el limitado número de sujetos, el haber dispuesto solo de niveles de AU en el momento inicial y el reclutamiento de pacientes de consultas externas hospitalarias, lo que dificulta la extrapolación al conjunto de la población de pacientes con DM. Además, las muertes súbitas fueron consideradas de origen vascular sin confirmación por necropsia, aunque la principal causa de muerte súbita es la enfermedad cardiovascular22.
En conclusión, los niveles de AU se asocian a incremento de MCV y, en menor medida, de mortalidad total, en pacientes con DM2. No obstante, la asociación puede no ser causal, sino mediada por la afectación de la función renal en los pacientes con HU. Serán necesarios estudios de intervención23 para resolver definitivamente el potencial papel causal del AU en el riesgo vascular.
Conflicto de interesesNinguno.