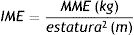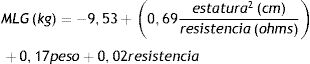Los cambios endocrinológicos debidos a la menopausia se han asociado al estrés oxidativo y la pérdida de masa muscular. El objetivo fue determinar la relación entre ambas variables en la posmenopausia temprana.
Material y métodosEstudio transversal exploratorio con 107 mujeres pre- y posmenopáusicas (40-57 años). Como marcadores de estrés oxidativo se midieron los niveles de lipoperóxidos plasmáticos y ácido úrico sérico, las enzimas antioxidantes superóxido dismutasa y glutatión peroxidasa, y la capacidad plasmática antioxidante total. También se midió la masa muscular por impedancia bioeléctrica y la fuerza por dinamometría, y se calculó masa músculo-esquelética, índice de masa esquelética, masa libre de grasa e índice de masa corporal.
ResultadosMás del 90% de las participantes fueron diagnosticadas de sobrepeso u obesidad. En las mujeres posmenopáusicas los marcadores de masa y fuerza muscular eran más bajos, con correlación negativa entre el nivel de lipoperóxidos y el índice de masa esquelética (r= –0,326, p< 0,05), y positiva entre el ácido úrico (r=0,295, p< 0,05) y el mismo índice. En un modelo multivariante que incluye los marcadores de estrés oxidativo, edad y circunferencia de cintura, se encontró que el nivel de lipoperóxidos es el que más contribuye a explicar la disminución de la masa esquelética en la posmenopausia; por cada aumento de 0,1μmol/l de lipoperóxidos hay un decremento del índice de masa esquelética de 3,03 unidades.
ConclusiónNuestros hallazgos sugieren una asociación entre el aumento del estrés oxidativo y la pérdida de masa muscular en la posmenopausia temprana.
Endocrine changes due to menopause have been associated to oxidative stress and muscle mass loss. The study objective was to determine the relationship between both variables in early postmenopause.
Material and methodsAn exploratory, cross-sectional study was conducted in 107 pre- and postmenopausal women (aged 40-57 years). Levels of serum lipid peroxides and uric acid and enzymes superoxide dismutase and glutathione peroxidase, as well as total plasma antioxidant capacity were measured as oxidative stress markers. Muscle mass using bioelectrical impedance and muscle strength using dynamometry were also measured. Muscle mass, skeletal muscle index, fat-free mass, and body mass index were calculated.
ResultsMore than 90% of participants were diagnosed with overweight or obesity. Postmenopausal women had lower values of muscle mass and strength markers, with a negative correlation between lipid peroxide level and skeletal muscle index (r= –0.326, p<.05), and a positive correlation between uric acid and skeletal muscle index (r=0.295, p<.05). A multivariate model including oxidative stress markers, age, and waist circumference showed lipid peroxide level to be the main contributor to explain the decrease in skeletal muscle mass in postmenopause, since for every 0.1μmol/l increase in lipid peroxide level, skeletal muscle index decreases by 3.03 units.
ConclusionOur findings suggest an association between increased oxidative stress and muscle mass loss in early postmenopause.
La menopausia, ocasionada por la pérdida de la actividad folicular ovárica con la consecuente disminución en la secreción de esteroides sexuales, principalmente estrógenos, afecta diversos tejidos y provoca diferentes trastornos1. De acuerdo al consenso del Taller de Etapas del Envejecimiento Reproductivo (STRAW por sus siglas en inglés), la posmenopausia se inicia a partir del último sangrado menstrual, denominándose temprana cuando abarca los siguientes 4 años después de este evento2.
En la posmenopausia se sustituye masa magra por grasa en todo el cuerpo, principalmente en la zona abdominal, incrementando el peso y la pérdida de masa muscular (MM), por lo que se puede manifestar obesidad sarcopénica1,3.
La sarcopenia es la disminución de la masa muscular esquelética (MME) y la fuerza (FM) que se produce de forma generalizada y gradual, acompañada de ganancia de grasa, cuyas alteraciones se intensifican con el envejecimiento4,5. Se ha propuesto que en las mujeres hay una disminución acelerada de MM y FM en la época de la menopausia que puede estar alineada con la deficiencia estrogénica6. La pérdida de músculo durante el envejecimiento es debida a un desequilibrio entre la síntesis de proteínas musculares, su degradación y el aumento de los factores catabólicos como el estrés oxidativo (EO), la inflamación y la disfunción mitocondrial, cuya interacción induce apoptosis por diferentes vías de señalización. En la mujer parece que la disminución estrogénica lleva a un incremento en las citosinas proinflamatorias que aceleran esta pérdida inducida por el EO7.
El EO es el desequilibrio bioquímico propiciado por el exceso de especies reactivas de oxígeno (ERO) y radicales libres que oxidan a las biomoléculas, sin efecto de los sistemas antioxidantes fisiológicos8, que se incrementa conforme avanza la edad. En la mujer, las diversas alteraciones funcionales que se presentan por la deficiencia de estrógenos tienen un papel importante en el aumento del EO, debido muy probablemente a que estas hormonas pueden funcionar como antioxidantes por diferentes mecanismos9,10.
A nivel muscular se ha demostrado que la deficiencia de estrógenos lleva a una acumulación de daño oxidativo en el tejido que contribuye a la pérdida de la homeostasis tisular, produciendo aumento en la generación de radicales libres y daño celular que podría inducir apoptosis, mecanismo clave para el desarrollo de sarcopenia11; sin embargo, los estudios sobre la función muscular y articular en la posmenopausia se han enfocado a síntomas clínicos, como el dolor debido a los cambios hormonales presentes en esta etapa12. Así mismo, las investigaciones sobre la pérdida de MM y prevalencia de sarcopenia en la posmenopausia son escasas, ya que se han enfocado a las mayores de 60 años13; por otra parte, la relación entre pérdida de MM y EO se ha referido principalmente en modelos animales14,15. Por todo ello, el objetivo de este trabajo fue determinar la relación entre el EO y la disminución de la MM en mujeres con posmenopausia temprana.
Material y métodoDiseño y participantesPara el reclutamiento se invitó a participar en el proyecto «Menopausia y estrés oxidativo» a residentes de la zona oriente de la ciudad de México durante los años 2015 y 2016. Asistieron un total de 132 mujeres; fueron candidatas para el grupo de premenopáusicas las que aún presentaban menstruación, y para el grupo de posmenopáusicas aquellas que tuvieron amenorrea espontánea de al menos 12 meses y/o niveles séricos de estradiol menor a 25 pg/ml y FSH mayor a 50 mU/ml. Del total de asistentes, 19 no desearon participar, 2 eran menores de 40 años y 4 eran mayores de 57 años, por lo que se conformó una muestra a conveniencia de 107 mujeres entre 40 y 57 años para llevar a cabo un estudio transversal exploratorio. Se formaron dos grupos, uno con 51 mujeres premenopáusicas y otro con 56 mujeres posmenopáusicas con un promedio de posmenopausia de 2,7 ± 1,5 años. En ambos grupos se incluyeron participantes sin enfermedad cardiovascular, renal, hepática, cáncer o antecedentes depresivos, de nivel socioeconómico medio, sin terapia hormonal previa ni ingesta de suplementos antioxidantes o algún otro fármaco en los últimos 6 meses, y que firmaron el consentimiento informado aprobado por el Comité de Ética de la Facultad de Estudios Superiores Zaragoza, UNAM (acuerdo 28/04/SO/3.4.1).
Medición de masa y funcionalidad muscularA todas las participantes se les realizó un análisis de impedancia bioeléctrica (Quantum III, RJL Systems; Michigan, EE. UU.) obteniendo el resultado de la resistencia en ohms, la grasa total y el porcentaje de grasa. Las mediciones del cuerpo entero se tomaron entre la muñeca y el tobillo derecho en posición supina y tras ayuno de 8 h. La FM fue obtenida con un dinamómetro hidráulico (Jamar; Illinois, EE. UU.). Se obtuvo también el peso con las participantes en ropa interior, ayuno y después de evacuar, en una báscula Torino (Tecnológica Mexicana, TLM; México) calibrada antes de cada medición, y la estatura con un estadímetro de aluminio graduado enmm. Se calculó el índice de masa corporal dividiendo el peso (kg) por la estatura (metros ymm) al cuadrado. Se midió el perímetro de la cintura con una cinta métrica graduada en 0,5cm rodeando la cintura a la altura del ombligo y sin hacer presión sobre la piel. Todas las mediciones fueron realizadas por personal técnico capacitado y supervisado para evitar sesgo.
La MME se calculó usando el dato de la impedancia bioeléctrica en la ecuación propuesta por Janssen et al.16 para mujeres:
La masa muscular absoluta se calculó con el índice de masa esquelética (IME) normalizando MME por la estatura al cuadrado16:
Se estimó la masa libre de grasa usando la ecuación propuesta por Sun et al.17:
Estado de saludEl estado de salud fue evaluado por un médico ginecólogo a través del expediente clínico abreviado orientado por problemas, y los resultados de la biometría hemática y la medición de glucosa, colesterol, triglicéridos, c-HDL y c-LDL. Estos resultados fueron interpretados respecto a los valores de referencia obtenidos para población mexicana18. Para confirmar el estado pre/posmenopáusico, se midieron los niveles de estradiol por radioinmunoensayo (Siemens; Pensilvania, EE. UU.) y FSH por quimioluminiscencia (Siemens), con una precisión intraensayo de 3,1 y 7,4%, respectivamente, y sensibilidad analítica para el estradiol de 5 pg/ml.
Medición del estrés oxidativoSe tomaron muestras sanguíneas en tubos al vacío con heparina como anticoagulante y sin anticoagulante (Becton-Dickinson; México), entre 7-9 am tras un ayuno mínimo de 8 h.
Se midió el nivel de lipoperóxidos plasmáticos (LPO) cuantificando las sustancias reactivas de ácido tiobarbitúrico (TBARS)19, método validado en nuestro laboratorio con precisión intraensayo de 6,0%. La formación artificial de TBARS en las muestras fue prevenida adicionando 10μL de butiril-hidroxitolueno 2mM en etanol al 95% inmediatamente después de la separación del plasma.
También se midió la actividad eritrocitaria de las enzimas superóxido dismutasa por el método de xantina oxidasa, y glutatión peroxidasa a través de la oxidación del glutatión; además se valoró la capacidad plasmática antioxidante total midiendo la cinética de formación del radical 2,2-azino-bis (3-etilbenztiazolina-6-ácido sulfónico (ABTS+). Los ensayos se hicieron con estuches comerciales (Randox Laboratories, Ltd., Crumlin Co., UK). Los métodos fueron validados previamente, con precisión intraensayo de 3,8%, 4,6%, y 4,3%, respectivamente. Todas las mediciones fueron realizadas en un espectrofotómetro Shimadzu UV-1601 UV-Vis (Kioto, Japón).
Con las muestras sin anticoagulante se midieron los niveles de ácido úrico y albúmina utilizando un analizador Cobas C111 (Roche Diagnostics; Basilea, Sw), con coeficientes de variación intraensayo menores al 5%. Se calculó la brecha antioxidante9,20.
Como complemento se aplicó un cuestionario estructurado sobre factores prooxidantes, considerando: tabaquismo (≥ 2cigarrillos/d), consumo de alcohol y bebidas con cafeína (≥ 2 copas o tazas/día), sedentarismo (< 30min ejercicio/d) e insomnio (≤ 6h sueño/d).
Análisis estadísticoSe estableció una disminución de MM si la mujer tenía un IME < 6,42kg/m2 y de la FM cuando la presión de la mano fue < 20kg, de acuerdo al Consenso Europeo sobre Sarcopenia4.
Fue calculada la media y desviación estándar para las variables cuantitativas con distribución normal o mediana, y rango para las de libre distribución; se establecieron frecuencias y porcentajes para las variables categóricas. Los resultados cuantitativos se compararon con la prueba de t para grupos independientes o U de Mann Whitney, según correspondía a la distribución de los datos; y los categóricos con χ2 de Pearson. Para establecer la asociación, se calculó la regresión lineal simple entre los marcadores de MM y FM como variable dependiente y los de EO como independiente, totales y estratificados por estado menopáusico. Se construyeron modelos con regresión lineal múltiple por el método saturado. Para el modelo final se incluyeron como variables independientes todos los marcadores de EO, la edad por estar relacionada con la pérdida de MM y la circunferencia de la cintura como indicador de adiposidad central ya que se asocia con el EO; y como variable dependiente el IME. Los demás marcadores musculares no mostraron asociación significativa en los modelos múltiples. Se utilizó el programa SPSS V. 20,0 (IBM SPSS Statistics, Armonk, NY, EE. UU) para el procesamiento. Se consideró un valor de p< 0,05 como estadísticamente significativo.
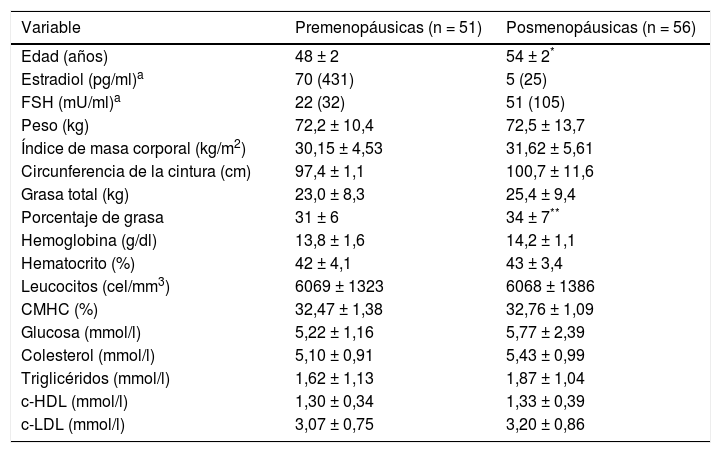
ResultadosCaracterísticas de las participantesLos grupos de estudio fueron semejantes en las mediciones antropométricas y bioquímico-hematológicas; solo resultaron diferentes en la edad, estradiol, FSH y porcentaje de grasa (p< 0,05) (tabla 1). Se observó que 46 (90%) de las premenopáusicas y 52 (93%) de las posmenopáusicas tuvieron sobrepeso/obesidad (IMC ≥ 25,00kg/m2).
Mediciones antropométricas y perfil bioquímico-hematológico en los grupos de estudio
| Variable | Premenopáusicas (n = 51) | Posmenopáusicas (n = 56) |
|---|---|---|
| Edad (años) | 48 ± 2 | 54 ± 2* |
| Estradiol (pg/ml)a | 70 (431) | 5 (25) |
| FSH (mU/ml)a | 22 (32) | 51 (105) |
| Peso (kg) | 72,2 ± 10,4 | 72,5 ± 13,7 |
| Índice de masa corporal (kg/m2) | 30,15 ± 4,53 | 31,62 ± 5,61 |
| Circunferencia de la cintura (cm) | 97,4 ± 1,1 | 100,7 ± 11,6 |
| Grasa total (kg) | 23,0 ± 8,3 | 25,4 ± 9,4 |
| Porcentaje de grasa | 31 ± 6 | 34 ± 7** |
| Hemoglobina (g/dl) | 13,8 ± 1,6 | 14,2 ± 1,1 |
| Hematocrito (%) | 42 ± 4,1 | 43 ± 3,4 |
| Leucocitos (cel/mm3) | 6069 ± 1323 | 6068 ± 1386 |
| CMHC (%) | 32,47 ± 1,38 | 32,76 ± 1,09 |
| Glucosa (mmol/l) | 5,22 ± 1,16 | 5,77 ± 2,39 |
| Colesterol (mmol/l) | 5,10 ± 0,91 | 5,43 ± 0,99 |
| Triglicéridos (mmol/l) | 1,62 ± 1,13 | 1,87 ± 1,04 |
| c-HDL (mmol/l) | 1,30 ± 0,34 | 1,33 ± 0,39 |
| c-LDL (mmol/l) | 3,07 ± 0,75 | 3,20 ± 0,86 |
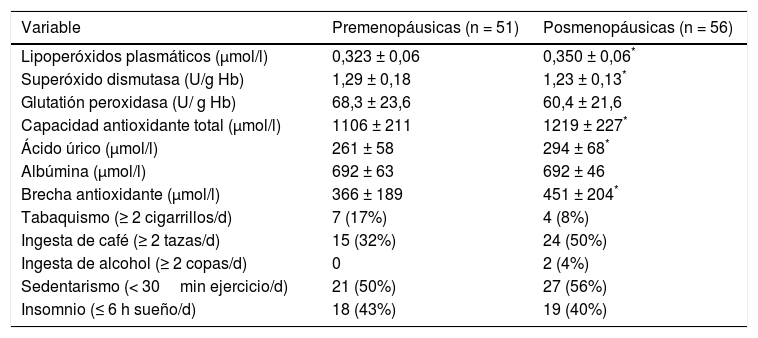
De los marcadores de EO, los LPO y los marcadores de antioxidantes plasmáticos fueron más altos en las mujeres posmenopáusicas, así como la actividad de la superóxido dismutasa fue más baja en ese grupo. Con relación a los factores prooxidantes, no hay diferencia entre los grupos (tabla 2).
Mediciones de marcadores de estrés oxidativo y factores prooxidantes en los grupos de estudio
| Variable | Premenopáusicas (n = 51) | Posmenopáusicas (n = 56) |
|---|---|---|
| Lipoperóxidos plasmáticos (μmol/l) | 0,323 ± 0,06 | 0,350 ± 0,06* |
| Superóxido dismutasa (U/g Hb) | 1,29 ± 0,18 | 1,23 ± 0,13* |
| Glutatión peroxidasa (U/ g Hb) | 68,3 ± 23,6 | 60,4 ± 21,6 |
| Capacidad antioxidante total (μmol/l) | 1106 ± 211 | 1219 ± 227* |
| Ácido úrico (μmol/l) | 261 ± 58 | 294 ± 68* |
| Albúmina (μmol/l) | 692 ± 63 | 692 ± 46 |
| Brecha antioxidante (μmol/l) | 366 ± 189 | 451 ± 204* |
| Tabaquismo (≥ 2 cigarrillos/d) | 7 (17%) | 4 (8%) |
| Ingesta de café (≥ 2 tazas/d) | 15 (32%) | 24 (50%) |
| Ingesta de alcohol (≥ 2 copas/d) | 0 | 2 (4%) |
| Sedentarismo (< 30min ejercicio/d) | 21 (50%) | 27 (56%) |
| Insomnio (≤ 6 h sueño/d) | 18 (43%) | 19 (40%) |
Prueba t para grupos independientes.
Cuatro (7%) mujeres posmenopáusicas presentaron sarcopenia y obesidad, y en las premenopáusicas la MM fue normal. Se observó que 25 (45%) mujeres posmenopáusicas y 11 (22%) participantes premenopáusicas tuvieron pérdida de FM (p< 0,05). De los marcadores musculares, la MME y FM fueron estadísticamente más bajas en las posmenopáusicas (tabla 3), encontrándose una relación negativa entre MME y la edad (r= –0,245, p< 0,05).
Marcadores de masa y función muscular en los grupos de estudio
| Marcador | Premenopáusicas (n = 51) | Posmenopáusicas (n = 56) |
|---|---|---|
| Masa muscular esquelética (kg) | 18,97 ± 2,12 | 17,78 ± 2,36* |
| Masa libre de grasa (kg) | 43,71 ± 3,98 | 42,53 ± 4,65 |
| Índice de masa esquelética (kg/m2) | 7,90 ± 0,8 | 7,75 ± 0,9 |
| Fuerza muscular (kg) | 22 ± 5 | 20 ± 5** |
Prueba t para grupos independientes.
En las mujeres posmenopáusicas se observó una correlación negativa entre el nivel de LPO y el IME (r= –0,326, r2= 0,11, p< 0,05), y positiva entre el ácido úrico y el mismo índice (r=0,295, r2= 0,09, p< 0,05).
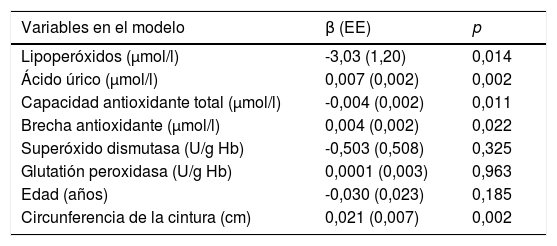
En el modelo multivariante de este mismo grupo, el nivel de LPO es el que más contribuye a la explicación del valor del IME, teniendo una relación negativa e independiente, aún después de agregar la edad y la circunferencia de la cintura al modelo. El ácido úrico se mantiene como el antioxidante más relacionado, además de los antioxidantes no enzimáticos que se asocian levemente al IME; los enzimáticos no mostraron asociación. Observamos así que por cada aumento de 0,1μmol/l de lipoperóxidos hay un decremento del IME en 3,03 unidades y por cada aumento de 1μmol/l de ácido úrico se incrementa 0,007 unidades este índice. De los factores prooxidantes, solo la circunferencia de la cintura se encontraba asociada (tabla 4).
Valores del coeficiente de β no estandarizado de los marcadores de estrés oxidativo, además de edad y circunferencia de la cintura como factores prooxidantes, en el modelo multivariante para el índice de masa esquelética en la posmenopausia
| Variables en el modelo | β (EE) | p |
|---|---|---|
| Lipoperóxidos (μmol/l) | -3,03 (1,20) | 0,014 |
| Ácido úrico (μmol/l) | 0,007 (0,002) | 0,002 |
| Capacidad antioxidante total (μmol/l) | -0,004 (0,002) | 0,011 |
| Brecha antioxidante (μmol/l) | 0,004 (0,002) | 0,022 |
| Superóxido dismutasa (U/g Hb) | -0,503 (0,508) | 0,325 |
| Glutatión peroxidasa (U/g Hb) | 0,0001 (0,003) | 0,963 |
| Edad (años) | -0,030 (0,023) | 0,185 |
| Circunferencia de la cintura (cm) | 0,021 (0,007) | 0,002 |
R: 0,516; R2: 0,267.
p< 0,0001.
Durante la transición menopáusica, la disminución de estrógenos contribuye a la pérdida de masa ósea y la redistribución de grasa subcutánea al área visceral. En este proceso, hay un menor depósito gluteofemoral con aumento de la lipogénesis visceroabdominal y disminución del efecto competitivo de la progesterona con los glucocorticoides3,6, de ahí que el sobrepeso/obesidad sea un evento muy frecuente en las mujeres en esta etapa de la vida, lo cual corroboramos al encontrar una prevalencia de sobrepeso/obesidad muy alta en ambos grupos, concordante con lo reportado en mujeres norteamericanas y españolas21,22.
Por otro lado, la caída de estrógenos tiene un efecto directo sobre el tejido muscular. Algunos estudios señalan que la MM comienza a disminuir alrededor de los 45 años, coincidente en la mujer con el periodo perimenopáusico, con una tasa de decremento de masa de 1-2% por año y disminución de la fuerza de 1,5% por año entre los 50 y 60 años23,24. En nuestra investigación pudimos comprobar que la MME disminuye notoriamente después de la menopausia, observando un 7% de posmenopáusicas sarcopénicas y 45% con pérdida de FM. En este sentido, se ha reportado una prevalencia de sarcopenia en la posmenopausia entre el 14 y 26% en personas de 50 a 70 años de edad25,26; la menor prevalencia observada en la presente investigación es debida a que el grupo de estudio fue de menor edad y en fase de posmenopausia temprana. Así mismo, resalta que la prevalencia de pérdida de la FM es mayor que la disminución de la MM, lo que sugiere que el daño muscular se inicia con la pérdida de la función en la premenopausia, aumentando en la posmenopausia.
Con la transición menopáusica hay un incremento del EO, como se señaló inicialmente. Al respecto, nuestro grupo de investigación reportó que la menopausia es un factor de riesgo para EO, probablemente debido a la disminución de los niveles estrogénicos9, lo cual es congruente con el incremento en los niveles de LPO y la disminución de los antioxidantes enzimáticos observados en este trabajo. Así mismo, se encontró una relación entre los cambios en la MM y el estrés oxidativo en la posmenopausia, asociación que ha sido analizada en modelos animales14,15, y en humanos solo en mayores de 60 años27; de ahí la importancia de este trabajo.
Al respecto, encontramos una correlación negativa entre el IME y el nivel de LPO, tanto en el modelo simple como el multivariante. En este último resulta relevante que los marcadores antioxidantes extracelulares tienen un aporte mínimo, por lo que se produce estrés oxidativo sin una respuesta antioxidante eficiente al disminuir la MM, independientemente de la edad y la circunferencia de la cintura. En este sentido, se ha propuesto que el EO es uno de los principales factores relacionados con la deficiencia muscular durante el envejecimiento con un incremento en el daño oxidativo a lípidos, proteínas y ADN28,29, como lo observado en este trabajo que muestra que por cada aumento de 0,1μmol/l de LPO disminuye el IME en 3,03 unidades. De hecho, en el músculo esquelético humano el nivel de peroxidación lipídica depende de la composición de la fibra muscular y la función del músculo30, sugiriéndose que el incremento de ERO es dañino para el mantenimiento del tamaño del músculo esquelético, pues activan importantes vías de señalización envueltas en su hipertrofia31. Es conocido que el tamaño de las fibras musculares está regulado por el balance entre la síntesis y el catabolismo de proteínas, y se señala que el EO favorece la proteólisis de las proteínas musculares de tres maneras: promoviendo la expresión génica de proteínas importantes envueltas en varios sistemas proteolíticos; incrementando el calcio libre del citosol que produce la activación de calpaina y caspasa-3; y modificando las proteínas miofibrilares aumentando su susceptibilidad al catabolismo proteolítico32, lo que lleva a la pérdida de MM.
Por otro lado, la relación positiva entre el ácido úrico y el IME es un hallazgo consistente con otros trabajos33–35. Estudios llevados a cabo en poblaciones orientales reportan una asociación positiva entre el IME y la FM con los niveles de ácido úrico séricos, destacando su papel protector contra el EO debido a su capacidad para remover ERO33, principalmente en mujeres35.
Finalmente, el diseño transversal y el pequeño tamaño de muestra son las limitaciones de este estudio; sin embargo, la consistente asociación en los diferentes modelos matemáticos de la relación entre los cambios en la MM y el estrés oxidativo después de la menopausia nos permite sugerir que hay un incremento del EO asociado a la pérdida de MM en mujeres con posmenopausia temprana, situación que no ha sido reportada en otras investigaciones, y que deberá ser corroborado en estudios longitudinales.
FinanciaciónEste trabajo fue apoyado por el programa PAPIIT-UNAM con clave de identificación IN224115.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.