Evaluar el impacto del control glucémico de la diabetes mellitus gestacional (DMG) en el peso y las complicaciones de origen metabólico neonatales de embarazos gemelares y de feto único.
MétodosEstudio observacional retrospectivo que incluyó gestantes con DMG: 120 embarazos gemelares y 240 embarazos de feto único como controles. Registramos los parámetros de control glucémico durante el embarazo (resultados de la sobrecarga oral de glucosa diagnóstica, tratamiento, insulinización, HbA1c media del tercer trimestre), las complicaciones neonatales y el peso neonatal.
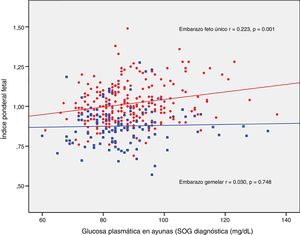
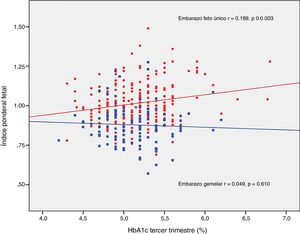
ResultadosLos neonatos de embarazos únicos tuvieron mayor índice ponderal fetal (IPF 1,02±0,12 vs. 0,88±0.12, p<0,001) y menor incidencia de pequeños para la edad gestacional grave (2,5% vs. 8,3%, p=0.012). La tasa de neonatos grandes para edad gestacional, macrosómicos y pequeños para la edad gestacional fue similar en ambos grupos. Los recién nacidos de embarazos gemelares tuvieron un mayor riesgo de hipoglucemia: OR ajustada 4,71 (1,38-16,07, p=0,013) y poliglobulia: OR ajustada 10,05 (1,82-55,42, p=0,008). El IPF se correlacionó con la glucosa basal en la sobrecarga oral de glucosa al diagnóstico (r=0,223, p=0,001) y la HbA1c media del tercer trimestre (r=0,199, p=0,003) en los embarazos únicos, pero no en los gemelares (r=0,003, p=0,748; r=0,049, p=0,610; respectivamente).
ConclusionesEl riesgo de pequeño para la edad gestacional grave, hipoglucemia y poliglobulia fue mayor en los embarazos gemelares con DMG. Los resultados de peso neonatal y las complicaciones de origen metabólico no se relacionan con el control metabólico materno en los embarazos gemelares.
To assess the impact of glycemic control in gestational on neonatal weight and metabolic complications of twin and singleton pregnancies.
MethodsAn observational, retrospective study to monitor 120 twin and 240 singleton pregnancies in women with GDM. Maternal glycemic parameters during pregnancy (oral glucose tolerance test results, treatment, insulinization rate, mean HbA1c in the third trimester), and neonatal complications and weight were recorded.
ResultsA higher infant birth weight ratio (IBWR 1.02±0.12 vs. 0.88±0.12, P<.001) and a lower rate of newborns small for gestational age (severe SGA 2.5% vs. 8.3%, P=.012) were seen after singleton pregnancies as compared to twin pregnancies. The rates of newborns large for gestational age (LGA 12.6% vs. 12.5%, P=.989); macrosomic (6.7% vs. 7.5%, P=.777); or small for gestational age (SGA 6.7% vs. 10.8%, P=.175) were similar in both groups. Neonates from twin pregnancies had a higher risk of hypoglycemia (adjusted OR 4.71; 1.38-16.07, P=.013) and polycythemia (adjusted OR 10.05; 1.82-55.42, P=0.008). A linear relationship was seen between third trimester HbA1c levels and IBWR in singleton (r=.199, P=.003), but not in twin pregnancies (r=0.049, P=0.610).
ConclusionsRisk of severe SGA, hypoglycemia, and polycythemia was significantly higher in twin pregnancies of women with GDM. Neonatal weight outcomes and metabolic complications in twin pregnancies of women with GDM were not related to glycemic control. Moreover, in our study population, fasting glucose at diagnosis and mean HbA1c in the third trimester showed a linear relationship with higher birth weights in singleton, but not in twin pregnancies.
En España el diagnóstico de diabetes mellitus gestacional (DMG) se realiza en el 8,8% de los embarazos. Dependiendo de los criterios diagnósticos aplicados la prevalencia puede ser incluso mayor en otras áreas geográficas1,2.
Los partos múltiples representan aproximadamente el 2% de todos los nacimientos en España3,4, con una tendencia creciente en las últimas décadas debido al aumento de la edad materna y al uso creciente de tratamientos de fertilidad. La incidencia de nacimientos de gemelos se incrementó un 76% entre 1980 y 2009 en los países desarrollados5. Los neonatos de embarazos múltiples conseguidos mediante técnicas de reproducción asistida suponen entre el 14,7% y el 29,0% de todos los recién nacidos de embarazos múltiples dependiendo el país6. La DMG y los embarazos múltiples logrados mediante tratamientos de fertilidad comparten algunos factores de riesgo (mayor edad materna, sobrepeso y obesidad), multiplicando la probabilidad de que estas 2 condiciones coexistan. Además, los embarazos gemelares tienen mayor riesgo de presentar complicaciones neonatales7, así como de hipertensión gestacional en comparación con embarazos de feto único8.
La DMG en embarazos únicos se asocia a un mayor riesgo de macrosomía, recién nacidos grandes para edad gestacional (GEG) y de complicaciones de origen metabólico neonatales, incluyendo hipocalcemia, hipoglucemia, poliglobulia e hiperbilirrubinemia. Sin embargo, en embarazos múltiples existe controversia acerca del impacto de la DMG. Algunos estudios han encontrado un mayor riesgo de neonatos GEG9, macrosomía4,10 y de crecimiento fetal asimétrico11, mientras que otros no han encontrado ninguna diferencia12,13. Por otro lado, parecen consistentes los datos que sugieren que la DMG ejercería un «efecto protector», reduciendo el riesgo de recién nacidos pequeños para la edad gestacional (PEG) y la restricción severa del crecimiento fetal4,11,14,15.
Varios autores han propuesto un impacto diferencial de la DMG en embarazos gemelares en comparación con embarazos de feto único. Estudios de base poblacional encontraron un menor incremento del riesgo de parto prematuro y macrosomía, y una disminución del riesgo de presentar baja puntuación de test de Apgar a los 5minutos y de muerte neonatal en embarazos gemelares, lo que sugiere un impacto más leve de la DMG9,10. Incluso se ha descrito que el control glucémico durante el embarazo no influye en el peso neonatal en los embarazos gemelares con DMG12, contrario a lo que se ha demostrado extensamente en embarazos de feto único con DMG16.
El objetivo del presente estudio fue evaluar la influencia que podría tener el control glucémico durante el embarazo, que explique las diferencias entre embarazos de gemelos y de feto único con respecto al peso neonatal (índice ponderal fetal [IPF], GEG, macrosomía, PEG y PEG grave) y las complicaciones de origen metabólico neonatales en embarazos complicados con DMG.
Material y métodosSe trata de un estudio observacional retrospectivo realizado en la Unidad de Diabetes y Embarazo del Hospital Universitario La Paz desde enero de 1999 hasta diciembre de 2012. Se incluyeron 360 mujeres: 120 embarazos gemelares y 240 embarazos de feto único que fueron atendidas durante el embarazo y fueron asistidas en el parto en nuestro centro.
Los controles fueron apareados por edad materna y año del parto entre 1.436 embarazos únicos complicados con DMG, en una proporción 2:1. Los recién nacidos de peso<0,5kg y de edad gestacional<24 semanas fueron excluidos. También fueron excluidas las pacientes con diabetes tipo 1 o tipo 2 pregestacional. El estudio fue aprobado por el comité ético institucional.
El diagnóstico de DMG se realizó con una estrategia en 2 pasos: cribado universal en la semana 24-28 de gestación o en el primer trimestre en mujeres con factores de riesgo (edad materna>35 años, obesidad pregestacional, antecedente personal de diabetes mellitus gestacional o hijo macrosómico, familiar de primer grado con diabetes mellitus). En los casos positivos (glucosa plasmática a la 1.ª hora ≥140mg/dl en sobrecarga oral de glucosa [SOG] con 50g) se realizó una SOG con 100g. El diagnóstico de DMG se hizo según los criterios de National Diabetes Data Group17. Además, se registró la edad gestacional al diagnóstico de DMG.
La edad gestacional se determinó en embarazos espontáneos a partir de la fecha de la última menstruación corregida por ecografía de primer trimestre. En embarazos conseguidos por técnicas de reproducción asistida se utilizó la fecha de recuperación de ovocitos corregida por ecografía de primer trimestre.
Las mujeres fueron clasificadas según su IMC pregestacional: bajo peso (IMC inferior a 18,5), peso normal (IMC 18,5-24,9), sobrepeso (IMC 25-29,9) y obesidad (IMC 30 o mayor)18. Se calculó la tasa de ganancia de peso materno como: aumento ponderal materno–peso neonatal/total semanas de gestación19.
Todas las mujeres recibieron consejo dietético impartido por enfermeras cualificadas basado en el índice de masa corporal (IMC) pregestacional y la actividad física habitual (25-40kcal/kg/día).
Las determinaciones de glucosa capilar fueron evaluadas cada 2-3 semanas en visitas médicas. Se agregó insulina al tratamiento dietético si la glucosa en ayunas era ≥95mg/dl o ≥120mg/dl 2 horas posprandial. En nuestro centro no se utiliza ningún fármaco oral para el control de la glucemia. Se determinó la HbA1c mensualmente tras el diagnóstico de DMG y se definió como mal control metabólico a los valores promedio de HbA1c del tercer trimestre por encima del tercer cuartil ([mediana 5,1%, 32mmol/mol] [rango intercuartílico 4,9-5,4%, 30-36mmol/mol]).
La glucosa sérica se midió por el método de la glucosa oxidasa (Hitachi 717, Boehringer, Mannheim, Alemania). La HbA1c se determinó por cromatografía líquida de alto rendimiento en autoanalizadores Diamat y Variant (BioRad, Richmond, CA), con resultados intercambiables calibrados para el rango de normalidad de acuerdo al Diabetes Control and Complications Trial20–22. Todas las mediciones fueron realizadas después de ayuno nocturno.
Se utilizaron las tablas de peso neonatales españolas para embarazos de feto único y gemelares23 para determinar el índice ponderal fetal (IPF: peso real al nacer/P50 de peso para la edad gestacional)24, recién nacidos GEG (peso neonatal>P90 o al menos un gemelo con peso>P90), recién nacidos PEG (peso neonatal<P10 o al menos un gemelo con peso<P10), recién nacidos PEG grave (peso neonatal<P5 o al menos un gemelo con peso<P5) y macrosomía (peso neonatal>P95 o al menos un gemelo con peso>P95)4,25,26.
Registramos la aparición de complicaciones neonatales de origen metabólico27: hipocalcemia (calcio sérico menor de 7mg/dl o calcio iónico menor de 4mg/dl), hipoglucemia (menor de 40mg/dl en las primeras 24 horas de vida), poliglobulia (hematocrito venoso mayor 65%) e hiperbilirrubinemia (según edad gestacional y el tiempo de vida extrauterina)28.
También documentamos otras variables materno-fetales, incluyendo método de concepción, paridad materna, trastornos hipertensivos del embarazo, edad gestacional al parto, parto prematuro (antes de las 37 semanas de gestación) y parto pretérmino temprano (antes de las 34 semanas de gestación), vía del parto, síndrome de distrés respiratorio (definido como disnea progresiva en las primeras 24 horas de vida que precisa de oxígeno suplementario), traumatismo obstétrico (distocia de hombro, parálisis braquial y/o desproporción céfalo pélvica), sepsis neonatal (cultivo positivo acompañado de cuadro clínico compatible), malformaciones congénitas graves (aquellas que causaran muerte neonatal, discapacidad significativa o que requirieran cirugía mayor para su corrección) y muerte neonatal.
Se definió como hipertensión inducida por el embarazo la presencia de presión arterial sistólica ≥140mmHg o presión arterial diastólica ≥90mmHg después de las 20 semanas de gestación y preeclampsia si se acompañara de proteinuria ≥30mg/mmol creatinina29.
En los embarazos gemelares la corionicidad (mono/bicorial) fue evaluada por ecografía y confirmada tras el alumbramiento por obstetras y por informes de patología, en los casos disponibles.
El objetivo primario fue comparar el efecto del control glucémico DMG en el peso neonatal (IPF, GEG, macrosomía PEG y PEG grave) y las complicaciones de origen metabólico fetales entre embarazos gemelares y de feto único.
Para el análisis estadístico se consideró un embarazo gemelar complicado como una unidad con uno o ambos gemelos afectados. Las comparaciones entre los grupos de estudio se realizaron usando la «t» de Student para variables cuantitativas y la Chi cuadrado o test exacto de Fisher para las variables categóricas. Se utilizó una regresión logística múltiple ajustada para evaluar la influencia de posibles factores de confusión en la asociación entre gestación múltiple y peso al nacimiento (ajustada por IMC materno antes del embarazo, tasa de ganancia ponderal materna, parto prematuro, malformaciones fetales severas, corionicidad, hipertensión o preeclampsia, hábito de fumar y paridad), y entre gestación múltiple y las complicaciones neonatales (edad materna, IMC materno antes del embarazo, tasa de ganancia ponderal materna, edad gestacional al parto, malformaciones fetales severas, corionicidad, hipertensión o preeclampsia, hábito de fumar, vía del parto y paridad).
Para analizar la influencia del control glucémico durante el embarazo se determinó el coeficiente de correlación de Pearson para medir la relación entre IPF con la glucosa en ayunas en la SOG al diagnóstico, y con la HbA1c media del tercer trimestre. También se realizó un subanálisis de la incidencia de complicaciones de origen metabólico fetales en las pacientes con mal control metabólico (HbA1c del tercer trimestre por encima del tercer cuartil [>5,4%, 36mmol/mol]). Además, se analizaron las variables de peso neonatal en el subgrupo de pacientes que precisaron insulina. Se utilizó SPSS versión 20 (Chicago, IL, EE. UU.) para el análisis de datos. La significación estadística se fijó en valores de p<0,050.
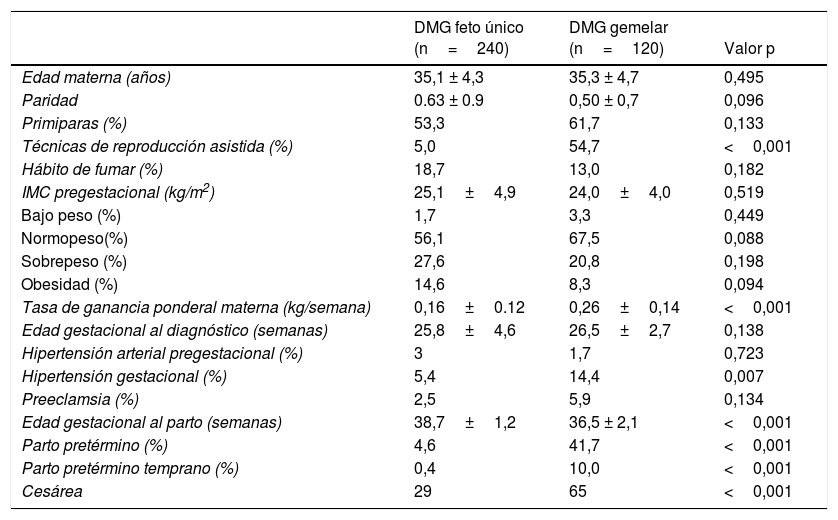
ResultadosResultados maternosLas características de las gestantes con diabetes gestacional se presentan en la tabla 1. Encontramos una mayor tasa de embarazos conseguidos por técnicas de reproducción asistida en el grupo de embarazos gemelares. El 87,9% de los embarazos gemelares fueron bicoriales. La tasa de ganancia ponderal materna fue significativamente mayor en el grupo de embarazos gemelares 0,26±0,14 vs. 0,16±0,12kg/semana, p<0,001. La hipertensión gestacional fue mayor en los embarazos gemelares (14,4 vs. 5,4%, p=0,007), pero no la tasa de preeclampsia (5,9 vs. 2,5%, p=0,134).
Características de las mujeres con DMG con embarazos de feto único y gemelares
| DMG feto único (n=240) | DMG gemelar (n=120) | Valor p | |
|---|---|---|---|
| Edad materna (años) | 35,1 ± 4,3 | 35,3 ± 4,7 | 0,495 |
| Paridad | 0.63 ± 0.9 | 0,50 ± 0,7 | 0,096 |
| Primiparas (%) | 53,3 | 61,7 | 0,133 |
| Técnicas de reproducción asistida (%) | 5,0 | 54,7 | <0,001 |
| Hábito de fumar (%) | 18,7 | 13,0 | 0,182 |
| IMC pregestacional (kg/m2) | 25,1±4,9 | 24,0±4,0 | 0,519 |
| Bajo peso (%) | 1,7 | 3,3 | 0,449 |
| Normopeso(%) | 56,1 | 67,5 | 0,088 |
| Sobrepeso (%) | 27,6 | 20,8 | 0,198 |
| Obesidad (%) | 14,6 | 8,3 | 0,094 |
| Tasa de ganancia ponderal materna (kg/semana) | 0,16±0.12 | 0,26±0,14 | <0,001 |
| Edad gestacional al diagnóstico (semanas) | 25,8±4,6 | 26,5±2,7 | 0,138 |
| Hipertensión arterial pregestacional (%) | 3 | 1,7 | 0,723 |
| Hipertensión gestacional (%) | 5,4 | 14,4 | 0,007 |
| Preeclamsia (%) | 2,5 | 5,9 | 0,134 |
| Edad gestacional al parto (semanas) | 38,7±1,2 | 36,5 ± 2,1 | <0,001 |
| Parto pretérmino (%) | 4,6 | 41,7 | <0,001 |
| Parto pretérmino temprano (%) | 0,4 | 10,0 | <0,001 |
| Cesárea | 29 | 65 | <0,001 |
Datos presentados como media±desviación estándar (DE) o como porcentaje; parto pretérmino<37 semanas; parto pretérmino temprano<34 semanas. La significación estadística se fijó en valores de p<0,050.
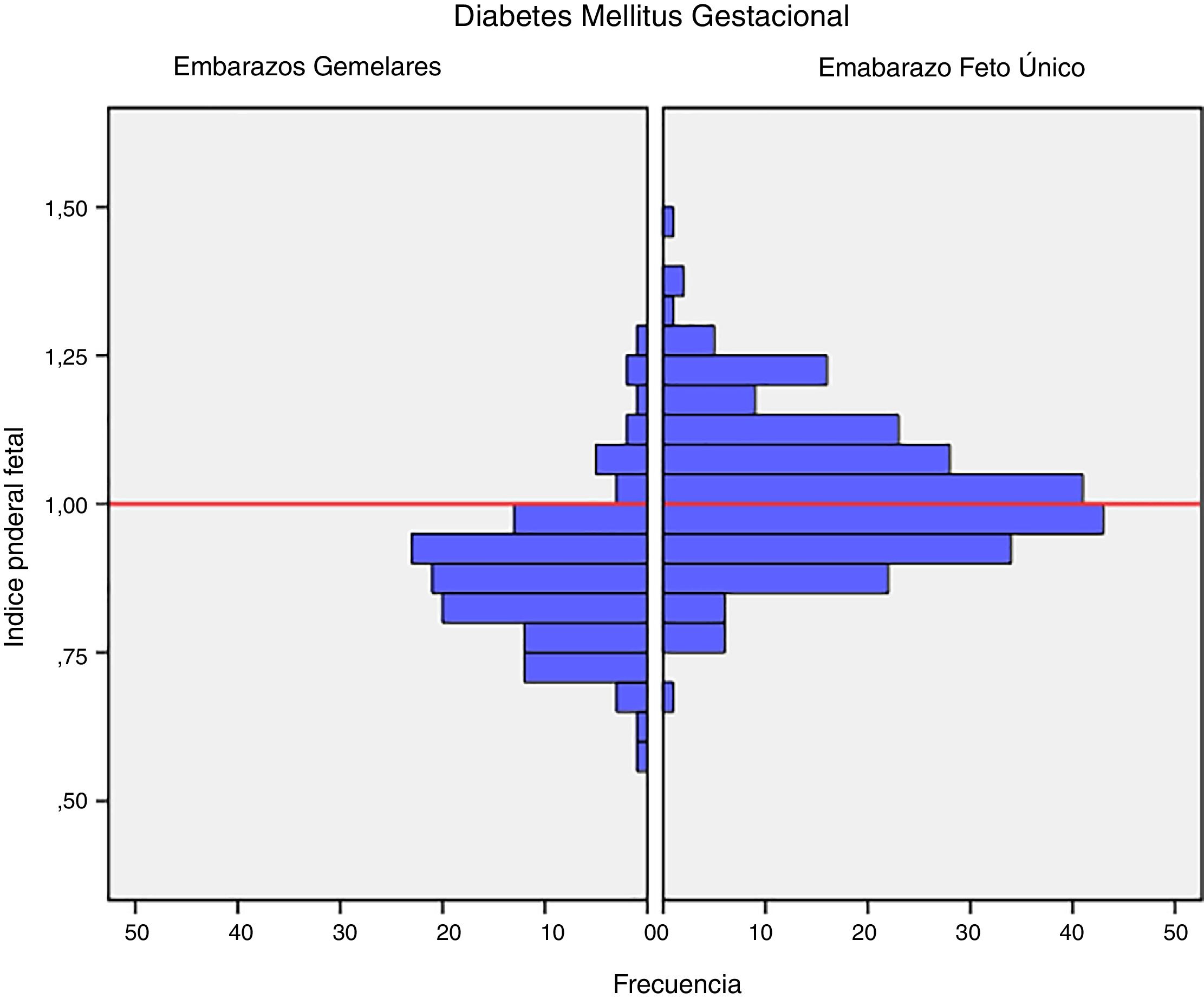
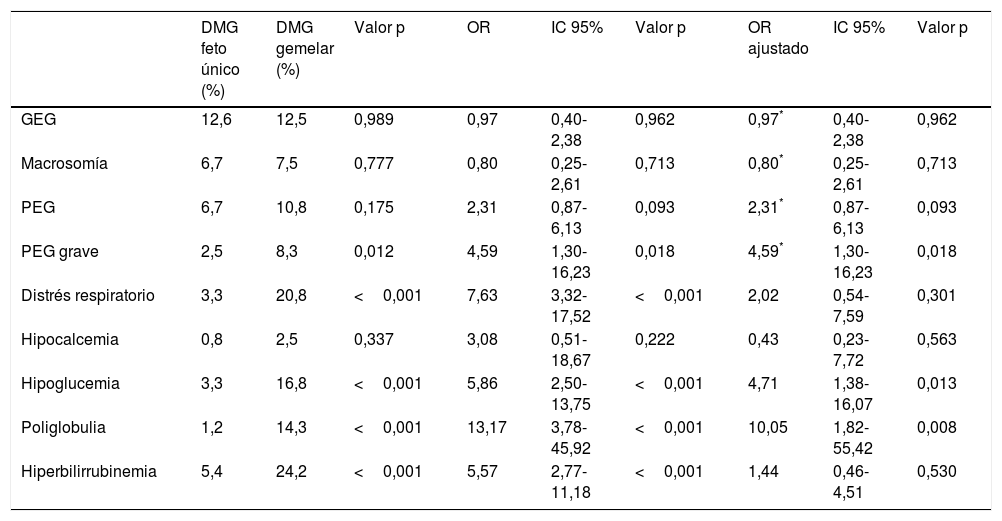
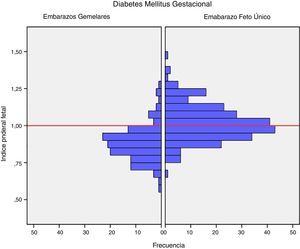
El peso medio al nacer fue mayor en los recién nacidos de embarazos de feto único con DMG (3.206,4g±381,6g vs. 2.382,3g±408,9g, p<0,001). El índice ponderal fetal también fue mayor en los embarazos de feto único 1,02±0,12 vs. 0,88±0,12 en los recién nacidos de embarazos gemelares, p<0,001 (fig. 1). La incidencia de neonatos PEG graves fue significativamente menor en el grupo de embarazos únicos (2,5% vs. 8,3%, p=0,012). No hubo diferencias en la incidencia de recién nacidos GEG, macrosomía o PEG en el grupo de embarazos de fetos únicos en comparación con grupo de gestación gemelar (tabla 2).
Complicaciones neonatales en embarazos complicados con DMG de feto único y gemelares
| DMG feto único (%) | DMG gemelar (%) | Valor p | OR | IC 95% | Valor p | OR ajustado | IC 95% | Valor p | |
|---|---|---|---|---|---|---|---|---|---|
| GEG | 12,6 | 12,5 | 0,989 | 0,97 | 0,40-2,38 | 0,962 | 0,97* | 0,40-2,38 | 0,962 |
| Macrosomía | 6,7 | 7,5 | 0,777 | 0,80 | 0,25-2,61 | 0,713 | 0,80* | 0,25-2,61 | 0,713 |
| PEG | 6,7 | 10,8 | 0,175 | 2,31 | 0,87-6,13 | 0,093 | 2,31* | 0,87-6,13 | 0,093 |
| PEG grave | 2,5 | 8,3 | 0,012 | 4,59 | 1,30-16,23 | 0,018 | 4,59* | 1,30-16,23 | 0,018 |
| Distrés respiratorio | 3,3 | 20,8 | <0,001 | 7,63 | 3,32-17,52 | <0,001 | 2,02 | 0,54-7,59 | 0,301 |
| Hipocalcemia | 0,8 | 2,5 | 0,337 | 3,08 | 0,51-18,67 | 0,222 | 0,43 | 0,23-7,72 | 0,563 |
| Hipoglucemia | 3,3 | 16,8 | <0,001 | 5,86 | 2,50-13,75 | <0,001 | 4,71 | 1,38-16,07 | 0,013 |
| Poliglobulia | 1,2 | 14,3 | <0,001 | 13,17 | 3,78-45,92 | <0,001 | 10,05 | 1,82-55,42 | 0,008 |
| Hiperbilirrubinemia | 5,4 | 24,2 | <0,001 | 5,57 | 2,77-11,18 | <0,001 | 1,44 | 0,46-4,51 | 0,530 |
OR ajustada por edad materna, IMC pregestacional materno, tasa de ganancia ponderal materna, edad gestacional al parto, malformaciones congénitas graves, corionicidad, hipertensión arterial, preeclamsia, hábito tabáquico, vía del parto y paridad.
GEG: grande para edad gestacional; PEG: pequeño para edad gestacional.
Al comparar la tasa de complicaciones neonatales, en los embarazos de feto único observamos una menor tasa de síndrome de distrés respiratorio (3,3% vs. 20,8%, p<0,001), y una menor incidencia de hipoglucemia (3,3% vs. 16.8%, p<0,001), poliglobulia (1,2% vs. 14.3%, p<0,001) e hiperbilirrubinemia (5,4% vs. 24,2%, p<0,001). No hubo ninguna muerte neonatal en nuestra población de estudio.
Tras ajustar los resultados por posibles factores de confusión, el riesgo de hipoglucemia y poliglobulia se mantuvo más elevado en los recién nacidos de embarazo gemelar. Con respecto a las asociaciones entre gestación gemelar y el peso neonatal, el riesgo de recién nacidos PEG grave fue 4,59 veces mayor en el grupo de embarazo gemelar en comparación con los embarazos de feto único (IC: 1,3-16,23, p=0,018) (tabla 2).
Control glucémicoHemos analizado un posible efecto del control glucémico y el tipo de tratamiento recibido durante la gestación sobre el peso del recién nacido. En nuestra población de estudio la media de la HbA1c del tercer trimestre fue 5,2±0,4 (33mmol/mol±4,2), y la mediana fue 5,1% (32mmol/mol), (rango intercuartílico 4,9-5,4%, 30-36mmol/mol). No hubo diferencias en los valores de HbA1c entre los grupos de estudio (tabla 3).
HbA1c del tercer trimestre en embarazos complicados con DMG de feto único y gemelares
| HbA1c tercer trimestre | DMG feto único (n=240) | DMG gemelar (n=120) | Valor p |
|---|---|---|---|
| %, mmol/mol | 5„2 ± 0,4 33 ± 4,3 | 5,1±0,4 32±4,0 | 0,407 |
| %, mmol/mol | 5,2 (RIC: 4,9-5,4)33 (RIC: 30-36) | 5,1 (RIC: 4,9-5,3)32 (RIC: 30-34) | 0,880 |
| Tratamiento con insulina | DMG feto único (n=126) | DMG gemelar (n=31) | |
| %, mmol/mol | 5,1 (RIC: 4,8-5,3) 32 (RIC: 9-34) | 5,0 (RIC: 4,9-5,3)31 (RIC: 30-34) | 0,357 |
Datos presentados como media±desviación estándar, o como mediana y rango intercuartílico (RIC). La significación estadística se fijó en valores de p<0,050.
La tasa de insulinización fue mayor en los embarazos de feto único en comparación con las gestaciones gemelares (52,5% vs. 26,1%, p<0,001). La dosis media de insulina para alcanzar un adecuado control glucémico fue 0,29±0,14UI/kg en embarazos de feto único vs. 0,34±0,16, p=0,028 en los embarazos gemelares.
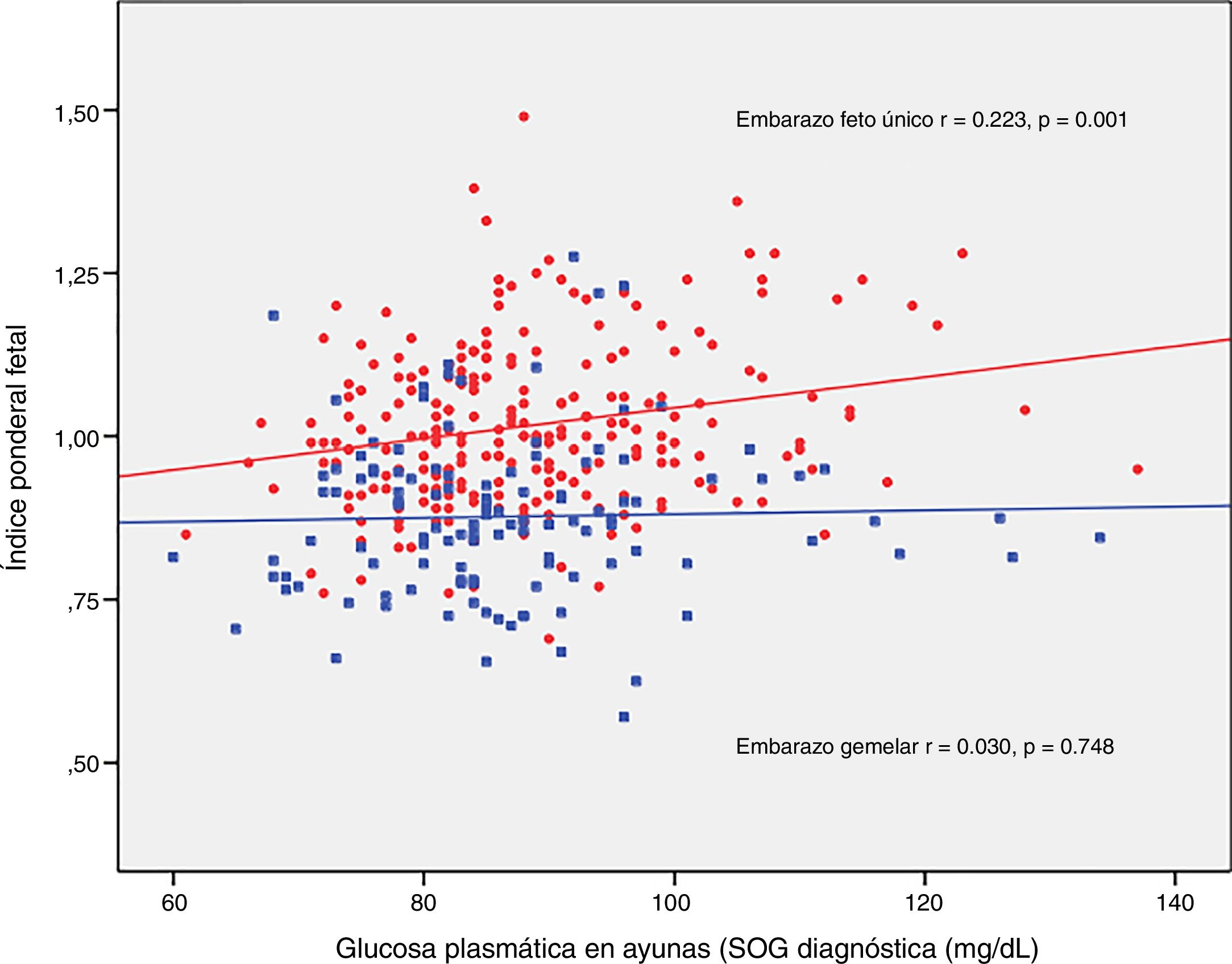
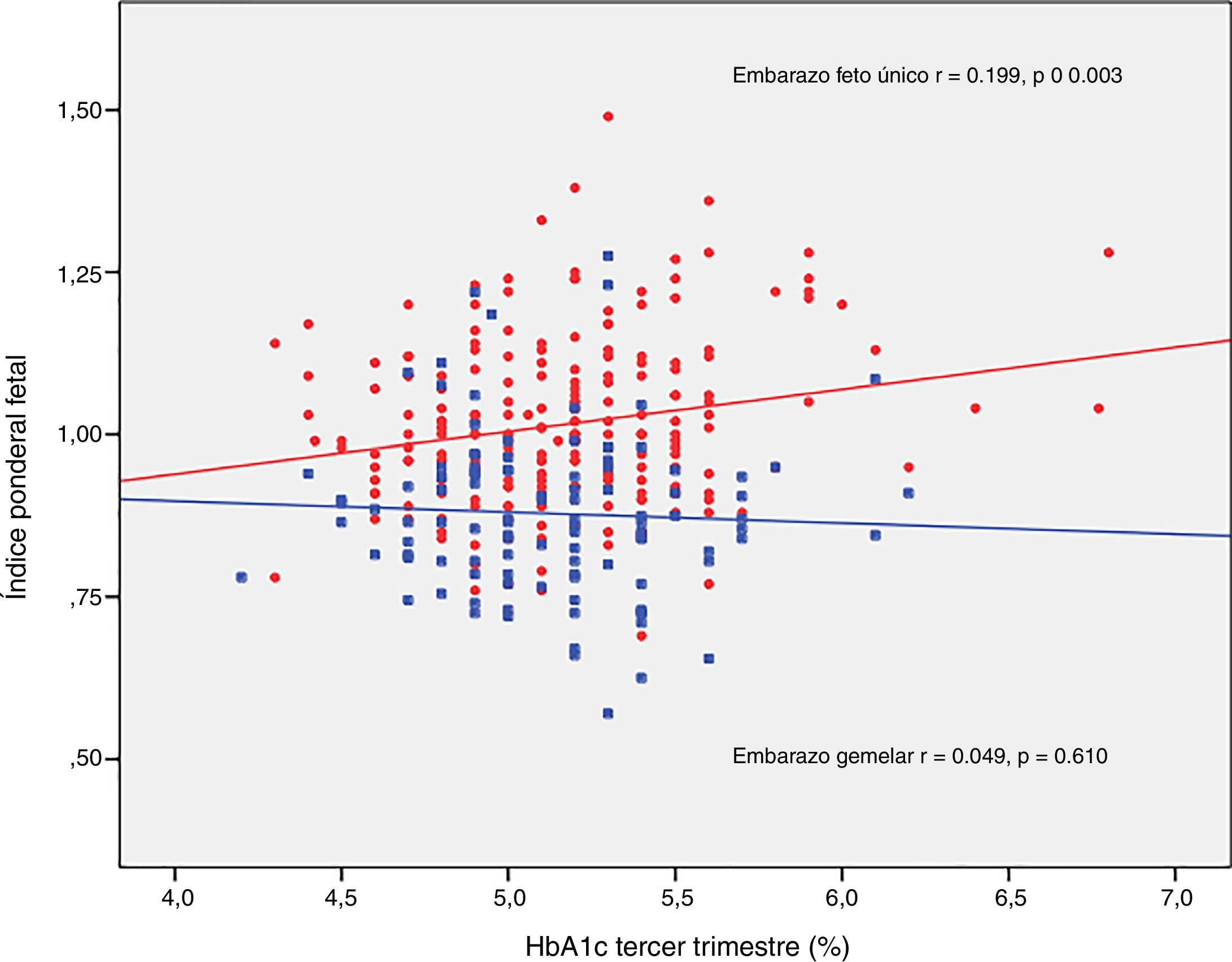
El IPF se correlacionó con la glucosa en ayunas en la SOG al diagnóstico (r=0,223, p=0,001) y con la HbA1c media del tercer trimestre (r=0,199, p=0,003) en los embarazos únicos, pero no en los embarazos gemelares (r=0,030, p=0,748; r=0,049, p=0,610, respectivamente) (figs. 2 y 3).
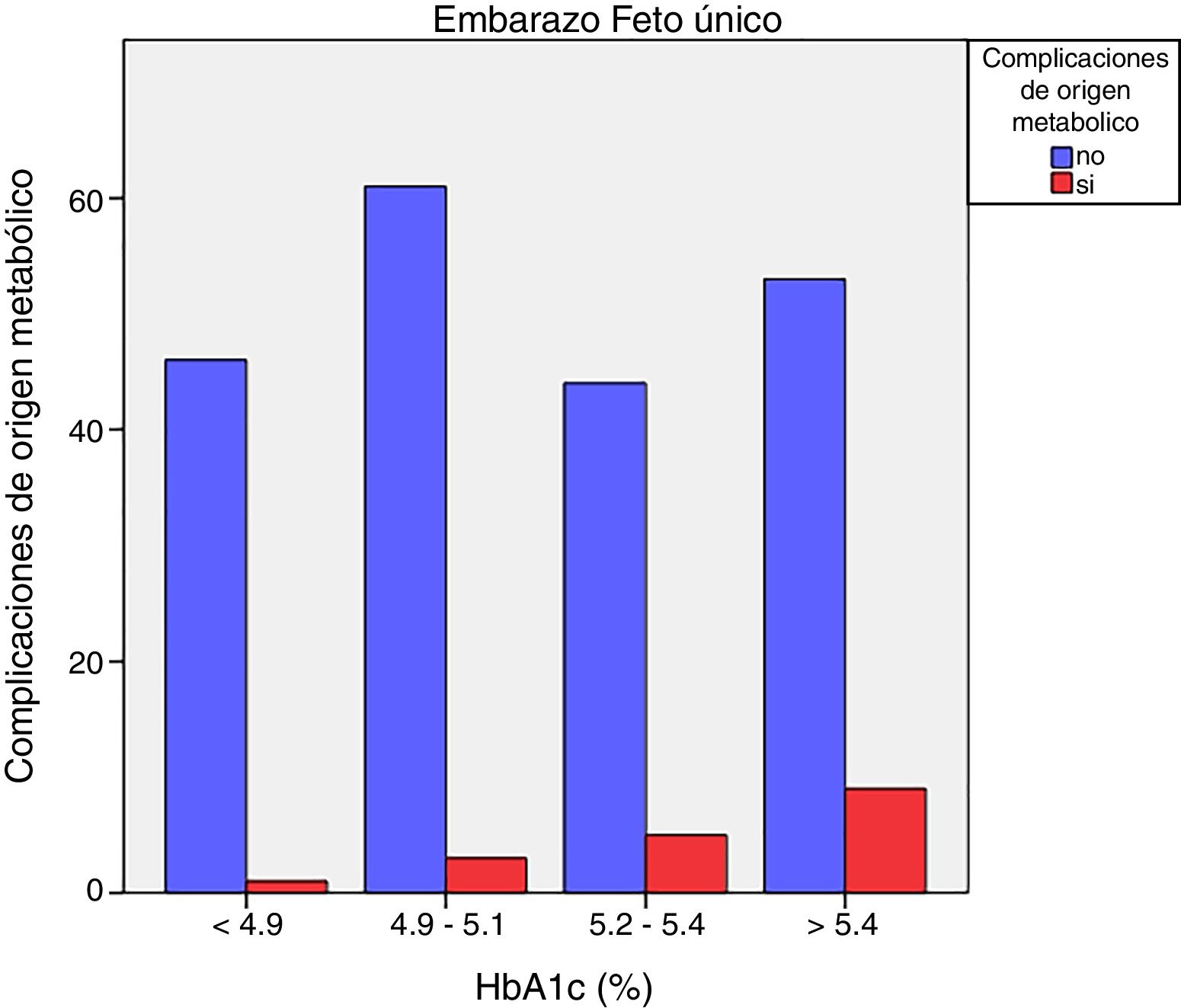
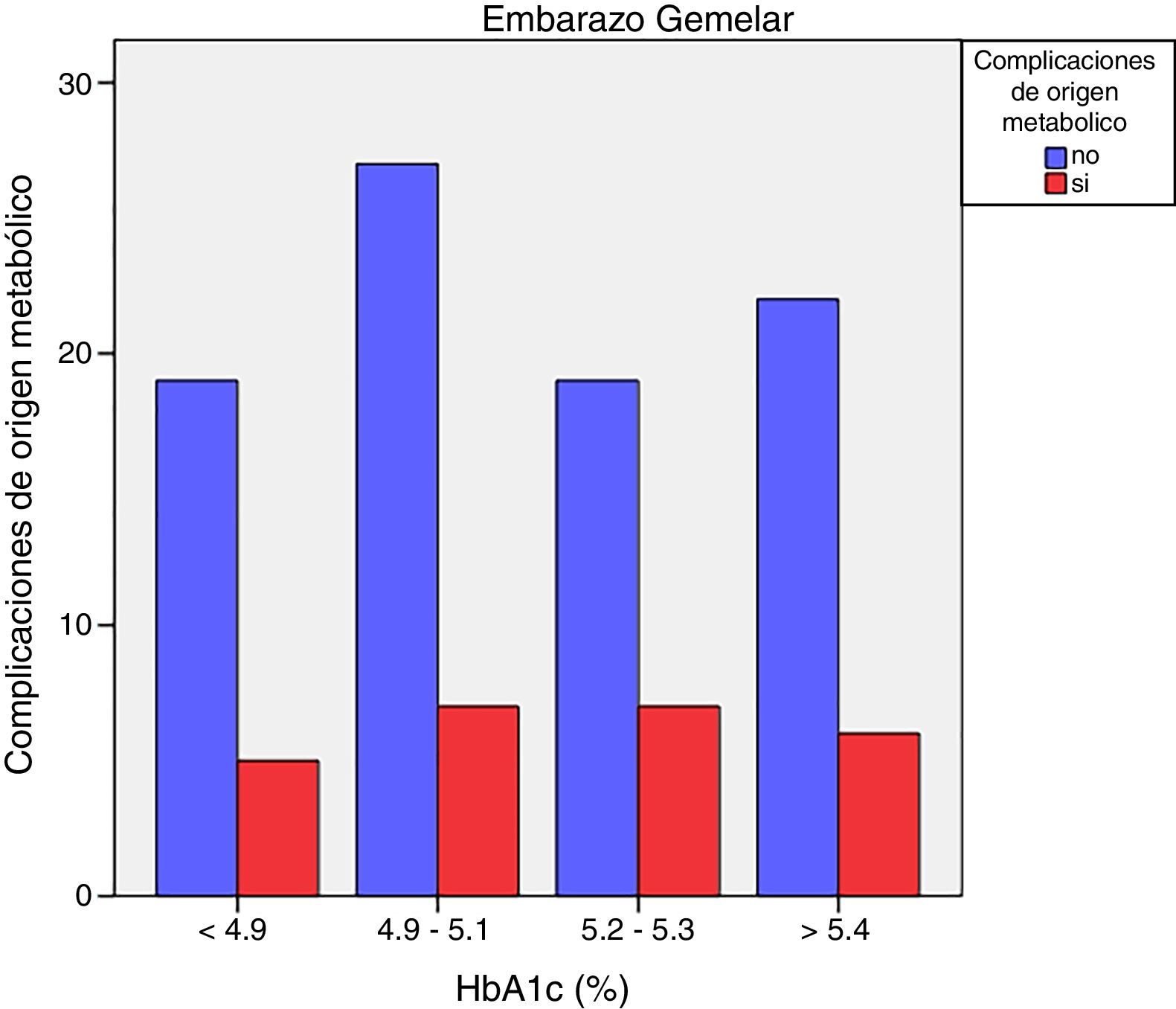
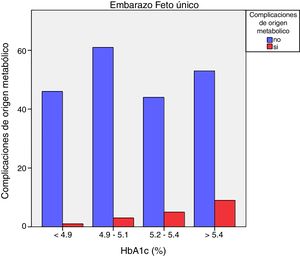
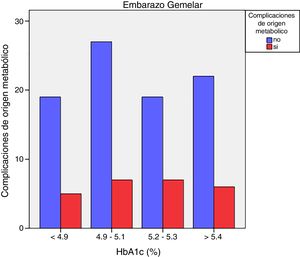
Las complicaciones de origen metabólico neonatales (hipocalcemia, hipoglucemia, poliglobulia e hiperbilirrubinemia) fueron más altas en las mujeres que tuvieron valores de HbA1c del tercer trimestre mayores de 5,4%: 14,5% vs. 5,6%, p=0,050 en embarazos de feto único, pero no en los embarazos gemelares (22,6% vs. 21,4%, p=1,000) (figs. 4 y 5)
Con respecto a los embarazos que precisaron insulina el IPF medio fue significativamente menor en los recién nacidos de gestaciones gemelares en este subgrupo también (1,03±0,13 vs. 0,90±0,15, p<0,001). No se encontró ninguna diferencia entre embarazos de feto único y gemelar en la incidencia de neonatos GEG (17,5% vs. 19,4%, p=0,805), macrosomía (10,3% vs. 6,5%, p=0.737); la incidencia de recién nacidos PEG (5,6% vs. 9,7%, p=0,415), PEG grave (1,6% vs. 6.5%, p=0,099) fue mayor en el grupo de recién nacidos de embarazos gemelares, aunque esta diferencia no fue estadísticamente significativa.
DiscusiónNuestro estudio apoya un efecto divergente de la diabetes mellitus gestacional sobre el peso neonatal en los embarazos de feto único y gemelares. De hecho, el índice ponderal fetal tuvo una distribución diferente en los grupos de comparación. En los embarazos de feto único tuvo una distribución normal alrededor del percentil 50, pero se encontró desviado hacia el percentil 25-50 en los embarazos gemelares. Este cambio en la distribución del peso neonatal se traduce en un incremento en la incidencia de recién nacidos pequeños para la edad gestacional por debajo del percentil 5 en los embarazos gemelares (8,3% vs. 2,5%). Además, la glucosa en ayunas al diagnóstico y la HbA1c mostraron una relación lineal con el IPF solo en los embarazos de feto único, pero no en los gemelos.
En los embarazos gemelares, la elevada prevalencia de factores de riesgo para la restricción del crecimiento y el bajo peso al nacer (mayor incidencia de trastornos hipertensivos del embarazo y parto prematuro7,8), probablemente contrarresten el impacto de la diabetes mellitus gestacional en el crecimiento fetal excesivo.
En un estudio previo Tward et al. describieron un crecimiento asimétrico excesivo en embarazos gemelares con DMG determinado por el cociente de la circunferencia abdominal/circunferencia de la cabeza en la última ecografía antes del parto, y este hallazgo se correlacionó con la glucemia al diagnóstico de DMG. También encontraron una mayor proporción de recién nacidos en el grupo de percentil de peso más alto al nacimiento y una menor proporción de fetos en el percentil de peso más bajo11. De hecho, este efecto promotor del crecimiento fetal ha sido puesto de manifiesto en varias publicaciones, en las que se ha documentado que la DMG en embarazos gemelares produce una reducción en la incidencia de recién nacidos PEG4,11,14,15.
Dada la baja probabilidad de eventos desfavorables tales como macrosomía, distocia de hombros y parto traumático en los embarazos gemelares, la disminución en la incidencia de recién nacidos de bajo peso al nacer podría contribuir a disminuir la morbilidad perinatal en general9,10.
En nuestra población de estudio el peso neonatal en embarazos gemelares con DMG no se relacionó con la glucemia en ayunas al diagnóstico o el control glucémico durante el embarazo, en consonancia con lo reportado previamente por nuestro grupo al comparar embarazos gemelares con y sin DMG12. No hubo diferencias en los valores de HbA1c media del tercer trimestre, a pesar de que las mujeres con embarazos gemelares tuvieron una mayor tasa de ganancia ponderal y una menor tasa de insulinización (52,5% vs. 26,1%).
Con respecto a las complicaciones neonatales de origen metabólico, observamos un incremento del riesgo de hipoglucemia y poliglobulia en los embarazos gemelares en comparación con los embarazos de feto único. El principal factor de riesgo para el incremento en la incidencia en las complicaciones neonatales es la prematuridad y el bajo peso al nacimiento inherente a esta condición30. Se ha descrito que los recién nacidos prematuros de embarazos múltiples tienen un incremento adicional de mortalidad en comparación con los recién nacidos de embarazos únicos de igual edad gestacional31.
Tanto la diabetes mellitus gestacional, como la prematuridad y los embarazos múltiples incrementan el riesgo de complicaciones de origen metabólico en el periodo perinatal inmediato, ya que condicionan una peor adaptación a la vida extrauterina. En nuestra cohorte la edad gestacional al parto y el peso al nacimiento fueron significativamente menores en el grupo de embarazo múltiple, multiplicando de esta manera la probabilidad de aparición de dichas complicaciones.
Una limitación a tener en cuenta en nuestro estudio es que se trata de un análisis retrospectivo, y no podemos descartar en nuestra población la influencia de otros factores como la insuficiencia placentaria, la hipoxia aguda perinatal, el retraso en el camplaje del cordón umbilical y el síndrome de transfusión feto-fetal en el incremento de la frecuencia de la policitemia neonatal.
Así mismo, las complicaciones de origen metabólico neonatales fueron más frecuentes en las mujeres con niveles de HbA1c del tercer trimestre más elevados solo en embarazos de feto único, como ha sido documentado previamente en la literatura12,16.
En nuestra cohorte, los embarazos gemelares requirieron una dosis mayor de insulina que los embarazos de feto único 0,34±0,16 vs. 0,29±0,14UI/kg para lograr el mismo control de la glucemia. Esta diferencia puede ser debida a un sesgo de selección causado por un enfoque de tratamiento conservador, en ausencia de crecimiento fetal excesivo, intensificando el tratamiento solo en aquellos embarazos gemelares con hiperglucemia evidente.
Estudios de base poblacional han propuesto previamente un impacto diferencial de la DMG en embarazos de feto único y gemelares. Una limitación importante de estos estudios es que los datos relativos a otros modificadores conocidos del crecimiento fetal, como la corionicidad, el IMC materno antes del embarazo, los protocolos de manejo y el control de la glucemia no se encontraban disponibles9,10. Este es el primer estudio que compara el control de la glucemia durante el embarazo en gestaciones complicadas con DMG en embarazos de feto único y gemelares. No hubo ninguna relación entre las variables de peso o las complicaciones neonatales y el control de la glucemia materna o el tipo de tratamiento recibido (solo dieta o dieta e insulina) en los embarazos gemelares en nuestra población de estudio.
El presente reporte apoya la hipótesis de que existen otros factores, como la incidencia de parto prematuro, tanto espontáneo como médicamente indicado, que tienen una mayor contribución sobre el peso neonatal y el aumento de la morbilidad perinatal que el control glucémico de la DMG en los embarazos gemelares.
Una limitación de nuestro estudio es el pequeño tamaño muestral, que podría enmascarar diferencias pequeñas. También es importante considerar que, en nuestra cohorte, todas las pacientes recibieron tratamiento siguiendo un protocolo de manejo estricto de la glucemia, y dicha intervención puede minimizar el impacto observado sobre el crecimiento fetal excesivo. Sin embargo, llama la atención el incremento del riesgo de recién nacidos pequeños para la edad gestacional grave en embarazos gemelares en los que no se puede descartar la influencia de sobretratamiento durante la gestación.
Estudios futuros deben determinar si las mujeres con embarazos gemelares complicados con DMG y sus hijos pertenecen a un grupo de alto riesgo metabólico y cardiovascular a largo plazo, como ha sido documentado en embarazos de feto único.
Protocolos de manejo específicos para embarazos gemelares complicados con DMG, con objetivos de control menos estrictos, podrían ser apropiados para estas mujeres, especialmente en ausencia de crecimiento fetal excesivo o asimétrico.
ConclusionesLa incidencia de PEG grave, hipoglucemia y poliglobulia fue mayor en los embarazos gemelares con DMG que en los embarazos de feto único con DMG. En nuestra población de estudio la glucosa basal al diagnóstico y la HbA1c del tercer trimestre mostraron una relación lineal con un incremento de peso neonatal solo en embarazos únicos.
AutoríaMaría A. Guillén, Lucrecia Herranz, Natalia Hillman y María A. Burgos colaboraron en la recolección de datos, María A. Guillén analizó los datos y escribió el manuscrito. Lucrecia Herranz y Beatriz Barquiel revisaron y editaron el manuscrito. Todos los autores han participado en la interpretación y discusión del manuscrito remitido.
Conflicto de interesesNinguno.