En los últimos años se han producido avances en el conocimiento de los cambios que experimenta el eje suprarrenal durante las distintas fases de la enfermedad crítica. Dichos avances han cristalizado en un cambio de paradigma, de modo que las referidas adaptaciones ya no se consideran resultado de la activación del eje a nivel hipotalámico, como se ha considerado tradicionalmente, sino fruto de una disminución en el metabolismo periférico del cortisol. Estos nuevos datos obligan a reconsiderar el diagnóstico y tratamiento de la insuficiencia suprarrenal del enfermo crítico, una entidad hasta ahora escasamente comprendida.
Recently, there have been advances in understanding of the changes that occur in the hypothalamic-pituitary-adrenal axis during the different stages of critical disease. Such advances have led to a paradigm change, so that the aforementioned adaptations are no longer considered the result of adrenal axis activation, but a consequence of decreased cortisol metabolism illness. Knowledge of this new pathophysiological bases should lead to reconsider the diagnosis and treatment of adrenal insufficiency in critically ill patients, a condition poorly understood to date.
Durante la enfermedad crítica, la forma más severa de estrés físico, se producen cambios metabólicos y endocrinológicos notables, destinados inicialmente a favorecer la adaptación del organismo a la situación de lucha. Gracias a los avances en la Medicina Intensiva, el pronóstico de condiciones antes letales ha mejorado considerablemente, lo que permite a muchos pacientes sobrevivir durante periodos prolongados en la Unidad de Cuidados Intensivos (UCI) y alcanzar la llamada fase crónica de la enfermedad crítica.
En los últimos años se han obtenido nuevas evidencias sobre los cambios fisiopatológicos que tienen lugar durante la respuesta del organismo al estrés, que podrían conllevar importantes implicaciones terapéuticas. Así, se sabe ahora que existen dos fases marcadamente distintas durante la enfermedad crítica: una primera fase o fase aguda, que transcurre durante los primeros días de enfermedad, y una segunda fase, o fase crónica, a la que llegarían solo aquellos pacientes que no se recuperan (ni mueren) en los primeros días de enfermedad. En la primera fase se producen cambios metabólicos, que tienen lugar fundamentalmente en los tejidos periféricos1,2 y cuya finalidad es favorecer la adaptación del organismo a la enfermedad. En la segunda fase acontecen cambios en los ejes hipotálamo-hipofisarios, que tienen un origen central. Estos cambios, a diferencia de lo que ocurre en la fase aguda, podrían contribuir a agravar la situación catabólica de los pacientes y dificultar su recuperación1,3. Si así fuera, los tratamientos hormonales podrían ayudar a mejorar el pronóstico de la enfermedad4.
Si bien estas consideraciones son válidas para el conjunto de los ejes hipotálamo-hipofisarios, ha sido en el conocimiento de las modificaciones del eje suprarrenal donde se ha profundizado de forma más notable en los últimos años.
Relevancia del eje suprarrenal durante la enfermedad críticaLa exposición del organismo a un agente estresante de suficiente entidad desencadena la liberación masiva de distintos mediadores y hormonas, con diferente secuencia temporal. La primera ola de respuesta hormonal se produce en pocos segundos e incluye como fenómeno más destacado y precoz la liberación de catecolaminas por parte del sistema nervioso5. Le sigue una segunda ola, de inicio más retardado (minutos), cuya manifestación más notoria es un aumento en las concentraciones plasmáticas de glucocorticoides. Las catecolaminas liberadas en la primera ola inducen una activación cardiovascular (aumento de la frecuencia cardíaca, gasto cardíaco y presión arterial), que se considera imprescindible para sobrevivir a la situación crítica. Además favorecen la derivación del flujo sanguíneo hacia los tejidos más activos en la lucha frente al agente estresante y contribuyen a la movilización de nutrientes desde sus depósitos para ponerlos a disposición de dichos tejidos.
El papel de los glucocorticoides en las situaciones de estrés es más complejo, pues regulan una extraordinaria diversidad de funciones fisiológicas. Ya desde hace tiempo se sabe que los requerimientos de cortisol se incrementan en situaciones críticas6–8, y que la imposibilidad de incrementar la disponibilidad de cortisol en estas situaciones, tal como ocurre en pacientes con enfermedad estructural del eje hipotálamo-hipofisario-adrenal (HHA) o bajo tratamiento prolongado con corticoides, incrementa el riesgo de mortalidad9.
En conjunto, las acciones de los glucocorticoides tienen como objetivo favorecer la lucha contra el agente estresante, o bien contrarrestar una excesiva reacción defensiva frente a este, que pudiera resultar perjudicial para el organismo. Entre las primeras se incluyen acciones permisivas (acontecen precozmente, en presencia de unos niveles de cortisol todavía no incrementados), y estimuladoras (tienen lugar más tardíamente, en presencia de niveles de cortisol incrementados en respuesta al estrés). Así por ejemplo, los efectos hemodinámicos de los glucocorticoides durante el estrés son resultado de su acción permisiva sobre las catecolaminas, mientras que los efectos metabólicos son resultado de acciones tanto permisivas como estimuladoras. Las acciones de los glucocorticoides destinadas a proteger el organismo de una excesiva reacción defensiva se denominan supresoras y entre ellas destacan las ejercidas sobre el sistema inmune. En este caso el efecto de los glucocorticoides es inicialmente permisivo, para favorecer la respuesta inmune e inflamatoria, y posteriormente, con el incremento de su concentración plasmática, el efecto se torna claramente supresor, con el fin de proteger al organismo de una excesiva activación inmune5,10.
Se comprende pues, que la disponibilidad de unos niveles apropiados de cortisol en situaciones de estrés sea de extraordinaria importancia para superar tales situaciones.
La insuficiencia de cortisol durante la enfermedad crítica puede resultar de un daño estructural en cualquier punto del eje HHA, ya sea previo a la enfermedad crítica, o acaecido durante la misma como consecuencia de complicaciones de la enfermedad (por ejemplo: hemorragia o trombosis suprarrenal como resultado de trastornos de la coagulación). Asimismo, algunos tratamientos empleados con frecuencia en las UCI, tales como ketoconazol o etomidato, pueden conducir a una producción insuficiente de cortisol11, a causa de su efecto inhibidor de la síntesis de esteroides. En ambos casos, la producción de cortisol por la glándula adrenal puede ser inferior a los requerimientos del paciente, incluso en ausencia de estrés físico. Se trataría, por tanto, de una insuficiencia suprarrenal absoluta12,13, cuya discusión queda fuera del objetivo de esta revisión.
Por otra parte, la propia enfermedad crítica puede inducir un trastorno funcional y transitorio del eje suprarrenal que condiciona una producción insuficiente de cortisol. Este trastorno, conocido tradicionalmente como insuficiencia suprarrenal relativa, recientemente ha pasado a denominarse insuficiencia suprarrenal del enfermo crítico14–16. Se trata de una entidad controvertida cuyo conocimiento ha experimentado avances en los últimos años, y es en ella donde se centra la presente revisión.
Respuesta del eje suprarrenal al estrés en el paciente crítico: nuevos conceptosClásicamente se ha considerado que la respuesta del organismo a la agresión en lo que al eje adrenal se refiere, se caracteriza por una activación central del eje HHA. Sin embargo, en la actualidad y como se ha señalado anteriormente, en esta respuesta se distinguen dos fases con causas y consecuencias marcadamente diferentes.
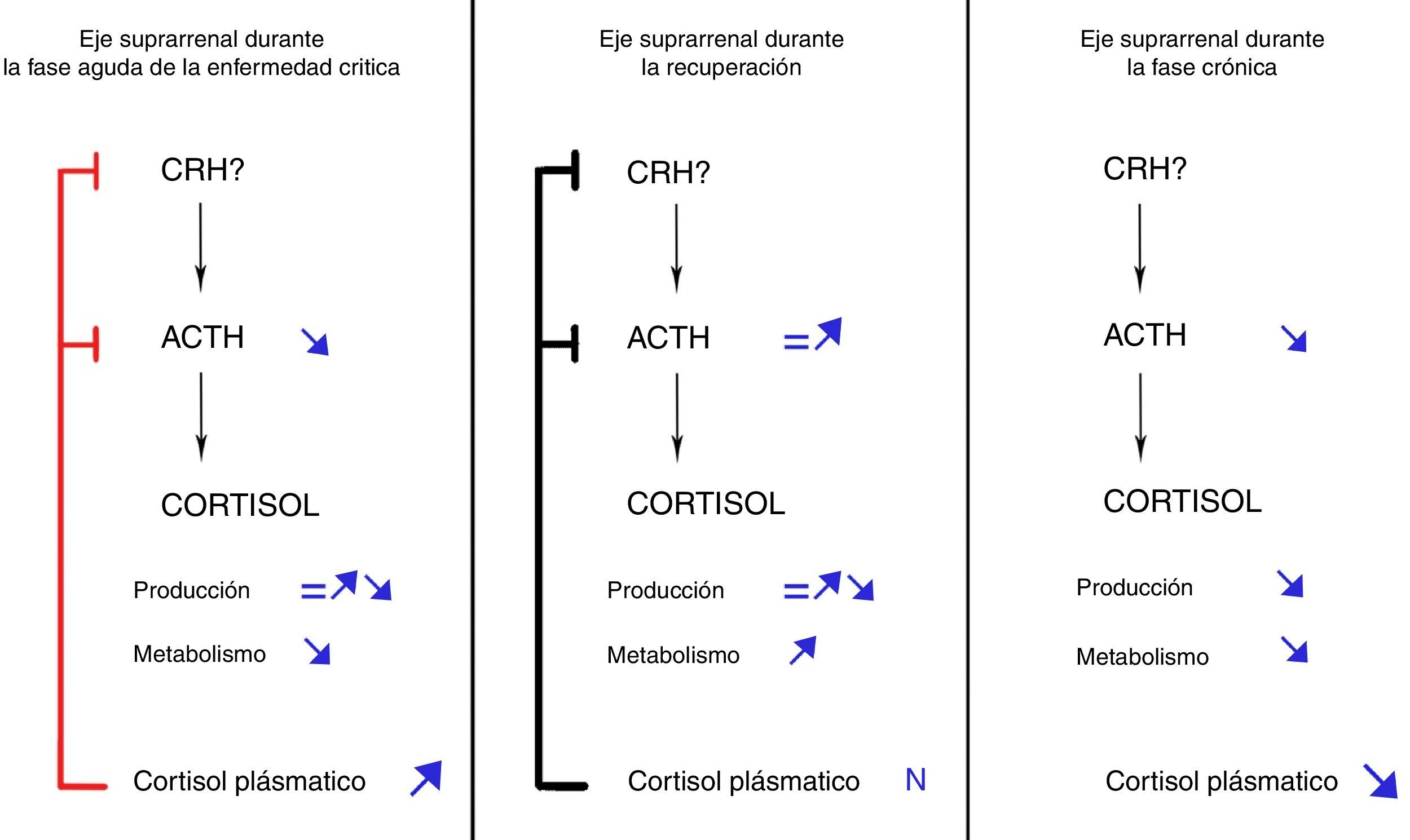
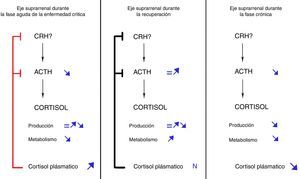
Fase agudaComienza en el momento en que tiene lugar la agresión al organismo, su duración es de unos pocos días y se caracteriza por un incremento en los niveles de cortisol plasmático. Tradicionalmente se ha considerado que este incremento en los niveles de cortisol durante los primeros días de la enfermedad crítica era el resultado de un aumento en su producción, como consecuencia de la activación central del eje HHA, que se traduciría en un incremento en la secreción de CRH y secundariamente de ACTH.
Esta concepción de la respuesta del eje HHA durante la enfermedad crítica se ha visto profundamente cuestionada, como resultado de las evidencias acumuladas en los últimos años. Ya en el año 1995 Vermes et al. pusieron de manifiesto que, en contra de lo esperable, los niveles de ACTH en los pacientes críticos se encontraban elevados solo de forma transitoria17. Más recientemente, Boonen et al. demostraron que ya desde el primer día de su ingreso en la UCI los pacientes críticos presentan unos niveles de ACTH inferiores a los de los sujetos sanos, manteniendo a pesar de ello unos niveles de cortisol más elevados18. Esta disociación entre los niveles de cortisol y ACTH era incompatible con la concepción clásica de una activación central del eje HHA y sugería que en la regulación de la producción de cortisol durante la enfermedad crítica participaban factores distintos de la ACTH. Entre estos factores se postularon diversas citoquinas, pero también catecolaminas y neuropéptidos19,20. Sin embargo, la cuantificación de la producción y el metabolismo del cortisol mediante técnicas isotópicas llevado a cabo por Boonen et al. reveló un hallazgo inesperado: la producción de cortisol se hallaba solo discretamente aumentada respecto a la de individuos sanos. Además, este aumento solo pudo evidenciarse en los enfermos con un grado de inflamación más marcada, mientras que en la mayor parte de los enfermos críticos la producción de cortisol, contra todo pronóstico, no era distinta a la de individuos sanos. Por el contrario, el metabolismo o aclaramiento del cortisol se encontró disminuido de forma muy notable y en todos los grupos de enfermos18.
En consonancia con estos hallazgos Boonen et al. pudieron demostrar una profunda inhibición de la expresión y actividad de las enzimas 5α-reductasa y 5β-reductasa hepáticas y de la β-hidroxiesteroide deshidogenasa renal18, todas ellas encargadas de la conversión de cortisol a metabolitos inactivos. Como posibles mediadores de esta inhibición se propuso a los ácidos biliares, cuya concentración plasmática se incrementa de forma notable durante la enfermedad crítica y se correlaciona positivamente con los niveles de cortisol18. Además, los ácidos biliares son conocidos inhibidores de la transcripción y actividad de las reductasas hepáticas21–23, y sus niveles se correlacionan de manera inversa con la expresión, concentración tisular y actividad de estas enzimas18.
Subsiguientes investigaciones de los mismos autores demostraron que la disminución de los niveles de ACTH evidenciada en esta fase de la enfermedad es resultado de la retroalimentación negativa ejercida por el hipercortisolismo, que condicionaría una reducción en la amplitud de los pulsos de secreción de ACTH por parte de las células corticotropas hipofisarias24.
Teleológicamente, la reducción del metabolismo de cortisol podría interpretarse (frente al aumento de su producción) como una manera más económica para el organismo de incrementar la disponibilidad de esta hormona en situaciones críticas. Por otra parte, este mecanismo resulta en un incremento de los niveles de cortisol proporcionalmente mayor en los órganos encargados de su inactivación que en el torrente circulatorio. Este hecho favorecería, a su vez, una mayor disponibilidad de cortisol en órganos clave como hígado y riñón, minimizando al mismo tiempo la disponibilidad en otros tejidos, tales como el sistema inmune, el musculoesquelético o el cerebro, en los que una excesiva exposición al cortisol podría acarrear efectos adversos. A este respecto se ha postulado también la existencia de una regulación selectiva de la expresión del receptor de glucocorticoides en los distintos tejidos, que permitiría focalizar las acciones del cortisol en los órganos de interés y minimizar sus efectos adversos. Así por ejemplo, se ha comprobado que el receptor de glucocorticoides de los granulocitos se encuentra disminuido en niños con sepsis, lo que posibilitaría el desarrollo de la respuesta inmune innata a pesar del hipercortisolismo25. No obstante, la regulación del receptor de cortisol en enfermedades críticas es poco conocida y debe investigarse más profundamente.
Fase crónicaSi durante la fase aguda de la enfermedad crítica las medidas terapéuticas y de soporte son exitosas, el paciente evolucionará hacia la mejoría y superará la situación crítica en pocos días. Si por el contrario, el paciente sobrevive a la fase aguda de la enfermedad pero no logra recobrarse de la misma, entrará en la llamada fase crónica de la enfermedad crítica. Tal como pusieron de manifiesto Boonen et al., esta fase se caracteriza por una atrofia progresiva de la glándula suprarrenal. Mediante el estudio posmortem de pacientes críticos y no críticos, estos autores demostraron que las glándulas suprarrenales de pacientes fallecidos tras largas estancias en la UCI mostraban una arquitectura más desorganizada, un peso menor y una concentración de ésteres de colesterol más baja que los sujetos fallecidos poco después de su ingreso, y los fallecidos en otras unidades de menor gravedad26. Aunque debido al diseño del estudio no se pudieron medir los niveles de ACTH en plasma, el hallazgo de una disminución en la expresión de genes regulados por esta hormona y el paralelismo entre los hallazgos histológicos y los presentes en ratones con mutación de la POMC (y por tanto deficiente en ACTH)27 sugirió que los niveles persistentemente bajos de ACTH presentes en los enfermos críticos estaban implicados en la génesis de la atrofia suprarrenal.
Por otra parte, Barquist et al. demostraron una correlación inversa entre los niveles de cortisol plasmático y la duración de la estancia en UCI28.
A la vista de estos hallazgos, se ha propuesto la siguiente secuencia de hechos, que puede observarse en la figura 1: si el enfermo crítico no se recupera en los primeros días de la enfermedad, la inhibición de la secreción de ACTH iniciada en la fase aguda se prolongaría en el tiempo debido al mantenimiento de la situación crítica. Como resultado, los niveles persistentemente bajos de ACTH inducirían una atrofia de la glándula suprarrenal, que a su vez daría lugar a una disminución progresiva en la secreción de cortisol26. El balance neto entre el incremento de cortisol derivado de una inhibición de su metabolismo (que persistiría en la fase crónica) y el descenso resultante de una producción disminuida se inclinaría progresivamente a favor de este último, dando como resultado unos niveles plasmáticos de cortisol en progresivo descenso. Esta secuencia de hechos explicaría el incremento en la tasa de insuficiencia suprarrenal sintomática a medida que se prolonga la estancia en UCI28.
Evolución dinámica del eje hipotálamo-hipófiso-adrenal durante la enfermedad crítica. Modificado de Boonen y van Den Berghe29.
Por el contrario, si el paciente supera la situación crítica pocos días después del inicio de la misma, los procesos responsables de la inhibición del metabolismo del cortisol revertirían, los niveles plasmáticos de cortisol regresarían a la normalidad y secundariamente se normalizaría la secreción de ACTH, restaurándose de este modo la función adrenal al completo.
¿Existe realmente la insuficiencia suprarrenal del paciente crítico?Parece claro que el aumento de la disponibilidad de cortisol en la fase aguda de la enfermedad crítica tiene un carácter adaptativo. Lo que no parece estar tan claro es si la disminución de cortisol plasmático que acontece en la fase crónica tiene también un carácter adaptativo (en cuyo caso la existencia de la insuficiencia suprarrenal del paciente crítico quedaría en entredicho), o supone un fenómeno perjudicial que podría dificultar la recuperación del paciente; o simplemente se trata de un marcador de gravedad. Esta cuestión solo puede encontrar respuesta en estudios de intervención. En un trabajo realizado con animales manipulados genéticamente, para lograr la inactivación del receptor Scavenger BI de las células adrenales (encargado de internalizar las moléculas de colesterol HDL para la fabricación de cortisol cuando sus requerimientos se ven aumentados) e inducir así una hiporrespuesta de la glándula suprarrenal al estrés, Ai et al. demostraron que la mortalidad por sepsis era mayor en estos animales que en los animales normales, y que el tratamiento con glucocorticoides era capaz de revertir el incremento de la mortalidad30. Sin embargo, este modelo experimental es más representativo de la insuficiencia suprarrenal absoluta (entendiendo como tal a la resultante de un daño en el eje HHA previo a la enfermedad crítica) que de la insuficiencia suprarrenal del paciente crítico. Por su parte, Guzman et al. describieron una serie de 13 pacientes sépticos cuyo nivel medio de cortisol pasó de 41μg/dl al ingreso en UCI a 10μg/dl cuando fueron reevaluados una semana después por la imposibilidad de retirar la terapia con drogas vasoactivas. La administración de glucocorticoides a estos pacientes permitió suspender la terapia vasopresora y el alta de la UCI tras una media de 1,5 días31. Obviamente, la falta de un grupo control limita la obtención de conclusiones robustas, pero este estudio sugiere un beneficio derivado del tratamiento con glucocorticoides y el carácter maladaptativo de los cambios en la función adrenal en fases avanzadas de la enfermedad crítica. No obstante, este aspecto deberá ser confirmado en el futuro mediante estudios convenientemente diseñados.
Implicaciones diagnósticasLa inestabilidad hemodinámica a pesar de una adecuada reposición de fluidos y la persistencia de datos de inflamación sin una causa obvia son datos clínicos que deben hacer sospechar una insuficiencia suprarrenal en el paciente crítico. Otros datos que en condiciones normales pueden ayudar al diagnóstico, tales como los trastornos iónicos, son de escasa utilidad en pacientes críticos.
Por otra parte, la confirmación bioquímica de una insuficiencia suprarrenal en el paciente crítico ofrece notables dificultades y clásicamente ha sido muy controvertida. No obstante, la identificación correcta de este trastorno es importante para poder focalizar la intervención terapéutica en los individuos afectos del mismo, y evitar el sobretratamiento de individuos no afectos. Al menos así lo sugieren estudios recientes, que han demostrado en modelos animales que, en ausencia de insuficiencia suprarrenal, el tratamiento con glucocorticoides no solo no es beneficioso, sino que puede incrementar el riesgo de complicaciones catabólicas y de infección, entre otros30.
Los test que evalúan el eje HHA en su conjunto, tales como la hipoglucemia insulínica, no son adecuados ni han sido validados en pacientes críticos. Por ello, los test empleados clásicamente para el diagnóstico han sido el cortisol sérico basal y el incremento máximo de cortisol sérico tras estímulo con 250 ug de ACTH. En ambos casos la identificación de valores anormales para pacientes críticos se ha basado en su asociación con el riesgo de mortalidad. Dado que el riesgo de mortalidad de un paciente crítico depende de numerosos factores, entre ellos el grado de estrés, y puesto que el cortisol plasmático basal se correlaciona con el grado de estrés, tanto niveles altos de cortisol (que reflejan un grado de estrés más elevado) como niveles bajos (que reflejarían una respuesta de cortisol insuficiente) se han asociado con un incremento de la mortalidad32. Como resultado, los valores propuestos como normales para el cortisol plasmático basal en situaciones críticas han sido muy dispares. La respuesta al test de ACTH, aparentemente menos dependiente del grado de estrés, teóricamente sería de mayor utilidad, aunque los resultados también han sido poco reproducibles33. Algunos autores han propuesto el empleo de la dosis de 1 ug de ACTH con el fin de incrementar la sensibilidad del test, pero por el momento no ha sido suficientemente estudiado34. A día de hoy, gran parte de la falta de reproducibilidad de los test mencionados (y la consecuente disparidad de criterios diagnósticos) podría explicarse por su aplicación en distintos estadios evolutivos de la enfermedad crítica, en los cuales los cambios fisiopatológicos en lo que al eje HHA se refiere son de naturaleza muy dispar.
De acuerdo con la nueva concepción de la respuesta al estrés, los niveles de ACTH se encuentran disminuidos desde el inicio de la enfermedad, pero solo aquellos pacientes críticos con una duración prolongada de la enfermedad experimentarán un descenso en los niveles de cortisol plasmático (mayor cuanto mayor sea la duración de la enfermedad). Varias consideraciones diagnósticas se desprenden de estos hechos: 1) unos niveles de ACTH bajos no deben considerarse indicativos o sugestivos de insuficiencia suprarrenal (secundaria en este caso); 2) la posibilidad de la insuficiencia suprarrenal inducida por la enfermedad crítica solo debe contemplarse en fases avanzadas de la misma, 3) el hallazgo de un cortisol bajo en la fase aguda de la enfermedad crítica debería interpretarse como reflejo de un daño orgánico en algún nivel del eje HHA, bien previo a la enfermedad crítica y no reconocido hasta entonces, o bien resultante de complicaciones de aquella (se trataría por tanto, de la denominada insuficiencia suprarrenal absoluta). Queda por definir aún el rango de normalidad para los niveles de cortisol en esta primera fase. De acuerdo con el estudio de Boonen et al.18, el nivel medio de cortisol durante la primera semana de estancia en UCI en pacientes críticos fue de 16,8g/dl.
Para el diagnóstico de la insuficiencia suprarrenal del paciente crítico tal como se concibe a día de hoy, tanto el cortisol plasmático basal como la respuesta al test con estímulo de ACTH podrían ser válidos, pues la atrofia de la glándula suprarrenal en fases avanzadas de la enfermedad ya es evidente. En ambos casos, el umbral de separación entre niveles fisiológicos y patológicos debería establecerse en función del beneficio aportado por el tratamiento con glucocorticoide y ser declarado como criterio diagnóstico. No obstante, hay que tener en cuenta que la disminución de la proteína ligadora de cortisol asociada a la enfermedad crítica35–37 conduce a una disminución de los niveles de cortisol total sin afectar a la fracción libre (la única biológicamente activa), lo que complica la interpretación de los niveles de cortisol total en situación crítica, pudiendo conducir a falsos positivos en el diagnóstico. Por su parte, los métodos que determinan la fracción libre, que teóricamente serían de ayuda para superar este inconveniente, son poco fiables38–40, y actualmente no están disponibles en la mayoría de los centros.
Implicaciones terapéuticasLos trabajos destinados a demostrar el beneficio de la terapia esteroidea en el enfermo crítico han ofrecido hasta ahora resultados opuestos y no concluyentes41–43. Es probable que la falta de reproducibilidad en estos trabajos se deba, de nuevo, a un diseño acorde con los conceptos imperantes en el pasado sobre los cambios del eje suprarrenal en respuesta al estrés, que no contemplaban la naturaleza dinámica de los mismos. Este hecho podría explicar, por ejemplo, que aquellos trabajos que evaluaron la respuesta al tratamiento en fases precoces de la enfermedad (cuando es altamente improbable una insuficiencia suprarrenal) no encontraran beneficio y sí lo hicieran aquellos en los que el tratamiento se administró en fases tardías31.
La ausencia de unos criterios bien establecidos para el diagnóstico de la insuficiencia suprarrenal en el paciente crítico dificulta la selección de los pacientes candidatos a tratamiento. En espera de estudios que ayuden a establecer dichos criterios diagnósticos, Boonen et al., basándose en la respuesta dinámica del eje suprarrenal en las situaciones críticas, han propuesto como candidatos a tratamiento esteroideo aquellos pacientes críticos que reúnan los siguientes criterios: 1) síntomas compatibles (dependencia de drogas vasoactivas fundamentalmente); 2) estancia en UCI de más de 6 días; 3) niveles de cortisol plasmático basal decrecientes hasta valores por debajo de 6μg/dl y 4) incremento de cortisol tras estímulo con ACTH inferior a 6μg/dl29.
La dosis de hidrocortisona recomendada y empleada tradicionalmente en el tratamiento de la insuficiencia suprarrenal del paciente crítico ha oscilado entre 200-300mg/día. Dicha recomendación se basaba en la creencia de que el incremento de los niveles plasmáticos de cortisol observado en la enfermedad crítica resulta de un marcado incremento en su producción. A luz de los nuevos conocimientos, esta dosis probablemente resulte en unos niveles de cortisol excesivamente elevados, puesto que en situaciones críticas no solo existe una reducción del metabolismo del cortisol endógeno, sino también de los preparados farmacológicos, que conduce a una prolongación sustancial de su vida media18. Estas dosis altas pueden conllevar efectos deletéreos sobre ciertos sistemas orgánicos, que podrían limitar el beneficio del tratamiento. Basándose en estudios isotópicos para investigar la producción diaria de cortisol en situaciones críticas, algunos autores han sugerido que una dosis de 60mg/día de hidrocortisona sería apropiada en estas situaciones29, debiendo procederse a su progresiva retirada tan pronto se inicie la recuperación del enfermo.
Estas consideraciones sobre las dosis de esteroides son también aplicables a enfermos críticos que durante su estancia en UCI reciban tratamiento esteroideo por otras indicaciones distintas de la insuficiencia suprarrenal.
Las principales implicaciones diagnóstico-terapéuticas se recogen a modo de resumen en la tabla 1.
Principales implicaciones diagnóstico-terapéuticas
| - La sospecha de insuficiencia suprarrenal del enfermo crítico debe suscitarse únicamente en pacientes con estancia prolongada (mayor de una semana) en UCI |
| - Los niveles bajos de ACTH no deben considerarse indicativos de este estado |
| - En los casos más graves el uso del cortisol sérico basal podría ser suficiente para el diagnóstico. En casos dudosos se podría recurrir al test de estímulo con ACTH |
| - Se desconoce qué niveles de cortisol basal o estimulado son indicativos de insuficiencia suprarrenal en el paciente crítico. Se ha sugerido un cortisol sérico basal inferior a 6μg/dl |
| - La dosis de hidrocortisona más apropiada para el tratamiento sustitutivo probablemente deba ser inferior a la empleada en la actualidad. Se ha propuesto una dosis de 60 mg diarios (en lugar de 300 mg diarios) |
Futuros estudios diseñados de acuerdo con los nuevos conocimientos sobre la fisiopatología del eje suprarrenal en las enfermedades críticas deberán servir para establecer las indicaciones de tratamiento, así como las dosis óptimas a emplear en estas circunstancias.
ConclusionesLa respuesta a la enfermedad del eje suprarrenal es dinámica y se compone de dos fases con causas y consecuencias distintas. Los cambios en la fase aguda son adaptativos y no requieren tratamiento, mientras que los cambios que acontecen en la fase crónica podrían contribuir a empeorar el pronóstico del paciente y justificarían el tratamiento con esteroides. Actualmente no se dispone de evidencias sólidas sobre las que sustentar las recomendaciones diagnósticas y terapéuticas, pues quedan todavía por precisar numerosos aspectos. Entre otros, es necesario confirmar el impacto del declive de los niveles de cortisol sobre el pronóstico de la enfermedad (o enfermo) crítica, así como los factores que contribuyen o acentúan este declive. Asimismo, es necesario establecer el umbral de cortisol plasmático (o en su defecto de otros parámetros bioquímicos) que permitan identificar los pacientes subsidiarios de tratamiento. Por último, es preciso determinar las dosis óptimas de sustitución que permitan minimizar los riesgos asociados al sobretratamiento. Estas cuestiones deberán ser abordadas mediante estudios cuyo diseño tenga presente los nuevos conocimientos sobre la respuesta del eje suprarrenal en situaciones críticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.