La obesidad sarcopénica se ha asociado con mayor discapacidad y morbimortalidad. Sin embargo, todavía existen pocos estudios sobre el papel de la sarcopenia en las comorbilidades asociadas a la obesidad en individuos con edad inferior a 65 años. La etiopatogenia es multifactorial pero parece que los mediadores inflamatorios y la resistencia a la insulina desempeñan un papel relevante. Aunque no existe un consenso claro sobre su definición y métodos diagnósticos, hay un creciente interés por disponer de biomarcadores que ayuden a su detección y seguimiento. Respecto al tratamiento, se postula el abordaje multimodal, que básicamente se fundamenta en recomendaciones dietéticas, ejercicio y eventualmente cirugía bariátrica.
Sarcopenic obesity has been associated with greater disability, morbidity and mortality. However, at present, there are few studies regarding the role of sarcopenia in the evolution of the comorbidities associated with obesity in individuals less than 65 years of age. The pathogenesis is multifactorial and uncompletely ilucidated, but it seems that inflammatory mediators and insulin resistance play an important role. Although there is no clear consensus on its definition and diagnostic methods, there is a growing interest in finding biomarkers useful for the detection and monitoring. Regarding the treatment, a multimodal approach is recomended, based on dietary recommendations, exercise and eventually bariatric surgery.
La obesidad sarcopénica (OS) es una entidad clínica y fisiopatológica que se ha asociado con mayor discapacidad y morbimortalidad que las dos entidades por separado (la obesidad y la sarcopenia). En el presente manuscrito se resumen los conceptos recientes sobre la OS: definición, criterios y métodos diagnósticos, así como factores patogénicos. Además, se revisa el papel de la OS en las comorbilidades asociadas a la obesidad (diabetes tipo 2, deterioro cognitivo y afectación ósea). Por último, se analiza el estado actual del manejo de la OS tanto desde el punto de vista dietético, como las recomendaciones basadas en el ejercicio físico y el papel que desempeña la cirugía bariátrica.
Definición y diagnósticoEl término sarcopenia proviene del griego sarx, que significa carne, y penia que significa pobreza. Se trata de un concepto relativamente reciente que acuñó Irwin Rosenberg en 19891, se engloba dentro de las enfermedades musculares y está codificada como situación patológica en el CIE-10 desde 20162. A pesar de su reciente filiación formal, la presencia de sarcopenia está cobrando relevancia clínica exponencial al tratarse de una situación fisiopatológica muy transversal que puede concernir a muchos campos de las ciencias médicas.
La sarcopenia se define como un síndrome complejo que se caracteriza por la pérdida de masa muscular esquelética (MME) y, sobre todo, de su función. Aunque no existe un claro consenso sobre su definición, los diferentes grupos de trabajo parecen coincidir en que el factor más relevante a la hora de definir la sarcopenia debe ser la pérdida de función, como se describe en la guía desarrollada por el Grupo Europeo de Trabajo sobre la Sarcopenia en Personas Mayores (European Working Group on Sarcopenia in Older People, EWGSOP)3. Cuando dicha pérdida de función o de masa muscular se asocia a una masa grasa conservada o incluso aumentada, nos encontramos ante la situación denominada OS. Existe evidencia suficiente para afirmar que la asociación de obesidad y sarcopenia confiere peor pronóstico en cuanto a morbimortalidad, que los obtenidos en cada una de estas situaciones de forma aislada4.
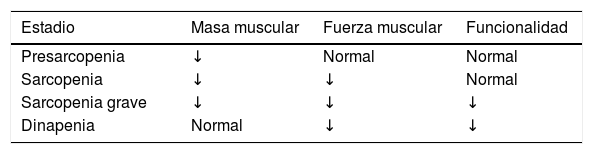
La pérdida de MME es una situación fisiológica que ocurre dentro de unos márgenes concretos, como sucede en el envejecimiento. Se considera que alcanzamos un nivel máximo de MME y fuerza entre los 30-50 años, momento en el que se inicia una pérdida progresiva de MME, acompañada de una mayor dificultad para su síntesis. Esta situación se cataloga como sarcopenia primaria, dado que no existe otra causa que lo provoque más que el propio envejecimiento. Cuando la pérdida ocurre en el contexto de un proceso patológico o disfuncional como el cáncer, la malnutrición o la obesidad, entre otros, entonces hablamos de una sarcopenia secundaria5.
Otra forma de clasificación tiene relación con su gravedad (tabla 1).
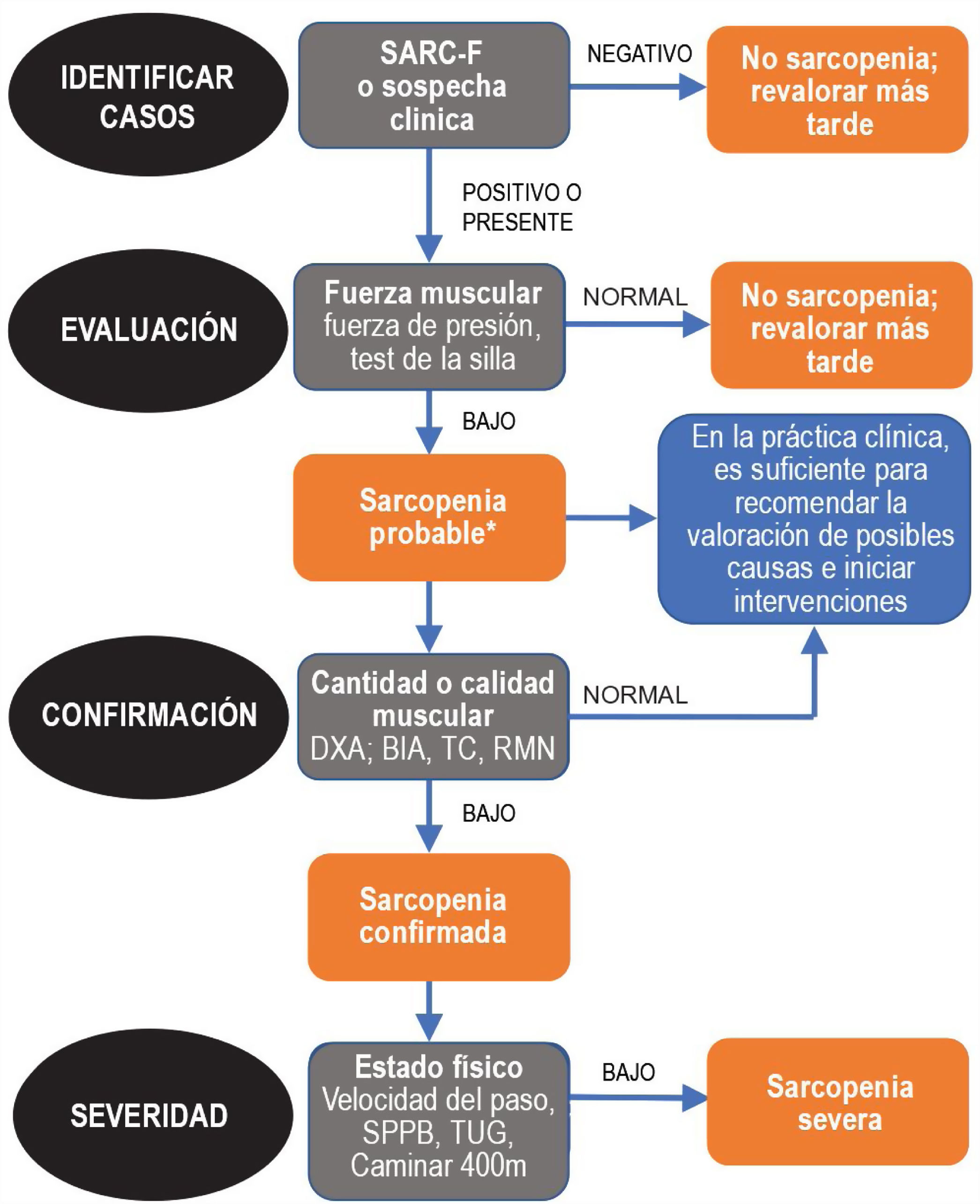
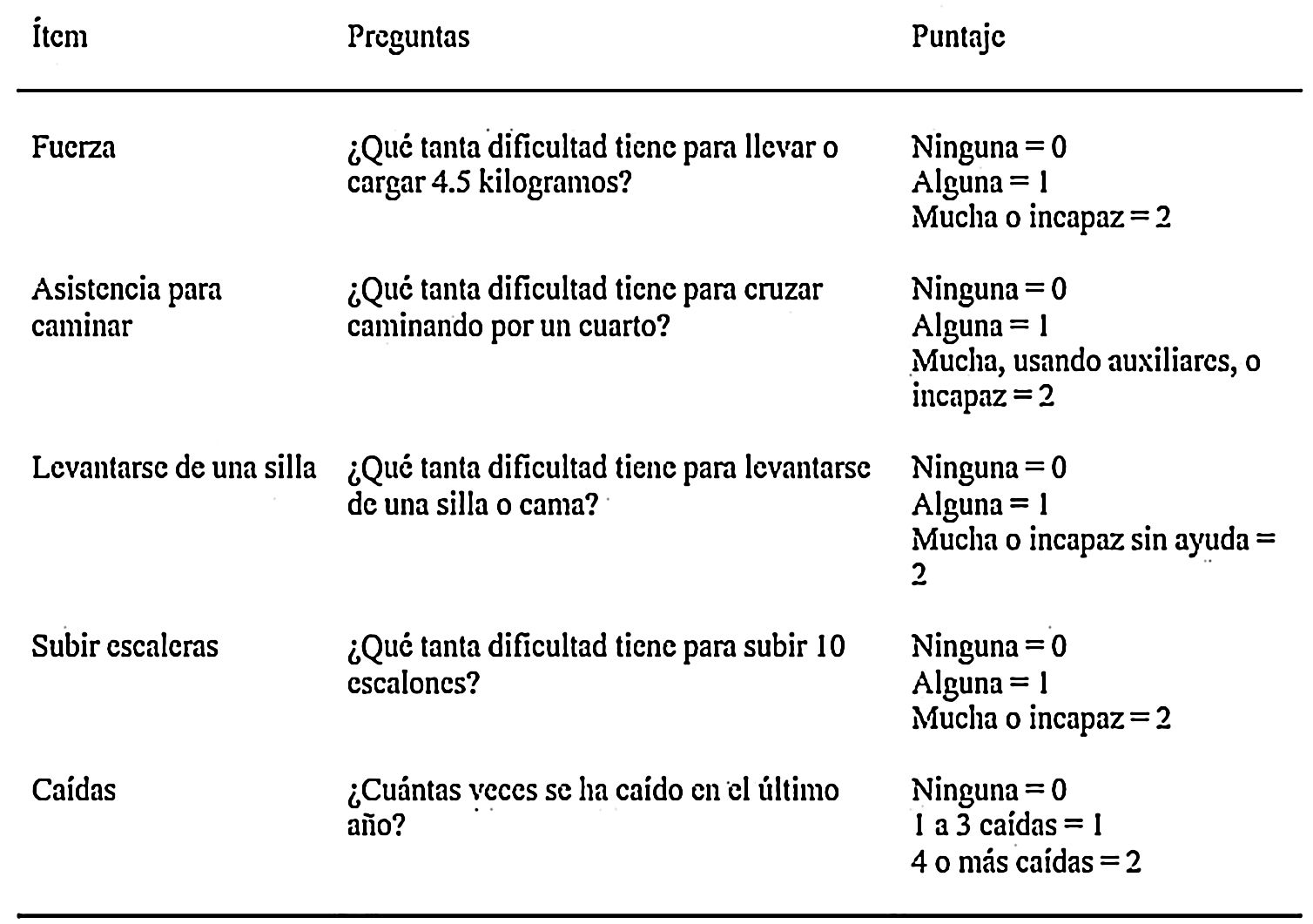
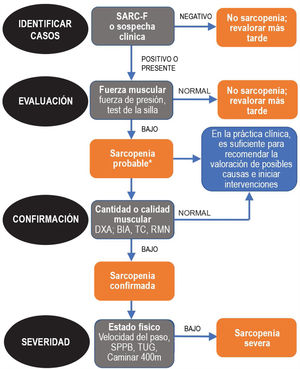
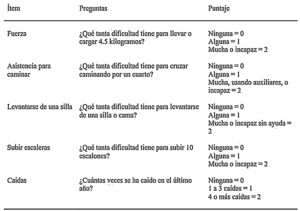
Dado que la sarcopenia comprende tanto la pérdida de masa muscular como su función, los métodos diagnósticos los podemos diferenciar en cuantitativos y cualitativos o funcionales. En el tratado de consenso del EWGSOP23 se recomienda una metodología de identificación y diagnóstico de la sarcopenia (fig. 1). El primer paso diagnóstico consiste en identificar aquellos pacientes con riesgo de sarcopenia utilizando cuestionarios como el SARC-F6. El cuestionario SARC-F (fig. 2) es un test de cinco preguntas que valora la capacidad para realizar tareas rutinarias como caminar, levantarse de la silla, subir escaleras y la presencia de caídas. Es una prueba que el paciente puede hacer por sí mismo, sin ayuda externa, y una puntuación mayor o igual a cuatro se considera sugestiva de sarcopenia.
Sarcopenia: algoritmo del EWGSOP2. Modificado de Cruz-Jentoft A.J. et al.3.
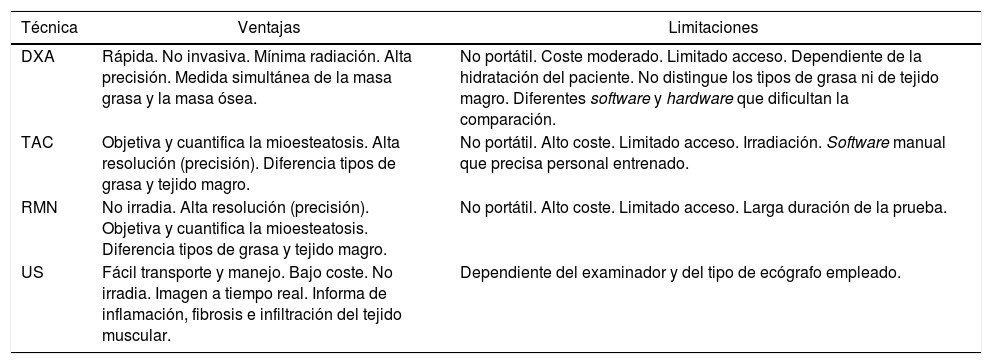
Se trata de una técnica de bajo coste pero requiere bastante tiempo y personal entrenado ya que se fundamenta en la correcta toma de diversas medidas, siendo una técnica dependiente del observador (tabla 2). Es de especial utilidad en los estudios realizados en deportistas pero, en general, no se consideran una buena medida de la masa muscular en pacientes de edad avanzada y obesidad, especialmente cuando se asocia a sarcopenia5.
Características principales de los métodos cuantitativos8,16
| Técnica | Ventajas | Limitaciones |
|---|---|---|
| DXA | Rápida. No invasiva. Mínima radiación. Alta precisión. Medida simultánea de la masa grasa y la masa ósea. | No portátil. Coste moderado. Limitado acceso. Dependiente de la hidratación del paciente. No distingue los tipos de grasa ni de tejido magro. Diferentes software y hardware que dificultan la comparación. |
| TAC | Objetiva y cuantifica la mioesteatosis. Alta resolución (precisión). Diferencia tipos de grasa y tejido magro. | No portátil. Alto coste. Limitado acceso. Irradiación. Software manual que precisa personal entrenado. |
| RMN | No irradia. Alta resolución (precisión). Objetiva y cuantifica la mioesteatosis. Diferencia tipos de grasa y tejido magro. | No portátil. Alto coste. Limitado acceso. Larga duración de la prueba. |
| US | Fácil transporte y manejo. Bajo coste. No irradia. Imagen a tiempo real. Informa de inflamación, fibrosis e infiltración del tejido muscular. | Dependiente del examinador y del tipo de ecógrafo empleado. |
La OS fue definida por primera vez en 1996 por Heber et al. usando BIA; posteriormente, una ecuación basada en BIA fue desarrollada por Andaluza R. et al.7 Esta técnica calcula la masa magra, masa grasa y agua corporal en función de la conductividad eléctrica. No mide la masa muscular de forma directa, pero mediante el uso de una serie de ecuaciones y ajustes matemáticos nos aporta una estimación bastante similar a la obtenida con la densitometría corporal7. Es una prueba barata, sencilla y fácilmente transportable. Sin embargo, es necesario realizar las mediciones en condiciones similares para que las muestras sean comparables, además, los resultados pueden verse influenciados por el estado de hidratación del paciente. Por otra parte, en pacientes con IMC >34 kg/m2 se puede sobreestimar la masa magra e infraestimar la masa grasa4.
Técnicas de imagenLa masa muscular puede ser evaluada por absorciometría de rayos x de doble energía (DXA), imágenes de tomografía axial computarizada (TAC), resonancia magnética nuclear (RMN) y ultrasonografía (US).
- •
Absorciometría radiológica de doble energía (DXA):
La DXA mide la absorción de dos fotones de rayos x, típicamente de 40-47 keV y 70-80 keV lo que permite la diferenciación de hueso, masa grasa y masa magra de los tejidos blandos, con base en su diferente grado de atenuación ante los rayos x. Utiliza una proyección bidimensional y nos proporciona información sobre la cantidad de grasa y tejido magro en cada parte del cuerpo8. Sin embargo, una de sus principales desventajas es la falta de exactitud para cuantificar la composición corporal a mayor IMC, lo que limita su uso en obesidad4.
- •
Tomografía axial computarizada (TAC)
En un estudio realizado por Shen et al.4 en 2004 se demostró que la medición de la masa muscular a nivel de un corte en L3 se correlacionaba significativamente con la masa muscular corporal total9. Desde entonces, el corte a nivel de L3 obtenido en TAC es utilizado para medir la composición corporal en la investigación clínica, especialmente en aquellas patologías en las que la TAC forma parte del estudio rutinario, como por ejemplo en algunos tipos de cáncer10-12.
La disminución de la fuerza muscular no sólo se debe al descenso de la masa muscular, sino que también es consecuencia de la pérdida de la calidad del músculo. Tanto en el envejecimiento como en la obesidad suele existir un descenso de la masa magra y un aumento del tejido adiposo, que puede infiltrar la masa muscular disminuyendo su capacidad funcional. A este concepto se le denomina mioesteatosis. Dicha mioesteatosis se puede encontrar e incluso cuantificar en el TAC al observar una disminución de las unidades Hounsfield (HU) del músculo y se ha correlacionado significativamente con peor evolución clínica y mayor mortalidad en pacientes con cáncer13.
- •
Resonancia magnética nuclear (RMN)
Aporta imágenes muy precisas, similar a la TAC, capaces de delimitar con detalle el tejido adiposo del tejido magro e identificar la infiltración grasa. Su coste es mayor en comparación con los otros métodos y aún existe poca literatura para realizar un análisis comparativo coste-beneficio4,5.
- •
Ecografía de tejido muscular (US)
Se trata de un método útil inicial para evaluar la masa y estimar la calidad muscular en todos los entornos clínicos. Dado que la disminución de la masa muscular no se produce en todas regiones anatómicas de forma homogénea, la evaluación mediante US permite la detección de la «sarcopenia específica de sitio» o «regional». La medición ultrasónica del grosor de las cuatro cabezas del músculo cuádriceps femoral es altamente reproducible en pacientes sarcopénicos y no sarcopénicos, y se correlaciona con la fuerza de contracción máxima voluntaria isométrica14. Además, se ha demostrado la existencia de una relación inversa entre la ecogenicidad muscular y la fuerza muscular. En este sentido, el aumento de la ecogenicidad muscular se ha relacionado con la presencia de grasa intramuscular en biopsias de pacientes15.
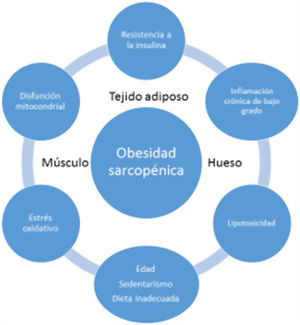
EtiopatogeniaLa etiopatogenia de la OS es multifactorial, existiendo una relación entre la edad, estilo de vida sedentario, hábitos dietéticos poco saludables y factores como la resistencia a la insulina (RI), inflamación sistémica y estrés oxidativo, resultando todo ello en una reducción cuantitativa y cualitativa de la masa y fuerza muscular y en un aumento concomitante de la masa grasa17.
La sarcopenia y la obesidad asociadas a la edad se deben habitualmente a una progresiva reducción de la actividad física y de la ingesta proteica. Esto daría lugar a una reducción del gasto energético y a un aumento de la RI, generando una serie de cambios en el tejido adiposo; más específicamente, los adipocitos aumentarían en tamaño y número, y las células inmunes infiltrarían el tejido adiposo dando lugar a una respuesta inflamatoria. Los adipocitos y las células inmunes producirían adipocinas (p. ej. leptina, quemerina, resistina, y disminuye la adiponectina) y citocinas (p. ej. TNF-α, interleucinas [IL], interferón-ϒ), por tanto, creando una situación de inflamación de bajo grado. Esta inflamación no sólo estaría localizada en el tejido adiposo, sino que también sería generalizada, ya que la mayoría de las adipocinas y citocinas pasan a la circulación sistémica. Este perfil desfavorable de adipocinas/citocinas aumentaría aún más la RI, la cual amplificaría la inflamación y el estrés oxidativo, pero también contribuiría al acúmulo de grasa ectópica18.
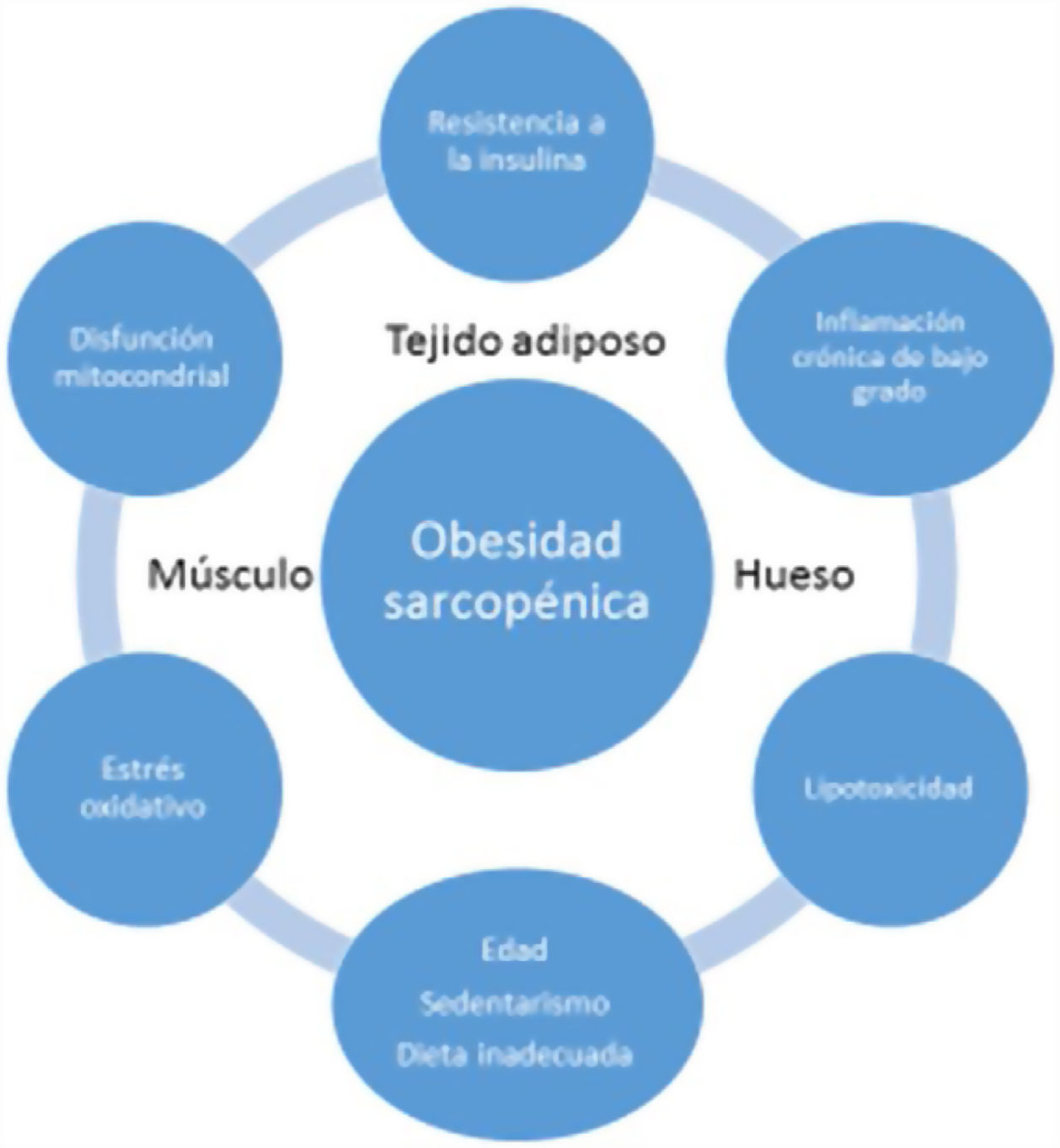
La inflamación sistémica de bajo grado y el acúmulo intramuscular de grasa resultaría en una disfunción mitocondrial y en un desequilibrio de las miocinas secretadas por los miocitos (miostatina, irisina, TNF-α y IL). Más específicamente, la β-oxidación mitocondrial estaría dañada, lo que conduciría a un aumento de la peroxidación lipídica. Esto, a su vez, aumentaría la acumulación de lípidos intermedios y de radicales libres, lo que empeoraría aún más la RI, la inflamación, el estrés oxidativo y lipotoxicidad dentro del miocito, provocando su disfunción y apoptosis. Además, las miocinas pueden exacerbar la RI en el tejido adiposo y en otros tejidos. Se establecería por tanto un círculo vicioso en el que se mantendría una interacción negativa no sólo entre músculo y tejido adiposo19, sino también con tejido óseo (fig. 3). Se ha descrito que el aumento de los niveles de IL-6 y proteína C reactiva (PCR) se asocia con un riesgo de dos a tres veces mayor de pérdida significativa (más del 40%) de la fuerza muscular y, por tanto, pueden considerarse factores de riesgo para desarrollar sarcopenia. También se ha sugerido que el TNF-α podría ser un potencial biomarcador de riesgo de sarcopenia20.
En los últimos años, existe un creciente interés por identificar el papel que juegan las miocinas, adipocinas y citocinas proinflamatorias en la fisiopatología de la sarcopenia y OS. Las miocinas que han despertado más interés en los últimos años son la miostatina y la irisina, producidas mayoritariamente en el músculo esquelético. Varios estudios han sugerido que la miostatina (que regula de forma negativa la masa muscular) estaría aumentada y la irisina (que se asocia de forma positiva con la masa muscular) se encontraría disminuida en la sarcopenia21,22.
La proteína de unión a ácidos grasos (A-FABP) es una adipocina que está involucrada en la absorción de ácidos grasos y su posterior transporte hacia el sistema de oxidación mitocondrial. Algunos estudios muestran que la A-FABP se asocia de forma positiva a la grasa corporal y negativamente a la masa muscular y, en humanos, se asocia a la severidad de la RI18.
Se ha sugerido que la determinación de transtiretina (TTR) en plasma puede ser un biomarcador de sarcopenia en sujetos de edad avanzada. La síntesis hepática de TTR disminuye en estados de depleción proteica y se suprime en estados inflamatorios inducidos por citocinas, como la IL-6. Datos recientes sugieren que la disminución de TTR ocurre en paralelo a la pérdida de masa magra que se observa en los procesos inflamatorios23.
Los niveles del receptor soluble para los productos finales de glicación avanzada (sRAGE) ejercen un papel protector en el desarrollo de trastornos crónicos relacionados con la edad, neutralizando la acción de los productos finales de glicación avanzada (AGE). Recientemente se ha sugerido que los niveles circulantes disminuidos de sRAGE podría ser un factor de riesgo independiente de sarcopenia24.
Algunas enfermedades endocrinológicas como el hipogonadismo (Aguirre et al.), el hipo e hipertiroidismo, el déficit de hormona de crecimiento en el adulto y el síndrome de Cushing podrían desempeñar un papel en el desarrollo de OS. Es indiscutible que se necesitan estudios adicionales para abordar la contribución de cada una de estas enfermedades a la patogenia de la obesidad sarcopénica25. Respecto a los factores dietéticos, una ingesta proteica inadecuada y un déficit de vitamina D han demostrado empeorar la OS26,27.
Papel de la obesidad sarcopénica en las comorbilidades asociadas con la obesidadSe ha planteado la hipótesis de que la OS aumenta significativamente los efectos deletéreos que la obesidad ejerce sobre la salud. De hecho, varios estudios que se detallan a continuación han relacionado recientemente esta condición con una mayor morbimortalidad y peor calidad de vida, así como con riesgo de diabetes tipo 2, deterioro cognitivo y osteoporosis.
Diabetes tipo 2Un metaanálisis reciente28 demostró que la presencia de OS se asocia con un aumento de riesgo (OR 1,38 [CI 95%, 1,27-1,50]) de diabetes tipo 2. El mecanismo subyacente aún no está claro, pero parece que existe una relación bidireccional, que tiene como principales factores la inflamación crónica y la resistencia a la insulina. Un interesante estudio publicado por Srikanthan et al.29 mostró que los pacientes con obesidad con sarcopenia tenían niveles de HOMA-IR (homeostatic model assessment of insuline resistance) y HbA1c más altos que los pacientes con obesidad sin sarcopenia. Este efecto estaba relacionado con la edad, viéndose solamente en el grupo de pacientes menores de 60 años. Una posible explicación sería que en la atrofia muscular relacionada con la edad, las fibras musculares de tipo II, que responden menos al efecto metabólico de la insulina30 se pierden en mayor medida que las fibras de tipo I. Sin embargo, los pocos datos aún son controvertidos y se necesitan más estudios para aclarar la influencia de la OS como factor patogénico de la diabetes tipo 2. Un estudio reciente mostró que las fluctuaciones de la glucosa en pacientes con diabetes tipo 2 estaban asociadas con sarcopenia31. Además, en el mismo estudio, la prevalencia de sarcopenia fue mayor en los pacientes con diabetes tipo 2 y deterioro cognitivo, en comparación con aquellos con función cognitiva normal. Este hallazgo es interesante aunque se conoce la relación entre la diabetes tipo 2 y el deterioro cognitivo32,33 se sabe poco sobre el papel de la sarcopenia. Cabe señalar que en la actualidad hay pocos estudios que evalúen la relación entre la sarcopenia y la variabilidad glucémica, y todos ellos se han efectuado en pacientes no obesos, mayores de 65 años. En realidad, la variabilidad de la glucosa, en particular la hiperglucemia aguda, aumenta la producción de beta-amiloide (Aβ) y altera la señalización de la insulina, tanto en el cerebro34 como en el músculo, lo que produce un deterioro del metabolismo de la glucosa periférica35 que contribuye a la sarcopenia.
Deterioro cognitivoRecientemente se ha visto que la presencia de la obesidad se relaciona con un deterioro cognitivo leve global, incluso en edades tempranas, al estar especialmente alterada la función ejecutiva y la velocidad de procesamiento de la información36,37. Además, varios estudios mostraron menores volúmenes cerebrales en pacientes con obesidad comparados con pacientes con normopeso38,39. Cabe destacar que se han encontrado hallazgos anatomopatológicos específicos de la enfermedad de Alzheimer (p. ej., gliosis cortical, atrofia del hipocampo, depósitos de Aβ) en modelos experimentales de obesidad40,41.
En estudios clínicos se ha observado asociación entre sarcopenia y deterioro de cognición global42,43, función ejecutiva, velocidad de procesamiento de la información, memoria global y atrofia cerebral. Además, la presencia de sarcopenia fue un factor predictor de deterioro de la función cognitiva44. Tolea et al.42 realizaron un estudio que evaluó a 353 pacientes de 69 años de edad en promedio y los dividieron en tres grupos: obesidad sin sarcopenia, OS y sarcopenia sin obesidad. El grupo con OS mostró un mayor grado de deterioro cognitivo, siendo la sarcopenia un predictor más potente de la pérdida de la función cognitiva que la obesidad.
Dado que la OS se asocia con RI, este mecanismo podría contribuir a las alteraciones cognitivas observadas en estos pacientes. En este sentido, es interesante resaltar que la sarcopenia exacerba la RI y la disglucemia relacionada con la obesidad41. Cabe mencionar que la alteración en la vía de señalización de la insulina a nivel cerebral (que conduce a la RI) desempeña un papel esencial en la patogenia de la demencia y precede a la disfunción cognitiva y los procesos patológicos incluso durante décadas45.
Sin embargo, debe destacarse que la mayoría de los estudios que relacionan la OS con el deterioro cognitivo se han realizado en pacientes mayores de 65 años. Por tanto, se necesitan estudios adicionales para evaluar la relación entre la OS y la función cognitiva en sujetos más jóvenes.
Obesidad osteosarcopénicaEl hueso y el músculo son estructuras que se encuentran física y funcionalmente emparejadas. La relación entre el sobrepeso y el metabolismo óseo es aún controvertida, pero se observa una tendencia que indica una protección en la densidad mineral ósea cuando hablamos de obesidad no sarcopénica, probablemente debido a que existe un aumento de masa magra que puede justificar en parte el efecto mecánico beneficioso que tiene la obesidad sobre el hueso46. Sin embargo, la OS se relaciona claramente con un aumento de la incidencia de osteoporosis, fracturas y fragilidad, probablemente debida a la pérdida de impacto mecánico del músculo sobre el hueso, la pérdida de los efectos positivos de la insulina sobre el tejido óseo y a que se trata de una situación fisiopatológica relacionada con un mayor estado proinflamatorio47-49. La «obesidad osteosarcopénica» (osteosarcopenic obesity, OSO) se considera desde hace algunos años como una entidad propia50,51. Incluso se han llegado a diferenciar dos entidades diferentes: la obesidad osteosarcopénica visceral (ostesarcopenic visceral obesity, OSVAT) y osteosarcopénica subcutánea (ostesarcopenic subcutaneous obesity, OSSAT)52. Se ha observado que los pacientes con OSVAT presentaban de forma significativa mayor riesgo de fracturas, inflamación y peor perfil metabólico, concluyendo que la identificación y clasificación de los pacientes dentro de estos tipos de perfiles de riesgo nos puede ayudar a enfocar distintos planes terapéuticos53.
Aunque la estrecha relación que existe entre el músculo y el hueso se conoce desde hace bastante tiempo, la inclusión del tejido graso, tanto por obesidad generalizada como por infiltración grasa de los tejidos, ha empezado a ganar relevancia recientemente52. Aun así son necesarios más estudios considerando la OSO como una única entidad para poder cuantificar exactamente el efecto deletéreo que ejerce per se47.
Impacto de la OS en la morbimortalidad y calidad de vidaComo se ha comentado anteriormente en el presente artículo, la OS afecta la fisiología del equilibrio energético, la función muscular y capacidad física17. Parece lógico pensar que aquellos sujetos con una fuerza muscular proporcionalmente baja a su masa corporal tengan mayor riesgo de desarrollar discapacidad física en el futuro, con consecuencias sobre su funcionalidad y calidad de vida. Estudios recientes54,55 mostraron que la OS aumenta la mortalidad por todas las causas. No obstante, en el análisis de subgrupos del metaanálisis, la mortalidad por todas las causas dependía de los criterios para el diagnóstico de OS, poniendo de nuevo de manifiesto la necesidad de homogeneizar los criterios.
Rantanen et al.56 encontraron un mayor riesgo de mortalidad (OR 1,39) asociado a sujetos obesos (IMC >30 kg/m2) que presentaban menor fuerza prensora, a diferencia de los sujetos con normopeso y mayor fuerza prensora. Hasta la fecha, pocos estudios han evaluado el efecto combinado de obesidad y baja fuerza muscular (como marcador de sarcopenia) sobre distintas actividades físicas cotidianas. Stenholm et al.54 mostraron que aquellos sujetos que presentaban ambas condiciones poseían mayores limitaciones en la marcha que los que solo presentaban un alto grado de grasa corporal o de baja fuerza muscular. En resumen, la obesidad puede conducir a la reducción de la actividad física y la acumulación de tejido adiposo, así como el deterioro de la masa muscular y la función. La OS precede la discapacidad para realizar las actividades instrumentales de la vida diaria57, limitando la calidad de vida. Además, un estudio reciente observa que la presencia de OS se asocia a peor calidad de vida según el cuestionario health-related quality of life(HRQoL), alcanzando significación clínica y estadística en comparación con la obesidad solamente, donde 64 de los 130 participantes que cumplieron con los criterios para OS (49,2%) mostraron puntuaciones significativamente más altas que las del grupo sin OS (p = 0,001)58.
Abordaje y plan terapéuticoIntervención nutricionalEn la formación, desarrollo y mantenimiento muscular intervienen varios factores, por lo que la estrategia terapéutica más reconocida se basa en una pauta multimodal que consiste en el adecuado aporte calórico y proteínico, actividad física, así como en la administración de determinados aminoácidos específicos, aceite de pescado, vitaminas y oligoelementos. Sin embargo, el tratamiento concreto está aún por determinarse por falta de consenso y evidencia suficiente59.
Generalmente se recomienda obtener un aporte proteínico de 0,8-1,0 g/kg/día en adultos sanos, 1-1,2 g/kg/día en personas de edad avanzada e incluso >1.2 g/kg/día en pacientes de edad avanzada que practiquen actividad física y tengan enfermedades agudas o crónicas asociadas60. Aunque algunos estudios han mostrado mejor tasa anabólica muscular aportando cantidades más elevadas en la cena61, en general se recomienda una distribución uniforme en las comidas (25-30 g por comida)60,62. En cuanto al tipo de proteína, se recomienda un consumo de proteínas de alto valor biológico, especialmente leucina63.
Por otra parte, empezamos a tener evidencia de beneficios con nutrientes específicos como el beta-hidroxi-metil-butirato (metabolito de la leucina), la vitamina D, la creatina y los ácidos grasos omega-349. No obstante, se necesitan más estudios que aporten mayor consistencia sobre las ventajas de estos nutrientes específicos, además de conocer su combinación y dosis ideales60. También se encuentran bajo desarrollo clínico fármacos que se espera favorezcan el desarrollo muscular, como los inhibidores de miostatina63.
Prescripción de ejercicio físicoLos datos disponibles hasta la fecha sugieren que los ejercicios de resistencia parecen ser más útiles para contrarrestar la sarcopenia, y el entrenamiento aeróbico para la obesidad, por lo que parece razonable que la mejor recomendación de actividad física en pacientes con obesidad sarcopénica sea una combinación de ambas17,64,65. En un estudio reciente controlado aleatorizado a seis meses realizado en sujetos con obesidad con edades comprendidas entre los 60 y 80 años, se observaron mejores resultados de rendimiento físico y calidad de vida en el grupo que realizaba ejercicio combinado que en el que sólo realizó ejercicios de resistencia o sólo actividad aeróbica64. Además, la fuerza muscular aumentó más y la masa magra disminuyó menos en los grupos de ejercicio combinado que en el grupo de ejercicio aeróbico. No obstante, existen poca información del efecto del ejercicio en población con OS y, principalmente, faltan estudios en población más joven.
Existen pocos datos sobre la eficacia de otros tipos de ejercicio como la electroestimulación. También parece efectiva la adición de un suplemento de proteínas a la prescripción de ejercicio físico en sujetos con OS66. Sin embargo, se necesitan más estudios para delimitar la cantidad óptima del suplemento proteínico.
Cirugía bariátrica y OSLa cirugía bariátrica (CB) es un tratamiento exitoso para la obesidad mórbida y conduce a una mejora muy importante de las comorbilidades asociadas y la calidad de vida67. Se ha comunicado una mejoría significativa en la RI y una tasa de remisión de la diabetes tipo 2 después de la CB del 60-70% después de un año de seguimiento68. En la actualidad hay pocos estudios sobre el papel de la CB en la OS. Un estudio reciente efectuado en 69 pacientes con obesidad mórbida mostró que la CB es eficaz para alcanzar el objetivo de pérdida de peso en pacientes con OS, con tasas de remisión similares de comorbilidades principales y un perfil de seguridad similar al del grupo no sarcopénico69. Sin embargo, los datos con respecto a la masa muscular se estimaron mediante ecuaciones matemáticas que podrían proporcionar un resultado poco preciso.
Otro estudio, realizado mediante DEXA70 identificó dos fenotipos de pacientes después de la CB en función del porcentaje de la masa muscular perdida referente al peso corporal total: «pérdida muscular aceptable» (< 15%) y «pérdida significativa de masa muscular» (> 15%). Los pacientes con la menor pérdida muscular mostraron una mejoría en la glucemia a los tres meses de la cirugía, en comparación con los que perdieron mayor masa muscular. Además, se detectó una correlación negativa entre la evolución de la glucemia y la masa muscular a los 12 meses tras la CB. Este hallazgo apoya una vez más la interrelación entre la masa muscular y el perfil metabólico.
Por otra parte, algunos estudios han mostrado un efecto perjudicial de la obesidad sarcopénica preoperatoria en los resultados de la CB: mayor riesgo de fuga gástrica después de la gastrectomía vertical71 y un impacto negativo de la estructura muscular72. Hoy en día la indicación de cirugía bariátrica en personas mayores de edad es todavía motivo de debate. En la mayoría de los centros, la indicación de cirugía bariátrica se limita a personas < 65 años. Además, la población mayor de 65 años tiene mayor riesgo de presentar sarcopenia. Prácticamente no hay datos en la literatura sobre el impacto de la cirugía bariátrica en esta población. En un estudio reciente, Voican et al. evaluó mediante TAC lumbar la evolución de la masa muscular tras la gastrectomía vertical en pacientes con obesidad < 45 años73. Encontraron que 8% de los pacientes tenían sarcopenia pre-CB y aproximadamente 33% a los 12 meses post-cirugía. En este estudio el sexo masculino, un menor IMC e índice de masa muscular pre-CB fueron los factores predictores significativos, subrayando la importancia de realizar un estudio de la masa muscular antes de plantear la CB.
ConclusionesLa OS se ha asociado con mayor discapacidad y morbimortalidad que las dos entidades por separado (obesidad y sarcopenia). También se ha asociado con un mayor riesgo de diabetes tipo 2 y deterioro cognitivo, siendo la inflamación crónica y la resistencia a la insulina factores patogénicos importantes. No existe un claro consenso sobre su definición y criterios diagnósticos. Actualmente disponemos de la DXA, TC y RM como técnicas de mayor precisión para medir la composición corporal, sin embargo, no son fácilmente accesibles en la práctica clínica diaria. Por ello, creemos que la combinación de la BIA junto con la US podría ser un buen método inicial para identificar aquellos pacientes con sarcopenia.
La pauta de tratamiento más respaldada sería el esquema multimodal con un adecuado aporte calórico-proteínico y la combinación de ejercicios de resistencia y aeróbicos. Se necesitan más estudios que ayuden a determinar la utilidad de biomarcadores en la detección precoz y seguimiento de pacientes con sarcopenia, así como estudios que evalúen la repercusión de la OS en población más joven (< 65 años). Además, se tendría que profundizar en la relación entre la OS y la cirugía bariátrica. Cabe destacar, que en la mayoría de los estudios no se ha evaluado correctamente la presencia de la sarcopenia pre-CB. Por este motivo consideramos que es fundamental en un primer lugar homogeneizar los criterios de diagnóstico y conocer la prevalencia de la sarcopenia en la población con obesidad.
La investigación en este campo ayudará a evitar o paliar las complicaciones asociadas a la OS que, sin duda, constituyen un emergente reto en la práctica clínica.