El SNP (rs7139228) del gen RETN es un polimorfismo que se ha asociado con trastorno metabólico en sujetos con obesidad y no se ha evaluado su efecto sobre la respuesta metabólica después de una intervención dietética.
ObjetivoNuestro objetivo fue analizar los efectos del polimorfismo del gen RETN rs7139228 sobre los cambios metabólicos secundarios a la pérdida de peso con una dieta hipocalórica de patrón mediterráneo.
DiseñoSe evaluaron 1.000 pacientes caucásicos con obesidad. Antes y después de 12 semanas de dieta hipocalórica con patrón mediterráneo, se realizó una evaluación antropométrica y un análisis bioquímico. El análisis estadístico se realizó como un modelo dominante (GG vs. GA + AA).
ResultadosLas variaciones en los parámetros antropometricos, los niveles de leptina y la presión arterial sistólica fueron similares en ambos genotipos. En los no portadores del alelo A, los niveles de resistina, insulina, HOMA-IR, triglicéridos y proteína C reactiva disminuyeron. Las modificaciones fueron estadísticamente significativas en los no portadores del alelo A; resistina (-1,3 + 0,1 ng/dL: p = 0,02), triglicéridos (-22,9 ± 4,9 mg/dL: p = 0,02), PCR (-2,7 ± 0,4 mg/dL: p = 0,02), insulina -6,5 ± 1,8 mUI/L: p = 0,02) y HOMA-IR (-2,2 ± 0,8: p = 0,03). Además, los niveles de insulina, HOMA-IR y resistina fueron más altos en los no portadores del alelo A. Por último, la prevalencia del síndrome metabólico e hiperglucemia fue más elevada en los portadores del alelo A y solo disminuyeron los porcentajes tras la intervención en los no portadores del alelo A.
ConclusiónExiste una asociación del alelo A rs7139228 con una peor respuesta metabólica (insulina, HOMA-IR, triglicéridos y PCR) tras pérdida de peso con dieta hipocalórica de patrón mediterráneo. Además, la disminución de la prevalencia de síndrome metabólico e hiperglucemia en los portadores del alelo A fue no significativa.
The SNP (rs7139228) of the DCN gene is a polymorphism that has been associated with metabolic disorder in subjects with obesity, and its effect on metabolic response after dietary intervention has not been evaluated.
ObjectiveOur objective was to analyse the effects of the polymorphism of the DCN gene rs7139228 on metabolic changes secondary to weight loss with a hypocaloric Mediterranean diet.
Design1000 obese Caucasian patients were evaluated. An anthropometric evaluation and a biochemical analysis were performed before and after 12 weeks of a hypocaloric Mediterranean diet. The statistical analysis was performed as a dominant model (GG vs.GA + AA).
ResultsImprovements in anthropometric parameters, leptin levels and systolic blood pressure were similar in both genotype groups. In non- A allele carriers, levels of resistin, insulin, HOMA-IR, triglycerides and C-reactive protein decreased. The improvements were statistically significant in this group; resistin (-1.3 + 0.1 ng/dL: p = 0.02), triglycerides (-22.9 ± 4.9 mg/dl: p = 0.02), CRP (-2.7 ± 0 .4 mg/dl: p = 0.02), insulin -6.5 ± 1.8 mIU/L: p = 0.02) and HOMA-IR (-2.2 ± 0.8: p = 0, 03). In addition, insulin, HOMA-IR and resistin levels were higher in A allele carriers than in non-carriers. Finally, the prevalence of metabolic syndrome and hyperglycaemia were higher in A allele carriers, and these percentages only decreased after intervention in non-A allele carriers.
ConclusionThe A rs7139228 allele is associated with a worse metabolic response (insulin, HOMA-IR, triglycerides and CRP) after weight loss with a hypocaloric Mediterranean diet. A non-significant decrease in the prevalence of metabolic syndrome and hyperglycaemia were detected in A allele carriers.
La resistina es una adipocitoquina bien conocida que se relaciona inicialmente con la resistencia a la insulina en modelos in vivo1. La resistina es secretada por adipocitos y macrófagos en el tejido adiposo. El tejido adiposo tiene un papel de almacenamiento de energía, pero además es un órgano endocrino al sintetizar muchas adipocitoquinas. Estas adipocitoquinas tienen funciones importantes en el metabolismo, la sensibilidad a la insulina, el estado inflamatorio, la saciedad y el apetito2 y una de las adipocitoquinas más relevante es la mencionada resistina. Por ejemplo, los niveles circulantes de resistina se han asociado con un aumento de la obesidad central, síndrome metabólico y diabetes mellitus tipo 23. Sin embargo, otros estudios no han podido demostrar estas asociaciones4, por tanto, la literatura es contradictoria ante el papel de la resistina en el metabolismo.
En la literatura, se ha descrito la heredabilidad de los niveles de resistina y un alto porcentaje de la variación en los niveles circulantes de resistina puede explicarse por factores genéticos. El gen que codifica la resistina (RETN) se encuentra en el cromosoma 19p13.2 y se han descrito algunas variantes genéticas en este locus5. Por ejemplo, se ha informado que los polimorfismos de un solo nucleótido (SNP) de este gen aumentan la susceptibilidad a la diabetes mellitus tipo 2 al aumentar los niveles de resistina6. Uno de estos SNP es rs7139228, habiendo sido escasamente evaluado en la literatura. La variante del intrón SNP 5́UTR C/T (rs7139228) es un polimorfismo que se ha asociado con niveles elevados de resistina7. A pesar de estos datos previos en estudios transversales, no existen investigaciones en la literatura que evalúen el efecto de la variante rs7139228 sobre los cambios metabólicos posteriores a la pérdida de peso. En la actualidad, uno de los patrones dietéticos con mayor efecto beneficioso sobre los parámetros bioquímicos tras la pérdida de peso es el patrón de dieta mediterránea8. El patrón de la dieta mediterránea ha demostrado beneficios cardiometabólicos, como la mejora de la resistencia a la insulina o el perfil de lípidos9. Algunos estudios con otros SNP en el gen RETN han mostrado diferentes respuestas metabólicas a las intervenciones dietéticas10, e incluso después de la cirugía bariátrica11.
Nuestro objetivo fue analizar los efectos del polimorfismo del gen RETN rs7139228 sobre los cambios metabólicos secundarios a la pérdida de peso tras una dieta hipocalórica de patrón mediterráneo.
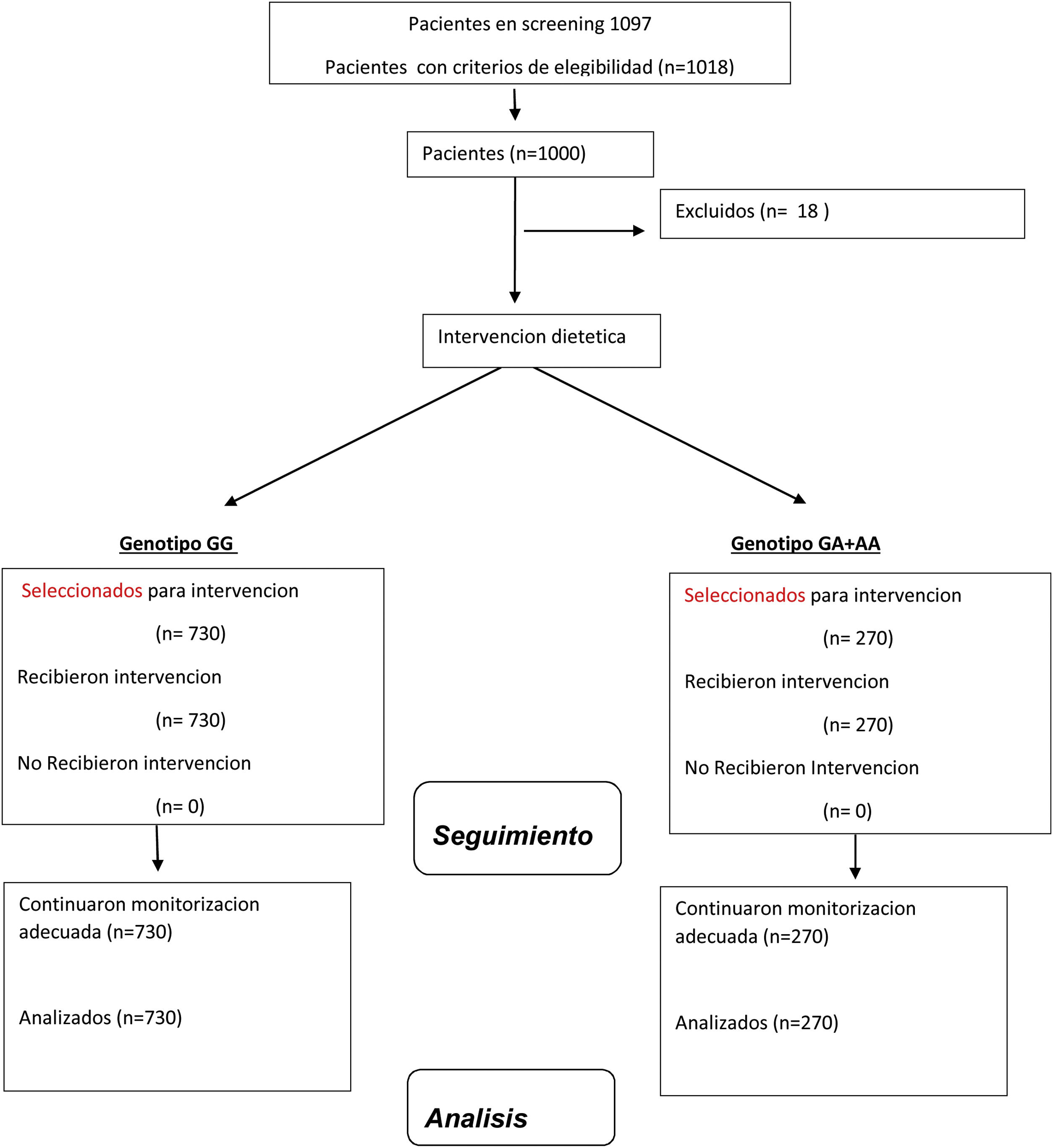
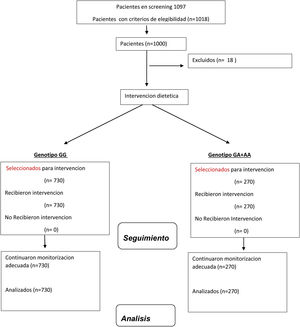
Material y métodosSujetosReclutamos una muestra de 1.018 adultos caucásicos con obesidad, índice de masa corporal (IMC) > 30 kg/m2) no diabéticos y se analizó finalmente un total de 1.000 sujetos (fig. 1), el reclutamiento fue unicéntrico y de enero de 2017 a enero de 2022. Los 18 pacientes excluidos lo fueron por haber realizado un tratamiento dietético en los 6 previos al inicio del estudio. Estos pacientes fueron reclutados de forma prospectiva con un método de muestreo no probabilístico consecutivo entre pacientes de médicos de atención primaria con obesidad. Este estudio se realizó de acuerdo con la Declaración de Helsinki y todos los procedimientos fueron aprobados por el Comité Central de Ética del HCUV. Todos los participantes firmaron un consentimiento informado. Para la inclusión de estos pacientes se utilizaron los siguientes criterios; edad mayor de 18 años, IMC > 30 kg/m2 y ausencia de dieta durante los tres meses previos al estudio. Los siguientes criterios se utilizaron como criterios de exclusión; eventos cardiovasculares durante los últimos 12 meses, antecedentes de diabetes mellitus, así como el uso de metformina, sulfonilureas, fármacos inhibidores de la dipeptidil tipo IV, tiazolidinedionas, insulina, análogos del receptor GLP-1, glucocorticoides, bloqueadores de los receptores de angiotensina, angiotensina inhibidores de la enzima convertidora, medicamentos psicoactivos y estatinas.
ProcedimientosSe obtuvieron muestras de sangre venosa en ayunas (12 h) por punción venosa y se recogieron en tubos Vacutainer. Los siguientes parámetros se determinaron en el tiempo basal y a las 12 semanas; glucosa basal en ayunas, proteína C reactiva, insulina, resistencia a la insulina (HOMA-IR), perfil lipídico (colesterol total, colesterol LDL, colesterol HDL, concentración de triglicéridos plasmáticos) y niveles de adipocitoquinas circulantes (leptina, adiponectina y resistina). En los dos tiempos de estudio comentados anteriormente se determinaron los siguientes parámetros; masa grasa con impedancia, peso y presión arterial. La variante rs7139228 del gen RETN se evaluó en el momento basal.
Se utilizaron los criterios del Adult Treatment Panel III (ATPIII) para diagnosticar en los sujetos la presencia de síndrome metabólico (SM)12. El diagnóstico de SM requirió al menos tres de los siguientes datos; glucosa en ayunas elevada o tratamiento para diabetes mellitus, triglicéridos elevados (> 150 mg/dL) o tratamiento para hiperlipidemia, colesterol HDL bajo < 40 mg/dL (hombres) o < 50 mg/dL (mujeres), presión arterial sistólica o diastólica elevadas (> 130/85 mmHg o tratamiento antihipertensivo) y perímetro de cintura aumentado (> 94 cm [hombres] o > 80 cm [mujeres]).
Genotipado del polimorfismo del gen RETN rs7139228El ADN genómico se obtuvo a partir de leucocitos de sangre periférica con el kit comercial Vineo Extract DNA (Biorad CA, LA, EE. UU.), de acuerdo con el protocolo del fabricante. La reacción en cadena de la polimerasa (PCR) en tiempo real se realizó con 50 ng de este ADN genómico, 0.5 uL de 100 μM de cada cebador oligonucleotídico (cebador directo: 5’- ACGTTGGATGGCAAAGATTCTGATCTCGGG -3’ y reverso 5’- ACGTTGGATGCCATCATTTTCAGCATGTATG -3’). El ADN se desnaturalizó a 95°C durante tres minutos; se realizaron 45 ciclos de desnaturalización a 95°C durante 15 s, y posteriormente a 59,3°C durante 45 s. La PCR se realizó en un volumen final de 25 μL que contenía 12,5 μL de IQ supermix (Bio-Rad®, Hercules, CA) con ADN polimerasa TAq. Si ambas cadenas crecían en la muestra, esta muestra se clasificaba como heterocigota. Si solo crecía una hebra en una muestra, esta muestra se clasificaba como homocigota. El software del termociclador clasifica a cada paciente como homocigoto de tipo salvaje (GG), heterocigoto (GA) y homocigoto mutante (AA). Además, en cada reacción se incluyeron un control negativo y muestras de control que representaban todos los genotipos. El equilibrio de Hardy-Weinberg se determinó con una prueba estadística (χ2). La variante del gen RETN estuvo en equilibrio de Hardy-Weinberg (p = 0,49).
Determinaciones de laboratorioEl análisis bioquímico sérico de glucosa, insulina, proteína C reactiva, colesterol total, colesterol HDL y triglicéridos se midió con el analizador COBAS INTEGRA 400 (Roche Diagnostic, Basilea, Suiza). El colesterol LDL se calculó utilizando la fórmula de Friedewald (colesterol LDL = colesterol total-colesterol HDL-triglicéridos/5)13. Con base en los niveles de glucosa e insulina, la evaluación del modelo de homeostasis para el índice de resistencia a la insulina (HOMA-IR) se obtuvo utilizando la siguiente ecuación (glucosa x insulina/22,5)14. Finalmente, todos los niveles de adipocinas se determinaron mediante ensayo inmunoabsorbente ligado a enzimas (ELISA); resistina (Biovendor Laboratory, Inc., Brno, República Checa) con una sensibilidad de 0,2 ng/mL con un rango normal de 4-12 ng/mL, leptina (Diagnostic Systems Laboratories, Inc., Texas, EE. UU.) con una sensibilidad de 0,05 ng/mL y un rango normal de 10-100 ng/mL y adiponectina (R&D Systems, Inc., Minneapolis, EE. UU.) con una sensibilidad de 0,246 ng/mL y un rango normal de 8,65-21,43 ng/mL.
Presión arterial y parámetros antropométricosLa presión arterial se midió tres veces después de un tiempo de descanso de 10 min con un esfigmomanómetro de mercurio (Omrom, LA, CA, EE. UU.) y se promediaron los resultados.
El peso corporal se midió con una balanza con una precisión de 100 g (Omrom, LA, CA, EE. UU.) y el índice de masa corporal se calculó como peso (kg)/talla (m2), clasificando como pacientes con obesidad a aquellos con un índice de masa corporal superior a 30 kg/m2. También se midió la circunferencia de la cintura con una cinta métrica (Tipo SECA, SECA, Birmingham, UK) (diámetro más estrecho entre el xifoides y la cresta ilíaca). La masa grasa total se obtuvo por impedancia con una precisión de 5 g15 (EFG BIA 101 Anniversary, Akern, It). Se utilizó esta fórmula (0,756 altura2/resistencia) + (0,110 x masa corporal) + (0,107 x reactancia) – 5.463.
Intervención dietéticaLos sujetos durante este estudio de intervención (12 semanas) recibieron asesoramiento individualizado por una única dietista ciega al resultado del polimorfismo evaluado sobre una dieta hipocalórica de perfil mediterráneo. Este aporte calórico se calculó restando 500 calorías al aporte calórico obtenido con la fórmula de Harris-Benedict en nuestra población con obesidad (2.018,4 ± 99,7 kcal por día). El porcentaje objetivo de energía derivada de carbohidratos, grasas y proteínas en la dieta fue; (45,7% de hidratos de carbono, 34,4% de lípidos y 19,9% de proteínas). La distribución de grasas dietéticas en la dieta fue; 21,8% de grasas saturadas, 55,5% de grasas monoinsaturadas y 22,7% de grasas poliinsaturadas (7 g al día de ácidos grasos omega 6, 2 g al día de ácidos grasos omega 3 y una relación omega 6/omega 3 de 3,5). La dieta contenía los siguientes alimentos; aceite de oliva virgen extra (a razón de 30 mL/día) (Oli Duero, Matarromera, Sl), tres raciones de pescado a la semana, tres raciones de frutos secos a la semana, verduras y frutas frescas cuatro a cinco raciones al día. El seguimiento de la intervención dietética se realizó cada 14 días por un dietista, mediante llamada telefónica para aumentar la adherencia a la dieta y el seguimiento del protocolo. Todos los sujetos recibieron información para registrar sus ingestas durante tres días diferentes. Los registros fueron evaluados por un dietista mediante un programa de computadora en línea (https://calcdieta.ienva.org/?lang=es calculadora de dietas CIENC®). El programa de ejercicio físico recomendado consistía en un ejercicio aeróbico al menos tres veces por semana (60 min cada una, alcanzando un total de 180 min cada semana) y el paciente lo registraba de manera diaria en una cartilla personalizada.
Análisis estadísticoEl tamaño de la muestra se calculó para detectar diferencias superiores a 1 ng/mL en los niveles de resistina circulante tras seguir la dieta con 90% de potencia y 5% de significación (n = 1.000). Se utilizó la prueba de Kolmogorov-Smirnov para determinar la distribución de las variables. Los datos se mostraron como promedio ± desviación estándar. Las variables numéricas con distribución normal se analizaron con una prueba t de Student de dos colas. Las variables categóricas se evaluaron con la prueba de χ2, con corrección de Yates cuando fue necesario. Las variables no paramétricas se analizaron con la prueba U de Mann-Whitney. Las diferencias en variables antropométricas y bioquímicas entre los grupos de genotipos se probaron con análisis de la covarianza (ANCOVA) ajustado por edad, sexo, así como BMI inicial y presencia de SM. El análisis estadístico se realizó con los genotipos GA y AA combinados como grupo (genotipo de riesgo, portadores del alelo A) y el genotipo GG como segundo grupo (genotipo salvaje, no portadores del alelo A), en un modelo dominante. Un valor de p < 0,05 se consideró estadísticamente significativo. Todos los análisis se realizaron con SPSS versión 23.0 (IBM Corp., Armonk, NY, EE. UU.).
ResultadosUn total de 730 (73%) eran mujeres y 270 (27%) hombres (n = 1.000). La edad media del grupo fue de 51,2 ± 5,2 años, sin diferencias significativas de edad entre varones y mujeres (51,4 ± 5,1 años vs. 51,0 ± 4,1 años: ns).
Tras el genotipado de los 1.000 sujetos con obesidad en función del polimorfismo rs7139228, la distribución del genotipo fue la siguiente: 850 sujetos con GG (84,8%), 146 sujetos con GA (14,6%) y cuatro sujetos con AA (0,4%). La frecuencia alélica fue G (0,92) y C (0,08). Al agrupar a los sujetos para realizar un análisis dominante, se obtuvieron las siguientes frecuencias: 850 sujetos con genotipo salvaje GG (84,8%), con un total de 613 mujeres (72%) y 237 hombres (28%) y un total de 150 (15,2%) sujetos con genotipo mutante (GA + AA), siendo 117 (78,8%) mujeres y 33 (21,2%) hombres.
Los pacientes siguieron las recomendaciones dietéticas y en ambos genotipos alcanzaron los objetivos de calorías y distribución de macronutrientes. La ingesta calórica total fue similar en ambos genotipos (GG vs. GA + AA) (1.542,9 ± 190,1 vs. 1.495,1 ± 119,1 calorías/día; ns). El porcentaje de macronutriente en ambos grupos (GG vs. GA + A) fue similar: (carbohidratos; 36,0 ± 3,1 vs. 36,4 ± 2,4%; p = 0,24), (grasas; 40,9 + 3,0 vs. 41,0 ± 2,9%; p = 0,29) y (proteínas; 23,1 ± 2,9 vs. 22,6 ± 1,5%; p = 0,33), también. La distribución de las grasas de la dieta en ambos grupos de genotipo (GG vs. GA + AA) fue similar: (grasas monoinsaturadas; 57,9 ± 4,1 vs. 56,4 ± 4,1%; p = 0,41), (grasas saturadas; 21,9 ± 3,1 vs. 23,9 ± 2,1%; p = 0,39) y (grasas poliinsaturadas; 19,8 ± 1,1 vs. 20,1 ± 1,9%; p = 0,16). El ejercicio basal fue similar en ambos grupos de genotipo (GG vs. GA + AA) (120,9 + 21,4 min/semana vs. 118,1 + 11,3 min/semana: p = 0,61). No se detectaron diferencias a los tres meses (125,1 + 11,3 min/semana vs. 122,1 + 11,1 min/semana: p = 0,33).
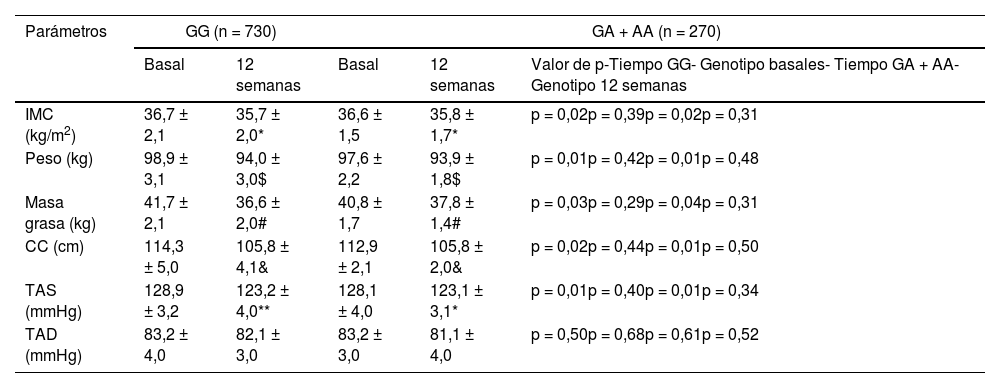
Tras el seguimiento de la dieta hipocalórica con patrón mediterráneo los siguientes parámetros disminuyeron; peso, IMC, masa grasa, presión arterial sistólica y perímetro de cintura. Estas modificaciones significativas fueron similares en ambos grupos de genotipos, sin diferencias estadísticas entre ambos grupos (tabla 1). En el grupo GG, la disminución de peso fue -4,9 ± 1,2 kg (disminución de portadores del alelo A -4,7 ± 1,2 kg: p = 0,41), IMC -1,0 ± 0,4 kg/m2 (disminución de portadores del alelo A -0,8 ± 0,2 kg /m2: p = 0,49, masa grasa -3,3 ± 1,0 kg (disminución de portadores del alelo A -3,1 ± 1,1 kg: p = 0,39) y circunferencia de cintura la disminución fue -9,0 ± 2,0 cm (disminución de portadores del alelo A -8,6 ± 2,3 cm: p = 0,38). En los no portadores del alelo A, la disminución de la presión arterial sistólica fue de -5,7 ± 1,4 mmHg (disminución en los portadores del alelo A -5,0 ± 2,0 mmHg p = 0,39), similar por tanto en ambos grupos. No se detectaron diferencias en la presión arterial diastólica. Finalmente, no se detectaron diferencias entre los valores basales y postratamiento de los parámetros antropométricos entre ambos genotipos GG vs. GA/AA.
Parámetros antropométricos basales y postintervención de obesidad y medición de la presión arterial (media ± DE)
| Parámetros | GG (n = 730) | GA + AA (n = 270) | |||
|---|---|---|---|---|---|
| Basal | 12 semanas | Basal | 12 semanas | Valor de p-Tiempo GG- Genotipo basales- Tiempo GA + AA- Genotipo 12 semanas | |
| IMC (kg/m2) | 36,7 ± 2,1 | 35,7 ± 2,0* | 36,6 ± 1,5 | 35,8 ± 1,7* | p = 0,02p = 0,39p = 0,02p = 0,31 |
| Peso (kg) | 98,9 ± 3,1 | 94,0 ± 3,0$ | 97,6 ± 2,2 | 93,9 ± 1,8$ | p = 0,01p = 0,42p = 0,01p = 0,48 |
| Masa grasa (kg) | 41,7 ± 2,1 | 36,6 ± 2,0# | 40,8 ± 1,7 | 37,8 ± 1,4# | p = 0,03p = 0,29p = 0,04p = 0,31 |
| CC (cm) | 114,3 ± 5,0 | 105,8 ± 4,1& | 112,9 ± 2,1 | 105,8 ± 2,0& | p = 0,02p = 0,44p = 0,01p = 0,50 |
| TAS (mmHg) | 128,9 ± 3,2 | 123,2 ± 4,0** | 128,1 ± 4,0 | 123,1 ± 3,1* | p = 0,01p = 0,40p = 0,01p = 0,34 |
| TAD (mmHg) | 83,2 ± 4,0 | 82,1 ± 3,0 | 83,2 ± 3,0 | 81,1 ± 4,0 | p = 0,50p = 0,68p = 0,61p = 0,52 |
IMC: índice de masa corporal; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica; CC: circunferencia cintura.
Diferencia estadísticamente significativa p < 0,05, en cada grupo de genotipo (* IMC, $ peso, # masa grasa, & WC, ** TAS).
Análisis ANCOVA ajustado por sexo, edad, BMI inicial y presencia de SM. Primera p, valor de p de la intervención dietética después de 12 semanas en el genotipo GG, segunda p, valor de p entre los genotipos GG frente a los valores basales de GA + AA, tercera p, valor de p de la intervención dietética después de 12 semanas en el genotipo GA + AA, cuarta p, valor de p entre los genotipos GG vs. GA + AA postratamiento.
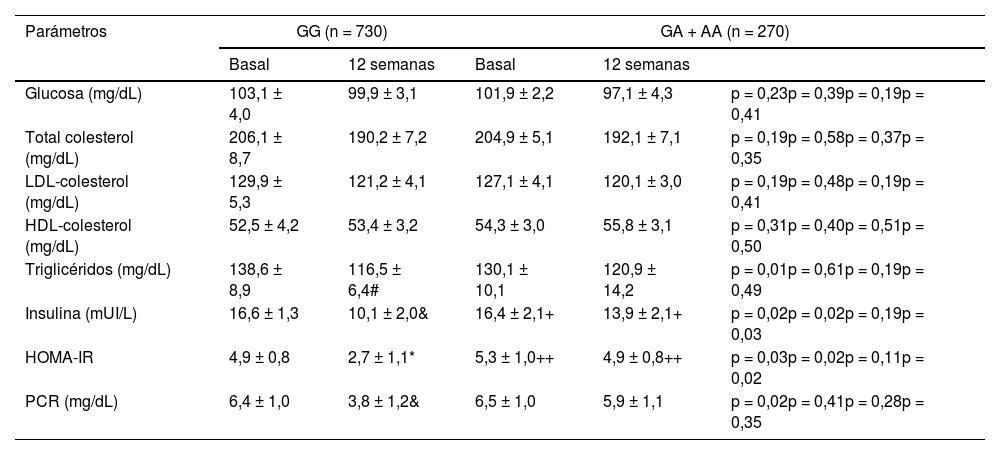
La modificación tras la dieta en las variables bioquímicas no alcanzó la significación estadística en pacientes con el alelo A (tabla 2). En los no portadores del alelo A, los niveles de insulina, HOMA-IR, triglicéridos y proteína C reactiva disminuyeron. La disminución de estos parámetros en los no portadores del alelo A fue estadísticamente significativa; triglicéridos (-22,9 ± 4,9 mg/dL: p = 0,02), PCR (-2,7 ± 0,4 mg/dL: p = 0,02), insulina -6,5 ± 1,8 mUI/L: p = 0,02) y HOMA-IR (-2,2 ± 0,8: p = 0,03). Finalmente, se detectaron diferencias estadísticas en insulina y HOMA-IR entre los valores basales y postratamiento de las variables entre el genotipo del alelo mayor GG y el genotipo del alelo menor (GA + AA), siendo más elevados en estos últimos pacientes.
Parámetros bioquímicos de niveles basales y postintervención (media ± DE)
| Parámetros | GG (n = 730) | GA + AA (n = 270) | |||
|---|---|---|---|---|---|
| Basal | 12 semanas | Basal | 12 semanas | ||
| Glucosa (mg/dL) | 103,1 ± 4,0 | 99,9 ± 3,1 | 101,9 ± 2,2 | 97,1 ± 4,3 | p = 0,23p = 0,39p = 0,19p = 0,41 |
| Total colesterol (mg/dL) | 206,1 ± 8,7 | 190,2 ± 7,2 | 204,9 ± 5,1 | 192,1 ± 7,1 | p = 0,19p = 0,58p = 0,37p = 0,35 |
| LDL-colesterol (mg/dL) | 129,9 ± 5,3 | 121,2 ± 4,1 | 127,1 ± 4,1 | 120,1 ± 3,0 | p = 0,19p = 0,48p = 0,19p = 0,41 |
| HDL-colesterol (mg/dL) | 52,5 ± 4,2 | 53,4 ± 3,2 | 54,3 ± 3,0 | 55,8 ± 3,1 | p = 0,31p = 0,40p = 0,51p = 0,50 |
| Triglicéridos (mg/dL) | 138,6 ± 8,9 | 116,5 ± 6,4# | 130,1 ± 10,1 | 120,9 ± 14,2 | p = 0,01p = 0,61p = 0,19p = 0,49 |
| Insulina (mUI/L) | 16,6 ± 1,3 | 10,1 ± 2,0& | 16,4 ± 2,1+ | 13,9 ± 2,1+ | p = 0,02p = 0,02p = 0,19p = 0,03 |
| HOMA-IR | 4,9 ± 0,8 | 2,7 ± 1,1* | 5,3 ± 1,0++ | 4,9 ± 0,8++ | p = 0,03p = 0,02p = 0,11p = 0,02 |
| PCR (mg/dL) | 6,4 ± 1,0 | 3,8 ± 1,2& | 6,5 ± 1,0 | 5,9 ± 1,1 | p = 0,02p = 0,41p = 0,28p = 0,35 |
HOMA-IR (homeostasis model assessment); PCR: proteína C reactiva.
Diferencias estadísticas p < 0,05, en cada grupo de genotipo (triglicéridos # insulina & OMA IR * PCR&).
Diferencias estadísticas p < 0,05, entre diferentes genotipos (+ insulina, ++ HOMA-IR).
Análisis ANCOVA ajustado por sexo, edad, BMI inicial y presencia de SM. Primera p, valor de p de la intervención dietética después de 12 semanas en el genotipo GG, segunda p, valor de p entre los genotipos GG frente a los valores basales de GA + AA, tercera p, valor de p de la intervención dietética después de 12 semanas en el genotipo GA + AA, cuarta p, valor de p entre los genotipos GG vs. GA + AA postratamiento.
Los niveles de leptina disminuyeron de manera similar en ambos grupos después de la intervención dietética (-28,3 ± 4,9 ng/dL en no portadores del alelo A frente a -26,1 ± 4,2 ng/dL en portadores del alelo A: p = 0,48) (tabla 3). Los niveles de resistina disminuyeron en los no portadores del alelo A después de la intervención dietética (-1,3 ± 0,1 ng/dL en los no portadores del alelo A frente a -0,5 ± 0,2 ng/dL en los portadores del alelo A: p = 0,01), y no se modificaron en los portadores del alelo A. Los niveles de adiponectina se mantuvieron sin cambios en ambos grupos. Se detectaron diferencias en los niveles de resistina entre el tiempo basal y postratamiento entre ambos grupos de genotipo GG vs. GA/AA. Los valores de resistina fueron más altos en los portadores del alelo A que en los no portadores del alelo A.
Niveles basales y postintervención de adipoquinas séricas (media ± DE)
| Parámetros | GG (n = 730) | GA + AA (n = 270) | |||
|---|---|---|---|---|---|
| Basal | 12 semanas | Basal | 12 semanas | ||
| Resistina (ng/dL) | 3,7 ± 0,4 | 2,5 ± 0,5** | 4,8 ± 0,3+ | 4,2 ± 0,4+ | p = 0,01p = 0,02p = 0,19p = 0,02 |
| Adiponectina (ng/dL) | 30,2 ± 8,1 | 34,2 ± 3,1 | 29,9 ± 7,0 | 34,4 ± 5,1 | p = 0,29p = 0,52p = 0,21p = 0,51 |
| Leptina (ng/dL) | 98,2 ± 8,6 | 70,2 ± 8,1* | 95,2 ± 9,2 | 69,7 ± 8,0* | p = 0,02p = 0,48p = 0,01p = 0,43 |
Diferencias estadísticas p < 0,05, en cada grupo de genotipo (* leptina, ** resistina).
Diferencias estadísticas p < 0,05, entre diferentes genotipos (+ resistina).
Análisis ANCOVA ajustado por sexo, edad, BMI inicial y presencia de SM. Primera p, valor de p de la intervención dietética después de 12 semanas en el genotipo GG, segunda p, valor de p entre los genotipos GG frente a los valores basales de GA + AA, tercera p, valor de p de la intervención dietética después de 12 semanas en el genotipo GA + AA, cuarta p, valor de p entre los genotipos GG vs. GA + AA postratamiento.
Para analizar la relación entre los niveles de resistina, los genotipos SNP rs7139228 y la presencia de SM, se compararon los valores de resistina en ambos genotipos. Los niveles séricos de resistina fueron mayores en portadores del alelo A con SM (SM 4,9 ± 0,4 ng/mL vs. no SM 4,7 ± 0,3 ng/mL; p = 0,03), sin embargo, no existieron diferencias en los niveles séricos de resistina en pacientes no portadores del alelo A (SM 3,9 ± 0,5 ng/ml vs. no SM 3,5 ± 0,8 ng/mL; p = 0,43).
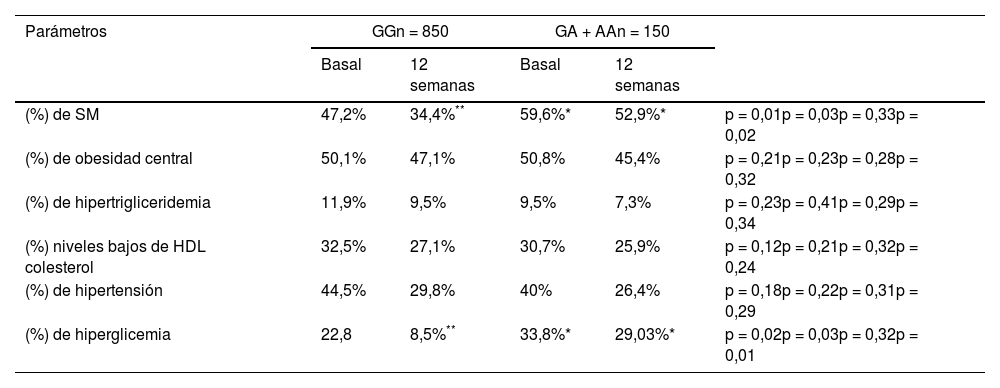
La prevalencia global de SM en la muestra fue de 52,1% (tabla 4). El porcentaje de pacientes con síndrome metabólico y sus diferentes componentes (obesidad central, niveles bajos de colesterol HDL, hipertrigliceridemia, hipertensión o hiperglucemia) se muestran en la tabla 4. El porcentaje de sujetos con obesidad que presentaban hiperglucemia (OR = 1,65, IC 95% = 1,16-2,34; p = 0,03) y síndrome metabólico (OR = 1,49, IC 95% = 1,12-1,97; p = 0,03) fueron mayores en los no portadores del alelo A que en los portadores de este alelo de riesgo. Por otra parte, tras la intervención dietética, en los no portadores del alelo A disminuyó la prevalencia del síndrome metabólico (47,2 vs. 34,4%; p = 0,01) y la prevalencia de hiperglucemia (22,8% vs. 8,5%; p = 0,02), esta disminución no fue significativa en los pacientes potadores del alelo A (tabla 4).
Síndrome metabólico y componentes del síndrome metabólico (SM)
| Parámetros | GGn = 850 | GA + AAn = 150 | |||
|---|---|---|---|---|---|
| Basal | 12 semanas | Basal | 12 semanas | ||
| (%) de SM | 47,2% | 34,4%** | 59,6%* | 52,9%* | p = 0,01p = 0,03p = 0,33p = 0,02 |
| (%) de obesidad central | 50,1% | 47,1% | 50,8% | 45,4% | p = 0,21p = 0,23p = 0,28p = 0,32 |
| (%) de hipertrigliceridemia | 11,9% | 9,5% | 9,5% | 7,3% | p = 0,23p = 0,41p = 0,29p = 0,34 |
| (%) niveles bajos de HDL colesterol | 32,5% | 27,1% | 30,7% | 25,9% | p = 0,12p = 0,21p = 0,32p = 0,24 |
| (%) de hipertensión | 44,5% | 29,8% | 40% | 26,4% | p = 0,18p = 0,22p = 0,31p = 0,29 |
| (%) de hiperglicemia | 22,8 | 8,5%** | 33,8%* | 29,03%* | p = 0,02p = 0,03p = 0,32p = 0,01 |
Los puntos de corte para los criterios de; obesidad central (perímetro de cintura > 80 cm en mujeres y > 94 en hombres), hipertensión (TA sistólica > 130 mmHg o TA diastólica > 85 mmHg o tratamiento específico), hipertrigliceridemia (triglicéridos > 150 mg/dL o tratamiento específico) o hiperglucemia (glucosa plasmática en ayunas > 110 mg/dL o tratamiento farmacológico para la glucemia elevada).
p < 0,05 dentro del mismo genotipo (GG vs. GA + AA).
Primera p, valor de p de la intervención dietética después de 12 semanas en el genotipo GG, segunda p, valor de p entre los genotipos GG frente a los valores basales de GA + AA, tercera p, valor de p de la intervención dietética después de 12 semanas en el genotipo GA + AA, cuarta p, valor de p entre los genotipos GG vs. GA + AA postratamiento.
Este es el primer trabajo de investigación en la literatura que analiza los efectos de una dieta hipocalórica y la variante del gen RETN rs7139228 sobre la respuesta metabólica tras una pérdida de peso. En nuestro estudio analizando esta variante genética del gen RETN, hemos observado una asociación significativa entre el alelo A de este SNP y una peor respuesta de la resistencia a la insulina, insulina basal, triglicéridos, proteína C reactiva y resistina circulante tras la pérdida de peso con un hipocalórico dieta mediterránea. Por otra parte, la pérdida de peso en los portadores del alelo A, no mejoró la prevalencia del SM ni de hiperglucemia. Por último, los pacientes con obesidad y portadores del alelo A, presentan peores niveles de insulina, HOMA-IR y resistina, así como mayor prevalencia de SM.
Como hemos referido previamente, el papel de la resistina en el metabolismo es controvertido y los estudios de intervención que evalúan la relación de esta molécula con algunos de los polimorfismos de su gen son muy escasos. Por ejemplo, algunos estudios han observado que los niveles de resistina están relacionados con la obesidad y sus comorbilidades16 y otros estudios no han conseguido demostrar estas asociaciones17. Por otro lado, el efecto sobre los niveles de resistina de las intervenciones dietéticas u otras intervenciones que producen pérdida de peso también son escasos y contradictorios. Hay estudios con dietas hipocalóricas10 en los que los niveles de resistina no se han modificado tras la intervención dietética y la pérdida de peso secundaria. Sin embargo, otros estudios sí han demostrado una disminución de los niveles de resistina después de la pérdida de peso18 o incluso un aumento paradójico de los niveles séricos después de la pérdida de peso19. Como observamos, la respuesta biológica de la resistina es compleja, por ejemplo, un grupo de pacientes con obesidad tras una intervención quirúrgica con banda gástrica ajustable demostró una respuesta bifásica con una disminución de los niveles de resistina inicialmente y un aumento al año de seguimiento20. En estas respuestas tan dispares a la pérdida de peso, pueden estar involucrados, desde los nutrientes presentes en las dietas hipocalóricas utilizadas, así como también variantes genéticas del gen RETN que pueden modular las respuestas. Por ejemplo, Cabrera et al.21 demostraron que el nivel de resistina se asocia positivamente con la ingesta de grasas saturadas e inversamente con la ingesta de grasas monoinsaturadas. En un estudio de intervención22, los niveles de resistina disminuyeron después de una intervención dietética suplementada con wakame y algarrobas. Curiosamente, sobre la base de diferentes componentes de la dieta mediterránea (ácidos grasos omega 3, ácidos grasos monoinsaturados, resveratrol, quercetina, etc.), se ha sugerido que las moléculas bioactivas de la dieta mediterránea pueden mejorar diferentes factores de riesgo cardiovascular a través de la modulación de la expresión de genes23.
El papel de las variantes genéticas de este gen ha sido previamente evaluado, por ejemplo, en un trabajo11 con una dieta hipocalórica de 1.500 calorías y una distribución de macronutrientes de 52% de calorías en forma de carbohidratos, 25% en forma de lípidos (50% grasas monoinsaturadas) y 23% en forma de proteínas se demostró una respuesta metabólica diferenciada basada en la variante genética rs10401670 del gen RETN. Estos resultados fueron similares con una dieta que alcanzó la misma restricción calórica, alrededor de 1.500 calorías, pero con un mayor porcentaje de grasa de 41% con 60% de grasas monoinsaturadas24. La composición de esta última dieta es muy similar a la de nuestro actual estudio.
Un resultado relevante de nuestro trabajo es el aumento de los niveles de resistina en portadores del alelo A con peor estado metabólico (insulina y HOMA-IR). Se ha demostrado que la resistina induce la síntesis de citocinas inflamatorias en los macrófagos del tejido adiposo y que el estado inflamatorio induce la expresión del gen de la resistina25, produciendo un círculo vicioso. Es bien sabido que el ambiente inflamatorio está involucrado en la patogenia de la resistencia a la insulina, y la resistina circulante podría vincular la inflamación y la resistencia a la insulina. Por ejemplo, se ha demostrado que la resistina eleva los niveles de TNF-alfa26 y la resistina disminuye la secreción de adipoquinas antiinflamatorias como la adiponectina27. En nuestro presente trabajo de intervención, los sujetos con obesidad y portadores del alelo A no mejoraron los parámetros inflamatorios (PCR), la insulina y el HOMA-IR con la misma pérdida de peso que los no portadores del alelo de riesgo. La mejoría observada en los niveles de triglicéridos también puede estar relacionada con la mejora en el estado inflamatorio de los pacientes que se observa tras la pérdida de peso en los no portadores del alelo A. Este papel de la resistina como molécula inflamatoria se ha demostrado en otras patologías no relacionadas con la obesidad como la artritis reumatoide y el estado protrombótico28.
El aumento de los niveles de resistina encontrados en nuestro estudio en los portadores del alelo A puede explicarse mediante varias teorías. El primero, se puede asociar a la unión específica de los factores de transcripción Sp1 y Sp3 a un elemento promotor que conduce a un aumento de la actividad promotora como se ha demostrado con otros SNP29. En segundo lugar, esta variante genética puede estar en desequilibrio de ligamiento con otro SNP que modula la expresión de resistina. En tercer lugar, esta variante genética formaría parte de una secuencia de elementos reguladores que media en la unión de proteínas correguladoras implicadas en la regulación de la expresión del gen RETN. Finalmente, este SNP podría formar parte de una transcripción de micro-ARN, que regula la estabilidad de la transcripción de un gen involucrado en la fisiopatología del síndrome metabólico.
Por último, la relación de este SNP con la presencia de SM es interesante para detectar en nuestra práctica clínica a pacientes con obesidad y alto riesgo de desarrollar este síndrome. Esta relación se puede explicar a través de la elevación de los niveles de resistina de los pacientes portadores del alelo A, de este modo la resistina suprime la diferenciación de los adipocitos, lo que conduce a una sobrecarga de ácidos grasos y una alta lipotoxicidad al aumentar la producción de colesterol LDL y la degradación de los receptores de LDL en los músculos y el tejido hepático, lo que conlleva un aumento de la presencia de síndrome metabólico30. Y, en segundo lugar, la resistina circulante induce la resistencia a la insulina al disminuir la supresión de la gluconeogénesis en el hígado inducida por la insulina, así como los niveles altos de glucosa, al disminuir el transporte de glucosa en los músculos.
En nuestro trabajo podemos citar algunas limitaciones. En primer lugar, solo se ha evaluado una variante genética en el gen RETN. En segundo lugar, la falta de un grupo de control sin una intervención dietética para comparar el efecto de la pérdida de peso. En tercer lugar, son necesarios nuevos estudios para validar estos hallazgos en pacientes con sobrepeso, así como en pacientes diabéticos y otras poblaciones de alto riesgo. Finalmente, la corta duración de la intervención dietética no permite observar qué sucedería con los niveles de resistina y sus implicaciones durante un período más largo.
En resumen, existe una asociación del alelo A de la variante rs7139228 del gen de la resistina con una peor respuesta metabólica (insulina, HOMA-IR, triglicéridos y PCR) tras pérdida de peso con dieta hipocalórica de patrón mediterráneo. Además, la disminución de la prevalencia de síndrome metabólico e hiperglucemia en los portadores del alelo A fue no significativa, siendo pacientes con una mayor tasa de estas complicaciones. Son necesarios más estudios para evaluar la importancia de la presencia del alelo A en pacientes con obesidad, para detectar pacientes de alto riesgo metabólico y peor respuesta a la dieta hipocalórica y por tanto realizar una nutrición personalizada a nuestros pacientes.
Contribución de los autoresDaniel Antonio de Luis y Rocío Aller diseñaron el estudio y escribieron el artículo. Olatz Izaola y Rocío Aller realizaron evaluación nutricional. D. Primo y D. de Luis realizaron evaluación bioquímica
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.