Los errores innatos del metabolismo (EIM) intermediario son un conjunto de enfermedades hereditarias que incluye la fenilcetonuria (PKU), la tirosinemia II (TSII), las acidemias orgánicas y el déficit de ornitina transcarbamilasa (DOTC) entre otras. Son cada vez más frecuentes en adultos debido a las mejoras en su abordaje. Esto ha permitido que más mujeres afectas puedan plantearse deseos gestacionales con buenas perspectivas. Sin embargo, el embarazo puede empeorar el control metabólico y/o aumentar las complicaciones materno-fetales. El objetivo es analizar las características y resultados de los embarazos de nuestras pacientes con EIM.
MétodosEstudio descriptivo retrospectivo. Se incluyeron los embarazos de mujeres con EIM atendidas en la unidad de referencia de EIM de adultos del Hospital Universitario Virgen del Rocío. Las variables cualitativas se describieron como n (%); las cuantitativas como P50 (P25-P75).
ResultadosSe registraron 24 embarazos: 12 recién nacidos fueron sanos, uno heredó la enfermedad materna, dos presentaron el síndrome de fenilcetonuria materna, uno nació muerto (semana de gestación 31 + 5), cinco fueron abortos espontáneos y tres se interrumpieron voluntariamente. Se dividieron las gestaciones en metabólicamente controladas y no controladas.
ConclusionesEs fundamental la planificación del embarazo y su manejo multidisciplinar hasta el posparto para garantizar la salud materno-fetal. La base del tratamiento en la PKU y TSII es la dieta estricta limitada en proteínas. Deben evitarse eventos que aumenten el catabolismo proteico en las acidemias orgánicas y el DOTC. Se necesita una mayor investigación de los resultados de embarazos de mujeres con EIM.
Intermediate Inborn Errors of Metabolism (IEM) are a group of inherited diseases that include phenylketonuria (PKU), tyrosinemia II (TSII), organic acidaemias and ornithine transcarbamylase deficiency (OTCD), among others. They are increasingly more common in adults due to improved management. This has allowed more affected women to consider having children with good prospects. However, pregnancy may worsen metabolic control and/or increase maternal-foetal complications. The objective is to analyse the characteristics and outcomes of pregnancies of our patients with IEM.
MethodsRetrospective descriptive study. Pregnancies of women with IEM attended to at the adult IEM referral unit of the Hospital Universitario Virgen del Rocío were included. The qualitative variables were described as n(%) and the quantitative as P50(P25-P75).
Results24 pregnancies were recorded: 12 newborns were healthy, 1 inherited their mother's disease, 2 had maternal phenylketonuria syndrome, 1 was stillborn (gestational week 31 + 5), 5 were spontaneous abortions and 3 were voluntarily terminated. The gestations were divided into metabolically controlled and uncontrolled.
ConclusionsPregnancy planning and multidisciplinary management through to postpartum is essential to ensure maternal and foetal health. The basis of treatment in PKU and TSII is a strict protein-limited diet. Events that increase protein catabolism in organic acidaemias and DOTC should be avoided. Further investigation of pregnancy outcomes in women with IEM is needed.
Las metabolopatías o errores congénitos del metabolismo (EIM) son enfermedades genéticas caracterizadas por la alteración de una proteína (enzima, transportador o cofactor), en las que se produce el bloqueo de la vía/ruta metabólica generando distintas consecuencias: acumulación del sustrato, déficit del producto o activación de rutas alternativas1. Actualmente suman más de 1.050 trastornos, con una prevalencia global estimada de 50,9/100.000 nacimientos2,3. El desarrollo de los programas de cribado neonatal (en España desde 1968 para fenilcetonuria [PKU] y desde el año 2000 para el resto) y la posterior aplicación de la espectrometría de masas en tándem con la que se pueden realizar hasta siete estudios de distintos EIM, han supuesto enormes avances en su detección temprana4 y una significativa mejora en el pronóstico y calidad de vida de estos pacientes, permitiendo su transición a la adultez en buenas condiciones5.
Esto ha facilitado que cada vez más mujeres con estas enfermedades puedan plantearse la gestación. Sin embargo, esta puede asociar un empeoramiento del control metabólico y un aumento de las complicaciones y el riesgo materno6. Además, pueden existir dificultades para la concepción debidas al efecto de la enfermedad sobre las gónadas y algunos trastornos están asociados con discapacidad neurológica o física significativa, limitando la capacidad de estas pacientes para socializar6. También pueden existir complicaciones fetales debidas a malnutrición o al paso transplacentario de sustancias tóxicas teratogénicas5 como la fenilalanina, que puede provocar el síndrome de fenilcetonuria materna (SPKUM)7, caracterizado por retraso mental, microcefalia, cardiopatía congénita y crecimiento uterino retardado (CIR), entre otras complicaciones; o la tirosina que puede tener efectos adversos sobre el desarrollo neurológico fetal. Asimismo, tampoco se conoce la seguridad de los tratamientos de los EIM en el embarazo6. En general, dada la baja frecuencia de estos trastornos, existe escasa evidencia y experiencia sobre el manejo y el seguimiento del embarazo de estas pacientes.
Actualmente, el soporte nutricional es la herramienta de mayor utilidad en el manejo de estas enfermedades. En ello radica la importancia de los servicios de las unidades de errores innatos del metabolismo de adultos, en cooperación con endocrinólogos, nutricionistas, genetistas, ginecólogos, obstetras y pediatras1,8. Este enfoque multidisciplinar es clave para optimizar el manejo de estas mujeres en la planificación y la propia gestación. Sin embargo, a día de hoy existen en España muy pocos centros especializados en EIM. En el año 2012 se creó la, referencia para todos los EIM de Andalucía occidental y acreditada como CSUR.
Los objetivos de este estudio fueron: analizar las complicaciones materno-fetales y las secuelas neonatales en relación con el tratamiento y el grado de control de las EIM; sacar conclusiones acerca de la vigilancia y el control metabólico durante el embarazo, el posparto y la lactancia, y si es posible, antes de la concepción; recoger información que facilite el asesoramiento de futuras gestantes con EIM.
MétodosSe realizó un estudio observacional retrospectivo en el que se incluyeron las mujeres con EIM gestantes que realizan seguimiento en la consulta de enfermedades metabólicas congénitas del adulto de la Unidad de Endocrinología y Nutrición del Hospital Universitario Virgen del Rocío. Todas las pacientes incluidas han sido informadas sobre las características y finalidad del estudio y han otorgado el consentimiento informado. El estudio fue aprobado por el Comité de Ética del centro.
Los criterios de inclusión fueron: 1) mujeres mayores de 18 años capaces de otorgar el consentimiento informado; 2) diagnosticadas de una EIM; 3) que hayan desarrollado una gestación, aunque no haya llegado a término. Los criterios de exclusión fueron el rechazo del consentimiento informado y cualquier condición que a criterio del investigador pueda suponer un riesgo inasumible para su participación en el estudio.
Las variables analizadas fueron aquellas relativas a la gestante (EIM que presenta; edad al diagnóstico –cribado neonatal, infancia o vida adulta–; año de nacimiento; variables antropométricas –peso, talla e índice de masa corporal [IMC]–; factores de riesgo cardiovascular y enfermedades concomitantes; número de gestaciones; edad de la mujer en la concepción; existencia o no de interrupción voluntaria del embarazo (IVE); existencia o no de aborto; semana de gestación al parto; modo de parto –cesárea, vaginal espontáneo (PVE) o vaginal inducido (PVI)–; enfermedades durante el embarazo y complicaciones obstétricas; ingresos por descompensación metabólica; cumplimiento del tratamiento; control de las cifras de Phe en PKU; cifras en los análisis rutinarios en otros EIM; lactancia materna; y aquellas relativas al recién nacido (peso al nacer; resultado de la enfermedad –sano o enfermo–; existencia y tipo de anomalía al nacer; complicaciones fetales durante la gestación). Para valorar el grado de cumplimiento de la dieta se realizaba en cada consulta un registro dietético de 24 h. Además, en el caso de PKU se realizaba un control semanal de fenilalanina en sangre seca. En cuanto al resto de tratamientos en cada consulta se comprobaba la adherencia al mismo en la entrevista clínica. Se consideró como buen cumplimiento terapéutico el mantenimiento de niveles de Phe < 6 mg/dL de media.
El análisis estadístico se realizó con el software SPSS® versión 26.0 para Windows (IBM Corp., Armonk, NY, EE. UU.). El análisis descriptivo se realizó obteniendo la mediana y los cuartiles de las variables cuantitativas (expresado como P50 [P25-P75]) y la frecuencia para las variables cualitativas (expresado como n [%]).
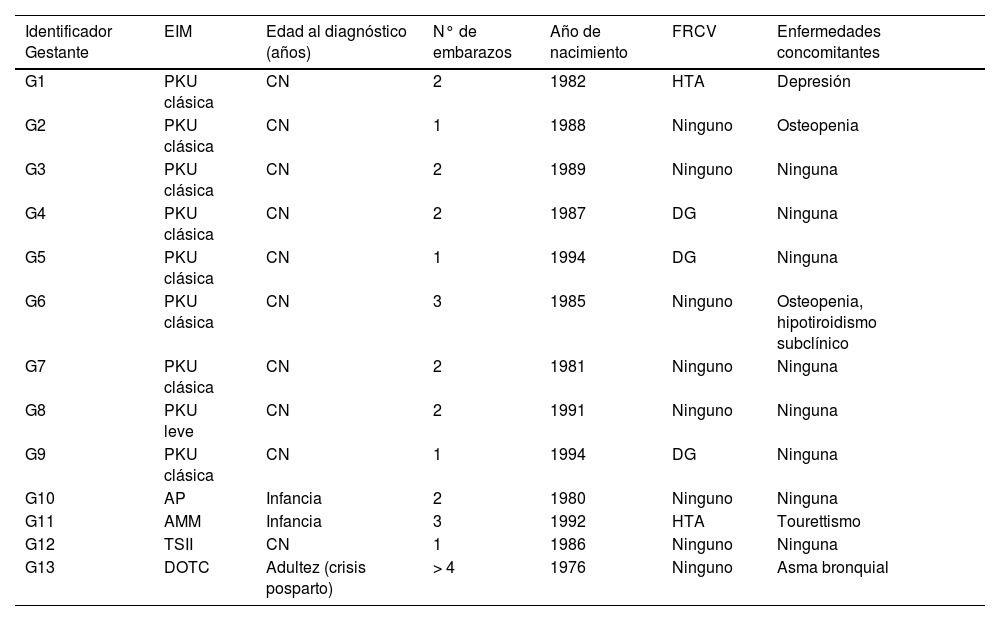
ResultadosSe incluyeron un total de 24 gestaciones de 13 pacientes (tabla 1): 16 (66,6%) de madres con PKU, dos (8,3%) de madres con déficit de ornitina transcarbamilasa (DOTC), tres (12,5%) de madres con acidemia metilmalónica (AMM), dos (8,3%) de madres con acidemia propiónica (AP) y una (4,1%) cuya madre presentaba tirosinemia tipo II (TSII). La edad en la gestación fue de 26,5 (24,7-33) años; 12 (92,3%) pacientes tenían un coeficiente intelectual dentro del promedio normal y uno (PKU, G4, E6 y E7) presentaba un coeficiente de 80. Solo una (7,6%) (DOTC, G13, E23 y E24) fue diagnosticada en la edad adulta tras tener un hijo afecto, puesto que esta enfermedad no queda incluida dentro del cribado neonatal.
Principales características de las pacientes incluidas en el estudio
| Identificador Gestante | EIM | Edad al diagnóstico (años) | N° de embarazos | Año de nacimiento | FRCV | Enfermedades concomitantes |
|---|---|---|---|---|---|---|
| G1 | PKU clásica | CN | 2 | 1982 | HTA | Depresión |
| G2 | PKU clásica | CN | 1 | 1988 | Ninguno | Osteopenia |
| G3 | PKU clásica | CN | 2 | 1989 | Ninguno | Ninguna |
| G4 | PKU clásica | CN | 2 | 1987 | DG | Ninguna |
| G5 | PKU clásica | CN | 1 | 1994 | DG | Ninguna |
| G6 | PKU clásica | CN | 3 | 1985 | Ninguno | Osteopenia, hipotiroidismo subclínico |
| G7 | PKU clásica | CN | 2 | 1981 | Ninguno | Ninguna |
| G8 | PKU leve | CN | 2 | 1991 | Ninguno | Ninguna |
| G9 | PKU clásica | CN | 1 | 1994 | DG | Ninguna |
| G10 | AP | Infancia | 2 | 1980 | Ninguno | Ninguna |
| G11 | AMM | Infancia | 3 | 1992 | HTA | Tourettismo |
| G12 | TSII | CN | 1 | 1986 | Ninguno | Ninguna |
| G13 | DOTC | Adultez (crisis posparto) | > 4 | 1976 | Ninguno | Asma bronquial |
FRCV: factores de riesgo cardiovascular; CN: cribado neonatal; HTA: hipertensión arterial; DG: diabetes gestacional.
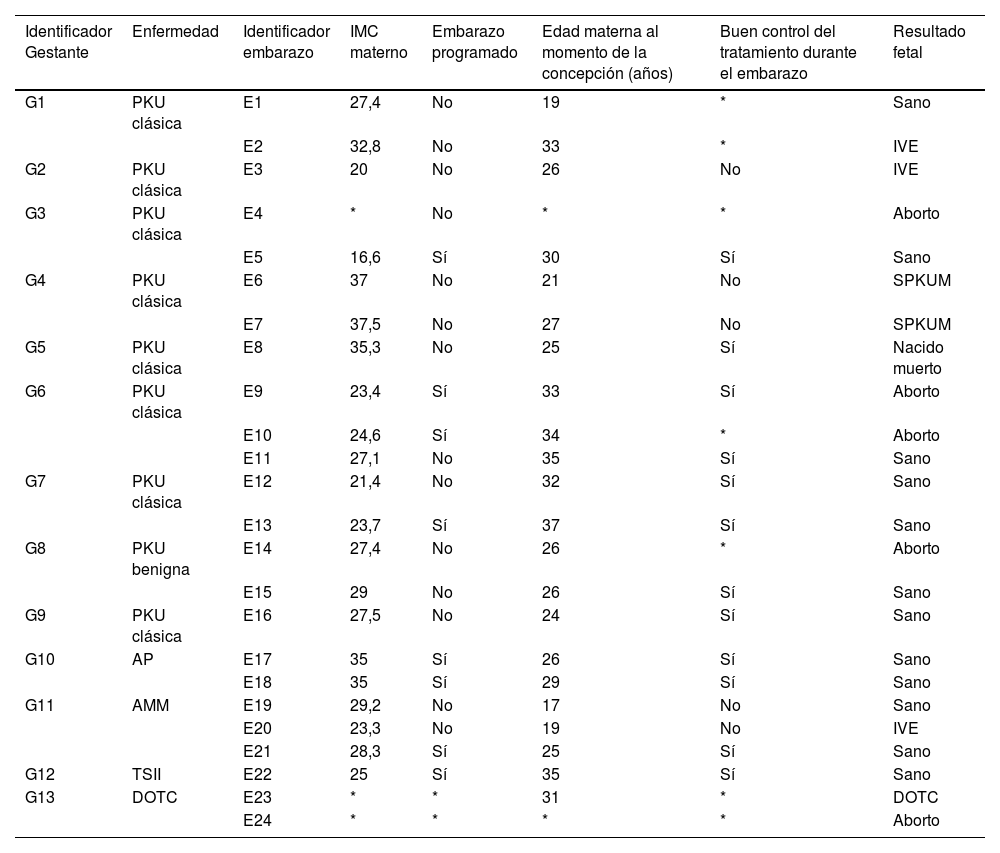
De las 24 gestaciones (tabla 2), 12 (50%) resultaron en recién nacidos sanos, uno (4%) nació con la enfermedad materna (DOTC, G13, E23), dos (8%) nacieron con SPKUM (PKU, G4, E6 y E7), cinco (20%) resultaron en abortos espontáneos y en tres (12%) se realizó una IVE.
Características generales de las pacientes y sus embarazos
| Identificador Gestante | Enfermedad | Identificador embarazo | IMC materno | Embarazo programado | Edad materna al momento de la concepción (años) | Buen control del tratamiento durante el embarazo | Resultado fetal |
|---|---|---|---|---|---|---|---|
| G1 | PKU clásica | E1 | 27,4 | No | 19 | * | Sano |
| E2 | 32,8 | No | 33 | * | IVE | ||
| G2 | PKU clásica | E3 | 20 | No | 26 | No | IVE |
| G3 | PKU clásica | E4 | * | No | * | * | Aborto |
| E5 | 16,6 | Sí | 30 | Sí | Sano | ||
| G4 | PKU clásica | E6 | 37 | No | 21 | No | SPKUM |
| E7 | 37,5 | No | 27 | No | SPKUM | ||
| G5 | PKU clásica | E8 | 35,3 | No | 25 | Sí | Nacido muerto |
| G6 | PKU clásica | E9 | 23,4 | Sí | 33 | Sí | Aborto |
| E10 | 24,6 | Sí | 34 | * | Aborto | ||
| E11 | 27,1 | No | 35 | Sí | Sano | ||
| G7 | PKU clásica | E12 | 21,4 | No | 32 | Sí | Sano |
| E13 | 23,7 | Sí | 37 | Sí | Sano | ||
| G8 | PKU benigna | E14 | 27,4 | No | 26 | * | Aborto |
| E15 | 29 | No | 26 | Sí | Sano | ||
| G9 | PKU clásica | E16 | 27,5 | No | 24 | Sí | Sano |
| G10 | AP | E17 | 35 | Sí | 26 | Sí | Sano |
| E18 | 35 | Sí | 29 | Sí | Sano | ||
| G11 | AMM | E19 | 29,2 | No | 17 | No | Sano |
| E20 | 23,3 | No | 19 | No | IVE | ||
| E21 | 28,3 | Sí | 25 | Sí | Sano | ||
| G12 | TSII | E22 | 25 | Sí | 35 | Sí | Sano |
| G13 | DOTC | E23 | * | * | 31 | * | DOTC |
| E24 | * | * | * | * | Aborto |
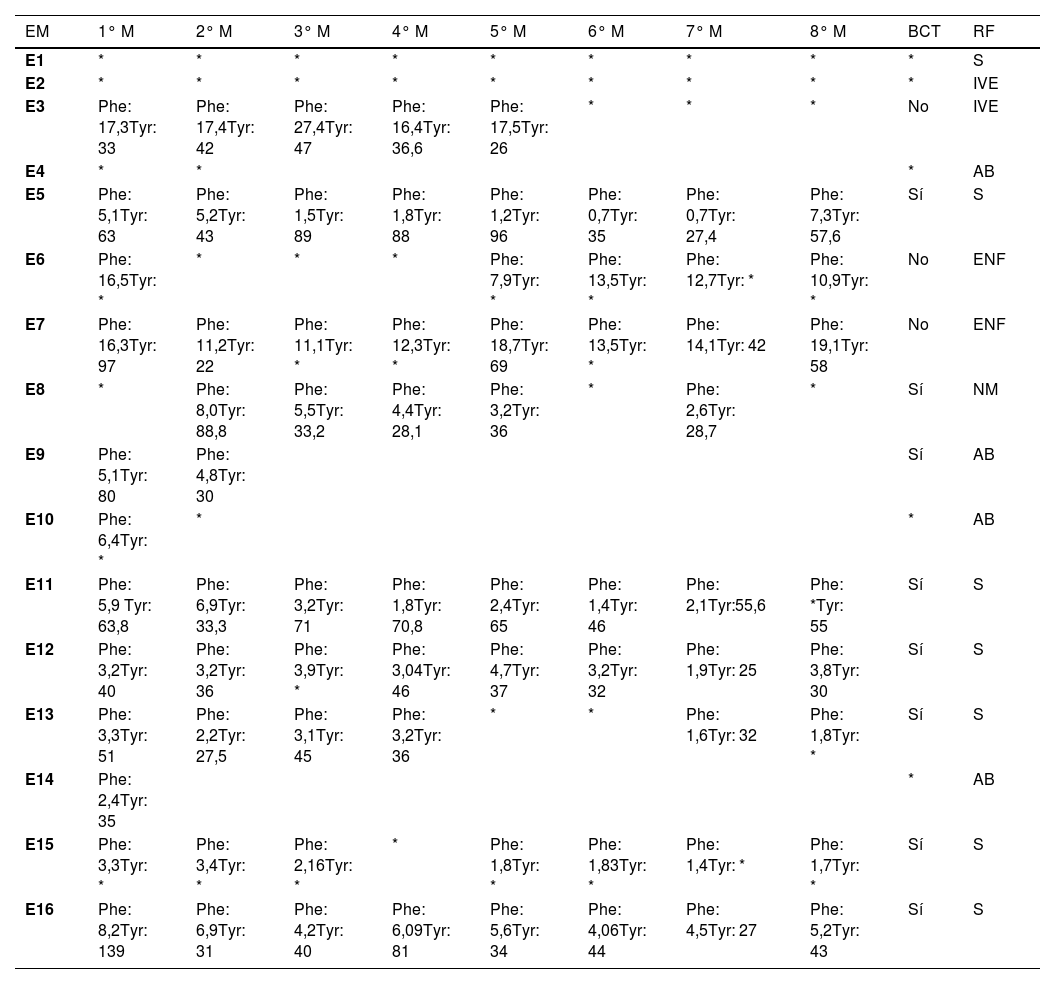
Este grupo sumó un total de 16 gestaciones de nueve mujeres. La mediana de edad fue de 27 (25-33) años. Solo cuatro (25%) fueron programadas y de ellas dos resultaron en aborto espontáneo (PKU, G6, E9 y E10). La mediana de IMC fue de 27,4 (23,4-32,8) kg/m2. Las mediciones de Phe y Tyr durante la gestación fueron recogidas en sangre papel (tabla 3); ocho (50%) lograron mantener las cifras de Phe dentro del rango objetivo establecido (< 6 mg/dL de media). Los datos de estas cifras no se encontraron en las historias clínicas de dos (12,5%) gestaciones (PKU, G1, E1 y E2).
Cifras de fenilalanina(mg/dL) (Phe) y tirosina(μmol/L) (Tyr) recogidas mensualmente durante la gestación de las pacientes con PKU
| EM | 1° M | 2° M | 3° M | 4° M | 5° M | 6° M | 7° M | 8° M | BCT | RF |
|---|---|---|---|---|---|---|---|---|---|---|
| E1 | * | * | * | * | * | * | * | * | * | S |
| E2 | * | * | * | * | * | * | * | * | * | IVE |
| E3 | Phe: 17,3Tyr: 33 | Phe: 17,4Tyr: 42 | Phe: 27,4Tyr: 47 | Phe: 16,4Tyr: 36,6 | Phe: 17,5Tyr: 26 | * | * | * | No | IVE |
| E4 | * | * | * | AB | ||||||
| E5 | Phe: 5,1Tyr: 63 | Phe: 5,2Tyr: 43 | Phe: 1,5Tyr: 89 | Phe: 1,8Tyr: 88 | Phe: 1,2Tyr: 96 | Phe: 0,7Tyr: 35 | Phe: 0,7Tyr: 27,4 | Phe: 7,3Tyr: 57,6 | Sí | S |
| E6 | Phe: 16,5Tyr: * | * | * | * | Phe: 7,9Tyr: * | Phe: 13,5Tyr: * | Phe: 12,7Tyr: * | Phe: 10,9Tyr: * | No | ENF |
| E7 | Phe: 16,3Tyr: 97 | Phe: 11,2Tyr: 22 | Phe: 11,1Tyr: * | Phe: 12,3Tyr: * | Phe: 18,7Tyr: 69 | Phe: 13,5Tyr: * | Phe: 14,1Tyr: 42 | Phe: 19,1Tyr: 58 | No | ENF |
| E8 | * | Phe: 8,0Tyr: 88,8 | Phe: 5,5Tyr: 33,2 | Phe: 4,4Tyr: 28,1 | Phe: 3,2Tyr: 36 | * | Phe: 2,6Tyr: 28,7 | * | Sí | NM |
| E9 | Phe: 5,1Tyr: 80 | Phe: 4,8Tyr: 30 | Sí | AB | ||||||
| E10 | Phe: 6,4Tyr: * | * | * | AB | ||||||
| E11 | Phe: 5,9 Tyr: 63,8 | Phe: 6,9Tyr: 33,3 | Phe: 3,2Tyr: 71 | Phe: 1,8Tyr: 70,8 | Phe: 2,4Tyr: 65 | Phe: 1,4Tyr: 46 | Phe: 2,1Tyr:55,6 | Phe: *Tyr: 55 | Sí | S |
| E12 | Phe: 3,2Tyr: 40 | Phe: 3,2Tyr: 36 | Phe: 3,9Tyr: * | Phe: 3,04Tyr: 46 | Phe: 4,7Tyr: 37 | Phe: 3,2Tyr: 32 | Phe: 1,9Tyr: 25 | Phe: 3,8Tyr: 30 | Sí | S |
| E13 | Phe: 3,3Tyr: 51 | Phe: 2,2Tyr: 27,5 | Phe: 3,1Tyr: 45 | Phe: 3,2Tyr: 36 | * | * | Phe: 1,6Tyr: 32 | Phe: 1,8Tyr: * | Sí | S |
| E14 | Phe: 2,4Tyr: 35 | * | AB | |||||||
| E15 | Phe: 3,3Tyr: * | Phe: 3,4Tyr: * | Phe: 2,16Tyr: * | * | Phe: 1,8Tyr: * | Phe: 1,83Tyr: * | Phe: 1,4Tyr: * | Phe: 1,7Tyr: * | Sí | S |
| E16 | Phe: 8,2Tyr: 139 | Phe: 6,9Tyr: 31 | Phe: 4,2Tyr: 40 | Phe: 6,09Tyr: 81 | Phe: 5,6Tyr: 34 | Phe: 4,06Tyr: 44 | Phe: 4,5Tyr: 27 | Phe: 5,2Tyr: 43 | Sí | S |
EM: identificador embarazo; M: mes; BCT: buen control del tratamiento durante la gestación; RF: resultado fetal; S: sano; NM: nacido muerto; ENF: enfermo; AB: aborto; P: fenilalanina (Phe); T: tirosina (Tyr).
En cuanto al tratamiento durante la gestación, se prescribieron dietas y suplementos nutricionales orales sin fenilalanina en todos los embarazos. En tres (23,1%) gestaciones se pautó sapropterina. Otros tratamientos pautados fueron hierro en tres (18,8%) gestaciones, suplementos de ácido fólico en 11 (68,7%), vitamina D y vitamina B12 en nueve (56,2%), insulina en cuatro (25%), levotiroxina en tres (18,8%) y antieméticos en una (6,2%) gestación.
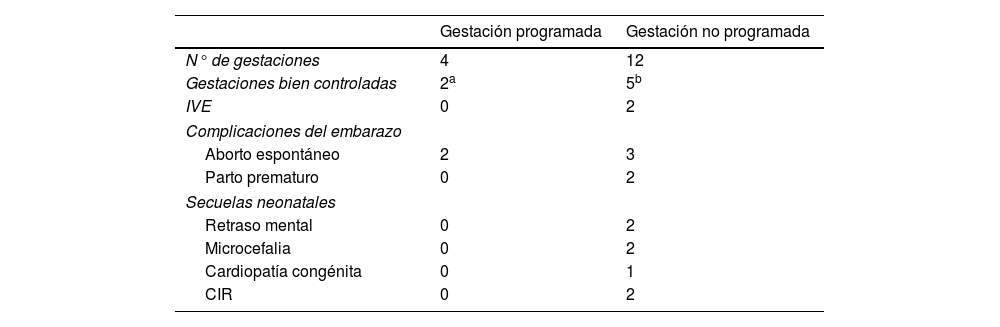
En cuanto a la planificación del embarazo, las diferencias entre gestaciones planificadas y no planificadas quedan reflejadas en la tabla 4.
Comparación de las complicaciones y secuelas neonatales entre las gestaciones programadas y no programadas
De las 16 gestaciones, nueve (56,3%) resultaron en nacidos vivos; un (6,3%) feto nació muerto por cesárea inminente debida a una rotura de aneurisma de la arteria esplénica de la madre que le provocó una hemorragia interna en la semana 31 + 5 de gestación (PKU, G5, E8). De las seis gestaciones restantes, cuatro (25%) resultaron en abortos en el primer trimestre y dos (12,5%) gestaciones se interrumpieron voluntariamente por la alta probabilidad de SPKUM (PKU, G1, E3; y PKU, G2, E3). La mediana de las semanas de gestación al momento del parto fue de 38 (37,5-39) (tabla 5).
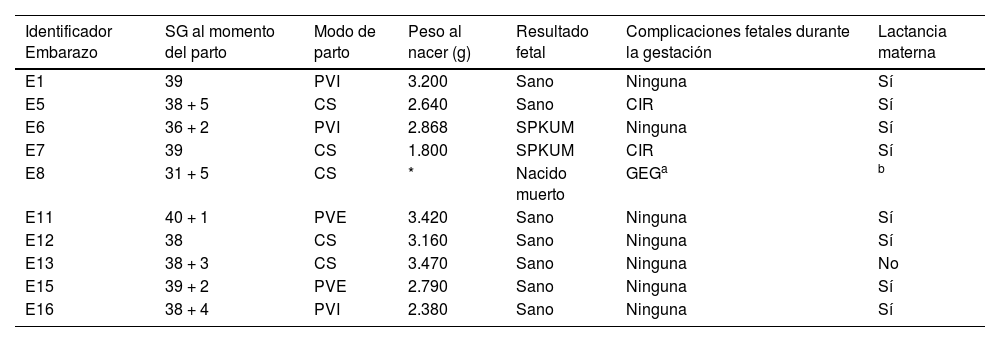
Características de los nacidos de madres con PKU
| Identificador Embarazo | SG al momento del parto | Modo de parto | Peso al nacer (g) | Resultado fetal | Complicaciones fetales durante la gestación | Lactancia materna |
|---|---|---|---|---|---|---|
| E1 | 39 | PVI | 3.200 | Sano | Ninguna | Sí |
| E5 | 38 + 5 | CS | 2.640 | Sano | CIR | Sí |
| E6 | 36 + 2 | PVI | 2.868 | SPKUM | Ninguna | Sí |
| E7 | 39 | CS | 1.800 | SPKUM | CIR | Sí |
| E8 | 31 + 5 | CS | * | Nacido muerto | GEGa | b |
| E11 | 40 + 1 | PVE | 3.420 | Sano | Ninguna | Sí |
| E12 | 38 | CS | 3.160 | Sano | Ninguna | Sí |
| E13 | 38 + 3 | CS | 3.470 | Sano | Ninguna | No |
| E15 | 39 + 2 | PVE | 2.790 | Sano | Ninguna | Sí |
| E16 | 38 + 4 | PVI | 2.380 | Sano | Ninguna | Sí |
GEG: feto grande para la edad gestacional.
Dos (22,2%) nacidos vivos (PKU, G4 E6 y E7), ambos procedentes de la misma gestante, con mal control durante ambas gestaciones, manifestaron SPKUM y uno de ellos fue diagnosticado de PKU mediante el screening neonatal. El recién nacido resultante del embarazo E6 requirió ingreso por presentar al nacimiento parálisis braquial obstétrica, anomalías en cabeza (microcefalia y cefalohematoma), nariz (raíz nasal amplia), sistema nervioso central (reflejos hiperexcitados y clonus tras mínima estimulación y moro asimétrico), extremidades (escasos movimientos espontáneos del miembro superior izquierdo e hipertonía de miembros inferiores), ojos (epicantus) y corazón (comunicación interauricular tipo foramen oval permeable); y retraso psicomotor con discapacidad intelectual. El recién nacido del embarazo E7 presentó al nacer una Apgar 5/8. Asimismo, presentó fallo de medro, anomalías en cabeza (microcefalia y cefalohematoma), facies (puente nasal ancho, implantación baja de orejas y labio superior fino), sistema nervioso central (moro asimétrico, crisis focal, discapacidad intelectual) y ocular (hipermetropía y miopía).
Complicaciones maternas durante el embarazo surgieron en ocho (50%) mujeres (un caso de prurito gestacional, tres casos de síndrome emético, una erupción polimorfa del embarazo, un caso de anemia normocítica normocrómica, un caso de amenaza de parto pretérmino y un caso de polihidramnios leve y rotura de la arteria esplénica). Tres (18,8%) manifestaron complicaciones obstétricas (todas ellas desgarro perineal). En uno de los embarazos (PKU, G4, E7), la gestante (que presentaba un mal control durante la gestación) precisó de ingreso hospitalario por niveles elevados de fenilalanina y bajos de tirosina, requiriendo administración de la dieta mediante sonda nasogástrica.
La lactancia materna fue proporcionada a ocho (88,9%) recién nacidos vivos. En uno de ellos (PKU, G7, E13) la madre no dio lactancia, ya que recibía tratamiento con sapropterina y prefirió no hacerlo tras informarle de que no está clara su seguridad durante la misma. Esta gestante sí proporcionó lactancia materna a su primer recién nacido (PKU, G7, E12), decidiendo tras el parto suspender este tratamiento para ello.
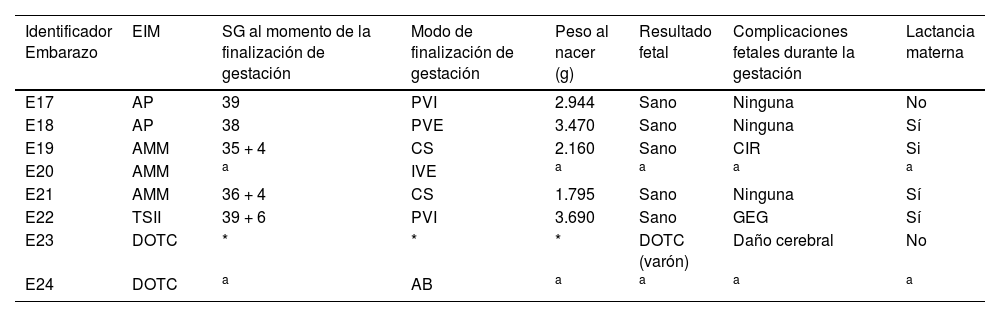
Embarazos con otros EIMEste grupo incluyó ocho gestaciones de cuatro mujeres (tabla 6). Solo se pudo obtener la información de seis gestaciones, puesto que los de la G13 (E23 y E24) con DOTC fueron seguidos en otro centro. El único dato obtenido fue que la gestante nunca había tenido una descompensación metabólica hasta el parto de su primer hijo, en el cual sufrió un coma hiperamonémico, diagnosticándose DOTC en madre e hijo.
Características de los resultados de las gestaciones de madres con EIM distintos de PKU
| Identificador Embarazo | EIM | SG al momento de la finalización de gestación | Modo de finalización de gestación | Peso al nacer (g) | Resultado fetal | Complicaciones fetales durante la gestación | Lactancia materna |
|---|---|---|---|---|---|---|---|
| E17 | AP | 39 | PVI | 2.944 | Sano | Ninguna | No |
| E18 | AP | 38 | PVE | 3.470 | Sano | Ninguna | Sí |
| E19 | AMM | 35 + 4 | CS | 2.160 | Sano | CIR | Si |
| E20 | AMM | a | IVE | a | a | a | a |
| E21 | AMM | 36 + 4 | CS | 1.795 | Sano | Ninguna | Sí |
| E22 | TSII | 39 + 6 | PVI | 3.690 | Sano | GEG | Sí |
| E23 | DOTC | * | * | * | DOTC (varón) | Daño cerebral | No |
| E24 | DOTC | a | AB | a | a | a | a |
SG: semanas de gestación; PVI: parto vaginal inducido; PVE: parto vaginal espontáneo; CS: cesárea; IVE: interrupción voluntaria del embarazo; AB: aborto espontáneo; GEG: feto grande para la edad gestacional.
Cuatro (66,6%) gestaciones fueron programadas, del total de las ocho gestaciones, seis (75%) dieron como resultados recién nacidos vivos. Fue interrumpida voluntariamente una (12,5%) gestación (AMM, G11, E20) de manera voluntaria y la gestación restante (DOTC, G13, E24) resultó en aborto espontáneo. Solo un recién nacido (DOTC, G13, E23) manifestó una EIM al momento de nacer (DOTC). Se propuso trasplante hepático, pero se le denegó debido al desarrollo de daño cerebral irreversible, falleciendo finalmente a los ocho meses de vida.
En cuanto a las complicaciones maternas, en el E23 (DOTC, G13) la gestante sufrió una descompensación hiperamoniémica desencadenada por el parto que requirió ingreso hospitalario, no disponiendo de más información al respecto. Esta gestante también presentó un síndrome emético. Por otro lado, la gestante con AMM (G11) durante su segundo embarazo (E20) se realizó una IVE al presentar un mal control metabólico secundario a hiperémesis junto con la aparición de una coreoatetosis secundaria a lesiones a nivel de los ganglios basales (sospecha de ictus metabólico), que actualmente ha evolucionado a un síndrome de Tourette. En el primer y tercer embarazo (G11, E19 y E21), esta paciente mantuvo una función renal adecuada y valores normales de amonio durante la gestación y posparto.
El embarazo de la paciente con TSII (G12, E22) fue programado y presentó cifras de tirosina y fenilalanina dentro del rango de normalidad (40-72 μmol/L y 40-64 μ mol/L respectivamente) durante casi toda la gestación.
La paciente con AP (G10) tuvo dos gestaciones (E17 y E18), en las cuales se detectaron niveles muy elevados de propionilcarnitina (C3) y glicina, con valores de carnitina libre (C0) normales o en límites inferiores de la normalidad, por lo que requirió altas dosis de carnitina. El resto de aminoácidos en sangre se mantuvieron en rangos normales. En la primera gestación, se recogieron las cifras de amonio en el momento preparto, en el posparto inmediato y en días posteriores, siendo estas de 36,9 μm/L, 101,6 μm/L y 38,6 μm/L, respectivamente (V.N. = 11-51). En la segunda gestación, el nivel de amonio en el posparto inmediato fue de 28,4 μ M/L y durante el mismo presentó niveles elevados de glicina, alanina, glutamina, arginina y lisina, y niveles indetectables de isoleucina y metionina. Durante la segunda gestación presentó disminuciones de metionina, tirosina, leucina, isoleucina y valina.
DiscusiónAunque la gestación puede empeorar la salud de una mujer con EIM, muchas de ellas son capaces de desarrollar embarazos con excelente resultado si se realiza una buena planificación y un buen control de la enfermedad durante el mismo. Nuestro estudio es un buen ejemplo de ello.
Embarazo y PKUEl elevado número de gestaciones en mujer con PKU respecto a otros EIM se debe a que es la alteración de mayor prevalencia en el grupo de enfermedades relacionadas con la degradación de los aminoácidos9.
En estas mujeres, además del asesoramiento genético se hace fundamental la educación temprana sobre programación del embarazo en todos los casos, y cuando se producen deben considerarse embarazos de riesgo. En nuestro estudio, la planificación del embarazo se logró en 25% de los casos (cuatro casos), con dos abortos espontáneos y dos embarazos con resultados materno-fetales excelentes. Siguiendo la evidencia científica actual, recomendamos a nuestras pacientes mantener desde la programación del embarazo cifras de Phe < 4 mg/dL, ya que un buen control antes y durante la gestación es un factor esencial para evitar el SPKUM7,10. Aunque el riesgo de padecer una fetopatía se reduce considerablemente cuando la madre mantiene durante todo el embarazo niveles de fenilalanina en sangre por debajo de 360 mmol/L (6 mg/dL)10, la recomendación de mantener niveles por debajo de 4 mg/dL se realiza para evitar picos de Phe9. De acuerdo con las recomendaciones de las guías europeas de manejo de fenilcetonuria11, recomendamos que las estrategias anticonceptivas solo deben interrumpirse después de que los niveles estables de Phe dentro del rango objetivo hayan sido alcanzado por un mínimo de dos semanas. Esto puede llegar a ser complicado, ya que la adherencia al tratamiento y seguimiento en PKU tiende a disminuir a partir de los diez años12. Nuestras pacientes eran adultas con una mediana de edad al momento de la concepción de 27 años y solo 50% mantuvo niveles de Phe en rango objetivo. Otro factor pregestacional asociado a menor riesgo de SPKUM es la inteligencia materna normal12. Todas las pacientes incluidas en este estudio se diagnosticaron a través del cribado neonatal, lo que les permitió un adecuado tratamiento precoz y por tanto un coeficiente intelectual normal excepto en un caso (PKU, G4, E6 y E7), cuyo coeficiente intelectual era de 80 y obtuvo un mal control de fenilalanina durante la gestación.
Durante el periodo gestacional, el pilar del tratamiento es la dieta baja en fenilalanina. Debe garantizarse un aporte diario > 70 g de equivalentes proteicos12 mediante la suplementación con fórmulas sin fenilalanina enriquecidas en tirosina y otras vitaminas y minerales. Recomendamos a nuestras gestantes un consumo de > 2.000 kcal/día, con ganancia de 11-16 kg, aunque estos aspectos deben individualizarse. Es cada vez más frecuente el exceso de peso en pacientes con PKU, causado principalmente por sedentarismo y un consumo inadecuado de alimentos, con una dieta rica en hidratos de carbono y pobre en frutas y verduras13,14. Esto puede provocar diabetes gestacional, dificultando aún más el tratamiento dietético. Por ello, debe enfatizarse la importancia de la identificación temprana de alteraciones nutricionales en estas pacientes.
Dependiendo de los niveles de Phe maternos, la restricción proteica debe ser estricta al inicio, permitiendo posteriormente aumentar su ingesta durante el segundo y tercer trimestre, ya que a partir de la semana 26 si el feto no padece PKU es capaz de metabolizar la fenilalanina materna15,16. Las guías recomiendan la monitorización de la Phe una o dos veces por semana10. Nosotros realizamos controles de Phe y Tyr en sangre papel semanal y visitas al menos mensuales, con mayor frecuencia si fuese necesario y combinándolas con consultas telemáticas para facilitar el seguimiento y manejo nutricional. Aun así, la frecuencia fue menor en nuestro estudio. Además de la medición semana de fenilalanina, realizamos un registro dietético de 24 h en cada consulta. Respecto a la adherencia al resto de tratamiento, la comprobamos en cada consulta en la entrevista clínica con el paciente, aunque podrían utilizarse otros métodos indirectos como el uso de cuestionarios. Se debe también considerar el ingreso hospitalario cuando sea necesario, como nuestra G4 (PKU, E6 y E7), que requirió ingreso por mal control metabólico en la semana 10 + 4 de gestación, desarrollando su recién nacido SPKUM. En el periodo posparto debe vigilarse estrechamente al menos cuatro semanas y posteriormente cada seis a 12 meses, con dieta baja en proteínas por sus múltiples beneficios en el ánimo y las capacidades cognitivas12, mejorando la capacidad de crianza. La lactancia materna es segura8, ya que el hijo sano puede metabolizar la fenilalanina de la leche materna.
En cuanto a las secuelas neonatales, siguiendo el patrón reportado, la aparición de SPKUM se produjo en embarazos no programados ni controlados (PKU, G4, E6 y E7). Como rasgos distintivos de otras investigaciones describimos alteraciones oculares en E7. En E6 se diagnosticó una cardiopatía congénita, lo que podría sustentarse en el pésimo control metabólico de la gestante especialmente durante las semanas 8-10, periodo de desarrollo del corazón fetal. Esta gestante tampoco tomó vitamina B12, cuyo déficit está asociado a un mayor riesgo de cardiopatía congénita17.
Por otro lado, es probable que la restricción proteica influya en los patrones de crecimiento de la descendencia. Una ingesta baja en proteínas y/o con niveles de fenilalanina < 120 μmol/L (1,98 mg/dL) se ha asociado con CIR18. Solo dos recién nacidos sufrieron CIR: uno en contexto de SPKUM y el otro (PKU, G3, E5) pesó 2.640 g al nacer y su madre presentaba infrapeso y presentó cifras de Phe < 1,98 mg/dL entre las semanas 10-32.
La sapropterina (categoría C en el embarazo) se utilizó en tres gestaciones. Dos obtuvieron un resultado fetal normal y en la otra gestación (PKU, G5, E8), el feto nació muerto por una complicación materna al final de la gestación (rotura aneurismática de la arteria esplénica).
Embarazo y otras EIMActualmente existen pocos casos publicados de gestaciones en los demás EIM, debido a su menor frecuencia. Al igual que en PKU, es importante la planificación del embarazo. Además de la mujer que fue diagnosticada de su EIM tras el parto (DOTC, G13, E23 y E24), y por ello, no pudo planificar su gestación, solo dos gestaciones no fueron planificadas, ambas de la misma mujer. En la primera, el feto (E23) desarrolló CIR y en la segunda (E24) fue interrumpida de manera voluntaria. Nuestras recomendaciones en la planificación han sido optimizar la condición materna previa, así como seguir un control dietético que garantice una adecuada nutrición. Además, se recomendó determinar mensualmente el pH, la vitamina B12 y el amonio en sangre8.
En estas enfermedades también es fundamental el asesoramiento genético y las pruebas genéticas prenatales para facilitar el control de posibles hiperamoniemias y sus complicaciones posparto o para permitir la IVE en casos de alto riesgo, como ocurrió en la gestación E20 (AMM, G11, E20).
En cuanto a las acidemias orgánicas y el DOTC, existen tres situaciones en las que existe un alto riesgo de descompensación metabólica: cuando la gestante no está diagnosticada de la enfermedad, cuando existe hiperémesis gravídica y en el posparto9,16.
Respecto a las situaciones en las que la gestante no se encuentra diagnosticada, el ejemplo en nuestra serie es la madre del recién nacido con DOTC (G13, E23), que sufrió un coma hiperamonémico en el posparto inmediato, lo cual le llevó al diagnóstico de su enfermedad. El diagnóstico de las formas tardías podría ser facilitado mediante una mayor conciencia de los síntomas inespecíficos de esta enfermedad. Durante el periodo gestacional pueden enmascararse las complicaciones de la hiperamonemia con problemas más comunes como vómitos, náuseas, cefaleas, alteraciones del ánimo y convulsiones, que suelen atribuirse a cambios hormonales19. De ahí radica la importancia de elaborar una historia clínica detallada de la gestante, a poder ser antes de la concepción. Asimismo, debe medirse la concentración de amonio en pacientes encefalopáticas o cuadros neuropsiquiátricos en el posparto inmediato no diagnosticadas de DOTC.
Por su parte, la hiperémesis gravídica puede ser tanto causa como consecuencia de hiperamonemia6,19. En nuestro estudio, tres gestantes sufrieron un síndrome emético durante sus embarazos, aunque a ninguna de ellas se le administraron antieméticos para frenar posibles descompensaciones, que finalmente no ocurrieron. En una de ellas (AMM, G11, E21) se diagnosticó una hiperémesis gravídica, aunque no sufrió ningún estado hiperamonémico agudo durante ni tras el embarazo. Por otro lado, es importante monitorizar la tolerancia digestiva de las gestantes con acidemias orgánicas a la suplementación con carnitina y cofactores como hidroxicobalamina y biotina, que en nuestra experiencia ha sido excelente.
En lo que concierne al mayor riesgo de descompensaciones metabólicas en el posparto inmediato, este se debe al estado catabólico por la involución del útero entre los días 3-8 posparto, así como por eventos que pueden aumentar el estrés catabólico (cesárea, traumatismo al nacimiento, infección y/o una transfusión de sangre)20. Por ello, en el posparto deben suministrarse calorías suplementarias20.
En consideración al modo de finalización de la gestación, debe discutirse individualmente. En nuestro estudio no hubo diferencias en cuanto complicaciones materno-fetales en relación a ello. Existen estudios que defienden la cesárea programada con infusión de dextrosa al 10% en pacientes con AMM15, y en nuestro estudio, la paciente con AMM (G11, E19 y E21) tuvo dos cesáreas sin complicaciones, lo que podría apoyar esta idea. Según nuestra experiencia, es recomendable durante el trabajo de parto y posparto inmediato evaluar el amonio en sangre cada 6-12 h y hasta 72 h posparto, así como mantener líquidos intravenosos con dextrosa para compensar el catabolismo producido.
ConclusionesEs importante el manejo multidisciplinar en mujeres con EIM. Siempre se debe recomendar la programación del embarazo y realizar asesoramiento genético previo. Actualmente, a pesar de su importancia, existe gran dificultad en la planificación, control y seguimiento durante la gestación y en el posparto de las pacientes con EIM. En nuestro estudio se confirma que la programación de la gestación en pacientes PKU mejora los resultados materno-fetales.
Debe procurarse mediante monitorización fetal ecográfica el estudio anatómico y evaluaciones del crecimiento para la detección de complicaciones fetales en mujeres embarazadas con EIM. Las mujeres con PKU y TSII requieren una estricta adherencia a la dieta, asegurando una buena nutrición para que sus niveles permanezcan dentro del rango seguro y evitar anomalías fetales. En mujeres embarazadas con DOTC y acidemias orgánicas deben evitarse eventos que aumenten el catabolismo por el riesgo de desarrollo de estados hiperamonémicos durante la gestación o el parto.
Es necesario relacionarse entre centros con experiencia en EIM para poder aportar los datos y resultados de un número importante de pacientes y así mejorar los protocolos y seguimiento de estas patologías.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.