La diabetes mellitus tipo 2 (DM2) es un problema de dimensiones globales por su alta y creciente prevalencia en todo el mundo y por los costes personales y económicos asociados a ella. Un tratamiento adecuado ha demostrado reducir la mortalidad y las complicaciones asociadas. Recientemente se han incluido nuevos conceptos en la práctica clínica habitual y en el árbol de decisión de la terapia farmacológica de la DM2. Por ello, la Sociedad Española de Diabetes (SED) encargó al Grupo de Trabajo de Consensos y Guías Clínicas actualizar el documento de 2010 «Recomendaciones para el tratamiento farmacológico de la hiperglucemia en la diabetes tipo2». Entre los aspectos novedosos se incluyen nueve características para describir a cada grupo farmacológico: eficacia, riesgo de hipoglucemia, efectos en el peso corporal, efecto demostrado en el riesgo cardiovascular, nefroprotección, limitación de uso en la insuficiencia renal, frecuencia de los efectos secundarios, complejidad y coste. Así mismo, se detallan las opciones de combinación y se desarrollan el inicio y el ajuste de las terapias inyectables disponibles.
Type 2 diabetes mellitus (DM2) has become a problem of global dimensions by their high and growing prevalence worldwide and the personal and economic costs associated with it. Correct treatment can reduce mortality and associated complications. New concepts have recently been included in routine clinical practice and have changed the algorithm of DM2 pharmacological therapy. Therefore, the Spanish Society of Diabetes (SED) entrusted to the Working Group of Consensus and Clinical Guidelines an update of the 2010 document Recommendations for Pharmacological Treatment of Hyperglycemia in Diabetes type2. Novel aspects include nine characteristics to describe each drug group: efficiency, the risk of hypoglycemia, effects on body weight, the demonstrated effect in cardiovascular risk, nephroprotection, limitation of use in renal insufficiency, the rate of secondary effects, complexity and costs. Additionally, the document details combination options, and develop the start and adjustment of available injectable therapies.
La diabetes mellitus tipo 2 (DM2) es un problema de dimensiones globales por su alta y creciente prevalencia en todo el mundo y por los costes personales y económicos asociados a ella1. Un tratamiento adecuado, que incluye medidas de estilo de vida y farmacológicas, ha demostrado reducir la mortalidad2 y las complicaciones asociadas3. El objetivo de reducir los efectos adversos propios de los agentes tradicionales, así como la necesidad de terapias diferentes para una enfermedad tan compleja y variada, han estimulado un ingente desarrollo de nuevos fármacos4.
En 2010, la Junta Directiva de la Sociedad Española de Diabetes (SED) decidió encargar al Grupo de Trabajo de Consensos y Guías Clínicas (GTCGC) la elaboración de un documento que adaptara lo más posible las evidencias disponibles y las distintas recomendaciones a la situación en nuestro país5. Se planteó que dicho documento debía actualizarse periódicamente, de acuerdo con las evidencias que fueran surgiendo y con las sugerencias de los miembros de la SED, por lo que recientemente se encargó de nuevo este trabajo al GTCGC. A diferencia del documento previo, que se sometió al consenso con otras sociedades científicas relacionadas con la diabetes, este ha sido elaborado por el GTCGC de la SED. Se ha considerado que la SED es ya de por sí una sociedad científica que agrupa a los distintos profesionales implicados en el manejo de la DM2 y que están representados en el GTCGC, puesto que incluye expertos de endocrinología y nutrición, atención primaria, educadores en diabetes, endocrinología pediátrica y farmacia comunitaria. Recalcamos que se trata de unas recomendaciones de los profesionales del grupo de trabajo basadas en una evaluación de la literatura y la experiencia clínica de los mismos y aprobadas por la Junta Directiva de la SED. Sin embargo, la metodología empleada no incluye una estratificación del grado de evidencia y la fortaleza de las recomendaciones.
En los últimos años, el escenario de la evidencia científica disponible respecto a los agentes para el tratamiento de la DM2 ha cambiado de forma sustancial. Desde el año 2008, la agencia reguladora estadounidense Food and Drug Administration (FDA) exige una evaluación completa del perfil de seguridad cardiovascular de los nuevos tratamientos antidiabéticos6. Desde entonces se han publicado numerosos estudios con algunos nuevos fármacos disponibles. Los resultados han sido heterogéneos y la metodología empleada ha sido objeto de debate7,8. Así mismo, la incorporación de estos resultados a las guías clínicas internacionales se ha hecho de forma dispar. Algunas de ellas hacen una recomendación explícita a favor de primar a los fármacos con resultados favorables en los estudios de seguridad cardiovascular9, si bien la mayoría reduce la aplicación de esta evidencia científica a personas con DM2 y enfermedad cardiovascular establecida9,10. Creemos que los resultados disponibles aportan un conocimiento susceptible de ser empleado en los algoritmos de manejo y que debe priorizarse el uso de los fármacos con este aval.
Por eso, el presente documento recoge los nuevos conceptos en la práctica clínica habitual y en el árbol de decisión de la terapia farmacológica de la DM2, como la reducción de morbimortalidad cardiovascular mencionada, la complejidad intrínseca de los nuevos agentes y el coste. No obstante, la constante aparición de nuevos agentes farmacológicos y de evidencia científica aconseja que estas recomendaciones sean actualizadas regularmente. El propósito sería hacerlo cada año.
Por último, debe reseñarse que las recomendaciones, guías y limitaciones administrativas de las autoridades locales pueden ser diferentes entre comunidades autónomas y, así mismo, distintas de las que se incluyen en este documento.
Objetivos de controlLa consecución de un buen control glucémico puede evitar o retrasar la aparición de las complicaciones micro y macrovasculares, tal como han demostrado diversos estudios con seguimiento a largo plazo11. Por ello, se recomienda conseguir un control muy estricto en las primeras fases del tratamiento de la diabetes (hemoglobina glucosilada [HbA1c] <6,5% como objetivo óptimo). En condiciones de vida real esto supone conseguir valores de glucemia en ayunas inferiores a 125mg/dl y posprandiales inferiores a 145mg/dl12. Sin embargo, diferentes efectos adversos, y muy especialmente el riesgo de hipoglucemia, pueden aumentar cuando buscamos un control más intensivo. Tanto la susceptibilidad como la gravedad de las consecuencias de estos efectos adversos son mayores en personas con:
- •
Alta comorbilidad, especialmente cardiovascular.
- •
Mayor edad.
- •
Mayor duración de la DM2.
- •
Ingesta irregular.
- •
Hipoglucemia inadvertida.
- •
Insuficiencia renal (IR).
- •
Falta de adherencia al tratamiento.
- •
Limitaciones personales para seguir correctamente el tratamiento.
- •
Fragilidad.
Por ello, se recomienda flexibilizar los objetivos de control en estos casos y considerar un objetivo de HbA1c menor de 8%, glucemia basal inferior a 140mg/dl y posprandial inferior a 200mg/dl13. Estos objetivos no implican que no se busque el mejor control glucémico posible utilizando una terapia antidiabética sin riesgo de hipoglucemia y poco agresiva para el paciente. El criterio clínico resulta insustituible para la individualización de estos objetivos.
Inercia terapéuticaEl retraso en la toma de decisiones para el ajuste del tratamiento de la DM2, que denominamos inercia terapéutica, es una de las causas fundamentales del fracaso en la consecución de sus objetivos14. Tras el inicio del tratamiento, o tras sucesivos ajustes, es necesario reevaluar la situación clínica del paciente, las nuevas opciones de tratamiento farmacológico disponibles y el control glucémico obtenido. Es importante que este proceso sea continuado y frecuente dada la variabilidad en la respuesta y el carácter progresivo de la DM2.
Las nuevas clases farmacológicas aparecidas pueden tener efectos adversos frecuentes, pero sobre todo de aparición precoz, así como requerir ajustes del tratamiento concomitante. Por ello recomendamos revisar la tolerancia y la eficacia (mediante autoanálisis de glucemia capilar) en las primeras 4semanas tras la introducción de un nuevo fármaco y a los 3meses confirmar la idoneidad del mismo con parámetros de control glucémico (HbA1c y autoanálisis de glucemia capilar) y clínicos. Después, cuando se hayan conseguido los objetivos, se revisará a todos los pacientes al menos dos veces al año. Este proceso continuado tiene como parte capital la educación terapéutica, especialmente en caso de iniciar nuevos fármacos con mayor complejidad de uso como son los inyectables. La implicación activa del paciente en el manejo del nuevo tratamiento resulta clave. Esto es especialmente aplicable para los tratamientos inyectables y, en el caso de la insulina, ha demostrado ser seguro y eficaz el autoajuste de las dosis por el paciente11,15. Los programas de educación diabetológica en estos casos deben incluir las modificaciones del tratamiento necesarias ante procesos intercurrentes agudos que pueden provocar un cierto grado de deshidratación o dificultades en la ingesta16.
Resultados de los ensayos clínicos con resultados cardiovascularesSi bien se han demostrado reducciones de complicaciones microvasculares de la DM2 mediante la mejoría del control glucémico desde hace décadas11, la evidencia científica en lo que respecta a complicaciones macrovasculares y mortalidad ha estado ausente hasta muy recientemente. Incluso surgieron algunas dudas sobre la seguridad cardiovascular de algunos tratamientos antidiabéticos17. Adicionalmente, resultados de ensayos que comparaban un tratamiento con objetivos de control intensivo (HbA1c<6,5%) respecto al tratamiento convencional en personas con DM2 y alto riesgo cardiovascular cuestionaron la seguridad de este abordaje y del tratamiento hipoglucemiante en general en la DM218.
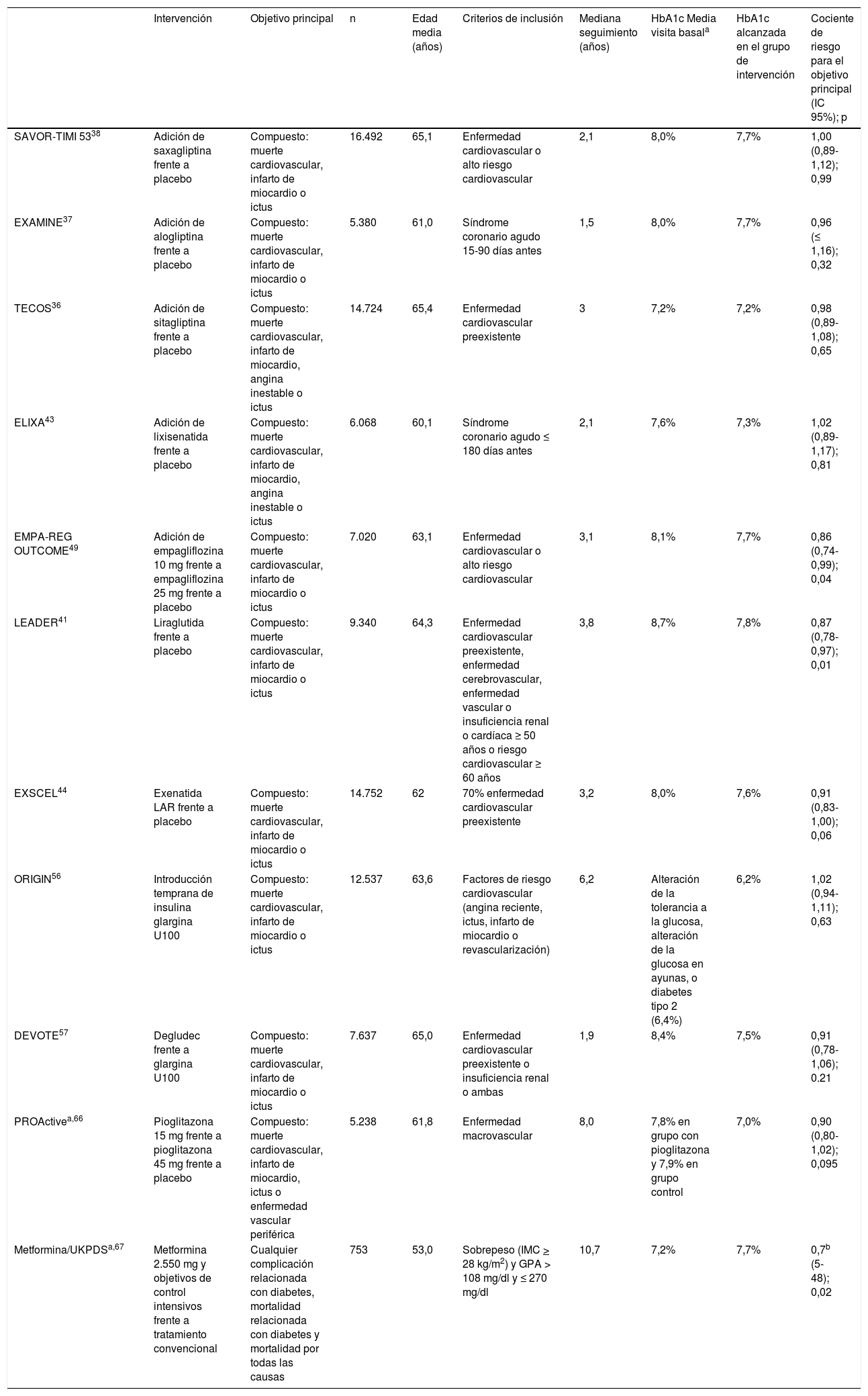
Desde el año 2008 la agencia reguladora estadounidense FDA exige una evaluación completa del perfil de seguridad cardiovascular de los nuevos tratamientos antidiabéticos6. Desde entonces se han publicado progresivamente estudios con objetivos cardiovasculares (CVOT) con los nuevos fármacos (tabla 1). Si bien es deseable obtener información más amplia que permita aumentar la validez externa de los estudios de seguridad cardiovascular, así como confirmación de la causalidad mediante estudios específicamente diseñados para ello, consideramos que los resultados disponibles aportan conocimiento susceptible de ser empleado. Algunos de los árboles de decisión más recientes han incorporado el criterio de reducción de riesgo de morbimortalidad cardiovascular con los agentes que lo han demostrado en estos estudios, especialmente en la población incluida en ellos (personas con enfermedad cardiovascular establecida o con riesgo cardiovascular muy alto).
Aspectos clave de los ensayos de resultados cardiovasculares con agentes antidiabéticos en pacientes con DM2
| Intervención | Objetivo principal | n | Edad media (años) | Criterios de inclusión | Mediana seguimiento (años) | HbA1c Media visita basala | HbA1c alcanzada en el grupo de intervención | Cociente de riesgo para el objetivo principal (IC 95%); p | |
|---|---|---|---|---|---|---|---|---|---|
| SAVOR-TIMI 5338 | Adición de saxagliptina frente a placebo | Compuesto: muerte cardiovascular, infarto de miocardio o ictus | 16.492 | 65,1 | Enfermedad cardiovascular o alto riesgo cardiovascular | 2,1 | 8,0% | 7,7% | 1,00 (0,89-1,12); 0,99 |
| EXAMINE37 | Adición de alogliptina frente a placebo | Compuesto: muerte cardiovascular, infarto de miocardio o ictus | 5.380 | 61,0 | Síndrome coronario agudo 15-90 días antes | 1,5 | 8,0% | 7,7% | 0,96 (≤ 1,16); 0,32 |
| TECOS36 | Adición de sitagliptina frente a placebo | Compuesto: muerte cardiovascular, infarto de miocardio, angina inestable o ictus | 14.724 | 65,4 | Enfermedad cardiovascular preexistente | 3 | 7,2% | 7,2% | 0,98 (0,89-1,08); 0,65 |
| ELIXA43 | Adición de lixisenatida frente a placebo | Compuesto: muerte cardiovascular, infarto de miocardio, angina inestable o ictus | 6.068 | 60,1 | Síndrome coronario agudo ≤ 180 días antes | 2,1 | 7,6% | 7,3% | 1,02 (0,89-1,17); 0,81 |
| EMPA-REG OUTCOME49 | Adición de empagliflozina 10 mg frente a empagliflozina 25 mg frente a placebo | Compuesto: muerte cardiovascular, infarto de miocardio o ictus | 7.020 | 63,1 | Enfermedad cardiovascular o alto riesgo cardiovascular | 3,1 | 8,1% | 7,7% | 0,86 (0,74-0,99); 0,04 |
| LEADER41 | Liraglutida frente a placebo | Compuesto: muerte cardiovascular, infarto de miocardio o ictus | 9.340 | 64,3 | Enfermedad cardiovascular preexistente, enfermedad cerebrovascular, enfermedad vascular o insuficiencia renal o cardíaca ≥ 50 años o riesgo cardiovascular ≥ 60 años | 3,8 | 8,7% | 7,8% | 0,87 (0,78-0,97); 0,01 |
| EXSCEL44 | Exenatida LAR frente a placebo | Compuesto: muerte cardiovascular, infarto de miocardio o ictus | 14.752 | 62 | 70% enfermedad cardiovascular preexistente | 3,2 | 8,0% | 7,6% | 0,91 (0,83-1,00); 0,06 |
| ORIGIN56 | Introducción temprana de insulina glargina U100 | Compuesto: muerte cardiovascular, infarto de miocardio o ictus | 12.537 | 63,6 | Factores de riesgo cardiovascular (angina reciente, ictus, infarto de miocardio o revascularización) | 6,2 | Alteración de la tolerancia a la glucosa, alteración de la glucosa en ayunas, o diabetes tipo 2 (6,4%) | 6,2% | 1,02 (0,94- 1,11); 0,63 |
| DEVOTE57 | Degludec frente a glargina U100 | Compuesto: muerte cardiovascular, infarto de miocardio o ictus | 7.637 | 65,0 | Enfermedad cardiovascular preexistente o insuficiencia renal o ambas | 1,9 | 8,4% | 7,5% | 0,91 (0,78-1,06); 0.21 |
| PROActivea,66 | Pioglitazona 15 mg frente a pioglitazona 45 mg frente a placebo | Compuesto: muerte cardiovascular, infarto de miocardio, ictus o enfermedad vascular periférica | 5.238 | 61,8 | Enfermedad macrovascular | 8,0 | 7,8% en grupo con pioglitazona y 7,9% en grupo control | 7,0% | 0,90 (0,80-1,02); 0,095 |
| Metformina/UKPDSa,67 | Metformina 2.550 mg y objetivos de control intensivos frente a tratamiento convencional | Cualquier complicación relacionada con diabetes, mortalidad relacionada con diabetes y mortalidad por todas las causas | 753 | 53,0 | Sobrepeso (IMC > 28 kg/m2) y GPA > 108 mg/dl y ≤ 270 mg/dl | 10,7 | 7,2% | 7,7% | 0,7b (5-48); 0,02 |
GPA: glucemia plasmática en ayunas.
Sin duda, las opciones de tratamiento farmacológico para la DM2 se han multiplicado en los últimos años, permitiendo una mayor individualización. Los nuevos fármacos incorporan ventajas indudables (especialmente menor riesgo de hipoglucemia y de ganancia de peso) y exploran nuevos mecanismos de acción previamente no implicados en la terapia. Por el contrario, su efectividad está condicionada por la función renal o por respuestas neurorreguladoras difícilmente predecibles. Algunos de sus beneficios o efectos adversos se han podido adjudicar a la clase o grupo farmacológico (efecto clase); sin embargo, otros solo se han observado en alguno de los agentes del mismo. Por otra parte, los efectos beneficiosos en reducción de presión arterial, volumen intravascular o glucemia obligan también a revisar la terapia concomitante al inicio de estos tratamientos antidiabéticos. Diuréticos, antihipertensivos y, especialmente, la insulina pueden requerir cambios que no son siempre fáciles. La terapia combinada que antes se reducía a dos agentes se ha multiplicado hasta la triple o cuádruple.
Todo ello ha incrementado claramente la complejidad del tratamiento farmacológico. Es algo que no se puede obviar y que los profesionales que la manejan (necesariamente muchos de ellos no endocrinólogos) perciben como una dificultad para la intensificación. Si bien esta y otras guías internacionales tienen como objetivo facilitar estas decisiones, no siempre es fácil para todos los profesionales incorporar adecuadamente estas novedades. La complejidad no debería ser, sin embargo, una barrera para que los pacientes candidatos a nuevas terapias se beneficien de ellas. Una conexión ágil entre todos los miembros del equipo interdisciplinar debería mejorar el acceso a estos nuevos agentes y terapias combinadas.
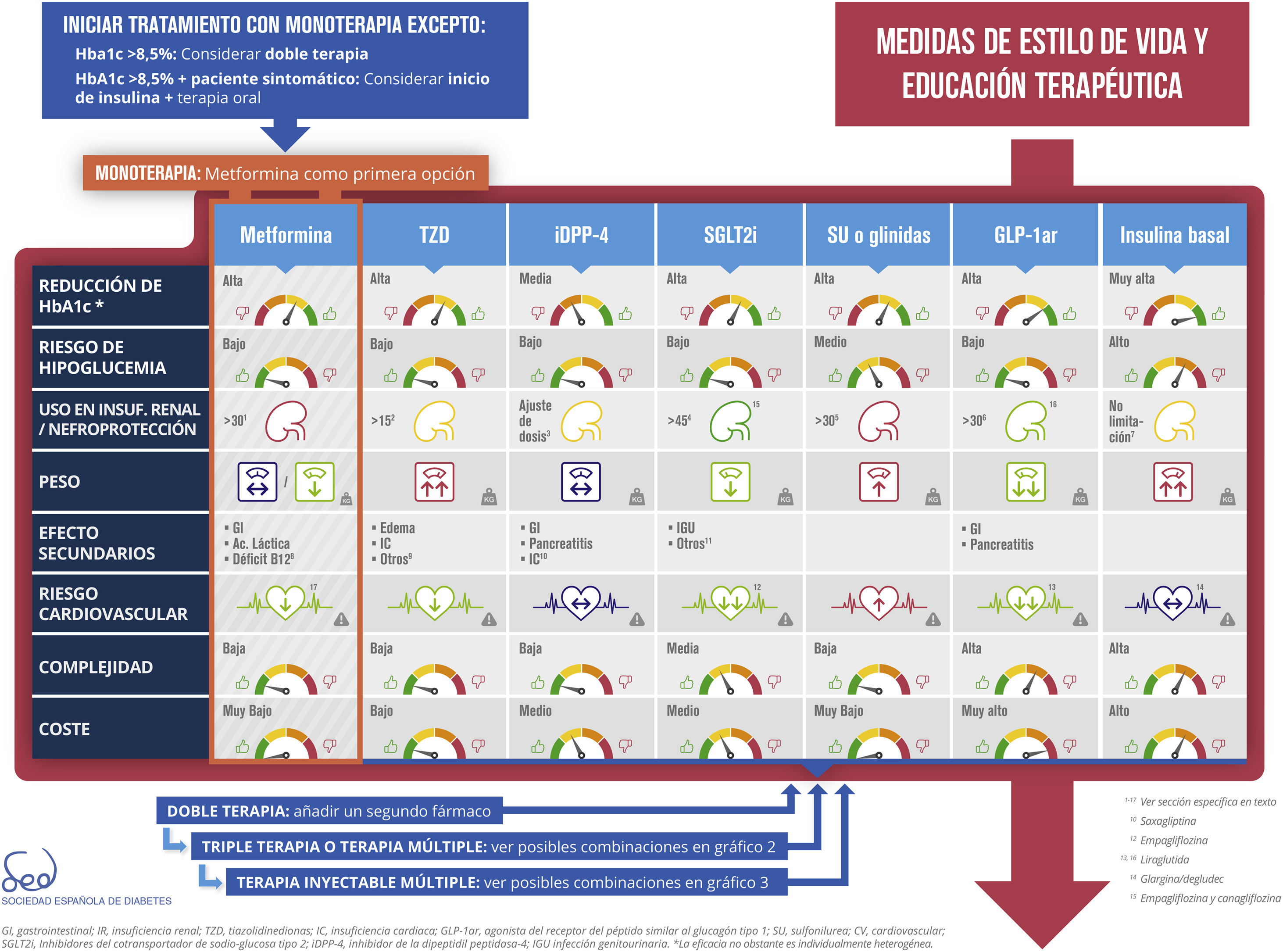
Primer tratamiento y combinación precozEn algunos casos el objetivo de control (HbA1c<6,5%) puede conseguirse únicamente con modificaciones del estilo de vida19, aunque este planteamiento no siempre es eficaz, ya que depende de las características del paciente y de su grado de adherencia a las recomendaciones. Por este motivo, la SED aconseja asociar metformina de forma concomitante desde el inicio en la mayoría de pacientes5.
En todo caso, no es recomendable demorar más de 3 meses la introducción de metformina si no se ha conseguido el objetivo de control individualizado.
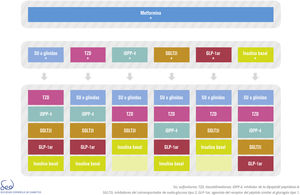
La fisiopatología de la DM2 incluye alteraciones en mecanismos y órganos diversos20. Esto hace que la necesidad y la conveniencia de un tratamiento combinado sean casi universales a lo largo de la historia natural de la misma. Por otra parte, el uso de dos fármacos diferentes simultáneamente puede dificultar la identificación del causante de un efecto secundario. Por todo ello, existen diferencias de criterio sobre cuándo debe hacerse un tratamiento farmacológico combinado desde el diagnóstico, utilizando puntos de corte de HbA1c de forma consensuada. Esta actualización propone dos situaciones en las que puede valorarse un tratamiento farmacológico combinado inicial (fig. 1):
- •
HbA1c > 8,5%.
- •
HbA1c > 8,5% en paciente sintomático. En este supuesto se propone considerar el inicio de insulina junto con terapia oral. Una vez mejorado el control y la situación clínica, podrá valorarse la suspensión del tratamiento con insulina.
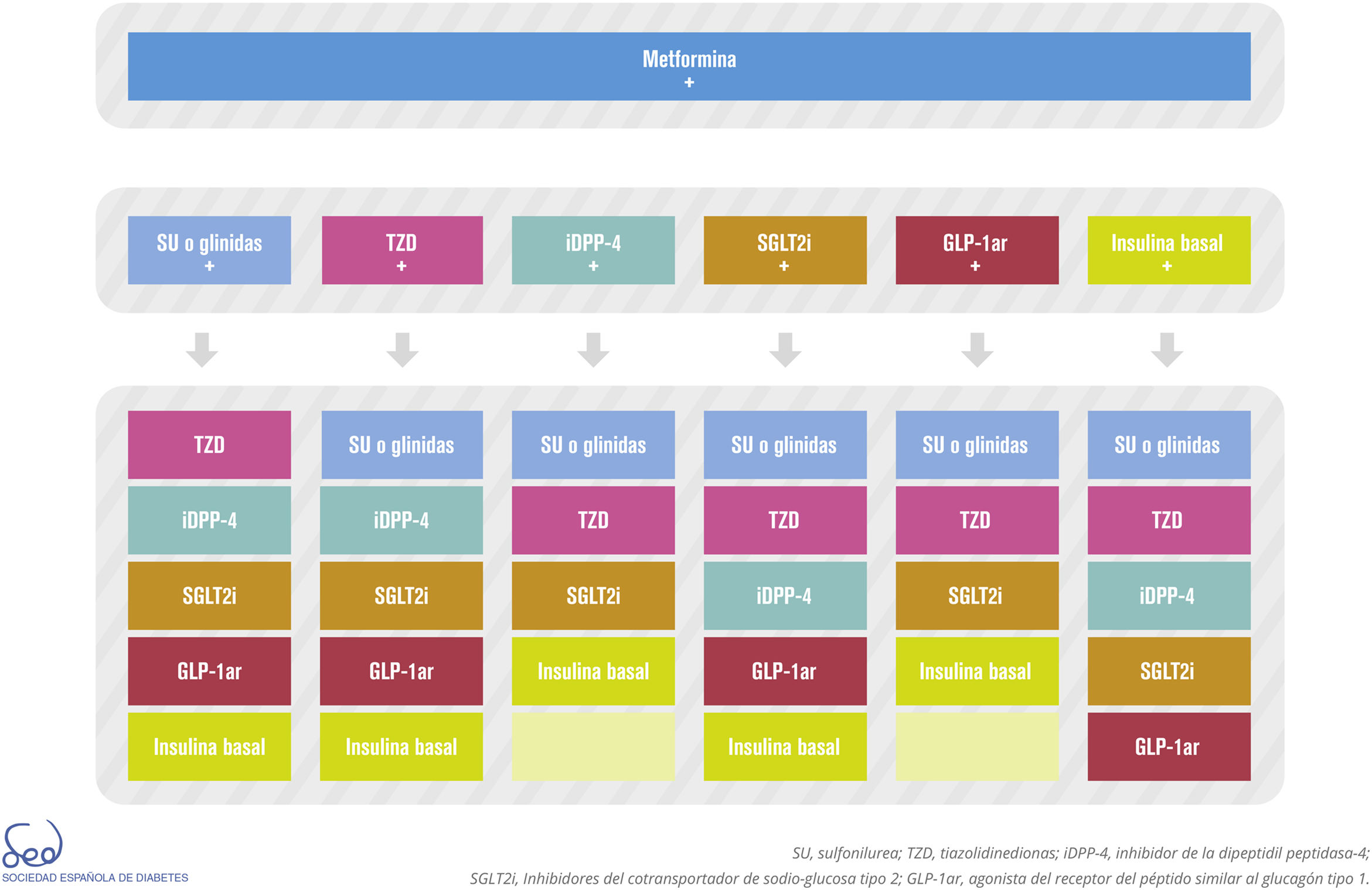
Las opciones de tratamiento combinado son actualmente múltiples (fig. 2), algunas disponibles en un comprimido de administración oral, e incluso será posible utilizar combinaciones de fármacos inyectables. El criterio clínico y las características y preferencias del paciente resultan insustituibles para elegir la opción terapéutica más oportuna.
Descripción de grupos farmacológicosMetforminaLa metformina es un fármaco efectivo (reducción media de HbA1c esperada 1,3% a 2,0%, especialmente en su uso habitual como primera opción al diagnóstico de la DM2 con HbA1c elevadas21). A pesar de su extensa experiencia de uso, solo recientemente se ha avanzado en el conocimiento de su mecanismo de acción. Mediante su unión a receptores específicos activa la AMP-cinasa, disminuye la producción hepática de glucosa22 y aumenta la captación intestinal de glucosa, que actúa como un mecanismo de aclarado de la hiperglucemia en la diabetes23. Su efecto en el peso corporal es neutro o, en algún caso, induce una modesta reducción24. Es un fármaco seguro, si bien sus efectos secundarios gastrointestinales parecen infraestimados en la bibliografía4. Para mejorar la tolerancia a este fármaco se aconseja una titulación progresiva de las dosis y la toma conjunta con alimentos. Si se observa intolerancia, debe reducirse de nuevo a la dosis previa tolerada y reintentar el incremento posteriormente. Si bien se ha aceptado como probado su potencial para disminuir el riesgo cardiovascular (RCV), la evidencia disponible es reducida25. En relación con su uso en IR, con filtrado glomerular estimado (FGe) por debajo de 45ml/min no se recomienda iniciar y debería reducirse la dosis en tratamientos ya instaurados. Se debe suspender por debajo de 30ml/min26. El uso de metformina está asociado con deficiencia de vitaminaB12, por lo que se ha sugerido revisar periódicamente los niveles de vitaminaB12 y/o la presencia de anemia o neuropatía periférica27. Es un fármaco de bajo coste y baja complejidad.
Sulfonilureas y glinidasEsta clase farmacológica ha sido usada durante décadas mostrando eficacia (reducción media de HbA1c esperada añadida a metformina 0,79%)28, si bien con dudas de su sostenibilidad a medio plazo29. Cierran los canales K-ATP en la membrana de las células beta estimulando la secreción de insulina. Este mecanismo es independiente de los niveles de glucosa plasmática, lo que condiciona su riesgo de hipoglucemia, considerado medio por su baja frecuencia pero con casos de elevada gravedad. Una revisión sistemática y metaanálisis mostró un aumento medio en el peso de 2,31kg en el tratamiento con sulfonilureas30. Debe evitarse glibenclamida en caso de IR y usar dosis más bajas en el caso de sulfonilureas de segunda generación (glicazida, glimepirida). En pacientes con IR se recomienda no iniciar el tratamiento con FGe menor de 45ml/min y suspenderlo si es inferior a 3026. Los metabolitos de repaglinida se excretan principalmente por medio de la bilis, por lo que no tienen limitación de uso en IR. También tienen un pico de biodisponibilidad temprano y una vida media más corta, por lo que pueden conseguir un control de glucemia posprandial superior a las sulfonilureas31.
Debido a su riesgo de hipoglucemia, aumento de peso y un posible incremento de mortalidad cardiovascular32, no son una opción preferente. Sin embargo, por su escasa complejidad de uso y por razones de coste-efectividad se siguen considerando fármacos adecuados en pacientes con bajo riesgo de hipoglucemia33.
Inhibidores de alfa-glucosidasasInhiben las alfa-glucosidasas intestinales, reduciendo la digestión y la absorción de los hidratos de carbono. En algunos casos pueden reducir ligeramente el peso y no causan hipoglucemias en monoterapia. Sin embargo, son escasamente utilizados en la actualidad, debido a que poseen menos potencia que el resto de opciones disponibles (reducción media de HbA1c esperada añadida a metformina 0,65%)28, y causan frecuentes efectos adversos gastrointestinales (fundamentalmente flatulencia) que obligan a suspender el tratamiento en un porcentaje elevado de pacientes34.
Pioglitazona (tiazolidindionas)Actúan activando el factor de transcripción nuclear PPAR-gamma, que incrementa la sensibilidad a la insulina. Pueden esperarse reducciones de HbA1c añadidas a metformina del 1%28. No requieren ajuste de dosis en IR y pueden utilizarse con FGe por encima de 15ml/min/1,73m2. Su uso se ha visto limitado por la presencia de efectos adversos, como incremento de peso, retención hídrica (edemas, insuficiencia cardíaca), fracturas óseas y una supuesta relación con el cáncer vesical24, por lo que se suele reservar para el tercer escalón terapéutico. Sin embargo, se valora positivamente su efecto favorable en la esteatosis y esteatohepatitis no alcohólica35 y ser una alternativa en los casos de intolerancia/contraindicación de metformina. Actualmente su coste es bajo, así como la complejidad.
Inhibidores de la dipeptidilpeptidasa tipo 4 (DPP-4)Inhiben la actividad de la enzima DPP-4, aumentando las concentraciones endógenas de hormonas incretinas (glucagon-like peptide-1 [GLP-1], gastric inhibitory polypeptide [GIP]) posprandialmente. Con este mecanismo de acción pueden incrementar la secreción de insulina y disminuir la secreción de glucagón de forma dependiente de la glucosa. Añadidos a metformina, la reducción media de HbA1c esperada es de 0,79%28. No causan hipoglucemias en monoterapia. Su efecto en el peso corporal es neutro, si bien en algunos casos puede producirse una ligera reducción. Pueden usarse con seguridad en cualquier estadio de insuficiencia renal crónica. Salvo linagliptina, que se elimina por vía biliar, el resto de inhibidores de la DPP-4 (iDPP-4) requieren ajuste de dosis en casos de insuficiencia renal moderada o grave, si bien esta es una recomendación por cuestiones farmacocinéticas, no por datos de seguridad. Los iDPP-4 sitagliptina, alogliptina y saxagliptina han demostrado seguridad cardiovascular en ensayos clínicos realizados en pacientes de alto riesgo cardiovascular36-38.
En el estudio SAVOR-TIMI 5, el uso de saxagliptina se asoció a un incremento significativo de hospitalizaciones por insuficiencia cardíaca38, aspecto que no se ha objetivado con el resto de moléculas. Su coste es elevado, aunque inferior al de los inyectables recientemente comercializados. Su seguridad y la comodidad de uso (dosis única diaria o dos veces al día en las presentaciones en combinación con metformina) los han convertido en una de las opciones farmacológicas más utilizadas, especialmente en fases iniciales de la enfermedad, en IR y en ancianos39.
Agonistas del receptor de glucagon-like peptide-1 (GLP-1)Se unen a los receptores del GLP-1, induciendo una disminución en la secreción de glucagón y un aumento en la secreción de insulina, ambos de manera dependiente del nivel de glucemia. Adicionalmente producen enlentecimiento del vaciamiento gástrico y aumentan la saciedad. Pueden conseguir reducciones medias de HbA1c añadidos a metformina del 0,99%28, unido a una pérdida ponderal significativa (media esperada −2,9kg)40. Los agonistas del receptor GLP-1(arGLP-1) no inducen hipoglucemias en monoterapia. Consiguen reducciones de presión arterial sistólica (−3,57mmHg) y diastólica (−1,38mmHg)40.
En general, no se recomienda su uso con FGe inferior a 30ml/min, salvo liraglutida y dulaglutida, que pueden usarse hasta FGe de 15ml/min. La experiencia en IR es más limitada en el resto, si bien no precisan ajuste de dosis. En el estudio LEADER, liraglutida ha mostrado reducir un objetivo compuesto renal (definido como macroalbuminuria de nueva aparición o una duplicación del nivel de creatinina sérica y un eGFR de ≤45ml/min/1,73m2, la necesidad de terapia de reemplazo renal o muerte por insuficiencia renal41). Sin embargo, la mayor parte de este beneficio se produjo a través del primer elemento del compuesto, macroalbuminuria, que es un marcador subrogado de enfermedad renal. Por ello, la posible detención de la progresión de enfermedad renal (nefroprotección) con la liraglutida es más incierta que con empagliflozina/canagliflozina (ver más adelante), y se necesitan estudios con un seguimiento más prolongado que el utilizado en LEADER para ver diferencias en los objetivos «duros»42. Así mismo, liraglutida ha demostrado reducir los principales eventos adversos cardiovasculares (ictus e infarto agudo de miocardio) y la mortalidad cardiovascular en pacientes de alto RCV41, mientras que lixisenatida43 y exenatida semanal han mostrado neutralidad cardiovascular44.
Aproximadamente el 20% de pacientes presentan efectos secundarios gastrointestinales (principalmente náuseas y, en menor medida, vómitos) al inicio de la terapia, tasa que disminuye en las semanas siguientes y supone en pocos casos la suspensión del tratamiento (3-8%)45. El uso de arGLP-1 se ha asociado con un ligero aumento del riesgo de pancreatitis aguda, aunque en los ensayos clínicos no se alcanza la significación estadística por ser poco frecuentes. Se debe informar a los pacientes de los síntomas característicos de la pancreatitis aguda y, ante su sospecha, deberá interrumpirse el tratamiento. Su coste es elevado y su reembolso en el sistema público limitado a personas con índice de masa corporal (IMC) >30kg/m2. Requieren administración subcutánea (diaria en dos dosis en el caso de exenatida, una para liraglutida y lixisenatida, y semanal con exenatida-LAR y dulaglutida) y formación relativa a los posibles efectos adversos, por lo que se consideran de complejidad alta.
Inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2)Estos fármacos impiden la reabsorción de glucosa en el segmento contorneado del túbulo renal proximal por el bloqueo del cotransportador SGLT2, induciendo glucosuria. La reducción de la HbA1c esperada está entre 0,7 y 1%46 y han mostrado eficacia sostenida en estudios de hasta 4años de seguimiento47. Dado que su mecanismo de acción es independiente de la insulina, son efectivos en todos los estadios de la DM2 y no producen hipoglucemia en monoterapia. Los inhibidores del SGLT2 (iSGLT2) inducen una pérdida ponderal media de −1,88kg y reducen la presión arterial (media: −2,46mmHg en sistólica y −1,46mmHg en diastólica)48. En los estudios EMPA-REG49, CANVAS y CANVAS-R50, realizados en pacientes con DM2 y elevado riesgo cardiovascular, empagliflozina y canagliflozina han demostrado reducción del RCV (incluyendo muerte por causas cardiovasculares, infarto de miocardio no fatal o accidente cerebrovascular no fatal y la hospitalización por insuficiencia cardíaca). En el estudio CANVAS el tratamiento con canagliflozina se asoció a un riesgo mayor de amputaciones (principalmente a nivel del dedo del pie o el metatarso) y fracturas50. Las fracturas fueron más frecuentes en las extremidades, y al excluir fracturas en mano, pie, cráneo y cara (es decir, lugares no asociados con osteoporosis o fragilidad esquelética), la incidencia de fracturas ya no era estadísticamente diferente con canagliflozina51.
La eficacia disminuye con FGe menor de 60ml/min/1,72m2. Por debajo de este FGe no debe administrarse dapagliflozina, mientras que empagliflozina y canagliflozina pueden utilizarse también con filtrados glomerulares de entre 45 y 60ml/min/1,72m2 reduciendo la dosis. Su administración debe suspenderse ante filtrados <45ml/min/1,72m2.
Empagliflozina demostró reducciones en nefropatía incidente o empeoramiento, duplicación del nivel de creatinina sérica y terapia de reemplazo renal en un análisis preespecificado del estudio EMPA-REG52. Así mismo, los resultados del estudio CANVAS mostraron un posible beneficio de canagliflozina en progresión de albuminuria y un objetivo compuesto que incluía reducción sostenida de un 40% del filtrado glomerular, necesidad de terapia de reemplazamiento renal o muerte por causa renal50. A diferencia de los resultados descritos previamente con liraglutida, los obtenidos con los SGLT2 sí incluyen objetivos robustos, lo que, unido a las acciones hemodinámicas renales de este grupo, hacen probable un efecto nefroprotector intrínseco42.
El efecto adverso más común de estos fármacos son las infecciones genitourinarias, sobre todo en mujeres. La glucosuria provoca diuresis osmótica y poliuria, por lo que se han observado eventos adversos por depleción de volumen, especialmente en personas de edad avanzada y con el uso simultáneo de diuréticos. Al asociarlos con sulfonilureas o insulina pueden aparecer hipoglucemias. Todos estos efectos adversos pueden manifestarse al inicio del tratamiento, por lo que se recomienda ajustar proactivamente el tratamiento hipoglucemiante y antihipertensivo53. Se han comunicado casos raros de cetoacidosis euglucémica, especialmente en pacientes tratados con insulina54.
Los iSGLT2 se administran en una dosis única diaria por vía oral (o dos veces al día en las presentaciones en combinación con metformina); sin embargo, la necesidad de ajuste de tratamientos concomitantes y la frecuencia de eventos adversos los convierte en un tratamiento de complejidad media.
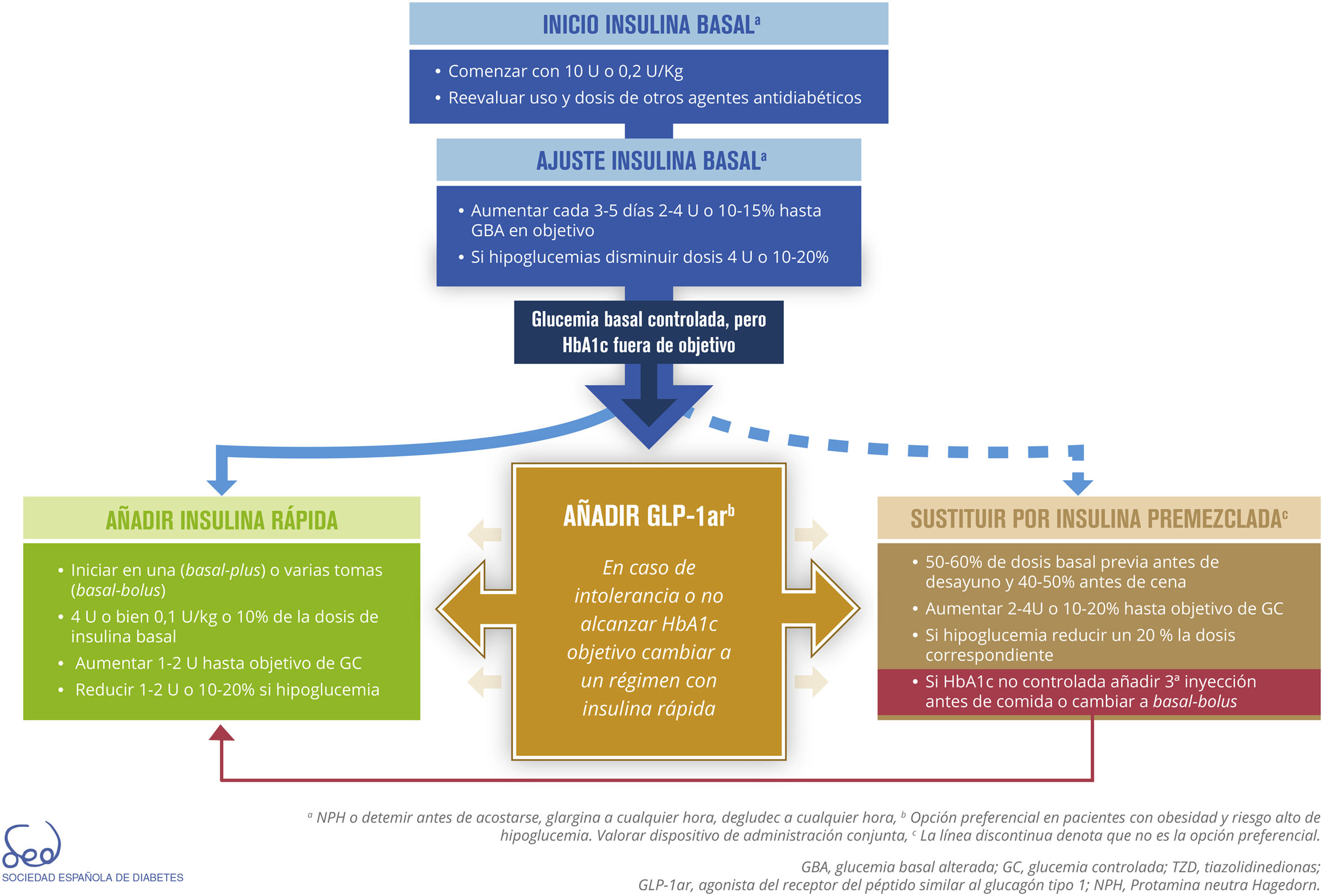
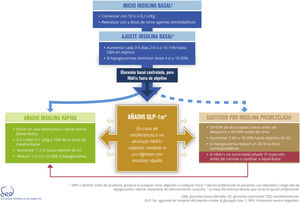
InsulinaLa administración directa de la hormona deficitaria en la DM2, la insulina, es la opción hipoglucemiante más potente, especialmente en pacientes insulinopénicos, en los que la reducción de HbA1c media esperada está entre 1 y 2%. También se asocia a un mayor riesgo de hipoglucemias. Actúa disminuyendo la producción de glucosa por el hígado y favoreciendo la utilización periférica de glucosa. La propuesta para el avance terapéutico desde fármacos no insulínicos hasta la insulinoterapia y su intensificación se describe en la figura 3.
El aumento de peso con insulina es mayor que con otras opciones actuales. En estudios observacionales el uso de insulina se asoció con un incremento de hasta 6kg de peso en 2años55.
La insulina no tiene contraindicación por IR, si bien su dosis debe reducirse en estos casos. Se ha demostrado seguridad cardiovascular en los estudios ORIGIN (glargina)56 y DEVOTE (degludec)57.
Los análogos de insulina basal (glargina U100 y U300, detemir, degludec) han mostrado un menor riesgo de hipoglucemias (especialmente nocturnas) que la insulina humana NPH58. Su coste es más elevado, siendo en el caso de insulina degludec mayor que el resto y su prescripción está limitada actualmente a condiciones de visado. Degludec y glargina U300 han demostrado una menor tasa de hipoglucemias, sobre todo nocturnas, en comparación con la insulina glargina U100 y mayor flexibilidad en el horario de administración59,60.
Como primera opción de tratamiento insulínico se opta por la insulina basal. Es recomendable mantener el tratamiento con metformina para reducir los requerimientos de insulina. La decisión de mantener otros antidiabéticos orales o arGLP-1 deberá valorarse de manera individual, pero también pueden aportar un mejor control posprandial y reducir las necesidades de insulina, lo que se asocia con menor ganancia ponderal. En el «Consenso sobre tratamiento con insulina en la diabetes tipo2», recientemente publicado por este mismo GTCGC, se aboga por mantener iDPP-4, iSGLT2 y reducir/suspender SU y pioglitazona61. Para el inicio de insulina basal, la dosis diaria recomendada es de 0,2U/kg o 10U. Los ajustes de dosis deberán realizarse de forma progresiva: aumentar cada 3-5días 2-4U o 10-15% hasta conseguir glucemia en ayunas en objetivo. Si aparecen hipoglucemias no justificadas, disminuir la dosis 4U o 10-20%61.
Cuando la glucemia basal está en objetivo, pero no la HbA1c, se recomienda intensificar el tratamiento. La combinación de insulina basal con arGLP-1 proporciona un control glucémico similar y menos riesgo de hipoglucemias que otras pautas insulínicas, por lo que se considera actualmente una opción preferencial (fig. 3)62.
En caso de intolerancia, no alcanzar HbA1c objetivo o si directamente no se ha considerado una opción válida, se puede optar por un régimen con insulina rápida. En estos casos la propuesta más recomendable es utilizar bolus de insulina rápida. Se puede iniciar en una toma con la excursión hiperglucémica más importante (basal-plus) o directamente en varias tomas (basal-bolus). La recomendación de dosis de estos bolus es 4U, o bien 0,1U/kg o 10% de la dosis de insulina basal. El ajuste se hará mediante el control de glucemia capilar posprandial: aumentar 1-2U hasta objetivo. Debe reducirse 1-2U o 10-20% si se presenta una hipoglucemia no justificada61.
La opción de insulinas premezcladas se asocia a mayor riesgo de hipoglucemias y ganancia de peso y requieren horarios y patrones de ingesta y actividad física regulares63. Cuando se inician insulinas premezcladas puede utilizarse el 50-60% de la dosis de insulina basal previa antes del desayuno y el 40-50% antes de la cena. Para su titulación, se recomienda aumentar 2-4U o 10-20% hasta objetivo de glucemia capilar. En caso de hipoglucemia reducir un 20% la dosis correspondiente. Si la HbA1c no está controlada, se puede añadir una tercera inyección antes de la comida. Si no se consigue el control adecuado, se puede cambiar a una estrategia basal-bolus.
Todas las opciones de tratamiento con insulina se consideran complejas por la necesidad de inyección subcutánea, titulación y riesgos, requiriendo educación diabetológica específica.
Combinaciones de fármacos en dosis fijaEn los últimos años se han ido incorporando a la terapia para la DM2 opciones de combinación de dos fármacos en un solo comprimido, con la finalidad de simplificar la pauta terapéutica y así mejorar la adherencia de los pacientes. Actualmente se dispone de combinaciones orales de metformina con SU, pioglitazona, iDPP-4 o iSGLT2, pero también de iDDP-4 e iSGLT2 o pioglitazona e iDPP-4. La experiencia indica que han sido muy bien aceptadas por su comodidad y seguridad. También han podido reducir la inercia terapéutica facilitando el acceso a terapia combinada más rápidamente.
La Agencia Europea de Medicamentos ha aprobado recientemente las combinaciones fijas de tratamientos inyectables en un dispositivo único: insulina +arGLP-1: insulina glargina más lixisenatida e insulina degludec más liraglutida. Ambos han demostrado potentes reducciones de HbA1c (1,6 a 1,9%), buen comportamiento en relación con el peso corporal, baja tasa de hipoglucemias y ahorro en dosis de insulina, respecto a cada uno de sus componentes por separado, y son una opción de tratamiento sencilla y cómoda para el paciente64,65. Sin embargo, en el momento actual no están disponibles en nuestro país.
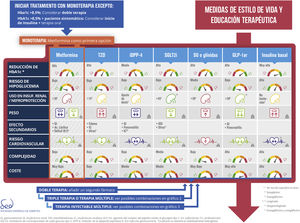
Algoritmo de tratamiento farmacológico de la DM2 SED 2018En la figura 1 se intenta plasmar las anteriores consideraciones en un algoritmo de decisión. La propuesta diferenciada de este consenso respecto al de 2010 consiste en que el tratamiento claramente escalonado se sustituye actualmente por una decisión más transversal. Prácticamente todos los agentes se encuentran disponibles desde el principio con sus características diferenciales más explícitas para que sea el médico a cargo del paciente el que elija la opción u opciones en combinación que mejor se adapten a las necesidades del paciente individual. Los aspectos antes desarrollados, como reducción demostrada de riesgo cardiovascular, limitación de uso en IR, nefroprotección o complejidad, están presentes en la tabla de agentes antidiabéticos disponibles. Con estos aspectos novedosos se incluyen en total 9 características para describir a cada grupo farmacológico: eficacia (reducción de HbA1c esperada), riesgo de hipoglucemia (incluyendo en la valoración la gravedad de las mismas aplicable especialmente a las sulfonilureas), limitación de uso en IR, nefroprotección, efectos en peso corporal, frecuencia de efectos secundarios (con mención de los más característicos de la clase, información ampliable en el texto), efecto demostrado en riesgo cardiovascular, complejidad y coste (teniendo en cuenta los precios en el sistema sanitario español). Cuando una valoración de estas es aplicable exclusivamente a uno o varios miembros concretos de la clase farmacológica, se identifica mediante una llamada en texto. Cada uno de estos elementos tiene un código de color y se describe cuantitativamente mediante una escala con ese color.
La figura 2 del algoritmo detalla las opciones de combinación de las distintas clases farmacológicas. No existe la combinación perfecta ni mucho menos única para todos los pacientes, por lo que en cada caso habrá que valorar cuál es la más adecuada para nuestro paciente. Sí se desaconseja la combinación de iDPP-4 con arGLP-1.
Por último, la figura 3 desarrolla el inicio y ajuste de las terapias inyectables disponibles y su combinación: insulina (basal, rápida y premezclada) y arGLP-1.
Debido a los numerosos estudios de seguridad cardiovascular aún pendientes de resultados y a la incorporación frecuente de nuevos tratamientos, estas recomendaciones serán actualizadas con la regularidad que marquen dichos condicionantes.
FinanciaciónEl Grupo de Trabajo de Consensos y Guías Clínicas de la SED no recibe ningún patrocinio para el desarrollo de su actividad ordinaria y no realiza actividades subvencionadas por la industria farmacéutica. Tampoco ha recibido ninguna financiación para realizar este documento.
Conflicto de interesesLos autores declararan no tener conflictos de intereses en relación con la redacción de este documento.