La identificación oportuna de niños con síndrome metabólico (SM) es la clave para disminuir el riesgo de desarrollar diabetes y enfermedad cardiovascular en la vida adulta, sin embargo, su detección representa un gran reto debido a las diversas definiciones para su diagnóstico dejando excluidos niños con factores de riesgo a los cuales no se les brindarán medidas preventivas. El objetivo es comparar la prevalencia de SM según las definiciones de la IDF, NCEP-ATP-III, Cook, de Ferranti y Weiss e incluir marcadores de resistencia a la insulina (RI) como el HOMA-IR y/o índice metabólico (IM).
MetodologíaEstudio transversal en 508 niños mexicanos de 9 a 13 años. Se registraron medidas somatométricas y evaluaron parámetros bioquímicos y hormonales.
ResultadosLa frecuencia de SM fue de 2,4-45,9% dependiendo de la definición utilizada. La RI en los niños sin diagnóstico de SM fue del 12,4-25,2% con HOMA-IR y 4,0-16,3% con IM. Al incluir el HOMA-IR o IM en cada una de las definiciones la frecuencia de SM fue 8,5-50,2% y 7,7-46,9% respectivamente. El valor de Kappa incluyendo HOMA-IR e IM fue mayor a 0,8.
ConclusionesEste trabajo revela la poca efectividad de las definiciones diagnósticas de SM empleadas actualmente, evidenciada por la variabilidad entre ellas y por la presencia de RI en niños que escapan al diagnóstico de SM. Incluir al HOMA-IR y/o IM en las definiciones, disminuye la probabilidad de excluir niños con SM y aumenta la concordancia entre ellas haciendo posible la comparación de la prevalencia de SM entre las poblaciones.
Early identification of children with metabolic syndrome (MS) is essential to decrease the risk of developing diabetes and cardiovascular disease in adulthood. Detection of MS is however challenging because of the different definitions for diagnosis; as a result, preventive actions are not taken in some children at risk. The study objective was therefore to compare prevalence of MS in children according to the IDF, NCEP-ATP-III, Cook, de Ferranti and Weiss definitions, considering insulin resistance (IR) markers such as HOMA-IR and/or metabolic index (MI).
MethodsA total of 508 Mexican children (aged 9 to 13 years) from seven schools were enrolled in a cross-sectional study. Somatometric, biochemical, and hormonal measurements were evaluated.
ResultsFrequency of MS was 2.4-45.9% depending on the definition used. Frequency of IR in children not diagnosed with MS was 12.4-25.2% using HOMA-IR and 4.0-16.3% using MI. When HOMA-IR or MI was included in each of the definitions, frequency of MS was 8.5-50.2% and 7.7-46.9% respectively. The kappa value including HOMA-IR and/or MI was greater than 0.8.
ConclusionsThis study demonstrated the poor effectiveness of the current criteria used to diagnose MS in Mexican children, as shown by the variability in the definitions and by the presence of IR in children who not diagnosed with MS. Inclusion of HOMA-IR and/or MI in definitions of MS (thus increasing agreement between them) decreases the chance of excluding children at risk and allows for MS prevalence between populations.
El síndrome metabólico (SM) es un problema de salud en la actualidad, cuyas complicaciones principales, la diabetes tipo 2 (DT2) y la enfermedad cardiovascular (ECV) son las dos causas de muerte más frecuentes desde el año 20001. El SM incrementa dos veces el riesgo a desarrollar ECV y cinco veces el riesgo de padecer DT2, se caracteriza por la presencia de al menos tres de cinco factores de riesgo: hipertensión, dislipidemia aterogénica (concentraciones elevadas de triglicéridos, bajas concentraciones de c-HDL), glucosa alterada en ayuno y obesidad abdominal2.
En el caso de la población infantil, es muy importante la identificación oportuna de aquellos niños en riesgo de padecer SM, los cuales tienen mayor susceptibilidad de desarrollar DT2 y ECV con el paso del tiempo. Son relativamente pocos los estudios que han investigado la prevalencia de SM en niños y adolescentes, sin embargo, es evidente que el SM es altamente prevalente en la población pediátrica con obesidad3,4.
En México y en algunos países latinoamericanos como Chile y Brasil se han estudiado poblaciones de niños y adolescentes obesos para investigar la prevalencia de SM y de resistencia a la insulina (RI)5–7. Se ha postulado que la RI y la obesidad abdominal son los factores principales que contribuyen a las manifestaciones del SM, y aunque la obesidad abdominal ha mostrado una mayor fuerza de asociación, muchos de los cambios metabólicos parecen ser desencadenados por la RI, ya que esta produce efectos sobre el metabolismo de lípidos, que se manifiestan a través del aumento plasmático de c-LDL, disminución de c-HDL, aumento de triglicéridos e incremento de ácidos grasos8,9.
El diagnóstico de SM en niños y adolescentes representa una gran dificultad, si se toma en cuenta que los puntos de corte de los diferentes componentes no han sido establecidos puntualmente en México, por lo que el diagnóstico y prevalencia varía de acuerdo a la definición utilizada10. A este respecto se pueden encontrar discrepancias en la prevalencia en una misma muestra poblacional3,4. Así, este trabajo tiene como objetivo la comparación de cinco definiciones: International Diabetes Federation (IDF), National Cholesterol Education Program Adult Treatment Panel III (NCEP-ATP-III), Cook, de Ferranti y Weiss para el diagnóstico de SM en la población infantil mexicana4,10–12. Adicionalmente, tomando en cuenta el papel de la RI en la aparición de DT2 se propone la inclusión de un criterio independiente como el índice HOMA-IR (homeostatic model assessment-insulin resistance) y/o (índice metabólico (IM)13,14.
MétodosEl presente trabajo es un estudio transversal en el que se incluyeron 508 niños mexicanos de 9 a 13 años de siete escuelas primarias. Los criterios de inclusión fueron: niños inscritos en 4.°, 5.° y 6.° año de primaria que contaran con un consentimiento informado firmado por sus padres o tutores, y con un asentimiento verbal por parte de los niños. El proyecto fue aprobado por el Comité de Ética del Hospital Juárez de México de acuerdo a la declaración de Helsinki. Los criterios de exclusión incluyeron: el uso de antihipertensivos, hipoglucemiantes e hipolipemiantes. La evaluación clínica incluyó la medición de parámetros antropométricos: altura, peso, circunferencia de cintura de acuerdo con métodos estandarizados15. El percentil del IMC fue calculado en el Pediatric Z score Calculator (http://stokes.chop.edu/web/zscore/). Para controlar la variabilidad entre observadores, una persona estuvo a cargo de la toma de medidas antropométricas en todos los participantes. La circunferencia de cintura fue tomada en el punto medio entre la décima costilla y las crestas ilíacas, después se transformó a percentiles de acuerdo a tablas para edad y género15. La presión arterial se midió por duplicado después de un periodo de reposo de 10min, el valor fue ajustado a percentiles (https://www.bcm.edu/bodycomplab/Flashapps/BPVAgeChartpage.html). Para las evaluaciones de bioquímicas y hormonales, las muestras de sangre fueron obtenidas después de 8 h de ayuno, se centrifugaron en los primeros 15min después de la toma de muestra y se mantuvieron en refrigeración (2-8°C) hasta su procesamiento. El colesterol total, las lipoproteínas de alta densidad (c-HDL) y baja densidad (c-LDL), triglicéridos y glucosa fueron medidos en el Laboratorio de Endocrinología Molecular del Hospital Juárez de México por métodos comerciales y de acuerdo con las instrucciones del fabricante. Las concentraciones de insulina se determinaron mediante quimioluminiscencia utilizando un kit Immulite 2000 de Seimens® en un equipo Immulite 2000 (Roche®) de acuerdo a las instrucciones del fabricante. Todos los métodos se basan en los criterios establecidos por la National Committee for Clinical Laboratory Standard garantizando la precisión intraanálisis e interanálisis, la sensibilidad de la prueba de insulina es de 0,2uU/mL. Los rangos de referencia pediátricos para niños mexicanos oscilan entre 2 y 15 uU/mL8. El índice HOMA-IR usado para estimar la RI se calculó multiplicando la concentración de insulina (μU/mL) por la concentración de glucosa (mg/dl), y dividiendo el producto por 405. Los valores superiores a 3,4 fueron indicadores de RI14. Otro indicador de RI empleado fue el IM el cual se estimó utilizando las concentraciones de glucosa y triglicéridos: IM= (triglicéridos [mmol/l] x glucosa [mmol/l])/c-HDL2 (mmol/l). Valores superiores a 7,0 se tomaron como indicativos de RI13. Se emplearon cinco definiciones para el diagnóstico de SM: la de la IDF, la NCEP-ATP-III, Cook, Weiss y de Ferranti4,10–12. Se realizó un análisis descriptivo; se determinaron las frecuencias de las cinco definiciones para SM y se establecieron diferencias entre las frecuencias obtenidas y las esperadas con el empleo de Chi cuadrada, se consideraron significativas cuando P≤0,05. El nivel de concordancia entre las cinco clasificaciones diagnósticas de SM se exploró mediante el índice de Kappa, la interpretación de los valores de concordancia entre las definiciones es: <0,2 (pobre), 0,21-0,4 (débil), 0,41-0,6 (moderada), 0,61-0,8 (buena), 0,81-1 (muy buena). Un valor de P <0,05 se consideró estadísticamente significativo. Se empleó el paquete estadístico SPSS versión 20.0.
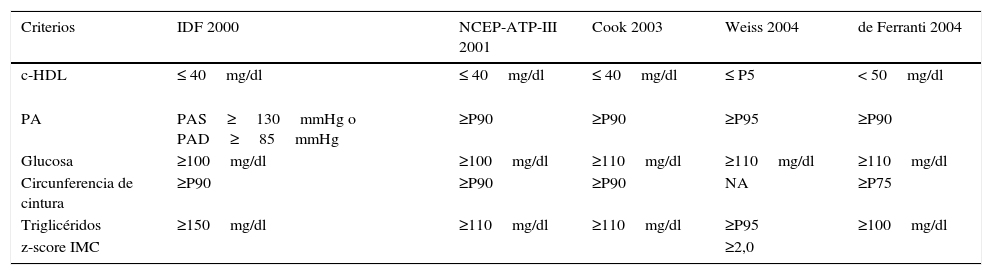
ResultadosEn la tabla 1 se muestran las cinco definiciones que se han empleado para el diagnóstico de SM en población infantil, cuatro de ellas incluyen los mismos criterios (IDF, NCEP-ATP-III, Cook y de Ferranti), sin embargo, es necesario notar que se utilizan diferentes puntos de corte para cada uno de los parámetros estudiados. La definición de Weiss difiere de las restantes debido a que no emplea el percentil de cintura como marcador de obesidad, utilizando para ello el valor de Z-score del IMC.
Criterios y puntos de corte de las cinco definiciones de SM para población infantil
| Criterios | IDF 2000 | NCEP-ATP-III 2001 | Cook 2003 | Weiss 2004 | de Ferranti 2004 |
|---|---|---|---|---|---|
| c-HDL | ≤ 40mg/dl | ≤ 40mg/dl | ≤ 40mg/dl | ≤ P5 | < 50mg/dl |
| PA | PAS≥130mmHg o PAD≥85mmHg | ≥P90 | ≥P90 | ≥P95 | ≥P90 |
| Glucosa | ≥100mg/dl | ≥100mg/dl | ≥110mg/dl | ≥110mg/dl | ≥110mg/dl |
| Circunferencia de cintura | ≥P90 | ≥P90 | ≥P90 | NA | ≥P75 |
| Triglicéridos | ≥150mg/dl | ≥110mg/dl | ≥110mg/dl | ≥P95 | ≥100mg/dl |
| z-score IMC | ≥2,0 |
c-HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; P5: percentil 5; P75: percentil 75; P90: percentil 90; P95: percentil 95; SM: síndrome metabólico.
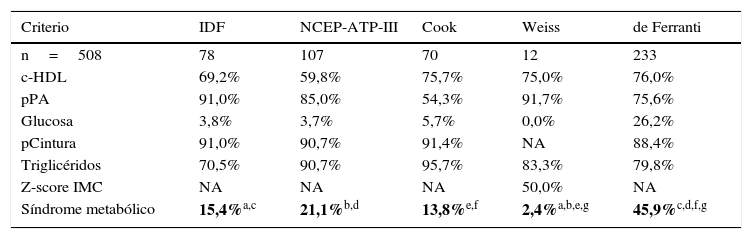
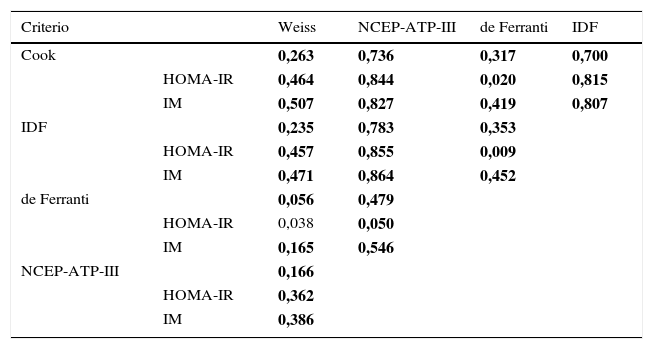
En este estudio se obtuvo una frecuencia de SM del 2,4% al 45,9% la cual depende de los parámetros y puntos de corte de cada una de las cinco definiciones empleadas (tabla 2). Las frecuencias de SM bajo el criterio de Weiss y de Ferranti son estadísticamente diferentes (P=0,005). El análisis de frecuencias de SM entre las definiciones de la IDF, NCEP-ATP-III y Cook no muestra diferencias estadísticas (P=0,55). Es importante destacar que la obesidad central y los triglicéridos elevados son los componentes más frecuentes empleando las definiciones del NCEP-ATP-III, Cook y de Ferranti. El análisis de concordancia entre las definiciones diagnósticas de SM, muestra una estrecha relación entre la definición de Cook con la NCEP-ATP-III e IDF además de la definición de la IDF con la de NCEP-ATP-III (tabla 3), mientras que las definiciones de Weiss y de Ferranti presentan una débil concordancia con el resto de las definiciones empleadas. Cuando se considera el HOMA-IR y/o IM en los criterios de SM, la disparidad entre las definiciones disminuye, existiendo concordancia en más de 0,8 (P=0,0001) entre las definiciones evaluadas a excepción de la definición de Weiss y de Ferranti. De manera inesperada se encontró una mayor concordancia entre las definiciones de SM al incluir al IM.
Prevalencia de SM de acuerdo a las cinco definiciones empleadas
| Criterio | IDF | NCEP-ATP-III | Cook | Weiss | de Ferranti |
|---|---|---|---|---|---|
| n=508 | 78 | 107 | 70 | 12 | 233 |
| c-HDL | 69,2% | 59,8% | 75,7% | 75,0% | 76,0% |
| pPA | 91,0% | 85,0% | 54,3% | 91,7% | 75,6% |
| Glucosa | 3,8% | 3,7% | 5,7% | 0,0% | 26,2% |
| pCintura | 91,0% | 90,7% | 91,4% | NA | 88,4% |
| Triglicéridos | 70,5% | 90,7% | 95,7% | 83,3% | 79,8% |
| Z-score IMC | NA | NA | NA | 50,0% | NA |
| Síndrome metabólico | 15,4%a,c | 21,1%b,d | 13,8%e,f | 2,4%a,b,e,g | 45,9%c,d,f,g |
c-HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal; pCintura: percentil de cintura; pPA: percentil de presión arterial; SM: síndrome metabólico.
Prueba estadística: chi2 P<0.05. En negrita se muestran las diferencias de P < 0.005.
Concordancia de las cinco definiciones empleadas para el diagnóstico de SM
| Criterio | Weiss | NCEP-ATP-III | de Ferranti | IDF | |
|---|---|---|---|---|---|
| Cook | 0,263 | 0,736 | 0,317 | 0,700 | |
| HOMA-IR | 0,464 | 0,844 | 0,020 | 0,815 | |
| IM | 0,507 | 0,827 | 0,419 | 0,807 | |
| IDF | 0,235 | 0,783 | 0,353 | ||
| HOMA-IR | 0,457 | 0,855 | 0,009 | ||
| IM | 0,471 | 0,864 | 0,452 | ||
| de Ferranti | 0,056 | 0,479 | |||
| HOMA-IR | 0,038 | 0,050 | |||
| IM | 0,165 | 0,546 | |||
| NCEP-ATP-III | 0,166 | ||||
| HOMA-IR | 0,362 | ||||
| IM | 0,386 |
IM: índice metabólico; SM: síndrome metabólico.
Interpretación de los valores de concordancia (valor de Kappa): <0,2 (pobre), 0,21-0,4 (débil); 0,41-0,6 (moderada); 0,61-0,8 (buena); 0,81-1 (muy buena). Prueba estadística: Kappa P<0,05, en negrita se muestran las que tuvieron una P <0,0001.
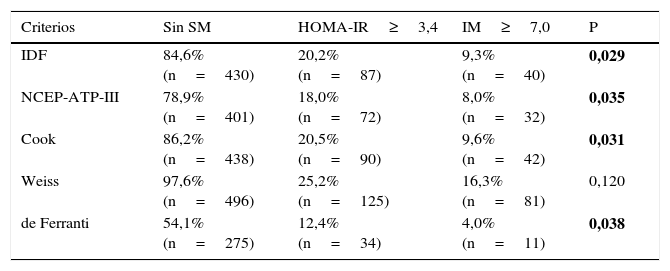
La frecuencia de RI en los 508 niños fue de 25,8% evaluados por HOMA-IR y del 18,3% cuando se utilizó IM, con una concordancia moderada entre el HOMA-IR e IM (P=0,001). Se analizó también si los niños que no fueron diagnosticados con SM en cada una de las definiciones presentaban RI (tabla 4), se observa que existe un porcentaje de niños que presentan RI que va del 12,4-25,2% y del 4,0-16,3% cuando se utiliza HOMA-IR e IM respectivamente, encontrando una frecuencia mayor estadísticamente significativa de RI evaluada por HOMA-IR en los niños que escapan del diagnóstico de SM con las definiciones de la IDF (P=0,029), NCEP-ATP-III (P=0,035), Cook (P=0,031) y de Ferranti (P=0,038) respecto a la RI evaluada por IM.
Frecuencia de niños con RI que no fueron clasificados con SM de acuerdo a las cinco definiciones estudiadas
| Criterios | Sin SM | HOMA-IR≥3,4 | IM≥7,0 | P |
|---|---|---|---|---|
| IDF | 84,6% (n=430) | 20,2% (n=87) | 9,3% (n=40) | 0,029 |
| NCEP-ATP-III | 78,9% (n=401) | 18,0% (n=72) | 8,0% (n=32) | 0,035 |
| Cook | 86,2% (n=438) | 20,5% (n=90) | 9,6% (n=42) | 0,031 |
| Weiss | 97,6% (n=496) | 25,2% (n=125) | 16,3% (n=81) | 0,120 |
| de Ferranti | 54,1% (n=275) | 12,4% (n=34) | 4,0% (n=11) | 0,038 |
HOMA-IR: homeostasis model assessment; IM: índice metabólico; RI: resistencia a la insulina; SM: síndrome metabólico.
Prueba estadística: chi2 P<0,05, en negrita se indican las las diferencias con una P<0,05, comparación de la frecuencia de RI con IM≥7,0 vs. HOMA-IR≥3,4.
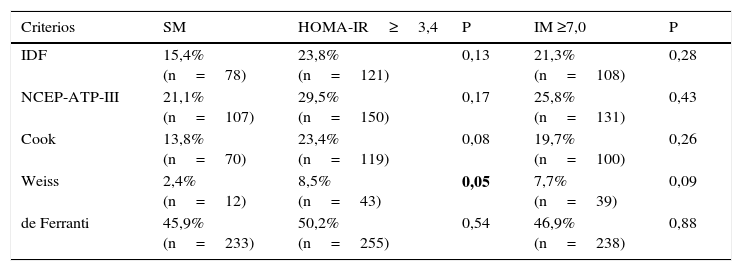
Al incluir la RI estimada por HOMA-IR e IM como un criterio adicional en cada una de las cinco definiciones estudiadas para el SM, se observa un aumento en la frecuencia al considerar ambos parámetros de RI, aunque solo llega a ser estadísticamente significativa cuando se emplea la definición de Weiss con HOMA-IR (P=0,05). De manera interesante al comparar las definiciones con la inclusión de HOMA-IR y/o IM estas presentan una distribución similar, no existiendo diferencias significativas entre las frecuencias encontradas (tabla 5).
Frecuencia de SM de acuerdo a las cinco definiciones empleadas considerando como factor adicional a la RI por HOMA-IR e IM en población infantil
| Criterios | SM | HOMA-IR≥3,4 | P | IM ≥7,0 | P |
|---|---|---|---|---|---|
| IDF | 15,4% (n=78) | 23,8% (n=121) | 0,13 | 21,3% (n=108) | 0,28 |
| NCEP-ATP-III | 21,1% (n=107) | 29,5% (n=150) | 0,17 | 25,8% (n=131) | 0,43 |
| Cook | 13,8% (n=70) | 23,4% (n=119) | 0,08 | 19,7% (n=100) | 0,26 |
| Weiss | 2,4% (n=12) | 8,5% (n=43) | 0,05 | 7,7% (n=39) | 0,09 |
| de Ferranti | 45,9% (n=233) | 50,2% (n=255) | 0,54 | 46,9% (n=238) | 0,88 |
HOMA-IR: homeostasis model assessment; IM: índice metabólico; RI:resistencia a la insulina; SM: síndrome metabólico.
Prueba estadística: chi2 P<0,05, en negrita se indican las las diferencias con una P<0,05, comparación de la frecuencia de SM y la RI (IM≥7,0) vs. SM y la RI (HOMA-IR≥3,4).
La prevalencia de SM en la población pediátrica depende de la definición utilizada para su diagnóstico. Así, las definiciones utilizadas han sido adaptadas de las múltiples que han sido propuestas para adultos por la OMS, NCEP-ATP-III, The European Group for the Study of Insulin Resistance e IDF, y todas ellas coinciden en los componentes esenciales del SM (intolerancia a la glucosa, obesidad central, hipertensión y dislipidemias)4,16,17. En niños y adolescentes se han adaptado más de 40 definiciones para el SM, que difieren tanto en los criterios como en los puntos de corte, las cinco empleadas en este trabajo derivan de las dos más utilizadas en el mundo, IDF y NCEP-ATP-III, adicionalmente las establecidas por Cook y por de Ferranti son resultado de modificaciones realizadas en los puntos de corte de presión arterial, glucosa y percentil de cintura a la del NCEP-ATP-III10,11,18. Por su parte Weiss establece su definición basada en modificaciones del European Group for the Study of Insulin Resistance16,19. En la tabla 1 se observa que Weiss utiliza para el diagnóstico de SM puntos de corte más estrictos, así tomando como ejemplo las concentraciones de c-HDL, establece el punto de corte en el percentil 5, mientras que la definición menos restrictiva, la de de Ferranti establece su punto de corte con base en el percentil 4020.
Actualmente el diagnóstico e interpretación de datos respecto al SM en niños y adolescentes es complejo debido a las diferencias derivadas del empleo de varios criterios para definirlo, dando como resultado una variabilidad muy extensa de la prevalencia del SM entre poblaciones, lo que ocasiona dificultades en el diagnóstico y como consecuencia en la identificación de la población infantil en riesgo a desarrollar de DT2 y ECV21.
Cuatro de las cinco definiciones evaluadas en este estudio coinciden en los componentes individuales pero difieren ampliamente en los puntos de corte que definen el riesgo biológico, los cuales en realidad son resultado de proyecciones estadísticas de los valores del adulto, más que de un efecto biológico22. Esto explica las diferencias encontradas en la prevalencia del SM en población infantil (2,4-45,9%). En la tabla 2 se muestra que la mayor frecuencia de SM se obtuvo con los criterios de de Ferranti (45,9%). Los niños diagnosticados con SM con esta definición presentaron obesidad central (88,4%), concentraciones elevadas de triglicéridos (79,8%) y bajas concentraciones de c-HDL (76,0%), cabe mencionar que las concentraciones elevadas de triglicéridos y bajas de c-HDL son característicos de la población mexicana1, lo cual ocasiona un sesgo en los datos para su análisis. Por otro lado, la prevalencia más baja para SM en el presente trabajo se obtuvo con la definición establecida por Weiss, la cual establece el punto de corte más alto para la concentración de triglicéridos (150mg/dl) que corresponde al percentil 95 en niños de 15 a 19 años20, a pesar de ello, el 83,3% de los niños presentan triglicéridos elevados, un porcentaje mayor al encontrado por la definición de la IDF (70,5%).
Es importante resaltar que Weiss considera el Z-score de IMC ≥ 2,00 como indicador de obesidad, descartando a la obesidad central medida a través del percentil de cintura, no obstante la obesidad central es considerada por la IDF como el criterio principal para el diagnóstico de SM, por el hecho de contribuir con el desarrollo de insulinorresistencia, hiperinsulinemia, alteración de la fibrinólisis y disfunción endotelial, así como su asociación con riesgo cardiovascular23,24. En este estudio el 20,3% de los niños tiene un pIMC≥95, el 34,4% presenta obesidad central (pCintura≥90) pero solo el 16,3% de estos niños es clasificado con SM de acuerdo a la definición de la IDF, estos datos indican que en esta población el SM no está condicionado por la obesidad central estimada por el percentil de cintura.
Por otra parte, la definición establecida por Weiss pondera por igual la presencia de tres de cinco componentes claves del SM relacionados con eventos cardiovasculares, por ello maneja el punto de corte más elevado para presión arterial (p95) a su vez Cook emplea el punto de corte de la ATP-III para presión arterial (p90), captando así en etapas tempranas a los niños que presenten cambios en este parámetro.
La definición de Cook y NCEP-ATP-III son las más similares en los puntos de corte de los parámetros que definen al SM exceptuando las concentraciones de glucosa, sin embargo la frecuencia encontrada difiere sin ser estadísticamente significativa y presentan una concordancia buena (índice Kappa=0,736); cuando se considera el HOMA-IR y el IM la concordancia es muy buena (índice Kappa=0,844 y 0,827 respectivamente). La concordancia entre las diferentes definiciones de SM mejora al emplear el IM, esto es favorable debido a que el IM podría ser un parámetro informativo útil y fácil de calcular. Los resultados para las definiciones de Weiss y de Ferranti muestran una escasa concordancia, evidenciando que una parte de la población puede quedar fuera del diagnóstico de SM presentando un riesgo futuro de padecer DT2 o ECV. Lo anterior plantea la necesidad de una definición que permita diagnosticar con mayor certeza a los niños con SM y que adicionalmente permita comparar los resultados entre las poblaciones.
Considerando que el SM se basa en la aparición de la RI como la condición metabólica central en la etiopatogenia desde lo publicado por Reaven en 1988, en este trabajo se analizaron aquellos niños que no fueron clasificados con SM, encontrando que un porcentaje alto presenta RI, hecho que los coloca en un riesgo potencial de desarrollar DT2 en la vida adulta. Por lo que adicionalmente a los criterios utilizados en cada una de las definiciones de SM se incluyó a la RI (tablas 4 y 5). El estándar de oro para la medición de RI es el CLAMP hiperinsulinémico-euglucémico, pero por ser un procedimiento complejo e invasivo, el CLAMP se empleó para validar y verificar la RI a través del HOMA-IR, que es más sencillo y presenta una correlación significativa con el CLAMP. La medición de la insulina en ayunas puede proporcionar información sobre la hiperinsulinemia compensatoria, aunque en muchos estudios los niveles de glucosa se emplean como sustitutos de la resistencia a la insulina, no es aplicable por que no siempre correlaciona con la resistencia a la insulina en niños.
Hasta el momento no existen estándares para determinar la RI en los niños, existe una variedad de técnicas para medir la sensibilidad a la insulina con una variación de hasta 53 veces en las concentraciones de insulina en ayuno, por lo que no se ha establecido con claridad el mejor método de evaluación de RI y su correlación con los trastornos clínicos y tratamientos. Sin embargo el HOMA-IR sigue mostrando una estrecha correlación con las concentraciones de insulina en ayunas en niños (r ≥ 0,95)25. Por lo anterior en este trabajo la RI se calculó a partir de dos índices: el HOMA-IR y el IM. El HOMA-IR describe la homeostasis entre los niveles de glucosa e insulina, sin embargo, una de las desventajas en el empleo de este índice, es la dificultad en la medición de las concentraciones de insulina por su gran variabilidad biológica, aunado a la selección del punto de corte adecuado, a la edad y género del niño (los puntos de corte van desde 2,16 hasta 3,43). Se empleó un punto de corte estricto para el diagnóstico de RI (HOMA-IR≥3,4)14,26, así el 26% de los 508 niños presenta RI. El otro índice propuesto es el IM, este es un método indirecto, eficaz y económico para evaluar la RI sin necesidad de medir las concentraciones de insulina13,14,26–29. Con un punto de corte (IM>7,0)13 el 18,5% de los 508 niños presenta RI. Es importante enfatizar los resultados de la tabla 4, que muestran la presencia de RI en los niños que no fueron clasificados con SM por alguna de las cinco definiciones empleadas. La frecuencia de RI es superior al 23% con el HOMA-IR y mayor al 7% con el IM. Las frecuencias de SM encontradas en cada una de las definiciones con excepción de la planteada por Weiss, con la inclusión de la RI calculada con HOMA-IR y/o IM muestran diferencias estadísticamente significativas. La definición de de Ferranti al tener puntos de corte más amplios incluye al mayor número de niños con alguna alteración metabólica, los niños que no son clasificados bajo los criterios de de Ferranti con SM presentan solo el 12,4% y 4,0% de RI determinado con el HOMA-IR e IM respectivamente. La definición que capta el menor número de niños con RI es la planteada por Weiss (HOMA-IR 25,2% e IM 16,3%), por otra parte la definición de la IDF que se basa en la presencia de obesidad central por su asociación con RI no considera al 20,2% de los niños con un HOMA-IR elevado (tabla 4).
La frecuencia de RI estimada por IM muestra diferencias significativas con respecto a la obtenida por HOMA-IR en este trabajo, esto puede deberse a que el punto de corte para IM fue establecido para una población de 18 a 65 años13, haciendo evidente la necesidad de establecer puntos de corte para la población infantil, sin embargo, a pesar de ello, el IM es una aproximación que puede ser considerada para identificar niños con RI. La tabla 5 muestra que al incluir un factor que estime la RI (ya sea HOMA-IR o IM) aumenta la posibilidad de captar el mayor número de niños con alteraciones metabólicas, por lo que es importante enfatizar que al considerar en la definición de Weiss al HOMA-IR aumenta significativamente el porcentaje de niños con SM.
Un punto muy importante de mencionar es que los resultados de este estudio muestran que al incluir HOMA-IR o IM a las diferentes definiciones de SM aumenta la concordancia entre ellas (Kappa >0,8), lo que permitirá eliminar la dificultad para establecer el diagnóstico de SM en población infantil. Con respecto al criterio de de Ferranti en este trabajo se observa que por sí solo es el que incluye al mayor número de niños con alteraciones metabólicos, dejando fuera de su definición pocos niños con RI con respecto a las demás definiciones.
Los resultados anteriores demuestran la complejidad de realizar un diagnóstico confiable de SM en la población infantil debido a que los criterios utilizados actualmente no consideran la RI, lo cual deja fuera a un gran porcentaje de niños que en su vida adulta presentarán un riesgo a desarrollar DT2 o ECV. Es importante señalar que a pesar de que existen estudios donde se comparan diferentes definiciones diagnósticas de SM en niños en ninguno de ellos se evaluó el empleo de índices alternos al HOMA-IR para la medición de RI en los niños que no presentaron SM. Cabe mencionar que una limitación del presente estudio es que no fue posible aplicar la prueba de Tanner para evaluar el estado puberal, sin embargo, Hirschler et al.30 no encontraron diferencias significativas entre los grupos con y sin SM y la distribución de los índices de Tanner.
Los resultados de este trabajo muestran que la definición de de Ferranti es la que capta el mayor número de niños con alteraciones metabólicas, sugiriendo que es la más útil para identificar niños con SM con mayor riesgo a desarrollar DT2 y ECV en edad adulta. Adicionalmente revela que la inclusión de HOMA-IR y/o IM a las definiciones de SM elimina las discrepancias entre los criterios, lo que favorecerá la comparación de estudios en las poblaciones sin la necesidad de una definición universal, permitiendo una identificación temprana de los factores de riesgo cardiometabólicos y la prevención de la progresión de SM a diabetes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue realizado bajo el apoyo de la Dirección General de Asuntos del Personal Académico UNAM (Proyectos IN221014 e IN231511).