La desnutrición es un problema médico frecuente de los pacientes oncológicos que impacta de forma negativa en la calidad de vida. El objetivo de este trabajo es analizar y dar respuesta a diferentes cuestiones relacionadas con el manejo nutricional de un paciente oncológico en la práctica clínica. Un grupo multidisciplinar de expertos en Oncología Médica, Endocrinología y Nutrición y Farmacia elaboró una lista de temas relacionados con el estado nutricional del paciente oncológico agrupados en 3 bloques: soporte nutricional, nutrición parenteral (NP) y NP domiciliaria (NPD). Se realizó una revisión de la literatura que incluyó artículos publicados en español, inglés y francés hasta abril de 2017. Este consenso destaca diferentes elementos clave que ayudarán a los médicos a normalizar el manejo del estado nutricional del paciente oncológico en la práctica clínica, estableciendo pautas comunes de indicación, monitorización, requerimientos nutricionales y vías de acceso a la NP.
Malnutrition is a common medical problem in cancer patients with a negative impact on quality of life. The aim of this study was to address different issues related to nutritional management of cancer patients in clinical practice. A multidisciplinary group of experts in Medical Oncology, Pharmacy, and Endocrinology and Nutrition prepared a list of topics related to the nutritional status of cancer patients and grouped them into three blocks: nutritional support, parenteral nutrition (PN), and home PN (HPN). A literature review was made of articles published in Spanish, English and French until April 2017. This consensus emphasizes several key elements that help physicians standardize management of the nutritional status of cancer patients in clinical practice, and establishes common guidelines for indication, monitoring, nutritional requirements, and access routes to PN.
La desnutrición es un hecho relativamente frecuente en los pacientes con cáncer y a menudo afecta significativamente a su calidad de vida. La proporción de pacientes que, en el momento del diagnóstico, presentan pérdida de peso oscila entre un 15 y un 40% en función del tipo de cáncer. Aún más, la incidencia de desnutrición aumenta conforme evoluciona la enfermedad, hasta afectar a un 80% de los pacientes1-3.
La presencia de desnutrición tiene un impacto negativo sobre la evolución de los pacientes con cáncer, aumentando la incidencia de infecciones, la estancia hospitalaria y el riesgo de mortalidad3,4.
Pese a ello, la información centrada en el paciente sobre las recomendaciones nutricionales a implementar es limitada, por lo que siguen existiendo una serie de dudas con relación al manejo nutricional del paciente con cáncer en la práctica clínica habitual.
Con el objetivo de dar respuesta a las preguntas que los oncólogos se plantean a la hora de afrontar el manejo nutricional de los pacientes con cáncer se ha redactado un documento de consenso para proporcionar a los especialistas responsables del manejo nutricional de los pacientes oncológicos un marco de referencia basado en la evidencia científica disponible y la experiencia clínica del grupo.
MetodologíaUn grupo multidisciplinar formado por especialistas de las áreas de Oncología Médica, Endocrinología y Nutrición y Farmacia, trabajando en colaboración, ha elaborado un documento de consenso sobre diferentes aspectos que afectan al estado nutricional y al tratamiento nutricional del paciente oncológico (disponible en http://www.seen.es/herramientasClinicas/guias/seen/guiaSeen.aspx), y aquí se describe un resumen ejecutivo del mismo. Se realizó una revisión de la literatura en la base de datos MEDLINE, a través del proveedor Pubmed, que incluyó los diferentes artículos publicados en español, inglés y francés hasta abril de 2017.
El documento se estructuró como un cuestionario que incluyó aquellas preguntas que, desde el punto de vista de los miembros del panel, podrían generar mayor controversia o duda.
Los diferentes bloques que centraron la atención del panel fueron: [1] el soporte nutricional en el paciente oncológico; [2] la nutrición parenteral (NP) en el paciente oncológico, y la [3] nutrición parenteral domiciliaria (NPD) en el paciente oncológico.
Resultados¿Cuál es la incidencia de malnutrición según los distintos tipos de enfermedad neoplásica y tratamientos oncológicos?La incidencia es variable según el tipo de tumor y estadio. Por tipo de tumor, su prevalencia es de un 86% en cáncer de páncreas, de un 48-61% en linfomas de mal pronóstico y cáncer colorrectal, hasta el 46% en tumores urológicos y pulmonares; y de un 30-40% en linfoma de buen pronóstico, cáncer de mama y sarcomas3-5. Por estadio, la malnutrición está presente hasta en el 15-20% de estadios iniciales, 80% en enfermedad avanzada y 80-90% en pacientes terminales3-5. El estudio español NUPAC6 confirmó un 52% de malnutrición moderada o grave, un 57,7% en cáncer esofágico, un 50% en cáncer gástrico, un 47,1% en cáncer laríngeo y un 17,6% en cáncer de próstata.
El estudio PREDyCES® encontró que la desnutrición repercutía en la estancia hospitalaria y en los costes, con un aumento medio de la estancia de 3-4 días de los pacientes desnutridos en comparación con los bien nutridos y un incremento de los costes asociados a la hospitalización de un 20-25%7.
¿Cómo influye el proceso oncológico en el estado nutricional del paciente?Existen múltiples causas asociadas a la desnutrición en pacientes con cáncer (tabla 1).
Diferentes causas asociadas con la desnutrición en pacientes con cáncer
| Causas asociadas con desnutrición |
|---|
| • El tumor: |
| a. Alteraciones mecánicas y funcionales, especialmente en tumores otorrinolaringológicos y digestivos |
| b. La liberación de hormonas catabólicas, citoquinas y factores movilizadores que favorecen el hipermetabolismo y la caquexia |
| • El paciente: |
| a. Hábitos personales, deterioro físico, anorexia y factores psicológicos |
| • El tratamiento: |
| a. Efectos secundarios de la cirugía, la radioterapia, la quimioterapia y la inmunoterapia. La mucositis, emesis y diarrea dificultan la ingesta y favorecen la malabsorción y pérdida de nutrientes |
| • El equipo sanitario: |
| a. Falta de valoración nutricional, escaso conocimiento y entrenamiento para detectar la desnutrición, retardo en iniciar nutriciones enterales y parenterales adaptadas y adecuadas |
| • Las autoridades sanitarias: |
| a. Ausencia de planificación de profesionales |
| b. Déficit en unidades de nutrición y dietistas en los organigramas de los hospitales y en las unidades multidisciplinares que atienden a pacientes con cáncer en la red pública y que garanticen la adecuada asistencia nutricional en los mismos |
La caquexia asociada al cáncer produce diversas alteraciones8 (tabla 2). La caquexia y la desnutrición tiene un impacto pronóstico negativo y se asocia hasta con el 30% de las muertes por cáncer1-3,9,10. Además, una pérdida de peso mayor del 5% previo al diagnóstico e inicio de tratamiento del cáncer era predictora de mortalidad temprana independientemente del estadio, la histología y el estado general11.
Alteraciones relacionadas con la caquexia asociada al cáncer
| Alteraciones producidas por la caquexia |
|---|
| • Deterioro de la imagen corporal, el estado funcional y la calidad de vida, con mayor riesgo de toxicidad por los tratamientos oncológicos |
| • Pérdida de masa muscular con riesgo de insuficiencia cardiaca, respiratoria y úlceras de decúbito |
| • Retardo en la cicatrización que favorece las fístulas y dehiscencias |
| • Deterioro del sistema inmune, lo que favorece las infecciones y la disminución de las enzimas digestivas con riesgo de malabsorción |
Fuente: adaptado de Tisdale8.
Se recomienda realizar una valoración nutricional en todos los pacientes con cáncer al diagnóstico y durante el tratamiento con el fin de detectar aquellos pacientes malnutridos o en riesgo nutricional y llevar a cabo una intervención precoz dado que el diagnóstico tardío puede dificultar la recuperación y ganancia de peso12.
Las guías de la Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN) publicadas en 201713 recomiendan evaluar periódicamente la ingesta nutricional, los cambios en el peso y el índice de masa corporal (IMC) desde el diagnóstico del cáncer, y repetir la evaluación en función de la estabilidad de la situación clínica.
Existen numerosas herramientas de cribado nutricional, de las cuales las más recomendadas serían: para el paciente hospitalizado, el Nutritional Risk Screening 2002 (NRS 2002); para la población en general, el Malnutrition Universal Screening Tool (MUST); para el paciente anciano, el Mini Nutritional Assessment Short Form (MNA-SF). El Malnutrition Screening Tool (MST) es un método de cribado sencillo y validado para pacientes oncológicos.
La valoración global subjetiva generada por el paciente (VGS-GP) es el método gold standard para evaluar el estado nutricional del paciente oncológico14. Esta clasifica al paciente en A: normonutrido; B: riesgo nutricional o desnutrición moderada, y C: desnutrición grave14.
¿Qué parámetros (clínicos, analíticos y antropométricos) se deben tener en cuenta para valorar el estado nutricional inicial y durante el seguimiento del paciente oncológico?No existe un único parámetro que nos informe sobre el estado nutricional, sino la combinación de varios de ellos (clínicos, analíticos, antropométricos y funcionales).
Las guías ESPEN13 recomiendan una valoración de la ingesta nutricional mediante una encuesta dietética, además de evaluar la masa muscular mediante absorciometría dual de rayosX (DEXA), análisis de bioimpedancia (BIA) o TAC, así como una evaluación del rendimiento físico utilizando diversas escalas como la ECOG, Karnofsky, dinamometría, velocidad de la marcha, etc.13. Con relación a los parámetros analíticos, la guía ESPEN recomienda, para medir la inflamación sistémica, el uso de la proteína C reactiva (PCR) sérica y la albúmina13.
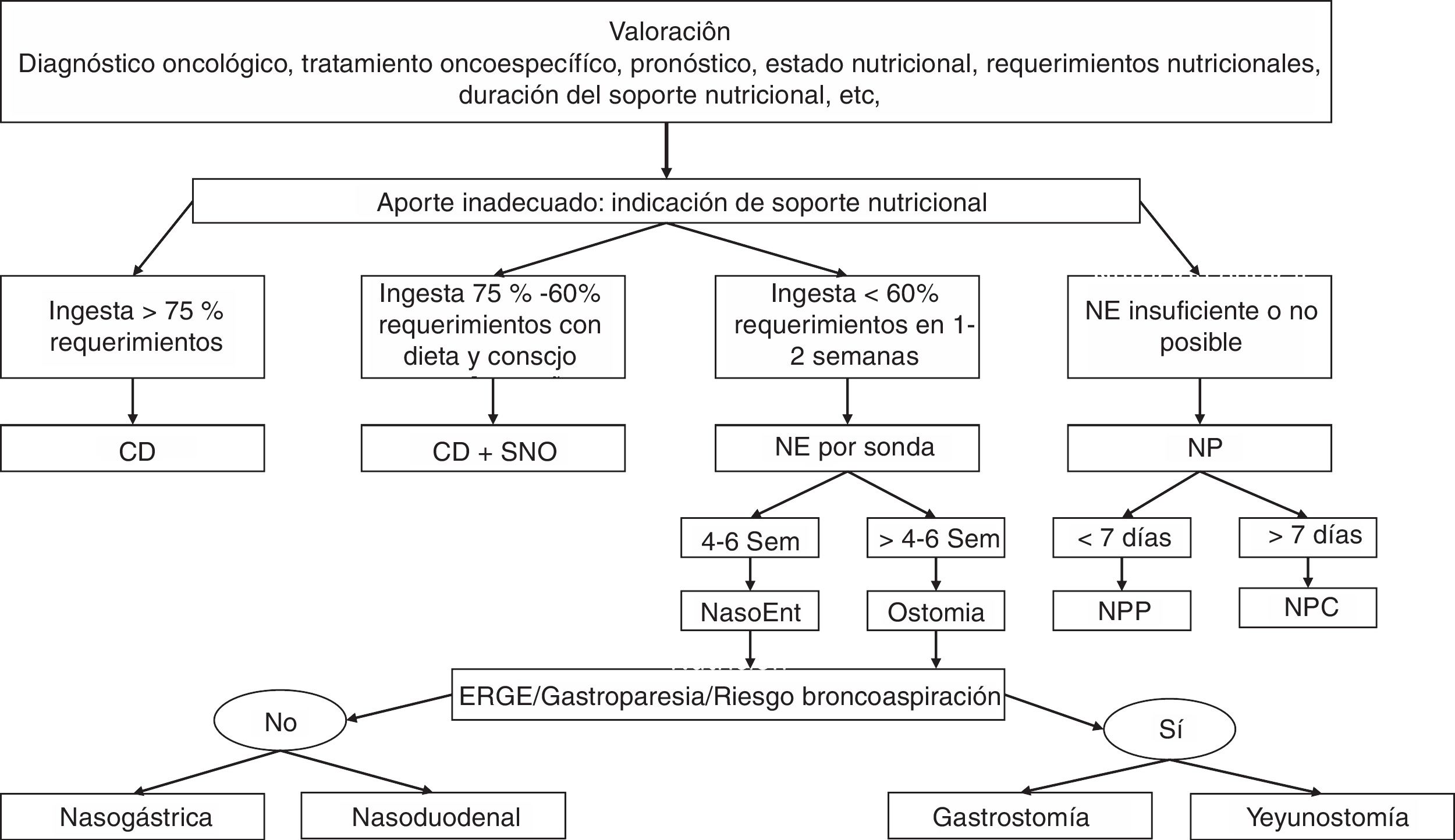
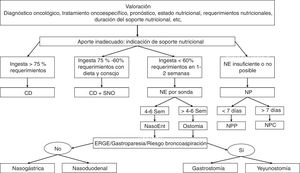
¿Cuáles son los objetivos e indicaciones de los distintos tipos de soporte nutricional especializado en el paciente oncológico?La elección depende de la situación actual del paciente: diagnóstico oncológico, tratamiento oncoespecífico, pronóstico, estado nutricional, requerimientos nutricionales y de la duración del soporte nutricional13,14. El algoritmo de soporte nutricional se muestra en la figura 1.
Algoritmo de soporte nutricional.
CD: consejo dietético; ERGE: enfermedad por reflujo gastroesofágico; NasoEnt: nasoenteral; NE: nutrición enteral; NP: nutrición parenteral; NPC: nutrición parenteral central; NPP: nutrición parenteral periférica; Sem: semana; SNO: suplementos nutricionales orales.
Fuente: adaptado de Hernández et al.42.
Si la ingesta de alimentos por vía oral es insuficiente, se recomienda iniciar nutrición enteral13-15. Si el aporte enteral no es suficiente o posible, se indicará NP13,14.
Se indica soporte nutricional en pacientes con cáncer cuando existe desnutrición, se espera que el paciente no pueda ingerir alimentos durante una semana o más o si su ingesta es inferior al 60% de sus necesidades durante más de 10 días (Grado de recomendación C)13.
¿Cuáles son los requerimientos nutricionales en el paciente oncológico?Los requerimientos energéticos de los pacientes oncológicos, en principio, y si no se realizan medidas individualizadas (calorimetría indirecta), se deben considerar semejantes a los de las personas sanas (25-30kcal/kg/día)13.
En cuanto a los requerimientos proteicos, deberían oscilar entre 1 (mínimo) y 1,2-1,5g/kg/día y en el caso de existir un catabolismo proteico muy elevado podría aumentarse hasta 2g/kg/día13.
La relación entre el gasto energético y los requerimientos nitrogenados se recomienda entre 130-100kcal/gN14,16.
Otro aspecto a tener en cuenta son las necesidades hídricas y de sodio de los pacientes, que deberemos recortar por debajo de la normalidad13.
¿Existen nutrientes específicos que influyen sobre la evolución del proceso oncológico?La glutamina (oral y parenteral) es el aminoácido más investigado en las últimas décadas, pero existe insuficiente consistencia clínica para su recomendación en la prevención de la enteritis y mucositis inducida por la radioterapia o la quimioterapia13,14,16,17.
Otros nutrientes, como los aminoácidos de cadena ramificada, algunos metabolitos de los aminoácidos como el hidroximetilbutirato (HMB), la leucina, la vitamina D o los probióticos han sido estudiados, pero con resultados no concluyentes13,14.
¿Cuándo está indicada una nutrición parenteral en un paciente oncológico?La NP como modalidad de soporte nutricional específico en el paciente oncológico está indicada principalmente cuando no es posible el uso del tubo digestivo y/o la alimentación oral y/o la nutrición enteral no es suficiente o posible13-15,18:
- A.
Por contraindicación de acceso al tubo digestivo.
- B.
Por imposibilidad de acceso al tubo digestivo.
- C.
Por tubo digestivo ineficaz.
- D.
Por bajo aporte oral y/o enteral.
Cuando la supervivencia estimada es superior a 1-3 meses, y en caso de insuficiencia intestinal, se puede ofrecer una NP, en caso de ser las vías oral/enteral insuficientes y existir expectativas de mejoría en la calidad de vida y funcionalidad del paciente y con un deseo expreso de este13.
¿Cuáles son las indicaciones de nutrición parenteral complementaria en el paciente oncológico?La NP complementaria a un soporte oral o enteral insuficiente estaría indicada en aquellos casos en los que se prevea una clara mejoría del estado nutricional o de la calidad de vida del paciente oncológico13,14,19. Se recomienda NP en pacientes con mucositis o enteritis rádica grave a largo plazo (Grado de recomendación C)20.
La composición de la nutrición dependerá de la complementación necesaria en cada paciente13,14.
¿Cuáles son las diferentes vías de administración de la nutrición parenteral en el paciente oncológico?Las vías de administración de NP en el paciente oncológico son las mismas que en el resto de los pacientes (tabla 3).
Diferentes vías de administración de la nutrición parenteral en el paciente oncológico
| Tipos de acceso | Características |
|---|---|
| Acceso periférico | Se utilizará si no se dispone de un acceso central y cuando se prevea una duración a corto plazo (inferior a 7-10 días). Se inserta de manera percutánea vía periférica. Es barato, de sencillo manejo y con poca incidencia de infección asociada a catéter. Los inconvenientes son que la osmolaridad de la mezcla no debe superar los 800mOsm/l y que debe rotarse cada 48-72h por la incidencia de flebitis |
| Acceso central | La elección dependerá del tipo de paciente, del manejo y de la disponibilidad en cada centro. Pueden ser de 4 tipos: |
| Catéter central percutáneo (vía central) | Lo implanta un médico en subclavia, yugular o femoral; es económico y fácilmente sustituible. Solo se usa para soporte parenteral a corto plazo, requiere sutura para su fijación y tiene una alta incidencia de infección asociada a catéter |
| Catéter central insertado vía periférica (PICC) | Tiene la ventaja de que puede ser implantado por diplomados en enfermería. Admite cualquier composición y osmolaridad de la mezcla. Puede ser algo más complicado el manejo para el paciente con acceso cubital en caso de soporte domiciliario |
| Tunelizado tipo Hickman | Lo implantan en subclavia o yugular en quirófano los radiólogos vasculares o cirujanos y se extrae de manera simple. Es preferible el de una sola luz ya que minimiza la posibilidad de infección. Es fácilmente manejable por el paciente en caso de soporte domiciliario, por lo que es el más recomendable en esos casos. Tiene el inconveniente cosmético de que es visible desde el exterior |
| Reservorio o Porth-a-cath | Se compone de un reservorio subcutáneo o puerto que es radiopaco y fabricado generalmente en titanio y de una membrana de silicona autosellante muy resistente. Lo implantan en subclavia o yugular en quirófano los radiólogos vasculares o cirujanos; la imagen corporal no se altera ya que es subcutáneo y además carece de elementos exteriores que puedan dañarse. Es el preferido en los pacientes oncológicos quienes requieren un acceso vascular repetido o continuo para la administración de quimioterapia, sangre o medicamentos. El inconveniente es que para el paciente con soporte domiciliario necesita una aguja especial denominada gripper o hubber que debe cambiarse semanalmente |
Fuente: adaptado de Derenski et al.21.
El seguimiento nutricional del paciente oncológico debe ser multidisciplinar y adaptado a las características de cada centro.
El cribado nutricional debe estar incluido en la rutina de los cuidados del paciente oncológico y debe ser sencillo de realizar por cualquier miembro del equipo terapéutico, ya sea por los diplomados en enfermería o por los médicos13.
El seguimiento del paciente oncológico con NPD también es multidisciplinar.
¿Cuándo está indicada la retirada de una nutrición parenteral en un paciente oncológico?La retirada de la NP deberá atender al alcance de los objetivos planteados en cada caso además de a las siguientes consideraciones:
¿Cuáles son los objetivos de la nutrición parenteral domiciliaria en un paciente oncológico?Los objetivos específicos de la NPD en los pacientes con cáncer son prevenir y tratar la malnutrición y/o la caquexia, mejorar el cumplimiento del tratamiento oncológico programado, reduciendo sus interrupciones, disminuir los efectos adversos del tratamiento y mejorar la calidad de vida de los pacientes (Grado de recomendación C)13,20.
Se recomienda que, además de presentar una estabilidad metabólica, antes del alta hospitalaria los pacientes hayan recibido el entrenamiento adecuado, tengan acceso a recursos materiales seguros necesarios para la NPD, sean capaces física y emocionalmente de manejarla y tengan un entorno adecuado en sus domicilios30,31.
Además, debe haber un equipo multidisciplinar con experiencia en NPD y un equipo médico-enfermero de apoyo a domicilio32.
¿Cuáles son las complicaciones de la nutrición parenteral domiciliaria en el paciente oncológico?Se observan 4 grandes grupos, los cuales incluyen complicaciones mecánicas, infecciosas, metabólicas y psicosociales34,35 (tabla 4).
Complicaciones de la nutrición parenteral domiciliaria (NPD) en el paciente oncológico
| Tipos de complicaciones | |
|---|---|
| Mecánicas | Estas complicaciones están relacionadas con la colocación y sobre todo con el mantenimiento del catéter. En el caso de la NPD, se deben destacar por su frecuencia la oclusión del catéter y la trombosis venosa35 |
| Infecciosas | Son las complicaciones más frecuentemente observadas en los pacientes con NPD, fundamentalmente la bacteriemia y/o sepsis asociada al catéter36 |
| Metabólicas | Pueden manifestarse de forma aguda, como es el caso de la hiperglucemia/hipoglucemia, las alteraciones hidroelectrolíticas y el síndrome de realimentación, o a largo plazo como consecuencia de los efectos de la NPT sobre el hígado y el hueso. La enfermedad hepática se presenta en forma de esteatosis, colestasis intrahepática, barro biliar o colelitiasis. Para prevenir esta complicación, ESPEN recomienda no aportar más de 1g/kg de grasas, ajustar el aporte calórico e infundir la NP de forma cíclica (Grado de recomendación B)37. La enfermedad metabólica ósea se caracteriza por la presencia de osteomalacia, osteoporosis, dolor o fracturas óseas. En esta entidad están implicados factores relacionados con la NP, como son la hipercalciuria, la toxicidad por aluminio, el déficit o toxicidad de vitamina D y la sobrecarga proteica37 |
| Psicosociales | La NPD puede influir en la calidad de vida del paciente38 |
Los pacientes con NPD requieren un seguimiento estrecho e individualizado con el objetivo de evaluar la eficacia y seguridad del tratamiento, así como poder detectar y resolver las complicaciones asociadas a esta modalidad terapéutica39,40.
Este seguimiento será realizado por el equipo de profesionales que hayan indicado la NPD, habitualmente la unidad de nutrición del hospital de referencia, en coordinación con los equipos médicos implicados en el control de la evolución del enfermo41.
¿Qué fuentes de información existen para mejorar el conocimiento de la importancia del soporte nutricional en los pacientes oncológicos?Las fuentes de información son muchas y variadas e incluyen estudios originales, revisiones sistemáticas, etc.
Conflicto de interesesNinguno de los autores tiene conflictos de intereses que declarar.