Estudiar las concentraciones plasmáticas de adiponectina en mujeres con diagnóstico de síndrome de ovario poliquístico (SOPQ) tratadas con suplementación de ácidos grasos omega-3.
Material y métodosSe realizó un estudio en 195 mujeres con diagnóstico de SOPQ que fueron tratadas con ácidos grasos omega-3 durante 12semanas (n=97; grupoA) y controles tratados con placebo (n=98, grupoB). Se compararon las características generales, las concentraciones hormonales, el perfil lipídico y la adiponectina.
ResultadosNo se encontraron diferencias significativas entre ambos grupos con relación a las características generales. Tampoco se encontraron diferencias significativas en las concentraciones hormonales, glucemia y HOMA entre los grupos. Las mujeres de los gruposA yB no mostraron diferencias estadísticamente significativas en la ingesta total, ingesta de hidratos de carbono, proteínas y grasas totales entre los valores al inicio y al final del estudio. Las mujeres del grupoA presentaron disminución en las concentraciones de colesterol total, de lipoproteínas de baja densidad y de triglicéridos (p<0,0001). Los valores promedio de adiponectina también mostraron aumento estadísticamente significativo luego del tratamiento (p<0,0001). No se encontraron diferencias estadísticamente significativas en los valores promedio de las diferentes variables en las mujeres del grupoB.
ConclusiónLa suplementación de ácidos grasos omega-3 durante 12semanas produce aumento significativo en las concentraciones plasmáticas de adiponectina en mujeres con SOPQ.
To study plasma adiponectin levels in women diagnosed with polycystic ovary syndrome given omega-3 fatty acid supplements.
Patients and methodsA study was conducted in 195 women diagnosed with polycystic ovary syndrome treated with omega-3 fatty acids for 12weeks (n=97; groupA) and control women given placebo (n=98, groupB). General characteristics, metabolism, lipid profile, and hormone and adiponectin levels were compared.
ResultsThere were no significant differences between the two groups in general characteristics. No significant differences were also found in hormone, blood glucose, and HOMA levels between the groups. Women in study groupsA andB showed no statistically significant differences in total calorie, carbohydrate, protein, and total fat intake between the baseline and final values. Decreased total cholesterol, low-density lipoprotein, and triglyceride levels were found in groupA women (P<.0001). Mean of adiponectin levels also showed a statistically significant increase after treatment (P<.0001). There were no statistically significant differences in the mean values of the different variables in groupB women.
ConclusionOmega-3 fatty acid supplementation for 12weeks caused a significant increase in plasma adiponectin levels in women with polycystic ovary syndrome.
El síndrome de ovario poliquístico (SOPQ) es un trastorno endocrino-metabólico común en mujeres en edad reproductiva, y se caracteriza por anovulación crónica e hiperandrogenismo. Afecta al 5-10% de las mujeres y es responsable del 50-70% de los casos de infertilidad anovulatoria. Se caracteriza por oligomenorrea o amenorrea e hiperandrogenismo (hallazgos de hirsutismo, acné, aumento de las concentraciones plasmáticas de andrógenos o combinación de estas condiciones)1. Es conocido que la obesidad y la insulinorresistencia aparecen con frecuencia en mujeres con SOPQ, y ambas están relacionadas con los cambios hormonales2,3.
El tejido adiposo es un órgano activo desde el punto de vista endocrino que produce diversos péptidos (entre los que destacan las adipocinas y factores de crecimiento), lípidos y esteroides. Las adipocinas actúan de forma autocrina y paracrina en el tejido adiposo mismo, y de forma endocrina sobre otros órganos o tejidos, como el músculo esquelético, las glándulas suprarrenales y el sistema nervioso central, modulando diferentes funciones, incluida la acción de la insulina4. La hipoadiponectinemia puede estar asociada con la fisiopatología y las complicaciones metabólicas del síndrome5. Varios estudios han demostrado disminución de las concentraciones plasmáticas de adiponectina en mujeres con SOPQ4,5.
En las mujeres con SOPQ, muchos estudios nutricionales se han centrado en los efectos de la restricción energética y la pérdida de peso sobre diferentes parámetros metabólicos y hormonales6. Los ácidos grasos omega-3 tienen acciones contra la obesidad, inflamación e insulinorresistencia7. Estudios experimentales han demostrado una asociación entre su consumo y el aumento de las concentraciones de adiponectina8. Sin embargo, en los humanos los resultados siguen siendo controvertidos en ensayos clínicos realizados con diferentes dosis y duración de la suplementación9.
Existen varios estudios sobre el efecto de los ácidos grasos omega-3 en el estado y el balance metabólico de diversas enfermedades10,11, pero los estudios en mujeres con diagnóstico de SOPQ son escasos. La comprensión de los efectos de los ácidos grasos omega-3 sobre el síndrome y algunas adipocinas, en especial de la adiponectina, puede ser importante para las mujeres. El objetivo de la investigación fue estudiar las concentraciones plasmáticas de adiponectina en mujeres con diagnóstico de SOPQ tratadas con suplementación de ácidos grasos omega-3.
Material y métodosEl presente estudio clínico prospectivo se realizó en mujeres con diagnóstico de SOPQ asistidas en el periodo de enero de 2011 a mayo de 2017. Todas las participantes fueron evaluadas clínicamente (examen general y ginecológico, incluyendo ecografía transvaginal).
El diagnóstico de SOPQ fue realizado en base a los criterios establecidos por el grupo de consenso para su diagnóstico12: oligomenorrea (intervalo mayor o igual a 35días) o amenorrea (ausencia de sangrado vaginal por 6meses), hirsutismo, aumento de la relación hormona luteinizante/hormona foliculoestimulante, concentraciones séricas elevadas de testosterona, presencia de múltiples quistes ováricos (más de 10 quistes pequeños, de 2-8mm de diámetro) dispuestos en forma periférica y dispersos a lo largo del núcleo denso de estroma (apariencia de collar de quistes foliculares) en la ecografía transvaginal, realizada por dos médicos del departamento de diagnóstico por imágenes del hospital e independientes a la investigación. Además de estos hallazgos, también se excluyeron otros síndromes similares, como: disfunción suprarrenal, síndrome de Cushing, hiperplasia suprarrenal congénita, tumores productores de andrógenos, hiperprolactinemia e hipotiroidismo no tratado o patología tiroidea.
Las participantes se excluyeron del estudio si utilizaban anticonceptivos orales, medicamentos antiandrogénicos, sensibilizadores de insulina o cualquier otro medicamento o suplemento que afectara el peso, la sensibilidad a la insulina o la función normal del eje hipotálamo-hipófisis-gonadal durante los 3meses previos al estudio. También fueron excluidas las mujeres con antecedentes de diabetes mellitus, enfermedad renal, hepática y/o gastrointestinal, hábito tabáquico o consumo de más de dos bebidas alcohólicas por semana, así como las que no cumplieron los protocolos del estudio o no podían consumir más del 80% del tratamiento.
Todas las mujeres seleccionadas estuvieron de acuerdo en participar en la investigación y se obtuvo un consentimiento informado por escrito de cada participante. Este protocolo del estudio estaba basado en las normas éticas del Hospital Central «Dr. Urquinaona» – La Universidad del Zulia y la Declaración de Helsinki de 1975, revisada en 2004. El Comité de Ética e Investigación aprobó la realización del estudio.
El tamaño de la muestra se calculó sobre la base de la revisión de investigaciones previas, que demostraron una disminución de alrededor del 20% de las concentraciones de adiponectina después del tratamiento de suplementación con ácidos grasos omega-3. Para alcanzar esta meta, con un alfa de 0,05 y poder del 90%, se consideró necesario incluir 125 participantes en cada grupo para alcanzar resultados similares.
Para la asignación al azar se utilizó una lista de números aleatorios generada por ordenador. Los sobres sellados y numerados fueron guardados por una persona independiente al estudio, que desconocía los objetivos del estudio. Cada sobre contenía la asignación a un grupo: grupoA (casos: suplementación con ácidos grasos omega-3) o grupoB (controles: suplementación con placebo). Cada cápsula de omega-3 contenía 180mg de ácido eicosapentaenoico y 120mg de ácido docosahexaenoico; cada cápsula de placebo contenía 1g de parafina. La apariencia de las cápsulas y envases eran similares. Los registros escritos que presentaban los códigos y el grupo de intervención respectivo fueron abiertos solo después de que se hubieran realizado todos los análisis.
Las participantes de ambos grupos fueron consultadas semanalmente por vía telefónica y asistían a la consulta cada 4semanas. Se les solicitó que mantuvieran sus hábitos habituales de dieta y estilo de vida. Los registros de alimentos consumidos durante 7días se obtuvieron al principio y al final del estudio y fueron analizados por dos nutricionistas que eran parte de la investigación —pero que desconocían a qué grupo pertenecía cada mujer— usando el Programa de Procesamiento de Alimentos y Análisis de Nutrición (Esha Research, EE.UU.).
El peso (kg) se midió dos veces hasta el 0,1kg más cercano, sin zapatos. La talla (m) se midió dos veces hasta 0,5cm más cercano, sin zapatos. El índice de masa corporal fue calculado con la fórmula peso/(talla)2, o kilogramos/metro cuadrado. La circunferencia de la cintura se estimó en la posición de pie en el punto medio entre el borde superior de la cresta ilíaca y el borde inferior de la última costilla a través de la cinta graduada en centímetros. La circunferencia de la cadera se estimó, en la posición de pie, como la mayor distancia entre los trocánteres mayores. La relación cintura-cadera se calculó como la circunferencia de la cintura en centímetros dividida por la circunferencia de la cadera en centímetros.
Las muestras de sangre venosa al inicio y tras 12semanas de tratamiento se tomaron entre las 8:00 y las 11:00h de la mañana, con las participantes en ayunas. Se realizó una prueba estándar de tolerancia oral a la glucosa (75g) y de la respuesta insulínica a esta sobrecarga, tras 10-12h de ayuno, entre las 8:30 y las 10:30h de la mañana. El resultado de la tolerancia a la glucosa se evaluó utilizando los criterios de la Asociación Americana de Diabetes13. Todas las muestras fueron almacenadas a −70°C hasta el momento de la determinación.
Las concentraciones de adiponectina plasmática fueron medidas utilizando una prueba de ELISA disponible comercialmente (B-Bridge International, EE.UU.). Los coeficientes de variación intra- e inter-ensayo fueron del 4,9 y del 6,3%, respectivamente. Todas las hormonas fueron medidas por métodos basados en inmunoanálisis de electroquimioluminiscencia utilizando el autoanalizador Elecsys 2010 (Boehringer Mannheim, Mannheim, Alemania) con reactivos específicos. Los coeficientes de variación intra- e inter-ensayo para cada hormona fueron: hormona foliculoestimulante (1,7 y 4,7%), hormona luteinizante (1,1 y 3,1%), prolactina (2,9 y 4,1%), hormona tiroestimulante (4,2 y 5,2%), Estradiol (2,1 y 4,5%), testosterona (2,4 y 3,8%) e insulina (3,0 y 4,7%) y androstenediona (4,1 y 5,2%), respectivamente. Las concentraciones de sulfato de dehidroepiandrosterona (coeficientes de variación intra- e inter-ensayo: 7,5 y 5,5%, respectivamente) y androstenediona (coeficientes de variación intra- e inter-ensayo: 6,8 y 7,2%, respectivamente) fueron medidas con pruebas de inmunoanálisis enzimático (Diagnostic Systems Laboratories, EE.UU.). La 17-hidroxiprogesterona fue medida utilizando una prueba de anticuerpo doble (ICN Pharmaceuticals, EE.UU; coeficientes de variación intra- e inter-ensayo: 5,1 y 7,6%, respectivamente).
Las concentraciones de glucosa se determinaron por método enzimático. Las mediciones se realizaron utilizando autoanalizador (Hitachi 912, Boehringer Mannheim, Alemania) con reactivos específicos. La resistencia a la insulina en estado de ayuno fue evaluada utilizando el modelo de homeostasis (HOMA-IR) y se calculó con la siguiente fórmula: (insulina x glucosa)/22,5. La insulina se midió en μU/ml y la glucosa en mmol/L14. Las puntuaciones de HOMA-IR por encima de 3,5 fueron interpretadas como insulinorresistencia. El área bajo la curva de insulina y glucemia se calculó de acuerdo a la fórmula que le corresponde a cada figura geométrica, que representa el incremento de las concentraciones plasmáticas posprandiales por encima de las concentraciones basales15.
Las concentraciones séricas de colesterol total (CT), de colesterol ligado a lipoproteínas de alta densidad (cHDL), de colesterol ligado a lipoproteínas de baja densidad (cLDL) y de triglicéridos (TG) fueron medidas utilizando el analizador automático Abbott Aeroset (Abbott Diagnostics, EE.UU.). Los valores de apolipoproteínaA (Apo-A) y apolipoproteínaB (Apo-B) fueron determinadas por ensayo nefelométrico utilizando un equipo Array 360 (Beckman Coulter, EE.UU.). El coeficiente de variación intra-ensayo e inter-ensayo para todas las pruebas fue menor del 10%.
Las variables se presentan como promedio ± desviación estándar. Después de la confirmación de la distribución normal utilizando la prueba de Kolmogorov-Smirnov, se utilizó la prueba t para muestras relacionadas para comparar los valores antes y después del tratamiento en ambos grupos de mujeres. Se utilizó la prueba de Pearson para correlacionar los valores de adiponectina con los valores de las diferentes variables de laboratorio en cada uno de los periodos de estudio. El porcentaje de cambios en las variables después de la intervención se determinó mediante la fórmula: [(valores finales − valores iniciales) / valores iniciales] ×100. Todos los análisis se realizaron utilizando el paquete estadístico para las ciencias sociales SPSS, versión 19.0 (SPSS Inc., EE.UU.). La significación estadística se estableció en p<0,05.
ResultadosSe seleccionaron 250 mujeres con diagnóstico de SOPQ. Se excluyeron 55 participantes del análisis final (28 en el grupoA y 27 en el grupoB) debido a que no completaron la etapa de seguimiento en la investigación, dejaron de tomar las cápsulas y/o no se logró realizar todas las determinaciones de las variables en estudio. Por tanto, las mujeres incluidas en el análisis final fueron 195: 97 tratadas con ácidos grasos omega-3 durante 12semanas (grupoA) y 98 controles (grupoB). La edad promedio fue 23,5±3,6años, el índice de masa corporal de 26,2±2,9kg/m2 y la relación cintura/cadera de 0,80±0,06.
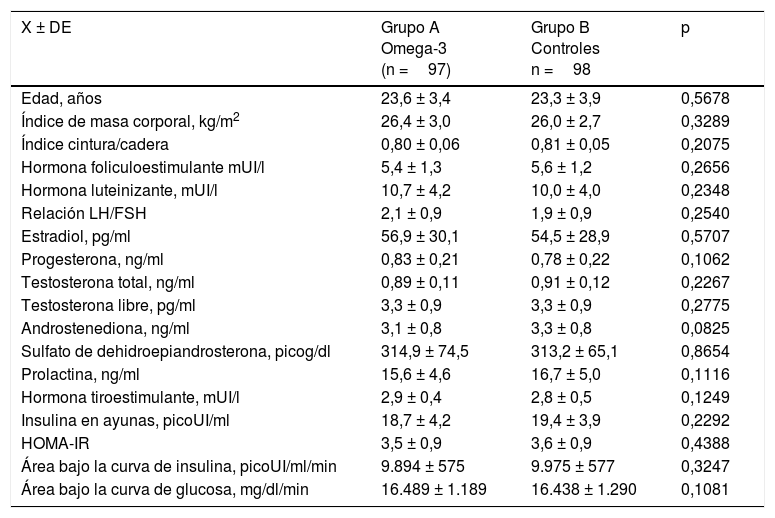
Las características generales de cada grupo de estudio se presentan en la tabla 1. No se encontraron diferencias estadísticamente significativas entre ambos grupos de mujeres con relación a la edad, el índice de masa corporal y la relación cintura/cadera. Tampoco se encontraron diferencias significativas en las concentraciones de hormonas sexuales, hormonas tiroideas y prolactina entre las participantes de los gruposA yB. De igual forma, no se observaron diferencias significativas entre ambos grupos de estudio en las concentraciones de insulina en ayunas, HOMA-IR, área bajo la curva de insulina y glucosa.
Características generales de cada grupo
| X ± DE | Grupo A Omega-3 (n =97) | Grupo B Controles n =98 | p |
|---|---|---|---|
| Edad, años | 23,6 ± 3,4 | 23,3 ± 3,9 | 0,5678 |
| Índice de masa corporal, kg/m2 | 26,4 ± 3,0 | 26,0 ± 2,7 | 0,3289 |
| Índice cintura/cadera | 0,80 ± 0,06 | 0,81 ± 0,05 | 0,2075 |
| Hormona foliculoestimulante mUI/l | 5,4 ± 1,3 | 5,6 ± 1,2 | 0,2656 |
| Hormona luteinizante, mUI/l | 10,7 ± 4,2 | 10,0 ± 4,0 | 0,2348 |
| Relación LH/FSH | 2,1 ± 0,9 | 1,9 ± 0,9 | 0,2540 |
| Estradiol, pg/ml | 56,9 ± 30,1 | 54,5 ± 28,9 | 0,5707 |
| Progesterona, ng/ml | 0,83 ± 0,21 | 0,78 ± 0,22 | 0,1062 |
| Testosterona total, ng/ml | 0,89 ± 0,11 | 0,91 ± 0,12 | 0,2267 |
| Testosterona libre, pg/ml | 3,3 ± 0,9 | 3,3 ± 0,9 | 0,2775 |
| Androstenediona, ng/ml | 3,1 ± 0,8 | 3,3 ± 0,8 | 0,0825 |
| Sulfato de dehidroepiandrosterona, picog/dl | 314,9 ± 74,5 | 313,2 ± 65,1 | 0,8654 |
| Prolactina, ng/ml | 15,6 ± 4,6 | 16,7 ± 5,0 | 0,1116 |
| Hormona tiroestimulante, mUI/l | 2,9 ± 0,4 | 2,8 ± 0,5 | 0,1249 |
| Insulina en ayunas, picoUI/ml | 18,7 ± 4,2 | 19,4 ± 3,9 | 0,2292 |
| HOMA-IR | 3,5 ± 0,9 | 3,6 ± 0,9 | 0,4388 |
| Área bajo la curva de insulina, picoUI/ml/min | 9.894 ± 575 | 9.975 ± 577 | 0,3247 |
| Área bajo la curva de glucosa, mg/dl/min | 16.489 ± 1.189 | 16.438 ± 1.290 | 0,1081 |
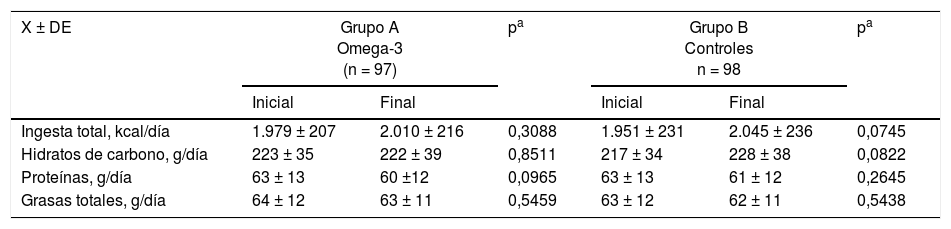
En la tabla 2 se muestran los valores de la ingesta dietética en ambos grupos al inicio y al final del estudio. Las mujeres del grupo A y B no mostraron diferencias estadísticamente significativas en la ingesta total, ingesta total de hidratos de carbono, proteínas y grasas totales entre los valores al inicio y al final del estudio. Tampoco se observaron diferencias estadísticamente significativas en ninguna de las variables estudiadas entre los dos grupos de ingesta dietética al final del estudio.
Ingesta dietética de cada grupo al incido y al final del estudio
| X ± DE | Grupo A Omega-3 (n = 97) | pa | Grupo B Controles n = 98 | pa | ||
|---|---|---|---|---|---|---|
| Inicial | Final | Inicial | Final | |||
| Ingesta total, kcal/día | 1.979 ± 207 | 2.010 ± 216 | 0,3088 | 1.951 ± 231 | 2.045 ± 236 | 0,0745 |
| Hidratos de carbono, g/día | 223 ± 35 | 222 ± 39 | 0,8511 | 217 ± 34 | 228 ± 38 | 0,0822 |
| Proteínas, g/día | 63 ± 13 | 60 ±12 | 0,0965 | 63 ± 13 | 61 ± 12 | 0,2645 |
| Grasas totales, g/día | 64 ± 12 | 63 ± 11 | 0,5459 | 63 ± 12 | 62 ± 11 | 0,5438 |
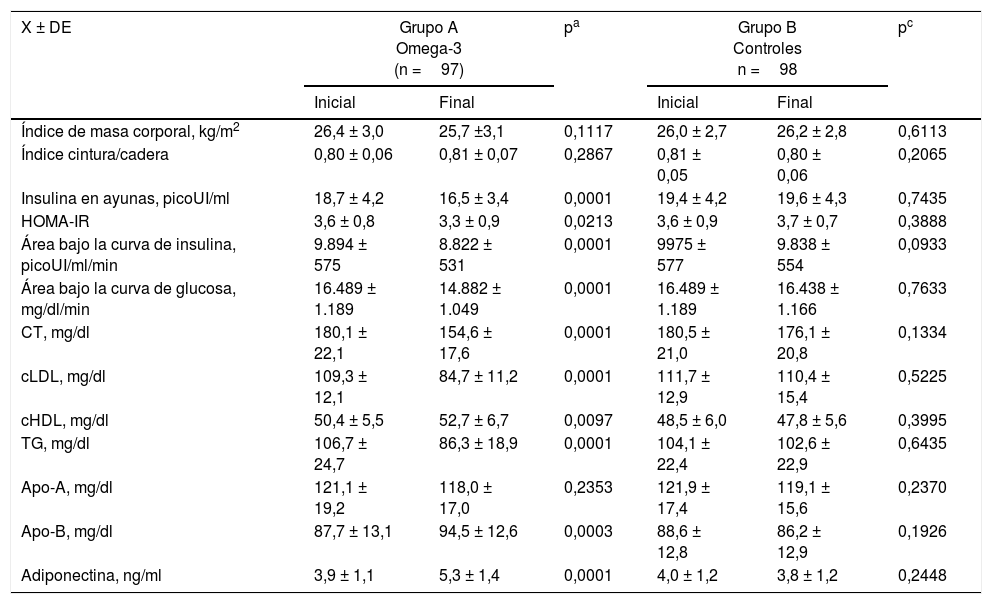
Con relación a las variables de insulinorresistencia, perfil lipídico y adiponectina (tabla 3), se observó que las mujeres tratadas con ácidos grasos omega-3 durante 12semanas presentaron disminución en los valores de insulina en ayunas (aproximadamente del 12%), HOMA-IR (superior al 8%), área bajo la curva de insulina (aproximadamente del 10%) y área bajo la curva de glucosa (superior al 10%). Todas estas diferencias fueron consideradas estadísticamente significativas (p<0,05). Las pacientes del grupoA también presentaron disminución de aproximadamente el 15% en las concentraciones de CT (p<0,0001). Esto se acompañó de una reducción del 23% en las concentraciones de cLDL (p<0,0001) y del 25% de las concentraciones de TG (p<0,0001). También se observó aumento significativo del 4% en las concentraciones de cHDL (p<0,0097) y del 7% en las concentraciones de Apo-B (p<0,0001). Las concentraciones de Apo-A no mostraron modificaciones significativas en sus valores (p=0,2353). Los valores promedio de adiponectina final mostraron un aumento estadísticamente significativo aproximado del 35% comparado con los valores iniciales (5,3±1,4ng/ml final comparado con 3,9±1,1ng/ml final; p<0,0001). No se encontraron diferencias estadísticamente significativas en los valores promedio de las diferentes variables en las mujeres del grupo control.
Parámetros clínicos y de laboratorio en cada grupo de pacientes al inicio y al final del estudio
| X ± DE | Grupo A Omega-3 (n =97) | pa | Grupo B Controles n =98 | pc | ||
|---|---|---|---|---|---|---|
| Inicial | Final | Inicial | Final | |||
| Índice de masa corporal, kg/m2 | 26,4 ± 3,0 | 25,7 ±3,1 | 0,1117 | 26,0 ± 2,7 | 26,2 ± 2,8 | 0,6113 |
| Índice cintura/cadera | 0,80 ± 0,06 | 0,81 ± 0,07 | 0,2867 | 0,81 ± 0,05 | 0,80 ± 0,06 | 0,2065 |
| Insulina en ayunas, picoUI/ml | 18,7 ± 4,2 | 16,5 ± 3,4 | 0,0001 | 19,4 ± 4,2 | 19,6 ± 4,3 | 0,7435 |
| HOMA-IR | 3,6 ± 0,8 | 3,3 ± 0,9 | 0,0213 | 3,6 ± 0,9 | 3,7 ± 0,7 | 0,3888 |
| Área bajo la curva de insulina, picoUI/ml/min | 9.894 ± 575 | 8.822 ± 531 | 0,0001 | 9975 ± 577 | 9.838 ± 554 | 0,0933 |
| Área bajo la curva de glucosa, mg/dl/min | 16.489 ± 1.189 | 14.882 ± 1.049 | 0,0001 | 16.489 ± 1.189 | 16.438 ± 1.166 | 0,7633 |
| CT, mg/dl | 180,1 ± 22,1 | 154,6 ± 17,6 | 0,0001 | 180,5 ± 21,0 | 176,1 ± 20,8 | 0,1334 |
| cLDL, mg/dl | 109,3 ± 12,1 | 84,7 ± 11,2 | 0,0001 | 111,7 ± 12,9 | 110,4 ± 15,4 | 0,5225 |
| cHDL, mg/dl | 50,4 ± 5,5 | 52,7 ± 6,7 | 0,0097 | 48,5 ± 6,0 | 47,8 ± 5,6 | 0,3995 |
| TG, mg/dl | 106,7 ± 24,7 | 86,3 ± 18,9 | 0,0001 | 104,1 ± 22,4 | 102,6 ± 22,9 | 0,6435 |
| Apo-A, mg/dl | 121,1 ± 19,2 | 118,0 ± 17,0 | 0,2353 | 121,9 ± 17,4 | 119,1 ± 15,6 | 0,2370 |
| Apo-B, mg/dl | 87,7 ± 13,1 | 94,5 ± 12,6 | 0,0003 | 88,6 ± 12,8 | 86,2 ± 12,9 | 0,1926 |
| Adiponectina, ng/ml | 3,9 ± 1,1 | 5,3 ± 1,4 | 0,0001 | 4,0 ± 1,2 | 3,8 ± 1,2 | 0,2448 |
Apo-A: apolipoproteína; Apo-B: apolipoproteína B; cHDL: lipoproteínas de alta densidad; cLDL: lipoproteínas de baja densidad; CT: colesterol total; TG: triglicéridos.
En las pacientes del grupo A se observó que las concentraciones de adiponectina antes del tratamiento se correlacionaban en forma significativa (p<0,05) con los valores de área bajo la curva de insulina (r=−0,245), mientras que las concentraciones tras el tratamiento se correlacionaron solo con los valores de TG (r=−0,340).
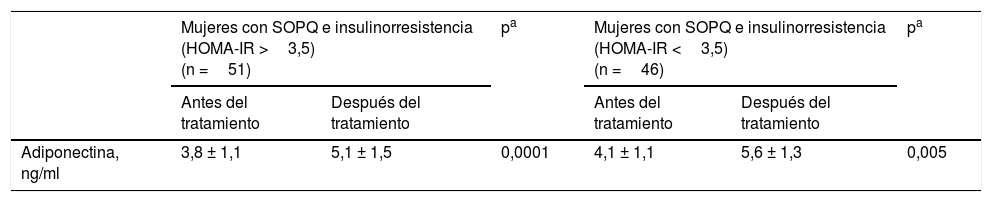
En la tabla 4 se muestran las concentraciones de adiponectina antes y después del tratamiento en las pacientes del grupoA estratificadas según la presencia de insulinorresistencia (valor de HOMA-IR mayor de 3,5). Se observó que las mujeres con insulinorresistencia presentaban un aumento significativo (34%) en las concentraciones finales de adiponectina al compararlas con los valores iniciales (5,1±1,5ng/ml comparado con 3,8±1,1ng/ml; p<0,0001). En el grupo de mujeres sin insulinorresistencia también se observó un aumento significativo (36%) en las concentraciones finales de adiponectina al compararlas con los valores iniciales (5,6±1,3ng/ml comparado con 4,1±1,1ng/ml; p=0,005). Al comparar las concentraciones iniciales y finales en ambos grupos de mujeres no se encontraron diferencias estadísticamente significativas.
Adiponectina plasmática según insulinorresistencia en las mujeres del grupo A al inicio y al final del tratamiento con ácidos grasos omega-3
La evidencia indica que el SOPQ contribuye al desarrollo de un ambiente pro-inflamatorio que se correlaciona con las variaciones de las concentraciones plasmáticas de varias adipocinas16. La adiponectina es conocida por sus importantes efectos antiinflamatorios, de protección vascular, antidiabéticos y cardioprotectores4. El propósito de esta investigación fue comparar los cambios en las concentraciones de adiponectina en las mujeres con SOPQ tratadas con suplementación de ácidos grasos omega-3. Cuando se comparó a las mujeres con SOPQ que recibieron suplementación con ácidos grasos omega-3 se observó un aumento significativo de las concentraciones después de 12semanas de uso.
Diferentes investigaciones clínicas y experimentales han sido realizadas en sujetos sanos y con diferentes tipos de patologías para estudiar los potenciales efectos de la suplementación de ácidos grasos omega-3 en las concentraciones de adiponectina. En una de ellas se demostró que el consumo de aceite de pescado durante 8semanas aumentó las concentraciones de adiponectina en sujetos jóvenes no obesos17. De igual forma, dos estudios —uno de ellos realizado en sujetos obesos8 y otro en mujeres con hiperinsulinemia y sobrepeso18— demostraron que la suplementación con ácidos grasos poliinsaturados aumentaba las concentraciones de adiponectina. Estudios en animales han demostrado que la dieta con aceite de pescado se asoció con concentraciones más elevadas de adiponectina19. Sin embargo, otras investigaciones previas no lograron demostrar modificaciones en las concentraciones de adiponectina tras la suplementación ácidos grasos omega-320, lo cual podría deberse al estado metabólico de los sujetos seleccionados o a diferencias en los diseños entre los estudio.
El incremento de las concentraciones plasmáticas de adiponectina observado en esta investigación en mujeres con SOPQ tras la suplementación durante 12semanas de ácidos grasos omega-3 fue similar a lo reportado por Mohammadi et al.21, quienes observaron un aumento de las concentraciones de adiponectina luego del tratamiento con omega-3 durante 8semanas. Este aumento se acompañó de efectos benéficos en la insulinorresistencia, sugiriendo que esto contribuiría en el control metabólico de estas mujeres. Sin embargo, otra investigación previa reportó la ausencia de modificaciones significativas en las concentraciones plasmáticas de adiponectina en mujeres con diagnóstico de SOPQ luego de 6semanas de suplementación con aceite de pescado22.
En esta investigación, la suplementación con ácidos grasos omega-3 causó reducciones significativas en las concentraciones de CT, TG, cLDL y Apo-B, junto con aumento en las concentraciones de cLDL. Esto es similar a las observaciones previas de disminuciones significativas en las concentraciones de TG en las mujeres con SOPQ que recibieron suplementación con aceite de pescado, si bien esos estudios no demostraron cambios significativos en las concentraciones séricas de CT, cLDL y cHDL23. En forma adicional, la disminución de las concentraciones de TG ha sido reportada por otras investigaciones24. Un estudio previo demostró que la suplementación de ácidos grasos omega-3 produjo disminución significativa de las concentraciones de TG, junto con aumento de los valores de cHDL25. El efecto de la suplementación de ácidos grasos omega-3 sobre las concentraciones de TG es dependiente de la dosis que se utiliza24. Es posible que la dosis y la duración de la suplementación de omega-3 fueran suficientes para producir las mejoras significativas observadas después de la intervención en este grupo de mujeres.
Las mujeres con SOPQ tratadas con ácidos grasos omega-3 no mostraron diferencias significativas en los valores de índice de masa corporal en comparación con los valores iniciales; este hallazgo fue similar al de un estudio previo que señaló los escasos efectos de esta suplementación sobre el perfil antropométrico de los sujetos26. Esto es un hallazgo importante, ya que no se encontraron diferencias en la dieta durante el estudio en concordancia con lo descrito previamente por Mohammadi et al.21, quienes no encontraron cambios en el peso de las mujeres luego de la suplementación durante 8semanas. Por otra parte, otros estudios demostraron disminución del índice de masa corporal después de 8semanas de suplementación con ácidos grasos omega-3 en mujeres con diabetes no insulinodependiente22, y disminución de peso en ratones27. Otros estudios sugieren que la suplementación tiene este efecto particularmente cuando es complementaria a otros tratamientos para la pérdida del peso, pero estos resultados con contradictorios28. La obesidad y sus comorbilidades (diabetes, cáncer y enfermedades cardiacas) están relacionadas con la inflamación, y los ácidos grasos omega-3 tienen propiedades antiinflamatorias.
La posible explicación de los resultados de esta investigación es que los ácidos grasos omega-3 son ligandos naturales para 4 receptores nucleares metabólicos: el receptor activado por proliferador de peroxisoma γ, el receptor hepáticoX, el factor nuclear de hepatocitos-4α y el receptor de farnesolX. La activación de estos receptores disminuye la regulación de genes que codifican proteínas que estimulan la síntesis de lípidos y regulan los genes que mejoran la oxidación de ácidos grasos en el hígado y el músculo29. Además, algunos efectos positivos sobre el perfil lipídico son mediados por la mejora de la proteína cinasa activada por AMP, un importante sensor de estado de energía celular que regula la partición entre la oxidación de lípidos y lipogénesis27. Uno de los principales efectos descritos de la suplementación de ácidos grasos omega-3 es que estimulan la activación del gen de la adiponectina en las células adiposas, probablemente actuando a través de ligandos del proliferador de peroxisoma γ, un regulador transcripcional que interactúa sobre el promotor del gen30.
Este estudio presenta varias limitaciones. La presente investigación fue realizada en mujeres con diagnóstico de SOPQ con peso normal. Esto puede llevar a sub- o sobre-estimación de los cambios en las concentraciones plasmáticas de adiponectina; debido a que los efectos de los ácidos grasos omega-3 son dependientes de la dosis, pueden no ser aplicables a mujeres con obesidad o sobrepeso, a otros tipos de suplementos o a diferentes periodos de suplementación. En este estudio solo se midieron las concentraciones totales de adiponectina y no las de adiponectina de alto peso molecular (la cual es más activa y está relacionada a la sensibilidad a la insulina). Finalmente, aunque se evaluó la ingesta calórica en las mujeres, no se evaluaron los cambios de la actividad física en las participantes durante la duración del estudio.
Sobre la base de los hallazgos de esta investigación se puede concluir que la suplementación de ácidos grasos omega-3 durante 12semanas produce aumento significativo en las concentraciones plasmáticas de adiponectina en mujeres con SOPQ. Esta modulación de la secreción de adiponectina, directamente relacionada con la regulación del metabolismo y la insulinorresistencia, podría implicar un efecto beneficioso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses