Establecer si determinados parámetros de variabilidad glucémica (VG) al diagnóstico de diabetes mellitus gestacional (DMG) podrían ayudar a predecir la probabilidad de precisar tratamiento farmacológico y analizar su relación con el desarrollo de complicaciones materno-fetales.
MétodosEstudio prospectivo en 87 mujeres con DMG a las que se realizó una monitorización continua de glucosa (MCG) retrospectiva entre las semanas 26 y 32 de gestación durante 6 días, tras el diagnóstico. Se analizan glucemia media y parámetros de VG y su asociación con complicaciones materno-fetales y necesidad de tratamiento farmacológico. Se elaboran curvas ROC para estimar la validez para detectar la necesidad de tratamiento farmacológico.
ResultadosLas pacientes con glucemia media más elevada (p<0,001) y solapamiento continuo de la acción de la glucosa en un periodo de n horas (CONGA) (p=0,001) precisaron tratamiento farmacológico. A partir de las curvas ROC se obtuvieron los puntos de corte de 98,81mg/dl para glucemia media y de 86,70mg/dl para CONGA, con una sensibilidad del 83,3% y una especificidad del 67,8% para ambos parámetros. No se observó una relación entre los distintos parámetros de VG y el desarrollo de complicaciones materno-fetales.
ConclusionesEl uso de la MCG al diagnóstico de la DMG permite identificar a aquellas pacientes que se beneficiarían de una vigilancia más estrecha durante la gestación, lo que facilita el inicio de un tratamiento farmacológico precoz. No obstante, son necesarios estudios prospectivos con un mayor número de pacientes y que evalúen los costes asociados para poder recomendar el uso de la MCG tras el diagnóstico de DMG.
To establish whether glycemic variability (GV) parameters used when gestational diabetes mellitus (GDM) has been diagnosed could help predict the probability that a patient will need pharmacological treatment, and to analyze the link of these parameters to the development of maternal-fetal complications.
Materials and methodsA prospective study of 87 women with GDM who underwent retrospective continuous glucose monitoring (CGM) for 6days between weeks 26 and 32 of gestation, following diagnosis. The mean glycemia levels and GV variables were analyzed together with their link to maternal-fetal complications, and the need for pharmacological treatment. ROC (receiver operating characteristic) curves were developed to determine validity to detect the need for pharmacological treatment.
ResultsPatients with higher mean glycemia (P<0.001) and continuous overlapping of net glycemic action in a period of n-hours (CONGAn) (P=0.001) required pharmacological treatment. The ROC curves showed cut-off points of 98.81mg/dl for mean glycemia, and 86.70mg/dl for CONGAn, with 83.3% sensitivity and 67.8% specificity for both parameters. No relation between the GV parameters and development of maternal-fetal complications was observed.
ConclusionsThe use of CGM, once GDM is diagnosed, enables us to identify those patients who would benefit from closer monitoring during gestation, and facilitate a speedier take-up of pharmacological treatment. However, prospective studies involving a higher number of patients are needed, as well as a cost assessment for recommending the use of CGM following GDM diagnosis.
La diabetes mellitus gestacional (DMG) se define como aquella intolerancia a los hidratos de carbono diagnosticada durante el segundo o tercer trimestre de embarazo, sin evidencia clara de diabetes mellitus previa1. Tiene una prevalencia aproximada del 8,8% de todas las gestaciones (1-12%)2. La hiperglucemia durante el embarazo está relacionada con un mayor riesgo de complicaciones maternas (hipertensión inducida por el embarazo, preeclampsia, muerte fetal intrauterina, parto mediante cesárea) y fetales (hipoglucemia, hiperbilirrubinemia, macrosomía, traumatismos obstétricos)3. Además, implica un mayor riesgo de desarrollar diabetes mellitus de tipo 2 y síndrome metabólico, con un incremento de incidencia de enfermedades cardiovasculares4,5.
El tratamiento de la DMG tiene como objetivo mantener los niveles de glucemia dentro de un rango muy estrecho, similar al de una gestante sin diabetes. Incluye, en primer lugar, la adopción de medidas higiénico-dietéticas y, cuando estas fracasan, de tratamiento farmacológico6.
En la práctica clínica habitual, la medición de glucosa se realiza mediante la automonitorización de glucemia capilar (AMGC). Sin embargo, hoy día disponemos de sistemas de monitorización continua de glucosa (MCG) que miden la glucosa del líquido intersticial mediante un método electroquímico con una adecuada correlación entre la glucosa determinada en el intersticio y en la sangre7. Existen sensores a tiempo real y ciegos o retrospectivos, estos últimos utilizados por profesionales como método diagnóstico-terapéutico, que permiten modificar el tratamiento de los pacientes con diabetes mellitus8.
En DMG los estudios con MCG son escasos, muchos de ellos con un bajo número de pacientes y, además, con frecuencia analizan conjuntamente a mujeres con diabetes mellitus tanto pregestacional como gestacional. No obstante, han demostrado que el uso de la MCG detecta un mayor tiempo en hiperglucemia que la AMGC9,10. Además, el uso de MCG, tanto retrospectivo como a tiempo real, se asocia con un mejor control glucémico respecto al uso de AMGC y con menor ganancia ponderal tanto en la madre como en el recién nacido. Sin embargo, no se ha evidenciado una disminución de otras complicaciones materno-fetales relacionadas con la DMG11,12. En los últimos años se ha desarrollado el estudio de parámetros de variabilidad glucémica (VG) con la MCG, en el que se ha descrito una mayor VG en mujeres con DMG13,14. Sin embargo, en cuanto al uso retrospectivo de la MCG en DMG y los datos obtenidos de VG como herramienta predictiva del desarrollo de complicaciones obstétricas y perinatales, los resultados son dispares15.
En cuanto al tratamiento de la DMG, las medidas higiénico-dietéticas han demostrado reducir el exceso de peso en el recién nacido y se ha evidenciado una disminución de las complicaciones tanto en la madre como en el feto con el tratamiento farmacológico16-18. En relación con la MCG en DMG y el tratamiento farmacológico, existen trabajos que muestran que cuando se utiliza la MCG hay un mayor número de pacientes que inician tratamiento farmacológico que cuando se usa solo la AMGC19. Sin embargo, hasta el momento actual no existe ningún estudio que analice el uso de la MCG tras el diagnóstico de DMG para detectar parámetros de VG y su relación con la probabilidad de requerir tratamiento farmacológico.
El objetivo de nuestro trabajo fue establecer, mediante el uso de MCG al diagnóstico de DMG, si la glucemia media y determinados parámetros de VG ayudan a predecir la probabilidad de precisar tratamiento farmacológico y si se relacionan con el desarrollo de complicaciones obstétricas y perinatales.
Material y métodosPacientesSe trata de un estudio prospectivo realizado en pacientes con DMG atendidas en la consulta específica de endocrinología y embarazo del Hospital Universitario de Jerez. El periodo de inclusión fue desde febrero de 2016 hasta julio de 2018. El Hospital de Jerez presta cobertura a más de 456.000 habitantes, con una media de 2.421 embarazos a término al año.
Se incluyó a aquellas mujeres entre las semanas 26 y 32 de gestación diagnosticadas de DMG mediante la estrategia de 2 pasos y con una sobrecarga oral de glucosa de 100g con 2 valores anormalmente elevados de acuerdo con los criterios diagnósticos de la National Diabetes Data Group y el 3rd Workshop-Conference on Gestational Diabetes Mellitus, que son los siguientes: glucosa basal 105mg/dl, a los 60 min 190mg/dl, a los 120 min 165mg/dl y a los 180 min 145mg/dl20. Se excluyó a aquellas pacientes con diabetes pregestacional, enfermedad sistémica crónica, proceso agudo infeccioso o ausencia de consentimiento informado.
En la visita inicial, tras el diagnóstico de DMG, se recogieron los datos relativos a raza, edad de la paciente y tiempo gestacional, antecedentes familiares de diabetes mellitus y antecedentes personales de DMG, historia obstétrica, índice de masa corporal pregestacional (IMCp) y los siguientes parámetros analíticos: glucosa, HbA1c, ácido úrico, triglicéridos, colesterol HDL y colesterol LDL.
Tras finalizar la gestación, se recogieron los datos relacionados con el tratamiento de la DMG y, además, se registraron las complicaciones maternas durante la gestación como es la hipertensión inducida por el embarazo (presión arterial sistólica ≥ 140mmHg o presión arterial diastólica ≥ 90mmHg después de las 20 semanas de gestación) o preeclampsia (hipertensión inducida por el embarazo acompañada de proteinuria ≥ 30mg/mmol de creatinina) y tipo de parto (eutócico, instrumentado o cesárea). En relación con los resultados neonatales, se registraron el peso del recién nacido y las complicaciones neonatales asociadas, como tamaño pequeño para la edad gestacional (percentil <10), grande para la edad gestacional (percentil>90), macrosomía (peso>4.000g), hipoglucemia (menor de 40mg/dl en las primeras 24 h de vida), hiperbilirrubinemia, traumatismo, infección y estancia en unidad de cuidados intensivos.
Medidas higiénico-dietéticasDurante la primera visita, todas las pacientes recibieron consejo dietético con un plan de alimentación individualizado según su IMCp que, en caso de ser inferior a 18,5kg/m2, fue de 36-40kcal/kg al día; si 18,5-25kg/m2 de 31-35kcal/kg al día; si 25-29kg/m2 entre 25-30kcal/día y si era superior a 30kg/m2 de 23-25kcal/kg al día. La distribución de macronutrientes fue del 40-50% de hidratos de carbono, 30-40% de grasas y del 20% de proteínas6.
Monitorización de glucosa y tratamientoEn la visita inicial, siguiendo la práctica clínica habitual, se proporcionó a cada mujer un medidor de glucemia capilar (modelo Contour®next) para la toma de AMCG antes y una hora después del desayuno, la comida y la cena. Los objetivos glucémicos marcados fueron los recomendados según la Asociación Americana de Diabetes: ≤95mg/dl antes de las comidas y ≤140mg/dl una hora después de las comidas21. En caso de superar dichos valores, se inició tratamiento farmacológico con insulina, ya que en nuestro medio es el tratamiento de elección en gestantes6. Se definió hipoglucemia a un valor de glucosa <70mg/dl.
Además, ese mismo día se implantó a cada gestante un MCG ciego o retrospectivo, modelo iPro™2, que llevaron durante 6 días consecutivos. El sensor se inserta en el tejido celular subcutáneo y está unido al transmisor, que se fija a la piel. Almacena 288 mediciones de glucosa de forma continua en 24 h y los datos son descargados y evaluados a posteriori. Se analizaron los siguientes parámetros: glucemia media como medida de centralización y de VG media, desviación estándar (DE), coeficiente de variación, amplitud media de las excursiones glucémicas (MAGE), diferencia entre las medias diarias (MODD) y solapamiento continuo de la acción de la glucosa en un periodo de n horas (CONGAn). Se define coeficiente de variación como la DE dividida entre la media de glucosa, cuya interpretación es porcentual; amplitud media de las excursiones glucémicas como la media aritmética de los valores de glucosa desde los puntos más bajos hasta los más elevados o viceversa; MODD como la media de las diferencias entre los valores de glucosa en la misma hora del día, durante 2 días consecutivos, lo que permitie analizar la VG entre diferentes días y CONGA como la DE del sumatorio de las diferencias entre un valor dado y los valores observados en las horas previas (n), lo que permite analizar la VG en un periodo de 24 h.
Este estudio fue aprobado por el Comité Ético de Investigación de la provincia de Cádiz conforme a los principios éticos recogidos en la Declaración de Helsinki. De forma previa a la inclusión en el estudio, durante la primera visita, cada paciente firmó el consentimiento informado.
Análisis estadísticoPara el análisis descriptivo, los resultados de las variables cuantitativas se expresaron en media, DE y, en el caso de las variables cualitativas, en frecuencias y porcentajes.
Se realizó análisis multivariante mediante modelos de regresión logística, tomando como variables dependientes cada uno de los resultados obstétricos y neonatales, y como variables independientes la glucemia media, DE, coeficiente de variación, amplitud media de las excursiones glucémicas, MODD y CONGAn, edad (años) y el IMCp en los modelos como variables de ajuste. En un segundo momento se analizó como variable dependiente la necesidad de tratamiento, asimismo, usando como variables independientes los parámetros de VG citados y ajustando por edad e IMC. Una vez identificadas las variables asociadas con la necesidad de tratamiento farmacológico (glucemia media y CONGA) se calculó el área bajo la curva ROC (receiver operating characteristic) de ambas variables. Se consideró una asociación estadísticamente significativa si el valor de p era menor de 0,05.
Para la recogida de datos y análisis se empleó el programa estadístico Stata, versión 16. El cálculo de los parámetros de VG se realizó mediante el programa informático específico EasyGV22,23.
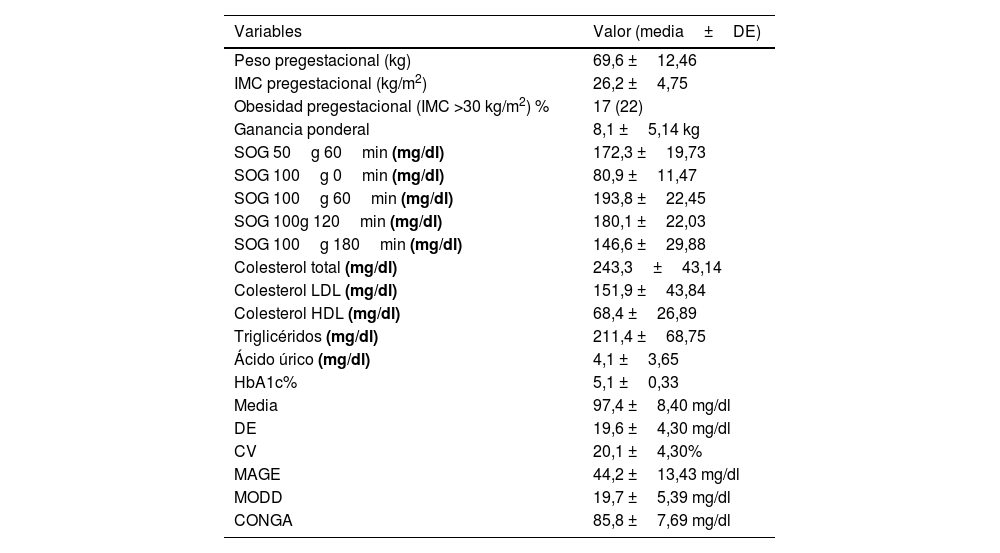
ResultadosCaracterísticas clínicas, parámetros antropométricos y analíticosSe incluyó inicialmente a un total de 87 pacientes con DMG, de las cuales se excluyó a 10 por problemas relacionados con el sensor (caída de sensor o transferencia incorrecta de datos), por lo que se analizaron los datos de 77 gestantes. De ellas, 75 (97,4%) eran de raza caucásica, 1 (1,4%) era asiática y otra (1,4%) era hispanoamericana. La edad media fue de 33,5±4,23 años; 30 pacientes (38,9%) tenían una edad igual o superior a 35 años. El diagnóstico de DMG se realizó a las 30,2±2,16 semanas de gestación. Los antecedentes familiares de diabetes mellitus estaban presentes en 51 (66,2%) pacientes. Del total de pacientes analizadas, 54 (70,1%) habían tenido uno o más embarazos previos y, de ellas, 15 (27,7%) habían presentado DMG en las gestaciones previas. Los parámetros antropométricos y analíticos vienen reflejados en la tabla 1.
Parámetros antropométricos y analíticos
| Variables | Valor (media±DE) |
|---|---|
| Peso pregestacional (kg) | 69,6 ±12,46 |
| IMC pregestacional (kg/m2) | 26,2 ±4,75 |
| Obesidad pregestacional (IMC >30 kg/m2) % | 17 (22) |
| Ganancia ponderal | 8,1 ±5,14 kg |
| SOG 50g 60min (mg/dl) | 172,3 ±19,73 |
| SOG 100g 0min (mg/dl) | 80,9 ±11,47 |
| SOG 100g 60min (mg/dl) | 193,8 ±22,45 |
| SOG 100g 120min (mg/dl) | 180,1 ±22,03 |
| SOG 100g 180min (mg/dl) | 146,6 ±29,88 |
| Colesterol total (mg/dl) | 243,3±43,14 |
| Colesterol LDL (mg/dl) | 151,9 ±43,84 |
| Colesterol HDL (mg/dl) | 68,4 ±26,89 |
| Triglicéridos (mg/dl) | 211,4 ±68,75 |
| Ácido úrico (mg/dl) | 4,1 ±3,65 |
| HbA1c% | 5,1 ±0,33 |
| Media | 97,4 ±8,40 mg/dl |
| DE | 19,6 ±4,30 mg/dl |
| CV | 20,1 ±4,30% |
| MAGE | 44,2 ±13,43 mg/dl |
| MODD | 19,7 ±5,39 mg/dl |
| CONGA | 85,8 ±7,69 mg/dl |
Durante la gestación, 18 (23,4%) mujeres precisaron tratamiento farmacológico con insulina según el protocolo de actuación de nuestra área6. En promedio, se inició el tratamiento con insulina a la 31 semana de gestación, se requirió una dosis total de insulina de 16,8±13,72 UI, lo que corresponde a 0,25 unidades por kilo de peso requeridas al día. El tipo de insulina requerida fue en el 33% solo basal, el 33% análogos de acción rápida y el 33% basal y análogos de acción rápida. En cuanto a la hora de administración más frecuente fue antes de las 3 principales comidas (n=8; 44,4%), seguida del periodo de la cena (n=5; 27,7%), menos frecuente a administración en desayuno y comida (n=2; 11,1%), desayuno y cena (n=1; 5,5%) y desayuno (n=1; 5,5%).
Respecto a las complicaciones maternas durante el embarazo, 2 (2,6%) mujeres desarrollaron hipertensión gestacional y en ningún caso preeclampsia. En 44 (57,1%) pacientes el parto fue de tipo eutócico, en 8 (10,4%) instrumentado y en 25 (32,5%) mediante cesárea.
Con relación a los resultados perinatales, el peso medio del recién nacido fue de 3.281,7±460,68 g (percentil 56,39±30,58), 5 (6,5%) de ellos fueron pequeños para la edad gestacional, 14 (18,2%) fueon grandes para la edad gestacional y 10 (13%) presentaron macrosomía. Un total de 17 (22,1%) recién nacidos tuvieron algún episodio de hipoglucemia, 6 (7,8%) hiperbilirrubinemia, 6 (7,8%) requirieron aporte de oxigenoterapia, 1 (1,3%) sufrió un traumatismo obstétrico, 1 (2,3%) presentó infección al nacimiento y 3 (3,9%) precisaron estancia en la unidad de cuidados intensivos.
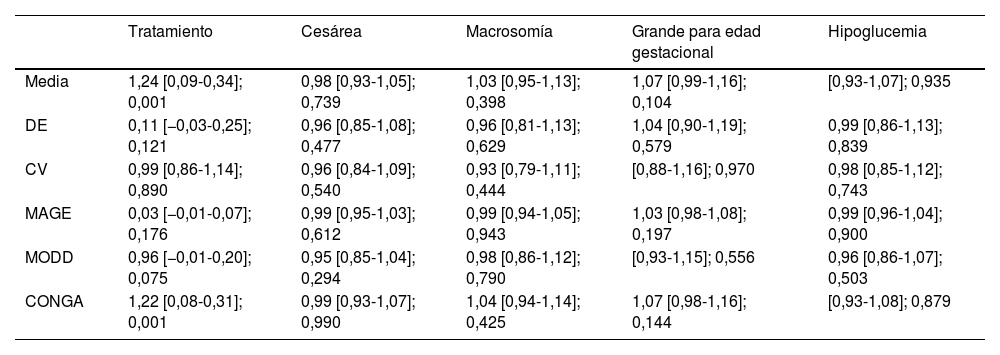
Monitorización continua de glucosaEn cuanto a los resultados obtenidos del uso de MCG retrospectiva durante 6 días consecutivos, los valores de los parámetros VG aparecen en la tabla 1. Tal como se muestra, no encontramos relación entre los distintos parámetros de VG y los resultados obstétricos y perinatales (tabla 2).
Análisis de regresión logística de la asociación existente entre VG con complicaciones materno-fetales y tratamiento con insulina
| Tratamiento | Cesárea | Macrosomía | Grande para edad gestacional | Hipoglucemia | |
|---|---|---|---|---|---|
| Media | 1,24 [0,09-0,34]; 0,001 | 0,98 [0,93-1,05]; 0,739 | 1,03 [0,95-1,13]; 0,398 | 1,07 [0,99-1,16]; 0,104 | [0,93-1,07]; 0,935 |
| DE | 0,11 [−0,03-0,25]; 0,121 | 0,96 [0,85-1,08]; 0,477 | 0,96 [0,81-1,13]; 0,629 | 1,04 [0,90-1,19]; 0,579 | 0,99 [0,86-1,13]; 0,839 |
| CV | 0,99 [0,86-1,14]; 0,890 | 0,96 [0,84-1,09]; 0,540 | 0,93 [0,79-1,11]; 0,444 | [0,88-1,16]; 0,970 | 0,98 [0,85-1,12]; 0,743 |
| MAGE | 0,03 [−0,01-0,07]; 0,176 | 0,99 [0,95-1,03]; 0,612 | 0,99 [0,94-1,05]; 0,943 | 1,03 [0,98-1,08]; 0,197 | 0,99 [0,96-1,04]; 0,900 |
| MODD | 0,96 [−0,01-0,20]; 0,075 | 0,95 [0,85-1,04]; 0,294 | 0,98 [0,86-1,12]; 0,790 | [0,93-1,15]; 0,556 | 0,96 [0,86-1,07]; 0,503 |
| CONGA | 1,22 [0,08-0,31]; 0,001 | 0,99 [0,93-1,07]; 0,990 | 1,04 [0,94-1,14]; 0,425 | 1,07 [0,98-1,16]; 0,144 | [0,93-1,08]; 0,879 |
Odds ratio [intervalo de confianza al 95%]; p valor.
Al evaluar la relación entre el tratamiento farmacológico y los parámetros de VG obtenidos a partir de la MCG, observamos que a mayores valores de glucemia media y CONGA aumenta la probabilidad de precisar posteriormente tratamiento farmacológico con OR=1,24 para MCG (intervalo de confianza al 95%: 1,10-1,40; p<0,001) y OR=1,22 para CONGA (intervalo de confianza al 95%: 1,09-1,37; p=0,001). De esta manera, si expresamos los datos en promedios, observamos que por cada mg/dl que aumenta la glucemia media y CONGA se incrementa el 24% y el 22%, respectivamente, la probabilidad de requerir tratamiento farmacológico.
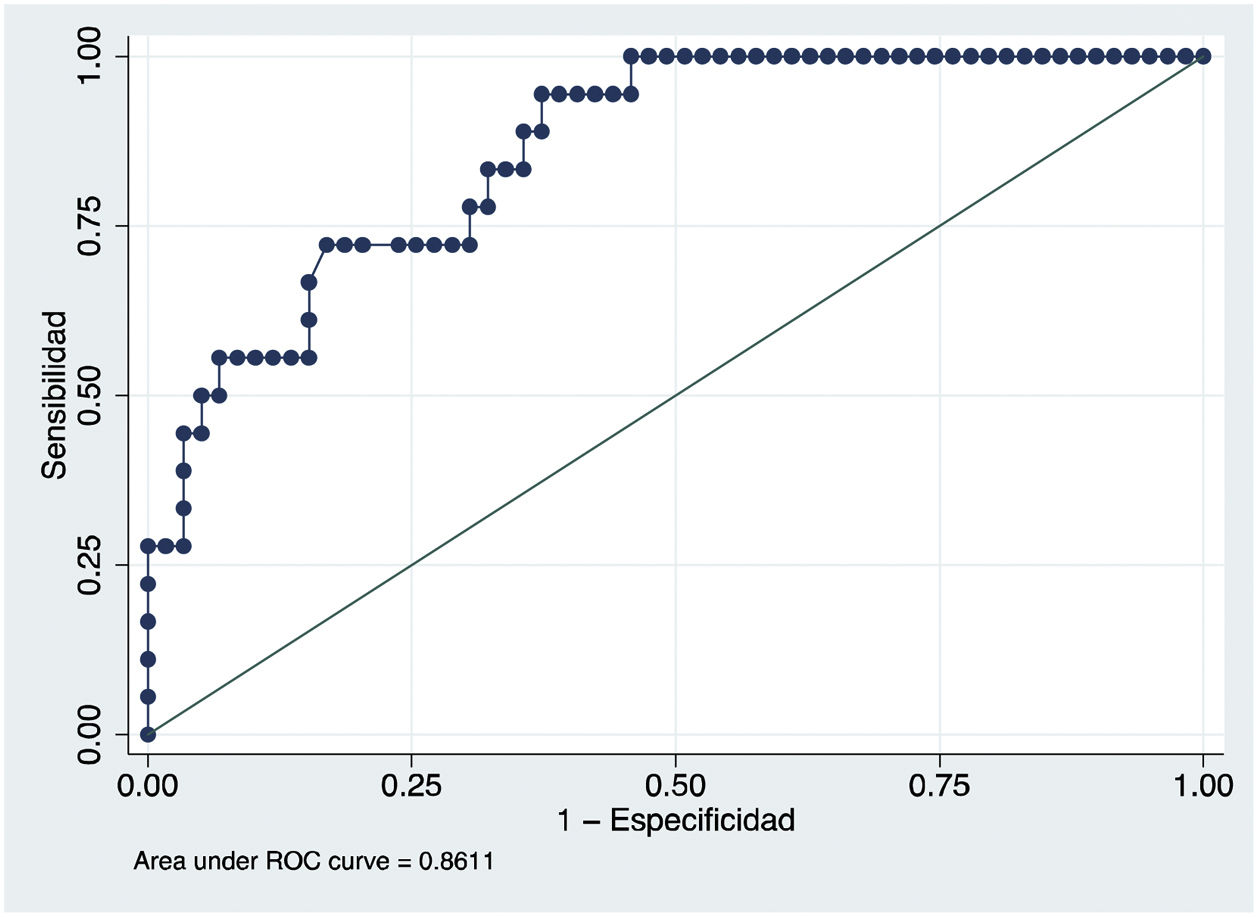
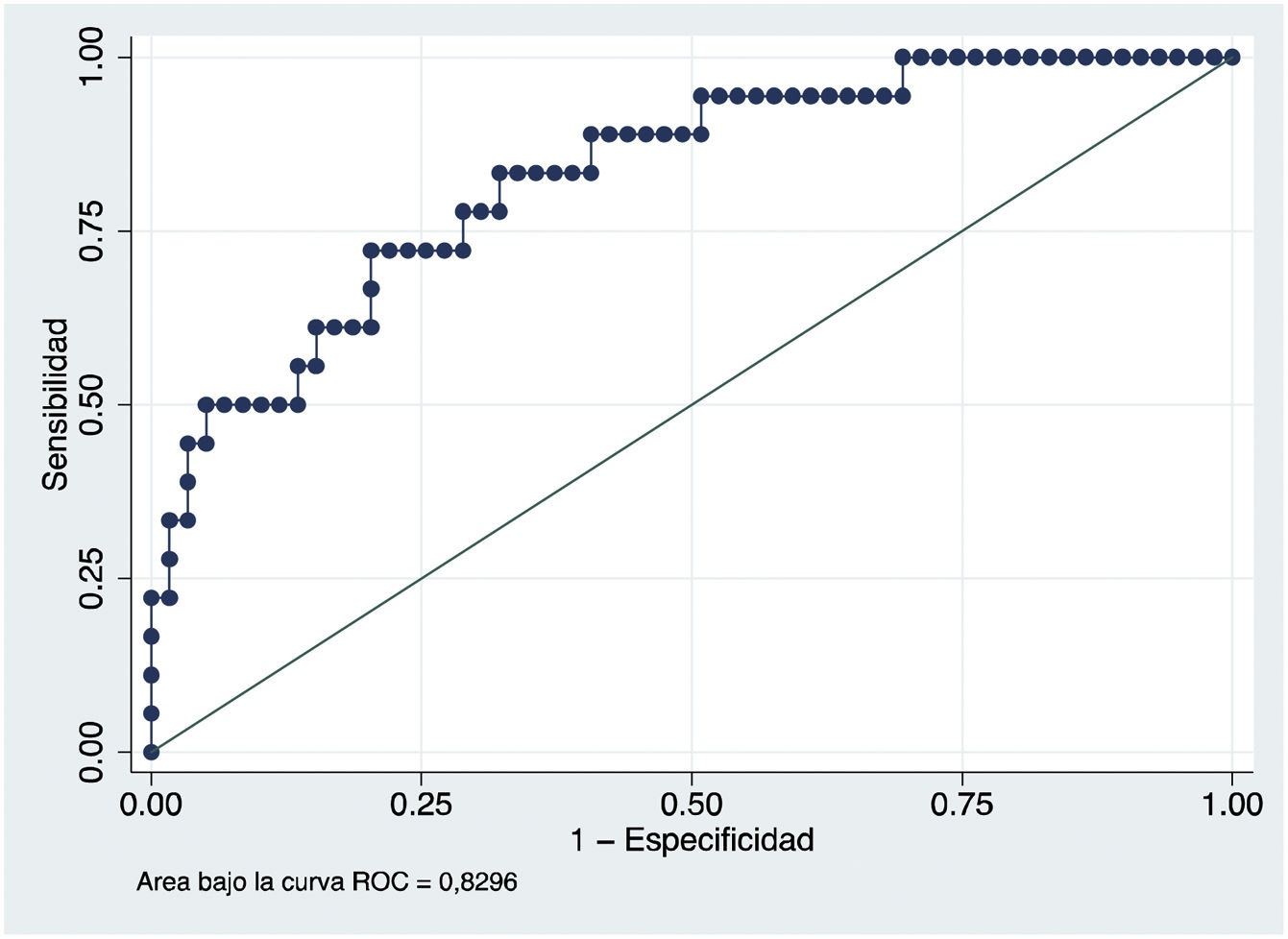
En cuanto a la capacidad para predecir la necesidad de tratamiento farmacológico según los datos obtenidos mediante MCG, se calcularon los puntos de corte para glucemia media y CONGA con mayor sensibilidad (S) y especificidad (E) y se obtuvieron unos valores de 98,81mg/dl (S de 83,3%; E de 67,8%) y 86,70mg/dl (S de 83,3%; E de 67,8%), respectivamente (figs. 1 y 2).
ConclusionesLos parámetros de VG obtenidos mediante MCG cuantifican la amplitud, frecuencia y duración de las fluctuaciones glucémicas, de manera que proporcionan una información adicional muy valiosa a la aportada por los métodos clásicos, como pueden ser la glucemia preprandial y posprandial, obtenidas con la AMCG, y la HbA1c. Por ese motivo, la VG tiene una importancia creciente en el control de la diabetes mellitus de tipo 1 y tipo 2, ya que se ha demostrado que tanto el tiempo como la amplitud de las fluctuaciones de la glucosa contribuyen a un mayor riesgo de hiperglucemia e hipoglucemia. Además, es conocido que la VG representa por sí misma un factor de riesgo de complicaciones asociadas a la diabetes24,25.
En los últimos años, los estudios sobre MCG en DMG también han comenzado a ir en una misma dirección al medir los parámetros de VG y analizar su relación con las complicaciones materno-fetales. Dado que los trabajos publicados son aún escasos, en la actualidad no están establecidos unos valores referencia de VG estandarizados para DMG como sí lo están para diabetes mellitus26-30. A esta escasez de estudios se suma la heterogeneidad de resultados, difíciles de comparar, ya que no siempre se analizan los mismos parámetros de VG26-28, se determinan en distintos estadios de gestación y se utilizan distintos programa para su cálculo23; en este estudio hemos utilizado el programa EasyGV22,23. Por todas estas razones, aunque resulta difícil comparar nuestros resultados con los de otros estudios publicados, la mayoría de estos muestran valores de VG superiores a los obtenidos en nuestro trabajo26-30.
El tratamiento dietético es el primer escalón terapéutico y ha demostrado reducir el exceso de peso en el recién nacido asociado a DMG31. En un 70-85% de los casos se consigue un adecuado control glucémico y no es necesario añadir tratamiento farmacológico. Los resultados obtenidos en nuestro estudio muestran que el 23,4% de las gestantes precisaron tratamiento farmacológico con insulina, cifra similar a lo descrito en la literatura6. En las pacientes que no cumplen los objetivos de glucemia con el tratamiento dietético, el tratamiento farmacológico reduce las complicaciones materno-fetales31, por lo que es prioritario identificar de una forma precoz a aquellas pacientes con mayor probabilidad de precisarlo.
Según los datos publicados hasta la actualidad, no existen estudios que hayan tenido como objetivo valorar la relación entre la glucemia media y VG al diagnóstico de DMG y la probabilidad de precisar tratamiento farmacológico a lo largo de la enfermedad. Nuestro estudio es el primero que demuestra que la glucemia media, como medida de centralización, y CONGA, como parámetro de VG, obtenidos de la MCG al diagnóstico de DMG podrían ayudar a predecir la necesidad de tratamiento farmacológico. De esta manera, observamos que por cada mg/dl que aumenta la glucemia media y CONGA se incrementa el 24% y el 22%, respectivamente, la probabilidad de precisar tratamiento farmacológico.
Los resultados de nuestro trabajo también permiten establecer puntos de corte de glucemia media y CONGA con una elevada sensibilidad y especificidad (figs. 1 y 2). En las pacientes con DMG, es prioritario tener pruebas con alta sensibilidad para intensificar las medidas terapéuticas de una forma precoz con el fin de prevenir o minimizar las complicaciones materno-fetales. Así, aquellas pacientes en las que se detecte mediante MCG al diagnóstico de la enfermedad un valor de glucemia media superior al 98,81mg/dl o CONGA superior al 86,70mg/dl deberían ser seguidas de una forma más estrecha. Por lo tanto, cabe decir que podría pronosticar al diagnóstico qué pacientes van a requerir tratamiento farmacológico posteriormente.
Por otro lado, otro hallazgo destacable del presente trabajo es la ausencia de relación entre los datos de glucemia media y VG obtenidos al diagnóstico de la DMG y el desarrollo de complicaciones materno-fetales. Existen varios trabajos que analizan VG en DMG con resultados dispares. Uno de ellos, en un estudio realizado en mujeres con DMG durante el tercer trimestre, se corroboran nuestros resultados, ya que en él tampoco se evidencia que la MCG sea predictor de desarrollo de complicaciones tanto en la madre como en el recién nacido, si bien el número de pacientes incluidas fue inferior al nuestro28. En contraposición, otro estudio muestra una relación directa entre VG y crecimiento fetal en pacientes con diabetes mellitus de tipo 1 y también con DMG (en diferentes estadios de gestación), pero incluye un bajo número de pacientes, por lo que los resultados son poco consistentes27. Más recientemente, un estudio prospectivo observacional realizado en pacientes con DMG entre las semanas 30 y 32 de gestación ha demostrado asociación directamente proporcional entre glucemia media y tamaño grande para la edad gestacional30. En nuestro trabajo, la MCG se realizó justo al diagnóstico de la DMG y, además, las pacientes recibieron durante su seguimiento un adecuado tratamiento farmacológico, con la consiguiente optimización del control glucémico y la consiguiente reducción en la afectación fetal y disminución del desarrollo de complicaciones.
El actual estudio presenta la novedad de mostrar la posible utilidad de la MCG al diagnóstico de la DMG como herramienta par identificar un determinado grupo de pacientes que se beneficiarían de un seguimiento más estrecho en función de los resultados de glucemia media y CONGA y los puntos de corte, con una alta sensibilidad. Hasta el momento no hay ningún estudio publicado que valore la VG mediante el uso la MCG tras el diagnóstico de DMG en el sentido que lo hace el actualmente presentado. Además, aporta, como valor añadido, las características homogéneas de la muestra y el aceptable número de pacientes incluidas. Los resultados obtenidos serían trasladables a poblaciones de similares características a la nuestra, si bien para poder extrapolarlo serían necesarios estudios futuros con un mayor número de pacientes.
Una de las limitaciones de nuestro estudio es, por consiguiente, el discreto número de pacientes, que podría disminuir su potencia para evaluar posibles asociaciones con resultados obstétricos o neonatales de baja incidencia, aunque sigue siendo superior al de la mayoría de los trabajos publicados en la literatura. Otra limitación es la posibilidad de que el cumplimiento de las medidas dietéticas haya sido desigual entre las pacientes y que esto pudiera afectar a las mediciones, ya que es difícil evaluar la adherencia a las recomendaciones. No obstante, es probable que no tenga un efecto importante, ya que se trata de una población muy homogénea con un patrón dietético similar por las costumbres y lugar de residencia.
En conclusión, el uso de la MCG al diagnóstico de DMG predice la probabilidad de requerir tratamiento farmacológico en aquellas pacientes que presentan unos valores de glucemia media y CONGA más elevados. De esta forma, mediante MCG se identificaría a aquellas pacientes que se beneficiarían de una vigilancia más estrecha durante la gestación con AMGC tanto pre- como posprandial que permita iniciar un tratamiento farmacológico precozmente. Sería interesante realizar futuros estudios prospectivos dirigidos a evaluar la eficiencia de la MCG, es decir, a demostrar una reducción de complicaciones materno-fetales y costes asociados para poder recomendar su uso tras el diagnóstico de la DMG.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.