El absceso hepático (AH) es una colección de pus localizada en el hígado, resultante de cualquier proceso infeccioso con destrucción del parénquima y del estroma hepático. Su origen, por orden de frecuencia es bacteriano o piógeno, micótico y amebiano.
El AH piógeno (AHP) puede producirse por contigüidad, como una complicación de una infección de la vía biliar o abdominal, por diseminación hematógena, o bien puede ser de origen criptogénico (hasta en el 25-60% de casos). Suelen ser polimicrobianos y, generalmente, los microorganismos proceden de la flora gastrointestinal. Recientemente, diversos artículos han sugerido un incremento de la incidencia de AHP en personas mayores, en pacientes con cáncer y en sujetos inmunosuprimidos1. En un estudio reciente realizado en el Reino Unido, Mohsen et al. encontraron una incidencia anual de 18 casos por 100.000 ingresos2. En España, la incidencia anual es de 14 - 35 casos por 100.000 ingresos3.
Tradicionalmente, se ha considerado a Escherichia coli como el principal agente responsable del AHP. Los abscesos hepáticos por Klebsiella pneumoniae (K. pneumoniae) se describieron inicialmente en países orientales4, pero en los últimos años se han comunicado casos de dicha infección en países occidentales, entre ellos España, y además, según algunos estudios, su incidencia está aumentando progresivamente5. La inmensa mayoría de abscesos hepáticos por Klebsiella spp. están producidos por K. pneumoniae6,7.
Se ha demostrado que la diabetes mellitus (DM) es el factor de riesgo más importante para desarrollar un AH producido por K. pneumoniae6. Presentamos un caso de descompensación hiperglucémica en un paciente joven cuya causa desencadenante fue un AH por K. pneumoniae con diseminación hematógena y embolismos pulmonares.
Se trataba de un varón de 46 años, asistido en el servicio de Urgencias al ser encontrado en su domicilio estuporoso, febril y con hiperglucemia. En los últimos 2 días había presentado tos seca, febrícula, vómitos autolimitados y polaquiuria. Como antecedentes personales presentaba una diabetes mellitus pospancreatectomía diagnosticada tras un episodio de pancreatitis alcohólica hacía 10 años. No se demostró litiasis biliar ni otra patología bilio-pancreática. Presentaba mal control glucémico de forma crónica con cifras de hemoglobina glucosilada entre 9 y 12%, y un ingreso hospitalario hacia 6 meses por cetoacidosis diabética. No se conocían complicaciones crónicas de la diabetes y el paciente no acudía de forma habitual a consultas médicas. La función renal era normal con cifras habituales de creatinina de 0,5 a 0,9mg/dl. Presentaba además hipertensión arterial, dislipemia, hipotiroidismo y esquizofrenia. Era fumador, consumidor esporádico de cannabis, y bebedor activo 50-90g de alcohol al día. Su tratamiento habitual incluía insulina premezclada lispro/NPL (25/%75%) 20 y 16 UI antes de desayuno y cena respectivamente, atorvastatina 10mg/día, losartán 100mg/día, levotiroxina 50 mcg/día, clorazepato dipotásico 5mg/día, omeprazol 20mg/día, y pancreatina 300mg 3 veces al día.
En la exploración física presentaba regular estado general, palidez, mucosas secas, diaforesis, presión arterial 107/54mmHg, temperatura 39° C, frecuencia cardíaca 101 lpm, y saturación de oxígeno de 96%. La auscultación cardíaca era normal, y la pulmonar roncus dispersos. El resto del examen físico no mostraba alteraciones.
En la analítica de sangre, destacaba glucemia 501mg/dl, urea 122mg/dl (valor normal (VN): 17-43), creatinina 1,83mg/dl (VN: 0,67-1,17), sodio 119 mEq/L (VN: 136-146), potasio 3,6 mEq/L (VN: 3,5-5,1), proteína C reactiva 14 (VN: 0,0-0,5), leucocitos 12.200 (94,1% neutrófilos) y hemoglobina 10,6 g/l. En el examen de orina presentó cetonuria y glucosuria máximas. La gasometría venosa mostraba pH de 7,47 y bicarbonato 19,7. La serología de hepatitis B, C y virus de la inmunodeficiencia human fue negativa. La radiografía de tórax mostraba patrón nodular de predominio periférico. Los hemocultivos a las 24h y 48h demostraron crecimiento de K. Pneumoniae.
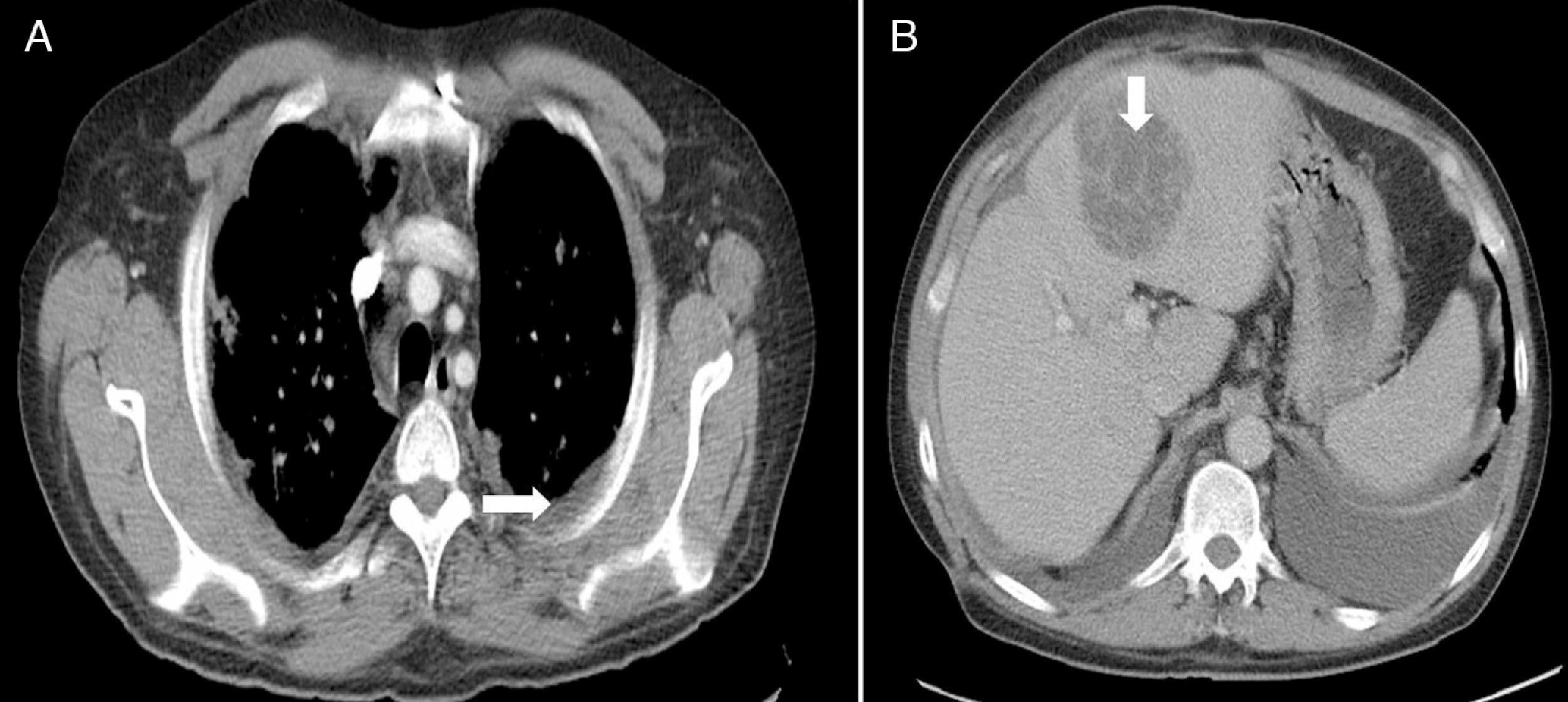
Se inició tratamiento con fluidoterapia y perfusión de insulina, así como antibiótico de amplio espectro (piperacilina-tazobactam). El ecocardiograma fue normal. La tomografía computerizada (TC) toraco-abdominal mostraba derrame pleural izquierdo, infiltrados bilaterales intersticiales difusos, y nódulos bilaterales de predominio periférico, y en abdomen una lesión hepática hipodensa de 6×7cm de diámetro (fig. 1).
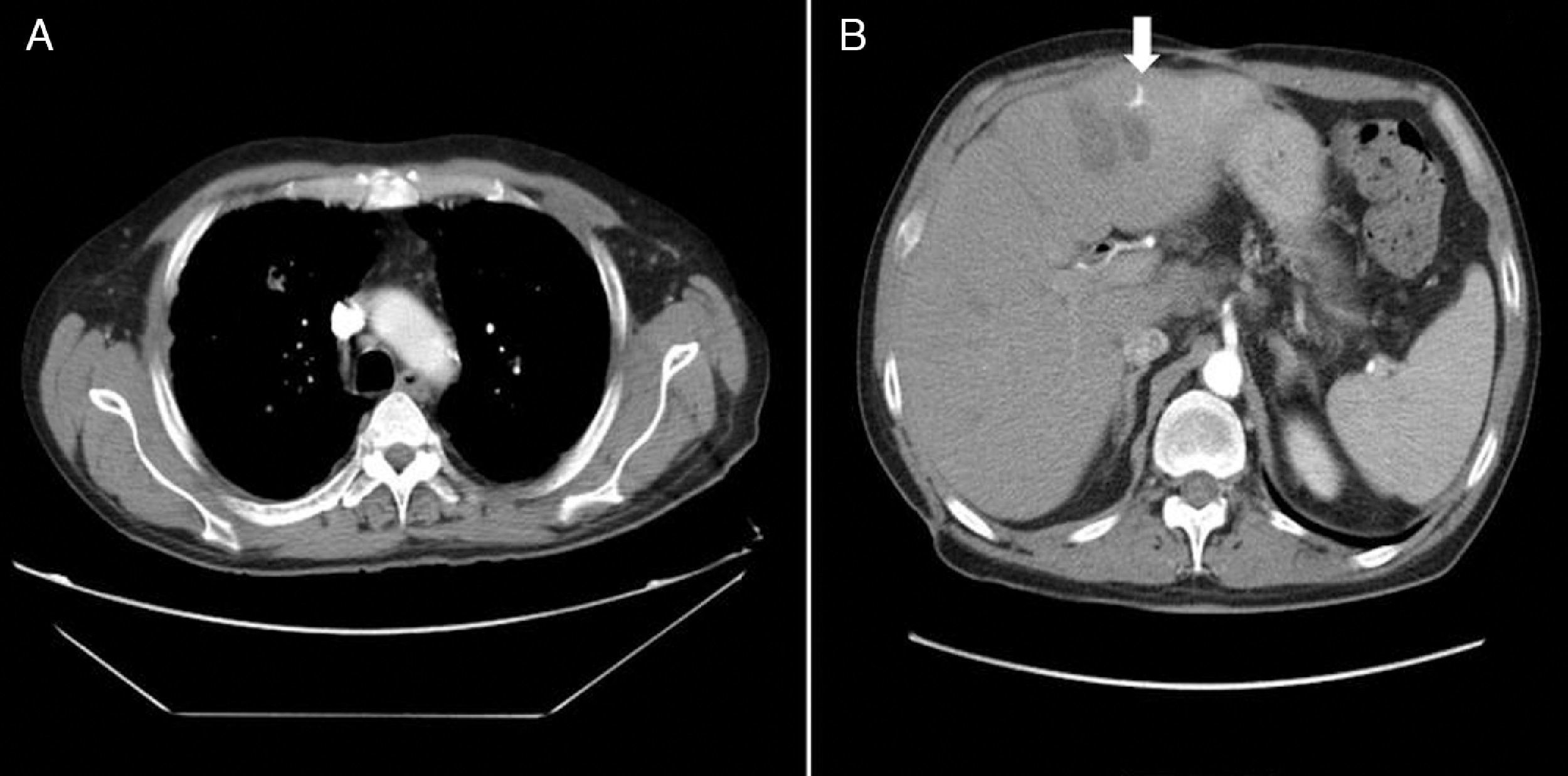
La insuficiencia renal inicial se solventó con la hidratación y la corrección de la glucemia, atribuyéndose un origen prerrenal. Sin embargo, el paciente presentó evolución tórpida con insuficiencia respiratoria parcial. Se realizó fibrobroncoscopia, toracocentesis y análisis del líquido pleural que no mostraron alteraciones. Se practicó punción-drenaje del absceso hepático guiada por TC. En el cultivo de material hepático drenado creció K. pneumoniae. Se diagnosticó un cuadro de síndrome de distress respiratorio del adulto junto con embolismos sépticos pulmonares secundarios a absceso hepático por K. pneumoniae. Se modificó el tratamiento antibiótico pasando a amikacina, linezolid y metronidazol. A las 48 horas del drenaje percutáneo el paciente mejoró, normalizándose la función respiratoria. Posteriormente, se decidió alta hospitalaria continuando tratamiento antibiótico oral con ciprofloxacino 500mg cada 12h y metronidazol 500mg cada 8 horas durante 4 semanas. La TC toraco-abdominal realizada un mes después del alta mostró mejoría radiológica con respecto al previo, objetivándose una desaparición del derrame pleural laminar bilateral. Persistía imagen de hipodensidad en lóbulo hepático izquierdo (segmento 3), de menor tamaño que en la TC previa (fig. 2).
El AH suele presentarse inicialmente como un reto diagnóstico, con datos analíticos poco específicos y siendo la clínica clásica fiebre, escalofríos, dolor en hipocondrio derecho con o sin hepatomegalia e ictericia. Este caso se presentó como una descompensación hiperglucémica severa, con cetosis, leve acidosis metabólica compensada, alteraciones radiológicas y clínicas pulmonares inespecíficas y leve leucocitosis. Solo el pico febril al ingreso obligaba a descartar un foco infeccioso, si bien los signos clínicos no orientaban al diagnóstico final. Se trata de un cuadro potencialmente grave pese a que ha mejorado el pronóstico en los últimos años. En una revisión de casos de abscesos hepáticos piógenos, la tasa de mortalidad observada era del 2,5%, en contraste con otras establecidas por otros estudios, de 11 a 31%7. Los AH por K. pneumoniae tienen mejor pronóstico que los abscesos polimicrobianos, con menos recidivas (4,3 vs 41%) y menor mortalidad6.
Tras obtenerse el resultado de los cultivos positivos para K. pneumoniae se debe instaurar tratamiento antibiótico adecuado, basado en el antibiograma, e investigar el origen del foco infeccioso primario.
Según lo descrito en las últimas revisiones clínicas, la DM es el principal factor de riesgo para abscesos piógenos por K. pneumoniae serotipo K16. Se ha propuesto como hipótesis fisiopatológica la existencia de una alteración de la fagocitosis en las células de Kupffer presente en los sujetos diabéticos. El tratamiento de los AH por K. pneumoniae incluye terapia antimicrobiana específica durante 4-6 semanas junto al drenaje percutáneo, que se ha demostrado como el tratamiento más útil7.
Paradójicamente, no se ha podido demostrar que la DM sea un factor predictor de mortalidad, mientras que sí lo son la formación de gas en el absceso y los niveles de creatinina mayores de 1.3mg/dl8. El AH por K. pneumoniae en sujetos no diabéticos suele presentarse después del tratamiento quirúrgico de cualquier proceso abdominal, especialmente digestivo. Sin embargo, en los pacientes diabéticos cursa característicamente sin enfermedad biliar o digestiva previa6. El antecedente de pancreatectomía hacía 10 años en este paciente es muy poco probable que tenga alguna relación con el AH. Solo un estudio ha demostrado que, además de la DM, el enolismo crónico puede ser factor de riesgo para presentar AH por K. pneumoniae9. Los pacientes diabéticos no suelen presentar sintomatología típica que haga sospechar esta patología, como dolor abdominal, fiebre, leucocitosis o aumento de trasaminasas8. El paciente descrito había presentado escasa febrícula previa y un pico febril aislado al ingreso. La leucocitosis era poco significativa y es, además, un hallazgo frecuente en los cuadros de cetoacidosis.
La presencia de focos metastáticos se ha demostrado en el 12% de sujetos diabéticos afectos de AH por K. pneumoniae6. Los más habituales son la endoftalmitis, abscesos pulmonares, meningitis/abscesos cerebrales, bacteriuria/abscesos prostáticos y abscesos del psoas. La afectación pulmonar se presenta en algunos estudios en el 100% de los pacientes10. A este paciente se le realizó TC toraco-abdomino-pélvica, ecocardiograma, estudio de orina y fibrobroncoscopía para descartar otros focos de abscesos metástasicos. No se solicitó TC cerebral ya que no presentaba ninguna sintomatología neurológica y el rastreo óseo que se solicitó de forma ambulatoria no mostró afectación.
En conclusión, aunque el AH por K. pneumoniae es una entidad poco frecuente, y hay que tenerla en cuenta en la práctica clínica puesto que la DM es el principal factor predisponente, especialmente en sujetos mal controlados o especialmente inmunocomprometidos. Aunque la mortalidad no es despreciable, un correcto y precoz diagnóstico y tratamiento conlleva una evolución favorable.