En 1898, Pearce Bailey comunicó el primer caso de apoplejía pituitaria (AP); sin embargo, no fue hasta 1950, cuando Brougham et al. reconocieron este síndrome en 5 casos, revisaron la literatura médica y acuñaron el nombre de AP1.
La AP es un síndrome clínico que se caracteriza por cefalea, vómitos, defectos visuales, oftalmoplejía, alteración del estado de conciencia y/o meningismo; debido al infarto o hemorragia de un adenoma pituitario1,2. La AP es una emergencia endocrina poco frecuente, pero potencialmente fatal, que ocurre en pacientes con adenomas pituitarios; especialmente, macroadenomas no funcionantes3. En el 80% de los casos, la AP es el primer síntoma del adenoma pituitario4,5.
En la mayoría de series, la incidencia de AP en adenomas pituitarios oscila entre el 2% y el 7%2,6; sin embargo, la frecuencia de AP subclínica; es decir, hemorragia y/o infarto asintomático de la hipófisis detectado de manera incidental, puede ser hasta de 25%2,5.
Las alteraciones en la agudeza y campo visual se deben al crecimiento rápido del adenoma pituitario, que se extiende de manera lateral en el seno cavernoso y comprime los pares craneales iii, iv y vi; o hacia arriba, comprimiendo al quiasma óptico7,8.
En esta comunicación, describimos el caso de un paciente que acudió a Urgencias por cefalea, náuseas y diplopía. La resonancia magnética nuclear (RM) mostró un macroadenoma pituitario con signos de hemorragia. La cirugía transesfenoidal resolvió las alteraciones oculares.
Varón de 71 años de edad, con antecedente de dislipidemia sin tratamiento farmacológico, que acudió a Urgencias de nuestro hospital por presentar 2 semanas de cefalea, náuseas, vómitos, diplopía y alteración del campo visual. Tres meses antes del ingreso, el paciente había presentado episodios de diplopía que remitían de manera espontánea. Un día antes del ingreso, acudió a médico quien solicitó RM de encéfalo (fig. 1), y derivó al paciente a nuestro hospital con el diagnóstico de macroadenoma pituitario. Al ingreso, sus funciones vitales fueron TA: 160/100mmHg, FC: 56 latidos/minuto, FR: 19 respiraciones/minuto y temperatura oral de 38°C. El examen físico mostró parálisis del iii, iv y vi pares craneales derechos; pupila derecha miótica con ausencia del reflejo fotomotor y hemianopsia bitemporal. No se detectaron signos meníngeos. Los análisis de laboratorio fueron normales, el electrocardiograma mostró bloqueo aurículo-ventricular de primer grado y la radiografía de tórax fue normal.
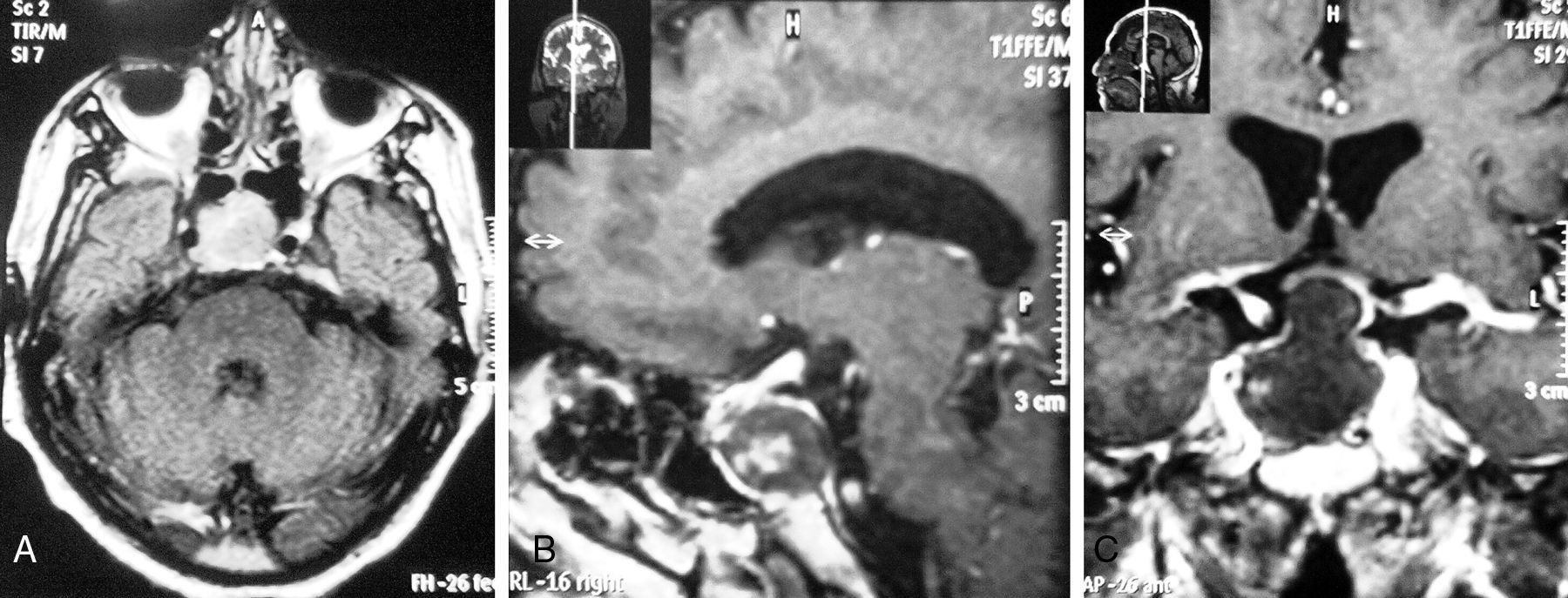
A) RM en secuencia T1 sin contraste (corte transversal). Se observa tumoración heterogénea e hiperintensa a nivel selar y supraselar, de aproximadamente 20mm de diámetro, con contenido hipointenso en su interior, que compromete al seno cavernoso derecho.
B) RM en secuencia T2 con gadolinio (corte sagital a nivel de la hoz del cerebro). Se observa tumoración de bordes hiperintensos, con contenido heterogéneo, de aproximadamente 20mm de diámetro en región selar, que comprime y desplaza silla turca.
C) RM en secuencia T1 con gadolinio (corte coronal a nivel de la silla turca). Se observa tumoración hipercaptadora con bordes hiperintensos y contenido heterogéneo, que comprime al quiasma óptico e invade ambos senos cavernosos, a predominio del lado derecho.
El paciente fue hospitalizado con los diagnósticos de síndrome de hipertensión endocraneana y apoplejía pituitaria. Los resultados de las hormonas pituitarias fueron prolactina 4,6ng/mL (VN: 3,1-16,5), TSH 3,44μU/mL (VN: 0,3-5), tiroxina libre 0,97ng/dL (VN: 0,8-2), FSH 1,7 mU/mL (VN: 2-11), LH 1,1 mU/mL (VN: 0,4-5,7), testosterona total 10pg/mL (VN: 181-772), ACTH 16,7pg/mL (VN: 5-63) y cortisol basal 11,8μg/dL (VN: 6,2-26).
El paciente fue sometido a cirugía transesfenoidal con extirpación del adenoma pituitario. En el postoperatorio, el paciente presentó diabetes insípida, insuficiencia adrenal y anemia aguda por sangrado nasal. La anatomía patológica confirmó el diagnóstico de macroadenoma pituitario no funcionante. Los controles de hormonas pituitarias poscirugía fueron prolactina 1,4ng/mL, tiroxina libre 0,22ng/dL, y cortisol basal <1μg/dL.
El paciente fue dado de alta con terapia sustitutiva de prednisona 7,5mg por día y levotiroxina 75μg por día. Después de 3 meses, había recuperado la motilidad del ojo derecho y no presentaba molestias.
En la presentación de la AP, los síntomas más frecuentes son cefalea (92%), náuseas y vómitos (54%), disminución del campo visual (56%), parálisis ocular (54%), hemianopsia bitemporal (34%) y alteración de la conciencia (42%)9,10. El hipopituitarismo puede estar presente en 50-87% de los casos11. En estos pacientes, el crecimiento rápido del adenoma provoca un incremento brusco de la presión intraselar, produciendo necrosis isquémica de diversas porciones de la hipófisis anterior, limitando la posibilidad de recuperación de la función hormonal12. El déficit hormonal más importante es de ACTH, que ha sido comunicado en el 70% de los casos. También se ha descrito deficiencia de TSH en el 50% y gonadotrofinas en el 75% de los casos2. Al ingreso, los pacientes con concentraciones de prolactina disminuidas tienen una presión intraselar elevada, y son los que menos posibilidades tienen de recuperar su función hormonal después de la cirugía2,12. Por otro lado, la insuficiencia adrenal es la principal causa de muerte2,11.
Los defectos en el campo visual y la disminución de la agudeza visual, pueden ser causados por la compresión de los pares craneales o del quiasma óptico. El crecimiento rápido del adenoma pituitario puede comprimir los pares craneales contra la pared del seno cavernoso o infiltrar directamente el seno7,8. La descompresión quirúrgica temprana (dentro de los 7 días de iniciados los defectos visuales), está asociada con recuperación de la visión y de la función endocrina2,5–9,13.
El diagnóstico diferencial de la AP incluye el crecimiento de un aneurisma carotídeo o basilar. Más del 90% de los aneurismas de la arteria comunicante posterior presentan parálisis de los nervios oculomotores antes que síntomas de hemorragia subaracnoidea. Otros diagnósticos a tener en cuenta son hemorragia intracraneal, hemorragia subaracnoidea, meningitis bacteriana, trombosis del seno cavernoso e infarto cerebral7,14.
Entre los factores precipitantes de AP se mencionan la cirugía coronaria, cirugía mayor, embarazo, radiación de la cabeza, anticoagulación, coagulopatías, test de estimulación endocrina15, hipertensión arterial, uso de estrógenos, traumatismo en la cabeza e inicio o suspensión de agonistas del receptor de dopamina2; sin embargo, un estudio encontró que el uso de agonistas del receptor de dopamina podría ser un factor protector6. En los pacientes sometidos a cirugía mayor se pueden producir fluctuaciones de la presión arterial que pueden desencadenar cuadros de AP2,16. Por otro lado, los test dinámicos de estimulación con GnRH, TRH o CRH pueden provocar un aumento de la presión intraselar y desencadenar una AP2,16.
Respecto al diagnóstico, la RM es el estudio de imágenes de elección, pues detecta el 90% de los casos (la tomografía computada solo detecta 20% de los casos)2,10,13. En el tratamiento, la terapia de reemplazo con glucocorticoides es la intervención médica más efectiva, debido a que la insuficiencia adrenal secundaria es el factor de riesgo más importante de muerte o complicaciones2,12. Se recomienda utilizar hidrocortisona 100-200mg en administración iv, seguidos por una infusión continua de 2-4mg por hora iv. Debido a la cinética de saturación de la globulina transportadora de cortisol, las inyecciones iv intermitentes de hidrocortisona son menos útiles (gran cantidad de la dosis administrada sería filtrada en la orina y no estaría disponible). No se recomienda el uso de dexametasona; sin embargo, sería útil para reducir el edema como una estrategia no quirúrgica de la AP2.
La descompresión transesfenoidal es el tratamiento de elección, especialmente en pacientes con signos neurooculares graves o alteración de la conciencia1,2. En el postoperatorio, se puede presentar diabetes insípida en 16% de los pacientes. Otras posibles complicaciones pueden ser pérdida de líquido cefalorraquídeo, meningitis e insuficiencia adrenal aguda2. Por otro lado, se recomienda el uso de glucocorticoides en pacientes con inestabilidad hemodinámica, con disminución del nivel de conciencia, con disminución de la agudeza visual o con defectos severos de los campos visuales2,11.
En el seguimiento a largo plazo, la mayoría de pacientes van a requerir algún tipo de terapia de reemplazo hormonal. La deficiencia de hormona de crecimiento es la más frecuente, pero los pacientes también van a requerir de glucocorticoides (60-80%), hormona tiroidea (50-60%), desmopresina (10-25%) y testosterona (60-80%)1,2.
Respecto a las alteraciones visuales, en la mayoría de pacientes sometidos a cirugía se ha observado recuperación casi total de la visión, que empieza a notarse desde el postoperatorio inmediato y se extiende en las semanas posteriores2,7; especialmente, de las paresias oculares y cuando la cirugía de descompresión pituitaria se realizó de manera temprana1.