El hipertiroidismo se debe a una síntesis y/o secreción inadecuada de hormonas tiroideas por diferentes causas, situándose su prevalencia en torno al 1%. La causa más frecuente de tirotoxicosis es el hipertiroidismo primario de etiología autoinmune (enfermedad de Graves), en donde la estimulación por parte de los anticuerpos antirreceptores de tirotropina (TRAb) condiciona un incremento de la producción de hormonas tiroideas. En Europa, el tratamiento de primera elección de la enfermedad de Graves son las tionamidas, siendo el tratamiento con radioyodo y la cirugía terapias de segunda línea. El metimazol, junto con el carbimazol y el propiltiouracilo, pertenece a la familia de las tionamidas y es uno de los principales fármacos empleados en el tratamiento del hipertiroidismo1.
Al igual que con cualquier otro fármaco, se han descrito efectos adversos de diferente gravedad con los antitiroideos. Entre estos, como efectos adversos más frecuentes y leves se encuentran las reacciones cutáneas (4-6%), las artralgias (1-5%) y las alteraciones gastrointestinales (1-5%). En cuanto a los efectos adversos graves que se han descrito con mayor frecuencia están la agranulocitosis (0,1-0,5%) y la hepatotoxicidad (0,1-0,2%). Se supone que las alteraciones leves anteriormente descritas son dosis dependientes en el caso del metimazol y carbimazol, mientras que la hepatotoxicidad en estos 2 fármacos, al contrario que en el caso del propiltiouracilo, es idiosincrásica2–5.
La prevalencia de hepatitis aguda secundaria a antitiroideos se sitúa en torno a 0,1-1%, y la mayoría de los casos descritos en la literatura son secundarios a propiltiouracilo. Datos de 2003 reportaban un total de 83 casos descritos de hepatitis aguda secundaria a propiltiouracilo, aunque se ha llegado a sugerir que hasta el 1,2% de los pacientes tratados con dicho fármaco pueden presentarla3,7.
A día de hoy, se han descrito en la literatura menos de 40 casos de hepatitis aguda secundaria a metimazol o carbimazol6. Los casos descritos corresponden en su mayoría a una hepatitis aguda colestásica4–6, a excepción de un caso en que predominaba un patrón de citolisis8, un caso de hepatitis granulomatosa9 y un caso de esteatosis hepática10.
Observación clínicaSe trataba de un varón de 68 años, exfumador, sin hábito alcohólico, hipertenso, dislipémico, cardiópata isquémico y con una miocardiopatía dilatada secundaria. El paciente era portador de un marcapasos desde el 2008 por un síndrome bradicardia-taquicardia. Desde entonces había presentado numerosos episodios de flutter y fibrilación auricular (FA), motivo por el cual se inició tratamiento con amiodarona 200mg/día 3 años antes del inicio del cuadro. Su tratamiento habitual era: bisoprolol 5mg, olmesartan 20mg, fluvastatina 80mg, ezetimiba 10mg, ácido acetilsalicílico 100mg, parches de nitroglicerina 5mg, acenocumarol 1mg, omeprazol 20mg y escitalopram 15mg.
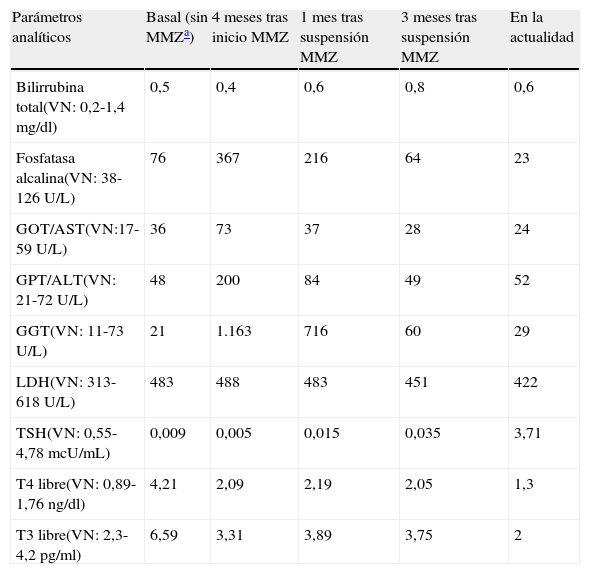
En un ingreso hospitalario en mayo de 2011, por un nuevo episodio de fibrilación auricular, se consultó al Servicio de Endocrinología por hallazgos analíticos compatibles con un hipertiroidismo primario: T4L 4,21ng/dl (0,89-1,76), T3L 6,59pg/ml (2,3-4,2), TSH 0,009mcU/ml (0,55-4,78). Se interrogó al paciente, que no relataba otros síntomas sugestivos de hiperfunción tiroidea. La palpación de la región cervical anterior fue anodina, así como el resto de la exploración física. La autoinmunidad tiroidea mostró unos anti-TPO de 60,6U/ml (0-60), antitiroglobulina de 213U/ml (0-60) y anti-TSI negativos. Se solicitó una ecografía tiroidea, en la que no se objetivaron alteraciones significativas. En conjunto se orientó como un hipertiroidismo secundario a amiodarona tipo 2 vs mixto, motivo por el cual se inició tratamiento con prednisona 20mg al día y metimazol 10mg cada 8 h, duplicándose la dosis de ambos ante la ausencia de respuesta (T4L 5,23ng/dl, T3L 6,15pg/ml, TSH 0,015mcU/ml) y un nuevo episodio de FA con respuesta ventricular media rápida 2 meses más tarde. Un mes más tarde, en la analítica de control destacaban los siguientes hallazgos: bilirrubina total 0,4mg/dl (normal 0,2-1,4), GOT/AST 73U/L (normal 17-59), GPT/ALT 200U/L (21-72), GGT 1.163U/L (11-73), fosfatasa alcalina 367U/L (38-126), LDH 598U/L (313-618). Tales resultados eran compatibles con un patrón de colestasis disociada, que no estaba presente en la analítica realizada en mayo de 2011 (bilirrubina total 0,5mg/dl, GOT/AST 36U/L, GPT/ALT 48U/L, GGT 21U/L, fosfatasa alcalina 76U/L, LDH sangre 483U/L).
Dado el inicio reciente del tratamiento con metimazol y no encontrándose otras causas de forma inmediata que justificaran dicha alteración analítica, se orientó el caso como una hepatitis aguda probablemente secundaria a dicho fármaco, por lo que se retiraron los antitiroideos de forma inmediata. Sin embargo, para confirmar el diagnóstico se solicitaron otras pruebas complementarias con el fin de descartar otras causas de hepatopatía. La ecografía abdominal no evidenció alteraciones hepáticas ni de la vía biliar. Las serologías de virus hepatotropos fueron negativas, así como el estudio de autoinmunidad hepática y otras conectivopatías, el perfil férrico, el cobre y la ceruloplasmina. Se descartaron así las causas infecciosas, autoinmunes o metabólicas.
Tras la retirada del fármaco se evidenció una mejoría progresiva del patrón de colestasis disociada hasta su completa normalización 12 semanas después (tabla 1), apoyando el diagnóstico de hepatitis aguda colestásica secundaria a metimazol.
Evolución de los parámetros analíticos
| Parámetros analíticos | Basal (sin MMZa) | 4 meses tras inicio MMZ | 1 mes tras suspensión MMZ | 3 meses tras suspensión MMZ | En la actualidad |
| Bilirrubina total(VN: 0,2-1,4 mg/dl) | 0,5 | 0,4 | 0,6 | 0,8 | 0,6 |
| Fosfatasa alcalina(VN: 38-126 U/L) | 76 | 367 | 216 | 64 | 23 |
| GOT/AST(VN:17-59 U/L) | 36 | 73 | 37 | 28 | 24 |
| GPT/ALT(VN: 21-72 U/L) | 48 | 200 | 84 | 49 | 52 |
| GGT(VN: 11-73 U/L) | 21 | 1.163 | 716 | 60 | 29 |
| LDH(VN: 313-618 U/L) | 483 | 488 | 483 | 451 | 422 |
| TSH(VN: 0,55-4,78 mcU/mL) | 0,009 | 0,005 | 0,015 | 0,035 | 3,71 |
| T4 libre(VN: 0,89-1,76 ng/dl) | 4,21 | 2,09 | 2,19 | 2,05 | 1,3 |
| T3 libre(VN: 2,3-4,2 pg/ml) | 6,59 | 3,31 | 3,89 | 3,75 | 2 |
Una vez resuelto el cuadro, a fin de controlar de forma más o menos inmediata la tirotoxicosis para evitar exacerbaciones de su patología cardíaca, se decidió realizar una tiroidectomía total. Tres meses después de la resección tiroidea, el paciente se encontraba asintomático y con unos niveles de hormonas tiroideas dentro del rango de la normalidad con 100mcg al día de levotiroxina sódica.
DiscusiónEn esta carta se describe un nuevo caso de hepatitis aguda colestásica secundaria al tratamiento con metimazol. Pese a ser un efecto adverso con una incidencia inferior al 1% y que se presenta con mayor frecuencia con el propiltiouracilo, su mortalidad cercana al 20-25% hace que sea un efecto secundario a tener en cuenta6.
La forma típica de presentación es un síndrome colestásico caracterizado por ictericia, coluria, acolia y prurito, junto con un incremento de los parámetros de colestasis, asociándose con frecuencia una elevación moderada de las transaminasas. Apoya su diagnóstico una secuencia temporal entre el inicio del tratamiento con tionamidas, habitualmente entre 2 semanas y 3 meses, y la aparición del cuadro clínico. Sin embargo, nuestro paciente presentaba un patrón de colestasis disociada, dificultando un posible diagnóstico clínico.
Ya se ha comentado previamente que se trata de un diagnóstico de exclusión. La única forma de confirmarlo sería a través de la histología que, en el caso del metimazol o carbimazol, correspondería a una colestasis hepatocanalicular, a diferencia del propiltiouracilo, en donde la lesión suele ser hepatocelular y, por ello, más grave5. Evidentemente, por cuestiones prácticas y éticas, la obtención de una muestra histológica resulta prácticamente imposible. Por otra parte, la normalización progresiva de los parámetros hepáticos tras la suspensión del fármaco apoyaría de forma indirecta el diagnóstico.
Por ello, ante la sospecha clínica deberíamos suspender el tratamiento con tionamidas y a su vez excluir otras causas de hepatopatía aguda. Sin embargo, se debe tener en cuenta que el hipertiroidismo per se condiciona incrementos en la FA y GGT hasta en el 50% de los pacientes, normalizándose dichos parámetros con la restitución del eutiroidismo5,6. No obstante, dichas elevaciones suelen ser más leves que cuando son secundarias al tratamiento con tionamidas y no se asocian a patrones de colestasis.
Las guías más recientes recomiendan descartar anomalías de la función hepática previo al inicio del tratamiento con antitiroideos, aunque no de forma rutinaria durante el seguimiento. Únicamente recomiendan solicitar un perfil hepático cuando el paciente presente síntomas y signos compatibles con una afectación hepática y especialmente si están en tratamiento con propiltiouracilo1. En nuestro caso no hubiéramos podido realizar un diagnóstico precoz por no presentar clínica alguna y por estar tratado con metimazol, con las potenciales consecuencias que hubieran podido derivarse de ello. Un aspecto a discutir es si la prevalencia de alteraciones en los parámetros hepáticos con las otras 2 tionamidas es tan baja, ya que, en nuestro caso, si no se determina de rutina el perfil hepático, dicho efecto secundario puede pasar desapercibido. Por otra parte, a nivel práctico el interés es menor, ya que probablemente el porcentaje de elevaciones asintomáticas que evolucionan mal es, casi con seguridad, muy bajo.
Es indudable la necesidad, por la frecuencia y gravedad de las consecuencias, de la determinación periódica, o ante la mínima sospecha clínica, de los parámetros de función hepática en sujetos tratados con propiltiouracilo.
El dilema reside en averiguar si sería coste-efectivo la realización de perfiles hepáticos de rutina en los individuos tratados con metimazol o carbimazol, puesto que, tal y como se ha mencionado, la yatrogenia hepática con dichos fármacos es poco frecuente y, en caso de aparecer, la mayoría corresponden a patrones de colestasis que pueden diagnosticarse clínicamente. Muy posiblemente la prevalencia de anomalías hepáticas con estos fármacos sea superior, aunque a nivel práctico posiblemente cursen de forma indolente y se resuelvan de forma espontánea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.