El síndrome de Cushing (SC) es una patología rara que puede verse más frecuentemente secundaria a la ingesta de glucocorticoides (GC). Los datos más distintivos entre SC endógeno (SCE) y yatrógeno (SCI) no han sido publicados.
ObjetivoComparar la puntuación obtenida del índice de gravedad en síndrome de Cushing (IGSC) en ambas etiologías: endógeno y yatrógeno; y documentar qué parámetros clínicos del IGSC son los más frecuentes y representativos del SC.
Material y métodosEstudio observacional, descriptivo y transversal. En el grupo SCE se incluyeron pacientes de ambos géneros con diagnóstico de hipercortisolismo endógeno, que dispusieran de una medición de corticotropina (ACTH) y ausencia de causas de pseudocushing. En el grupo con SCI se incluyeron aquellos pacientes con antecedentes de uso de GC sistémicos a dosis altas, facies cushingoide, ausencia de causas de pseudocushing y sin diagnóstico de hipertensión arterial y diabetes mellitus previo al inicio de la ingesta de GC. Se indagó el diagnóstico de la entidad nosológica causante de SCE. A los pacientes con SCI se les documentó las características de los GC empleados y la forma de uso. Se calcularon las dosis diarias y acumuladas en miligramos de prednisona. Se aplicó el IGSC a los pacientes con SCI y SCE, y se comparó la puntuación y características clínicas entre ambos.
ResultadosSe incluyeron 20 pacientes, 10 con SCI y 10 con SCE. El 80% (8) de los pacientes con SCE y la mitad (5) de los pacientes con SCI fueron mujeres. Los diagnósticos en los pacientes con SCE fueron 9 SC dependientes de ACTH y 1 independiente de ACTH. El promedio de la dosis diaria en equivalencia de prednisona utilizada por los pacientes de SCI fue de 13,5mg, y la media de dosis total acumulada para todos los pacientes con SCI fue de 9.962,5mg. El promedio de la puntuación total del IGSC para el grupo de SCE fue de 8,6 vs 3,8 puntos para pacientes con SCI, (p<0,005, 95% intervalo de confianza 3,36–6,23). Todos los pacientes con SCE obtuvieron una puntuación de 6 o más puntos, ningún paciente con SCI obtuvo más de 6 puntos. Las variables de distribución de grasa, hipertensión arterial, diabetes mellitus y alteraciones relacionadas con el género son las que tuvieron mayor representatividad clínica en pacientes con SCE.
ConclusiónLos pacientes con SCE tienen un IGSC mayor a los pacientes con SCI. Las diferencias clínicas entre ambos grupos pueden ser importantes.
Cushing's syndrome (CS) is a rare condition that is most often secondary to glucocorticoid (GC) intake. Definitive data on the distinction between endogenous CS (ECS) and yatrogenic (YCS) have not been published.
ObjectiveTo compare the severity index in Cushing's syndrome (SICS) score in the two etiologies, endogenous and yatrogenic, and identify which clinical parameters of the SICS are the most frequent and representative of CS.
Material and methodsWe performed an observational, descriptive and cross-sectional study. The ECS group included men and women with a diagnosis of endogenous hypercortisolism, with measurement of adrenocorticotropin hormone (ACTH) and absence of causes of pseudo-Cushing's syndrome. The YCS group included patients with a history of use of high-dose systemic GC, cushingoid facies, absence of causes of pseudo-Cushing's syndrome and no diagnosis of hypertension or diabetes mellitus before the start of GC intake. We investigated the diagnosis of the disease entity causing ECS. In patients with ICS, the characteristics of the GC employed and how these drugs were used were recorded. We calculated daily and cumulative doses in milligrams of prednisone. In all patients, the SICS was applied and the clinical characteristics of the two groups were compared.
ResultsWe included 20 patients, 10 with YCS and 10 with ECS. There were eight women in the ECS group (80%) and five in the YCS group (50%). The diagnoses in patients with ECS were ACTH-dependent CS in nine and ACTH-independent CS in one. The mean daily dose of prednisone equivalent used by patients with YCS was 13.5mg, and the mean total cumulative dose for all patients with ICS was 9962.5mg. The mean total SICS score for the ECS group was 8.6 and was 3.8 points for the YCS group (p <0.005, 95% CI 3.36–6.23). All patients with ECS had a mean score of 6 or higher whereas none of the patients with ICS scored more than 6 points. Fat distribution, hypertension, diabetes mellitus and gender-related changes were more representative of patients with ECS.
ConclusionSICS scores were higher patients with ECS than in those with ICS. The clinical differences between the two groups may be important.
El síndrome de Cushing (SC) se presenta como consecuencia a la exposición prolongada y crónica de glucocorticoides (GC), la causa más común es el síndrome de Cushing exógeno o yatrógeno (SCY)1,2. El SC es más común en mujeres, su incidencia es de 0,7 a 2,4 por 1 millón de población por año3. Los GC son esteroides sintéticos efectivos en el manejo de procesos inflamatorios, alérgicos, hematológicos, autoinmunes, etc. Debido a su notable efecto antiinflamatorio y de reducción de dolor de manera secundaria, el empleo de estos medicamentos lleva al paciente al consumo indiscriminado y a la presentación de los efectos adversos4,5. Los pacientes con SC no controlado tienen un incremento de 5 veces en la mortalidad6. Los estudios de despistaje realizados en pacientes diabéticos, especialmente aquellos con obesidad e hipertensión, sugieren que tiene una prevalencia de 2 a 5%7.
El síndrome de Cushing endógeno (SCE) se debe en el 80 a 85% de los casos a causas dependientes de corticotropina (ACTH): el 80% es debido a tumores pituitarios, y el 20% restante es secundario a secreción ectópica de ACTH, que usualmente deriva de tumores carcinoides o carcinoma de células pequeñas del pulmón. El SC independiente de ACTH ocurre en 15 a 20%, y la mayoría de estos casos es debido a un tumor adrenal (adenoma o cáncer 75%)1,6,8. La complicación sistémica más importante del SCE es el síndrome metabólico, que ocurre en alrededor de 75% de los pacientes9. Las manifestaciones clínicas del SCE son muy variadas e incluyen la afectación de múltiples órganos y sistemas como dermatológico, renal, óseo, neurológico, reproductivo, etc.
El SCY es debido a una exposición crónica y en exceso de GC sintéticos que suprimen la síntesis y secreción del factor hipotalámico liberador de corticotropina y por lo tanto de ACTH, que produce una atrofia bilateral de las glándulas suprarrenales y un descenso del cortisol endógeno10. El uso de prednisona a dosis altas durante 5 días disminuye el peso de la glándula adrenal, aunque depende de las dosis y tiempo total en que se haya empleado. La administración de prednisona a dosis de 20 a 30mg durante 7 días o más inhibe el eje hipotálamo hipófisis suprarrenal (HHS). A dosis bajas (menores de 7,5mg) puede suprimir el eje HHS en un intervalo de un mes11,12. El cuadro clínico es multisistémico y los signos y síntomas aparecen de forma progresiva en función del tiempo de uso y la dosis utilizada. Las manifestaciones clínicas más frecuentes son la obesidad central (90%), hipertensión arterial en el 85% de los casos, intolerancia a la glucosa (75%) y diabetes en el 20%. Los pacientes pueden desarrollar osteoporosis, miopatía proximal y alteraciones neuropsiquiátricas.
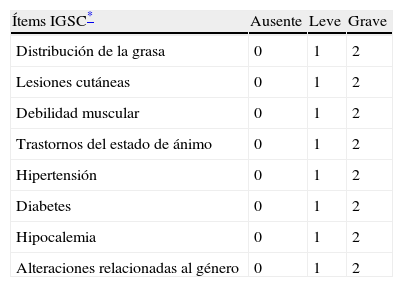
Como instrumentos clinimétricos para la medición de la gravedad del SC, contamos con un índice de gravedad de Cushing diseñado por Sonino et al13 Este índice fue validado en pacientes con SCE, consta de 8 variables clínicas que se califican de 0 a 2 (tabla 1) con un intervalo de puntuación total de 0 a 16. La validación se realizó en 14 pacientes con SCE evaluados de manera independiente por dos endocrinólogos, antes y después del tratamiento. La calificación promedio obtenida antes del tratamiento fue de 8,5±2,7 (observador 1) y de 8,4±2,8 (observador 2) y después del tratamiento de 1,9±1,6 para los dos observadores (p<0,001). En el SCE el cortisol urinario se correlacionó con dos escalas globales de gravedad. Este instrumento no se había empleado en pacientes con SCY.
Índice clínico para grado de gravedad en el síndrome de Cushing13
| Ítems IGSC* | Ausente | Leve | Grave |
| Distribución de la grasa | 0 | 1 | 2 |
| Lesiones cutáneas | 0 | 1 | 2 |
| Debilidad muscular | 0 | 1 | 2 |
| Trastornos del estado de ánimo | 0 | 1 | 2 |
| Hipertensión | 0 | 1 | 2 |
| Diabetes | 0 | 1 | 2 |
| Hipocalemia | 0 | 1 | 2 |
| Alteraciones relacionadas al género | 0 | 1 | 2 |
En un trabajo del servicio de Reumatología del Hospital General de México14 el índice de gravedad del síndrome de Cushing (IGSC) que se utilizó, modificado del original de Sonino, tuvo una adecuada correlación con las manifestaciones clínicas en pacientes con uso crónico de GC. Se logró mejorar la concordancia inter-observador al establecer mejores parámetros para evaluar las manifestaciones clínicas subjetivas. El IGSC tuvo una adecuada validez convergente y una buena consistencia y reproducibilidad. En base a que el IGSC original realizado por Sonino tiene como dificultades la ausencia de rangos bien establecidos en las definiciones de sus ítems, en el presente trabajo tomamos como base el IGSC modificado por Barerra-Guerra y colaboradores14.
El SCE puede ocurrir en pacientes que previamente estén tomando o aplicándose GC, esto lleva al clínico a la confusión diagnóstica y generalmente a la ausencia de investigación de SCE, intuyendo el cuadro típico como causa de los GC exógenos. Es necesario comparar aspectos clínicos y ciertas mediciones bioquímicas en pacientes con SCY y SCE; se propone indagar sus diferencias de acuerdo al IGSC y evaluar si existe diferencia entre ambas entidades para poder decidir cuándo estudiar a un SC de probable etiología endógena en un paciente que además esté utilizando de manera exógena GC.
El objetivo del estudio fue documentar qué parámetros clinimétricos del IGSC son los más frecuentes y representativos del SC. Comparar la puntuación obtenida con el IGSC en ambas etiologías: SCE y SCY. Los objetivos secundarios fueron averiguar la frecuencia de SCE en un año en el servicio de endocrinología del Hospital General de México, describir las características del SC en ambos grupos y correlacionar la puntuación del IGSC con las concentraciones séricas de ACTH y cortisol urinario en el SCE.
Material y métodosEstudio observacional, descriptivo y transversal. Se estudiaron a pacientes del servicio de endocrinología y reumatología del Hospital General de México. Se obtuvieron los datos clínicos y bioquímicos de SCE y SCY de dichos servicios respectivamente. Los pacientes del servicio de reumatología presentaban ingesta de GC y SCY.
Se establecieron los siguientes criterios de inclusión: para pacientes con SCE: 1) pacientes de ambos géneros con diagnóstico hipercortisolismo endógeno, es decir, pacientes con cortisol libre urinario (CLU) de 24h mayor de 100μg/d medida por radioinmunoanálisis, con una segunda prueba confirmatoria; y que tras la administración de 1mg de dexametasona a las 23.00h, la medición de cortisol sérico al día siguiente a las 8.00h fuera mayor de 1,8μg/dl1,2; 2) pacientes con una medición de ACTH; 3) ausencia de alcoholismo activo, anorexia nervosa y trastornos psiquiátricos previos; 4) expediente clínico completo; 5) ausencia de uso actual y en los seis meses previos de GC exógenos. Para pacientes con SCY: 1) pacientes de ambos géneros con antecedentes de uso de GC sistémicos por vía oral a dosis altas (>30mg/d por semana) durante al menos 6 meses; 2) ausencia de alcoholismo activo y trastornos psiquiátricos previos; 3) facies cushingoide; 4) ausencia de diagnósticos de hipertensión arterial y diabetes mellitus previo al inicio de la ingesta de GC; 5) expediente clínico completo. Criterios de exclusión para ambos grupos fueron embarazo en mujeres y presencia de insuficiencia renal crónica con depuración de creatinina menor a 60ml/min. Se realizó la recolección de datos de manera prospectiva.
Se tomaron en cuenta las siguientes características demográficas: género, edad y la presencia o ausencia de los siguientes datos clínicos: empleo o no de GC, obesidad, presencia de lesiones cutáneas, debilidad muscular, hipertensión arterial sistémica (HAS) y alteraciones relacionadas con el género como hirsutismo, alteraciones menstruales o pérdida de pelo para mujeres e impotencia o disminución de la libido para hombres.
A todos los sujetos con SCE se les realizó determinación de niveles séricos de ACTH, cortisol libre urinario (CLU) de 24h, cortisol sérico como prueba confirmatoria de hipercortisolismo posterior a la administración de 1mg de dexametasona la noche previa (23.00h); electrolitos séricos y bioquímica. Para el diagnóstico de la entidad nosológica causante del SCE se midió ACTH sérica además de realizarse como prueba de localización la prueba de supresión con dexametasona a dosis altas (8mg) a las 23.00h y medición de cortisol sérico matutino al día siguiente. De acuerdo a los resultados de las pruebas anteriores se decidió realizar a los pacientes resonancia magnética (RM) de cráneo con foco en silla turca, si el SCE era dependiente de ACTH y existía una supresión del cortisol post-dexametasona mayor o igual al 68% con respecto del cortisol basal. En el caso contrario (SC independiente de ACTH) se realizó tomografía abdominal con búsqueda de alteraciones a nivel de glándulas adrenales. La búsqueda con tomografía computada se intensificó a tórax, abdomen y pelvis ante casos dependientes de ACTH con RM de cráneo normal.
Todos los pacientes con SCY cumplimentaron un cuestionario dirigido por un encuestador de recolección de datos el cual abarcó tanto los datos demográficos generales, así como las características de los GC empleados y la forma de uso. Además se registró la presencia o ausencia de eventos adversos. Se calcularon las dosis diarias y acumuladas en miligramos de prednisona o equivalente.
Se tomó el IGSC modificado y ya estudiado por Barrera Guerra et al14. Se aplicó a pacientes tanto con SCY y SCE. Los parámetros evaluados se muestran en la tabla 2:
Parámetros evaluados en el índice de gravedad en síndrome de Cushing (IGSC) de Sonino modificado por Barrera Guerra et al14
|
ICC: índice cintura cadera; SC: superficie cutánea; K: potasio.
Se establecieron las siguientes definiciones de variables:
- 1)
Obesidad central: se clasificó en base al índice cintura/cadera (ICC) que es un indicador de la distribución de grasa corporal que permite distinguir entre la obesidad de tipo androide con predominio de la grasa en la parte superior del tronco, de la de tipo ginecoide predominantemente en las caderas. Las medidas se hacen midiendo el perímetro de la cintura a la altura de la última costilla flotante, o bien a nivel de las crestas iliacas y el perímetro máximo de la cadera a nivel de los glúteos. Los valores normales para la población mexicana mestiza son de 0,77 a 0,84 para las mujeres y 0,78 a 0,93 para hombres. Las cifras más altas indica distribución de tipo androide y las menores, una distribución ginecoide. Su fórmula es la siguiente15: ICC=perímetro de cintura (cm)/perímetro de cadera (cm).
- 2)
Facies cushingoide: hábito externo de un paciente con hipercortisolismo presentando cara de luna llena, pletórica con o sin hipertricosis, y obesidad central. Puede haber giba dorsal (acumulo de grasa en región media dorsal alta) y acné (lesiones comedogénicas que aparecen en cara y tronco).
- 3)
Estrías: lesiones cutáneas que aparecen en tronco y extremidades que se observan de color rojizo violáceo cuando son de reciente aparición o blanquecino cuando son lesiones de mayor tiempo de evolución.
- 4)
Fragilidad en la piel: adelgazamiento y atrofia cutánea con aparición de equimosis aun con contactos leves. Para la clasificación de lesiones cutáneas se utilizará la regla de los 9's, considerando que la afección de ≤de 18% de la superficie corporal es una afección leve y >18% de afección de la superficie corporal es una afección grave16.
- 5)
Infecciones agregadas: aumento de la predisposición o susceptibilidad a infecciones. Se considera infecciones graves las que requieren uso de antibióticos intravenosos u hospitalización e infecciones leves aquellas que no requieren hospitalización ni uso de antibióticos intravenosos.
- 6)
Debilidad muscular: deterioro en la función de grupos musculares para realizar actividades cotidianas, que bien puede condicionar solo disminución o bien incapacidad funcional importante. De acuerdo a la escala de puntuación de debilidad muscular tenemos que: 0=ausencia de contracción voluntaria, 1=se produce contracción, pero no desplazamiento, 2= se produce desplazamiento pero no vence gravedad, 3=vence gravedad, 4 (−)=vence gravedad y una débil oposición al examinador, 4 (+)=vence a una oposición fuerte del examinador, 5=fuerza normal. En el cuestionario CSI se tomo como ausente, leve (fuerza muscular en puntuación 4,5), y moderado (por debajo de 3)17.
- 7)
Trastornos de conducta: aquellas alteraciones del estado de ánimo. Se dice que son leves cuando el individuo puede controlarlas, sin que afecte su desempeño cotidiano, y moderadas cuando implica un deterioro funcional y requiere apoyo por médico especialista en salud mental.
- 8)
Hipertensión arterial sistémica (HAS): aumento de la presión arterial sistémica. Se medirá con esfigmomanómetro. Un valor ≥140/90mmHg se considerará como hipertensión arterial. Se considera HAS leve la presión arterial diastólica entre >90mmHg y ≤105mmHg e HAS grave a la presión arterial diastólica >105mmHg.
- 9)
Diabetes mellitus: se medirá por medio de la determinación las concentraciones de glucosa plasmática en sangre venosa. Dos valores mayores de 126mg/dl (7mmol/l) en ayunas, realizados en diferentes días se considera como diagnóstico.
- 10)
Dosis de GC: bajas: ≤7,5mg/d de prednisona o equivalente. Medias: 7,5–30mg/d de prednisona o equivalente. Altas: >30–100mg/d de prednisona o equivalente.
Se utilizaron medidas de tendencia central (mediana) y dispersión (mínimo y máximo) para las variables cuantitativas, las frecuencias fueron expresadas en términos de proporción para variables nominales y ordinales. Para comparar los grupos de variables categóricas se usaron como pruebas de hipótesis la chi cuadrado (χ2) y la de la probabilidad exacta de Fisher; se aplicó la U de Mann-Whitney para datos cuantitativos y se estimaron medidas de correlación de Pearson o Spearman. El nivel de significancia se consideró en p<0,05 (dos colas). Se usó el paquete estadístico SPSS versión 12.0.
ResultadosSe incluyeron un total de 20 pacientes, 10 de ellos con SCY y 10 con SCE. En cuanto a los pacientes con SCE, 8 corresponden al género femenino (80%), con una mediana de edad de 29,9 años. La mitad de los pacientes con SCY fueron de género femenino (50%), con una mediana de edad de 35,7 años. La media de edad para todos los pacientes fue de 32,8 años con una desviación estándar (DE) de 12,2 años.
Los diagnósticos establecidos en los pacientes con SCE fueron los siguientes: 9 de ellos con SCE dependiente de ACTH de los cuales 6 tuvieron enfermedad de Cushing (5 con microadenoma y un paciente con macroadenoma hipofisario), y en tres pacientes no se identificó la causa del SCE secretor de ACTH. Un paciente presentó SCE independiente de ACTH cuyo diagnóstico fue adenoma suprarrenal derecho productor de cortisol. El promedio de CLU de 24h en estos pacientes fue de 829,3μg/24h (mínimo 517,2, máximo 2.406,2) con una mediana de 1.110,7. El promedio de ACTH sérica fue de 99,1pg/ml (10–281). Sin embargo, cuando tomamos como promedio la concentración de ACTH de los 9 pacientes que presentaron SCE dependiente de ACTH, esta resultó en 109pg/ml (17–281).
Todos los pacientes con SCY utilizaban GC para enfermedades reumatológicas con los siguientes diagnósticos: 5 de ellos artritis reumatoide, 3 lupus eritematoso sistémico, un paciente dermatomiositis y otro con enfermedad por adyuvantes. El esteroide más utilizado fue la prednisona (8 pacientes), un paciente con betametasona y otro con daflazacort.
El promedio de tiempo de consumo de esteroides fue de 11 meses, la dosis diaria en equivalencia de prednisona utilizada por los pacientes fue de 13,5mg/d (5–50mg). El promedio de dosis total acumulada para todos los pacientes con SCY fue de 9.962,5mg (3.630–245.280mg).
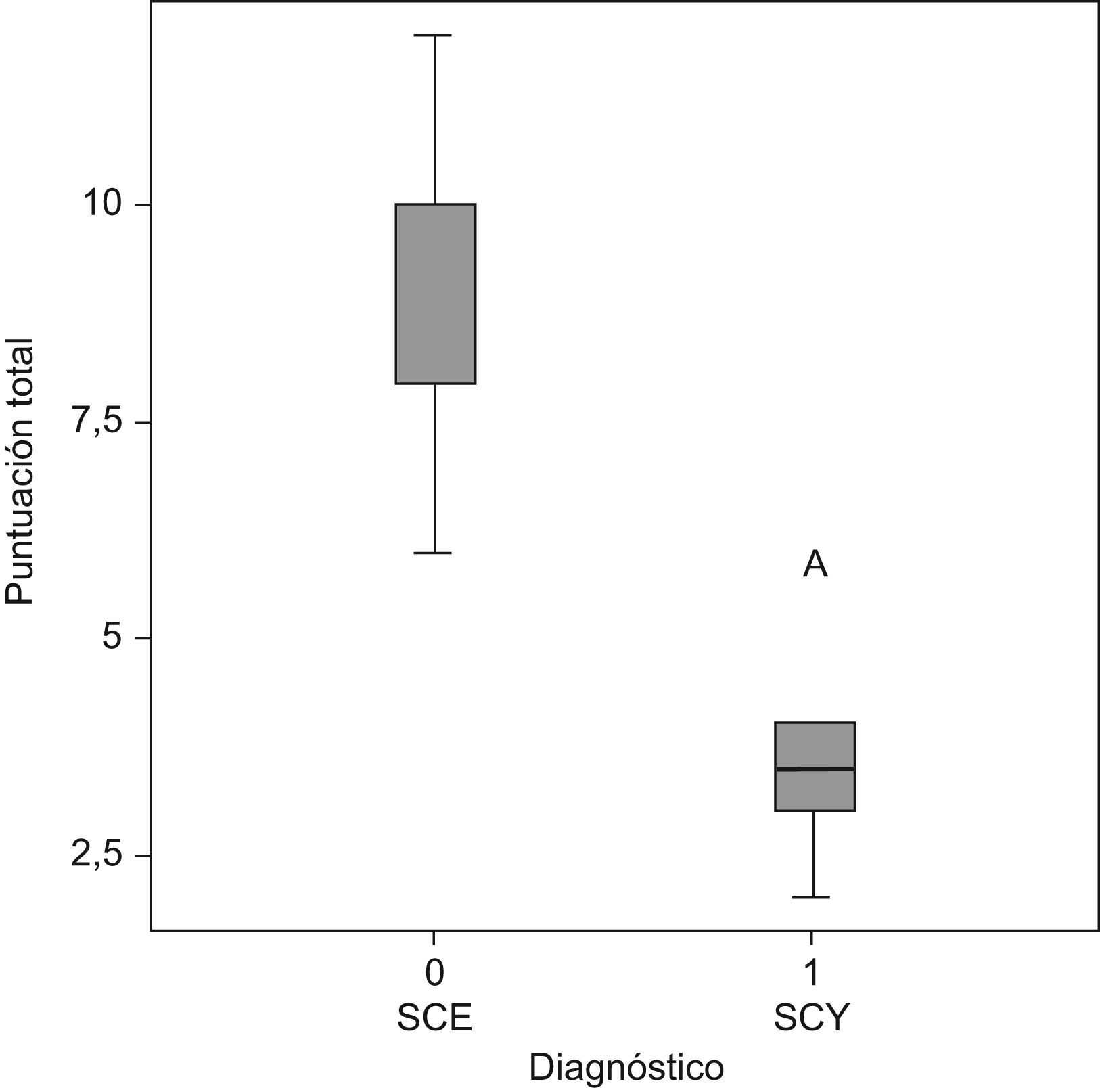
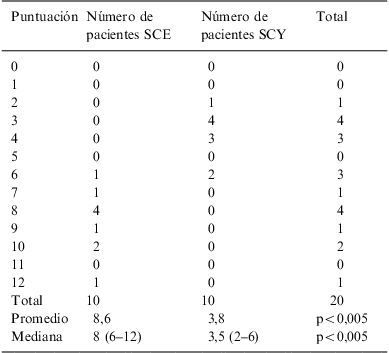
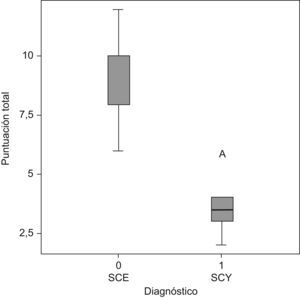
En cuanto al promedio de la puntuación total del IGSC para el grupo de SCE fue de 8,6 puntos con DE de 1,7, comparado con 3,8 puntos (DE=1,3) para pacientes con SCY, (p<0,005, 95% intervalo de confianza 3,36–6,23). Todos los pacientes con SCE obtuvieron una puntuación de 6 o más puntos, en cambio ningún paciente con SCY obtuvo más de 6 puntos. La mediana de la puntuación total del IGSC para todos los pacientes fue de 6,2 con DE=2,8 (tabla 3, fig. 1).
Escala de la puntuación total del índice de gravedad del síndrome de Cushing que presentaron los pacientes
| Puntuación | Número de pacientes SCE | Número de pacientes SCY | Total |
| 0 | 0 | 0 | 0 |
| 1 | 0 | 0 | 0 |
| 2 | 0 | 1 | 1 |
| 3 | 0 | 4 | 4 |
| 4 | 0 | 3 | 3 |
| 5 | 0 | 0 | 0 |
| 6 | 1 | 2 | 3 |
| 7 | 1 | 0 | 1 |
| 8 | 4 | 0 | 4 |
| 9 | 1 | 0 | 1 |
| 10 | 2 | 0 | 2 |
| 11 | 0 | 0 | 0 |
| 12 | 1 | 0 | 1 |
| Total | 10 | 10 | 20 |
| Promedio | 8,6 | 3,8 | p<0,005 |
| Mediana | 8 (6–12) | 3,5 (2–6) | p<0,005 |
SCE: síndrome de Cushing endógeno; SCY: síndrome de Cushing yatrógeno.
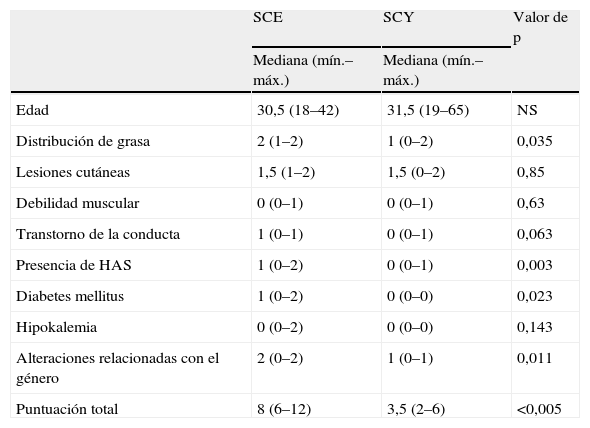
De las características de los pacientes con SCE evaluadas en el IGSC, se observó que las variables de distribución de grasa, presencia de HAS, diabetes mellitus y alteraciones relacionadas con el género son las que tuvieron mayor significación estadística en cuanto a la frecuencia de presentación y representatividad en pacientes con SCE; y no así las variables de lesiones cutáneas, debilidad muscular, trastornos de la conducta e hipocalemia, las cuales se presentan en una frecuencia similar en pacientes tanto de SCY como de SCE (tabla 4). Se puede señalar que existe cierta tendencia, aunque no significativa, de que los trastornos de conducta se presenten mayormente en pacientes con SCE. De las características clinimétricas del IGSC que mejor distinguieron entre el SCE del SCY fueron la presencia de HAS, diabetes mellitus y alteraciones relacionadas con el género (tabla 4). No encontramos correlación entre los niveles de CLU de 24h y las concentraciones de ACTH en pacientes con SCE.
Frecuencia de presentación de las variables del IGSC en SCE y SCY
| SCE | SCY | Valor de p | |
| Mediana (mín.–máx.) | Mediana (mín.–máx.) | ||
| Edad | 30,5 (18–42) | 31,5 (19–65) | NS |
| Distribución de grasa | 2 (1–2) | 1 (0–2) | 0,035 |
| Lesiones cutáneas | 1,5 (1–2) | 1,5 (0–2) | 0,85 |
| Debilidad muscular | 0 (0–1) | 0 (0–1) | 0,63 |
| Transtorno de la conducta | 1 (0–1) | 0 (0–1) | 0,063 |
| Presencia de HAS | 1 (0–2) | 0 (0–1) | 0,003 |
| Diabetes mellitus | 1 (0–2) | 0 (0–0) | 0,023 |
| Hipokalemia | 0 (0–2) | 0 (0–0) | 0,143 |
| Alteraciones relacionadas con el género | 2 (0–2) | 1 (0–1) | 0,011 |
| Puntuación total | 8 (6–12) | 3,5 (2–6) | <0,005 |
HAS: hipertensión arterial sistémica; IGSC: índice de gravedad del síndrome de Cushing; máx.: máximo; mín.: mínimo; NS: no significativo; SCE: síndrome de Cushing endógeno; SCY: síndrome de Cushing yatrógeno.
La frecuencia del SCE en el Hospital General de México fue de 10 pacientes en un año, parece ser una frecuencia baja, pero hay que tener en cuenta que la incidencia de SC a nivel mundial es baja y va de 0,7 a 2,4 por 1 millón de población por año3. De igual manera se señala una mayor frecuencia de SCE en mujeres, coincidentemente 80% fueron mujeres en nuestro estudio. La edad promedio para SCE fue de 29,9 años similar al reportado en la literatura desde las descripciones iniciales de esta patología18.
En nuestro estudio la distribución en cuanto a su etiología fue similar a la reportada en la literatura, pues el 90% (9 pacientes) se debió a dependencia de ACTH: 67% debido a tumores pituitarios y 33% de origen no identificado a pesar de habérseles realizado a estos pacientes rastreo corporal con imágenes de tomografía computarizada. El 10% (un paciente) de los casos fue secundaria a SCE independiente de ACTH (tumor adrenal).
En cuanto a los pacientes con SCY podemos señalar que la dosis media de prednisona que fue de 20,4mg/d, por un promedio de 11 meses, lo que fue suficiente para causar SCY caracterizado por facies cushingoide y algunas otras características o variables señaladas en el IGSC. El empleo de prednisona a dosis de 20 a 30mg por 7 días o más inhibe el eje HHS. A dosis bajas (menores de 7,5mg) pueden suprimir el eje HHS en un intervalo de un mes11,12. Con una dosis mayor de 5mg al día se produce con mayor frecuencia una inhibición del eje HHS19. El promedio de dosis de prednisona de nuestros pacientes fue de 13,5mg/d y por lo tanto era de esperarse la supresión del eje HHS y el desarrollo de SCY.
La puntuación total de acuerdo al IGSC en pacientes con SCE tuvo un promedio de 8,6 equiparable al reportado en el estudio inicial de Sonino13. Es de señalar que nuestros pacientes con SCE que ya fueron tratados y cumplen criterios de curación de SC (cortisol sérico posterior al tratamiento ≤5μg/dl o cortisol libre en orina de 24h <20μg/d)2 serán reevaluados para aplicarles el IGSC a los 6 y 12 meses de seguimiento. El puntuación total para SCE adquirió una significancia estadística comparado con el puntuación total de los pacientes con SCY (3,8 puntos), dato relevante que puede orientarnos acerca de las diferencias clínicas al estudiar a un SC de etiología endógena comparado del SC de etiología yatrógena. Lo anterior adquiere aún mayor relevancia ya que se estima que entre 1–3% de la población adulta a nivel mundial consume GC de manera crónica4. Además en nuestro medio se ha reportado que hasta el 58% de los pacientes que solicitan ayuda por probable patología reumática utilizan GC antes de ser valorados por el especialista20.
De las características más significativas de SCE que se presentaron en nuestro estudio de acuerdo a las evaluadas por el IGSC, la distribución de grasa, trastornos de la conducta, presencia de HAS, diabetes mellitus y alteraciones relacionadas con el género son las que tuvieron mayor significancia estadística. Las alteraciones anteriores ya han sido reportadas previamente y con una frecuencia considerablemente alta9. Lo comentado anteriormente no exime que un paciente con SCY esté exento de dichas manifestaciones, pues como observamos en la tabla 4 éstas pueden estar presentes en pacientes con SCY.
Consideramos que los pacientes con SCE tienen un IGSC mayor a los pacientes con SCY, explicado parcialmente por el mecanismo fisiopatológico endógeno debido al exceso de producción de ACTH o cortisol, lo cual inducirá por una parte un efecto mineralocorticoide y mayor HAS a diferencia del empleo de GC con leve o ausencia de dicho efecto. Toma relevancia de igual manera que el aumento de andrógenos de procedencia adrenal en respuesta a ACTH puede ejercer efectos anabólicos y así contrarrestar algunas acciones catabólicas de los glucocorticoides.
No se demostró que exista correlación entre la puntuación del IGSC con las concentraciones plasmáticas de ACTH y el cortisol urinario de 24h en el SCE. Lo anterior pudiera estar en relación a la variabilidad de secreción de ACTH a lo largo del día, variabilidad en diferentes días y al ritmo cíclico de su liberación. De igual manera las lesiones cutáneas, debilidad muscular, trastornos de la conducta e hipocalemia se pueden presentar en ambos tipos de pacientes (SCE y SCY) sin embargo no mostraron tener alto peso de distinción.
Sugerimos que se realicen estudios de despistaje para SC en pacientes diabéticos, especialmente aquellos con obesidad e hipertensión de difícil control, pues se ha estimado una prevalencia de 2–5% en estos pacientes1,7.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.