Exenatida es un agonista del receptor de GLP-1 empleado como tratamiento adyuvante en la diabetes mellitus tipo 2 (DM2), que ha demostrado ser tan eficaz como insulina glargina (IG) reduciendo la concentración de hemoglobina glucosilada, cuando se administra en combinación con metformina o/y sulfonilureas. Exenatida se asocia a una reducción de peso y a una mayor incidencia de acontecimientos adversos de tipo gastrointestinal.
El objetivo de este estudio fue evaluar el coste-efectividad de exenatida frente a IG en pacientes obesos con DM2, que no alcanzan un control glucémico adecuado, desde la perspectiva del sistema nacional de salud.
Material y métodosSe utilizó un modelo farmacoeconómico que incluyó información procedente de un ensayo clínico internacional, aleatorizado y controlado, que comparaba exenatida con IG, en pacientes con un inadecuado control de la glucosa, en concreto de la subpoblación de pacientes obesos (IMC ≥ 30 k/m2), y de datos específicos del país.
ResultadosExenatida se asocia con un incremento de años de vida ganados y años de vida ajustados por calidad (AVAC) (0,11 y 0,62, respectivamente), frente a IG. Los costes directos se incrementaron 9.306 € en comparación con IG (47.010 frente a 37.704 €) siendo los costes farmacológicos los más importantes. Esto se tradujo en un coste-efectividad incremental de 15.068 €/AVAC de exenatida frente a IG.
ConclusionesEn pacientes obesos con DM2, exenatida se asocia con mayores beneficios clínicos y mayores costes que IG. Considerando el umbral de disposición a pagar de 30.000 € /AVAC para España, exenatida representa una opción eficiente en comparación con IG.
Exenatide, a GLP-1 receptor agonist for adjuvant treatment of type 2 diabetes mellitus (T2DM), has been shown to be as effective as insulin glargine (IG) for reducing glycated hemoglobin levels combined with metformin or/and sulphonylureas. Exenatide is associated to weight reduction and a higher incidence of gastrointestinal adverse events.
The objective of this study was to assess the cost-effectiveness of exenatide as compared to IG in obese patients with T2DM not achieving an adequate blood glucose control from the perspective of the Spanish healthcare system.
MethodsPharmacoeconomic model inputs were obtained from an obese subpopulation (BMI ≥ 30 k/m2) of an international, randomized, controlled clinical trial comparing exenatide with IG in poorly controlled T2DM patients, and were supplemented with country-specific data.
ResultsExenatide was associated to improvements in life-years gained and quality-adjusted life years (QALYs) by 0.11 and 0.62 respectively versus IG. Direct costs were € 9,306 higher as compared to IG (€ 47,010 versus € 37,704, with increased pharmacy costs as the main driver). Exenatideís incremental cost-effectiveness ratio was € 15,068 per QALY gained versus IG.
ConclusionsExenatide was associated to greater clinical benefits and higher costs in obese T2DM patients as compared to IG. Considering a willingness-to-pay threshold of € 30,000 per QALY gained in the Spanish setting, exenatide represents an efficient option in comparison with IG.
La naturaleza crónica y progresiva de la diabetes mellitus tipo 2 (DM2) constituye un importante reto para el sistema sanitario español. La prevalencia actual de la diabetes en España se estima en un 8,7%1, siendo la DM2 responsable del 90% de los casos2. En términos de impacto global sobre la mortalidad de la población, en 2006 la diabetes constituyó la octava causa más común de muerte en España3. En términos de impacto económico, el tratamiento de la diabetes supone aproximadamente el 6% del gasto anual total de cada una de las 17 comunidades autónomas españolas4, siendo probablemente el tratamiento de las complicaciones y las hospitalizaciones los principales factores que explican este impacto económico. Existen distintas opciones para controlar la glucemia en los pacientes con DM2. Recientemente, se ha comercializado una nueva clase de fármacos, los agonistas del receptor de GLP-1 (glucagon like peptide-1 o péptido similar al glucagón tipo 1), de los cuales, exenatida, un péptido sintético inyectable, ha sido el primero en ser comercializado, demostrando no sólo una reducción de la glucemia (comparable a los actuales análogos de insulina), sino también del peso (característica que no se observa en las insulinas)5. Asimismo, se ha demostrado que la administración de exenatida reduce la concentración posprandial de glucosa y retrasa el vaciado gástrico6. Por otra parte, los datos de distintos estudios abiertos a largo plazo han demostrado que exenatida ejerce un efecto sostenido –durante un período de 3 años– sobre la concentración de hemoglobina glucosilada (HbA1c)7.
Teniendo en cuenta la creciente población de pacientes diabéticos y de los costes sanitarios cada vez mayores, es necesario que las nuevas intervenciones desarrolladas para mejorar la salud del paciente sean eficaces y presenten una buena relación coste-efectividad. Recientemente, se han publicado evaluaciones económicas en las que se hace una comparación entre exenatida e insulina glargina (IG)8–10. Sin embargo, ninguna de estas evaluaciones ha determinado la eficiencia de exenatida en la subpoblación de pacientes obesos con DM2 de España. A la vista de esta necesidad, el objetivo del estudio fue determinar y comparar en el entorno sanitario español el coste-efectividad de exenatida frente a IG, en pacientes con obesidad y DM2, desde la perspectiva del financiador sanitario.
Material y métodosModeloEn este análisis se empleó el Modelo de Diabetes CORE IMS11,12. Se estimaron los resultados clínicos y económicos a largo plazo, tomando como referencia los datos obtenidos en un ensayo clínico aleatorizado y multinacional, llevado a cabo por Heine et al5 (identificador ClinicalTrials.gov: NCT00082381). Este estudio, de una duración de 26 semanas, incluyó pacientes con DM2 que no alcanzaban una concentración de HbA1c<7,0% a pesar de administrarles dosis efectivas máximas de metformina o/y una sulfonilurea. Los pacientes fueron aleatorizados al tratamiento con exenatida (dos veces al día) o insulina IG (una vez al día), administrados en combinación con el antidiabético oral que el paciente estuviera recibiendo. La concentración de HbA1c se determinó a las 12 y 26 semanas de la aleatorización.
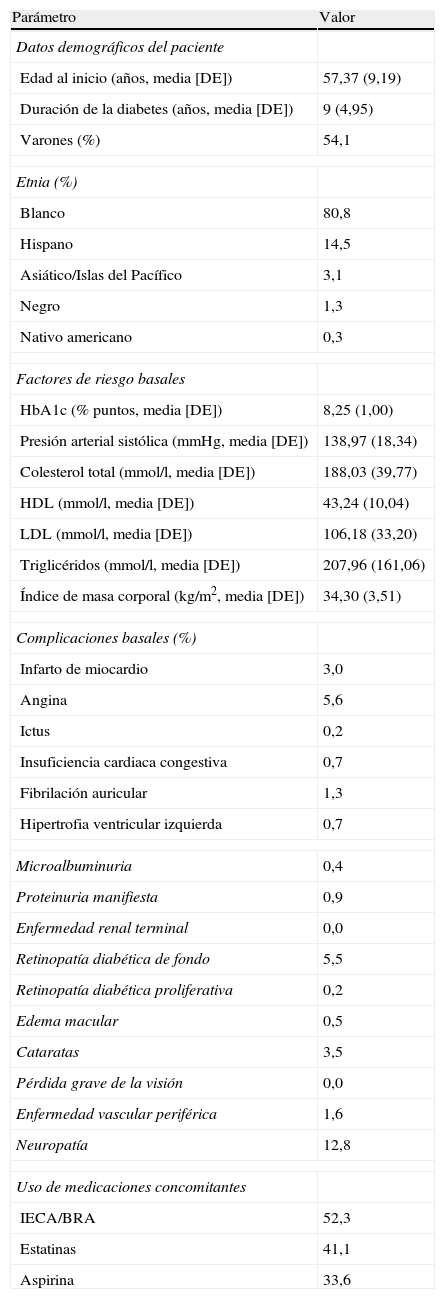
Características de las cohortes y eficacia del tratamientoSe definió una cohorte de pacientes, considerando los datos demográficos basales, las complicaciones y las medicaciones concomitantes más relevantes, representativos de la totalidad de este subgrupo de pacientes, con un índice de masa corporal (IMC) ≥ 30kg/m2, tomado a partir de los 2 grupos de tratamiento de la población por intención de tratar del ensayo clínico de Heine et al5 (n=318) (tabla 1). Teniendo en cuenta estos datos, se calcularon los resultados a largo plazo, utilizando una población hipotética de 1.000 pacientes (con cada uno de los cuales se realizaron 1.000 simulaciones en el modelo), con una edad basal media de 57,4 años, y de los cuales el 54,1% eran varones. En la visita basal, la duración media de la diabetes era de 9 años, la concentración media de HbA1c era del 8,25% y el IMC era de 34,3kg/m2. En este análisis, se asumió que los pacientes continuarían recibiendo el mismo tratamiento durante la totalidad de la simulación (es decir, durante 35 años o hasta el fallecimiento del paciente).
Características de los pacientes, complicaciones y tratamientos basales
| Parámetro | Valor |
| Datos demográficos del paciente | |
| Edad al inicio (años, media [DE]) | 57,37 (9,19) |
| Duración de la diabetes (años, media [DE]) | 9 (4,95) |
| Varones (%) | 54,1 |
| Etnia (%) | |
| Blanco | 80,8 |
| Hispano | 14,5 |
| Asiático/Islas del Pacífico | 3,1 |
| Negro | 1,3 |
| Nativo americano | 0,3 |
| Factores de riesgo basales | |
| HbA1c (% puntos, media [DE]) | 8,25 (1,00) |
| Presión arterial sistólica (mmHg, media [DE]) | 138,97 (18,34) |
| Colesterol total (mmol/l, media [DE]) | 188,03 (39,77) |
| HDL (mmol/l, media [DE]) | 43,24 (10,04) |
| LDL (mmol/l, media [DE]) | 106,18 (33,20) |
| Triglicéridos (mmol/l, media [DE]) | 207,96 (161,06) |
| Índice de masa corporal (kg/m2, media [DE]) | 34,30 (3,51) |
| Complicaciones basales (%) | |
| Infarto de miocardio | 3,0 |
| Angina | 5,6 |
| Ictus | 0,2 |
| Insuficiencia cardiaca congestiva | 0,7 |
| Fibrilación auricular | 1,3 |
| Hipertrofia ventricular izquierda | 0,7 |
| Microalbuminuria | 0,4 |
| Proteinuria manifiesta | 0,9 |
| Enfermedad renal terminal | 0,0 |
| Retinopatía diabética de fondo | 5,5 |
| Retinopatía diabética proliferativa | 0,2 |
| Edema macular | 0,5 |
| Cataratas | 3,5 |
| Pérdida grave de la visión | 0,0 |
| Enfermedad vascular periférica | 1,6 |
| Neuropatía | 12,8 |
| Uso de medicaciones concomitantes | |
| IECA/BRA | 52,3 |
| Estatinas | 41,1 |
| Aspirina | 33,6 |
BRA: bloqueante de los receptores de angiotensina II; DE: desviación estándar; HbA1c: hemoglobina glucosilada; HDL: lipoproteína de alta densidad; IECA: inhibidor de la enzima conversora de la angiotensina; LDL: lipoproteína de baja densidad.
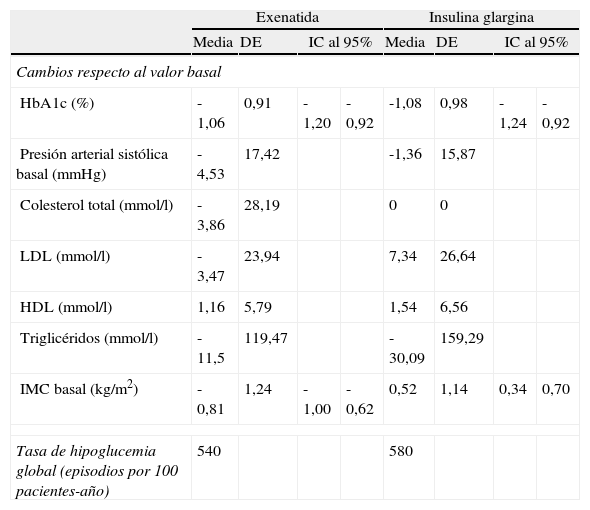
En las simulaciones, los efectos de la intervención se basaron en los resultados obtenidos en el mismo subgrupo de pacientes del ensayo clínico que se empleó en la cohorte de simulación (es decir, aquellos con un IMC ≥ 30kg/m2) (tabla 2). El tratamiento con exenatida se asoció con una reducción de 1,06% respecto a la concentración basal de HbA1c, mientras que el tratamiento con IG conllevó una reducción del 1,08%. La diferencia más notable entre los tratamientos se observó en relación con el cambio respecto al IMC basal: exenatida conllevó una reducción de 0,81kg/m2, mientras que IG se asoció con un aumento de 0,52kg/m2. Durante el estudio no se produjo ningún episodio hipoglucémico grave, y las tasas de episodios hipoglucémicos de carácter leve fueron comparables entre ambos grupos de tratamiento.
Resumen de los resultados de las intervenciones
| Exenatida | Insulina glargina | |||||||
| Media | DE | IC al 95% | Media | DE | IC al 95% | |||
| Cambios respecto al valor basal | ||||||||
| HbA1c (%) | -1,06 | 0,91 | -1,20 | -0,92 | -1,08 | 0,98 | -1,24 | -0,92 |
| Presión arterial sistólica basal (mmHg) | -4,53 | 17,42 | -1,36 | 15,87 | ||||
| Colesterol total (mmol/l) | -3,86 | 28,19 | 0 | 0 | ||||
| LDL (mmol/l) | -3,47 | 23,94 | 7,34 | 26,64 | ||||
| HDL (mmol/l) | 1,16 | 5,79 | 1,54 | 6,56 | ||||
| Triglicéridos (mmol/l) | -11,5 | 119,47 | -30,09 | 159,29 | ||||
| IMC basal (kg/m2) | -0,81 | 1,24 | -1,00 | -0,62 | 0,52 | 1,14 | 0,34 | 0,70 |
| Tasa de hipoglucemia global (episodios por 100 pacientes-año) | 540 | 580 | ||||||
DE: desviación estándar; HbA1c: hemoglobina glucosilada; HDL: colesterol asociado con lipoproteínas de alta densidad; IC: intervalo de confianza; IMC: índice de masa corporal; LDL: colesterol asociado a las lipoproteínas de alta densidad.
En el análisis llevado a cabo desde la perspectiva del financiador sanitario, se incluyeron datos de costes específicos de España (tabla 3). Los costes sanitarios directos (costes farmacológicos y costes derivados de las complicaciones), junto con los beneficios clínicos, se descontaron a un 3% anual, de acuerdo con las recomendaciones para el entorno sanitario español13. Los costes derivados de las complicaciones y aquellos relativos a los programas de cribado se obtuvieron a partir de fuentes publicadas14, tomando las cifras del año 2007, e incrementando las cifras correspondientes a años previos cuando se precisara, utilizando los índices de precios de consumo publicados por el Instituto Nacional de Estadística de España (http://www.ine.es/en/welcome_en.htm). En el caso base del análisis se estableció un horizonte temporal de 35 años, para así tener en cuenta las principales complicaciones a largo plazo, los costes asociados y el efecto sobre los años de vida ganados y la calidad de vida.
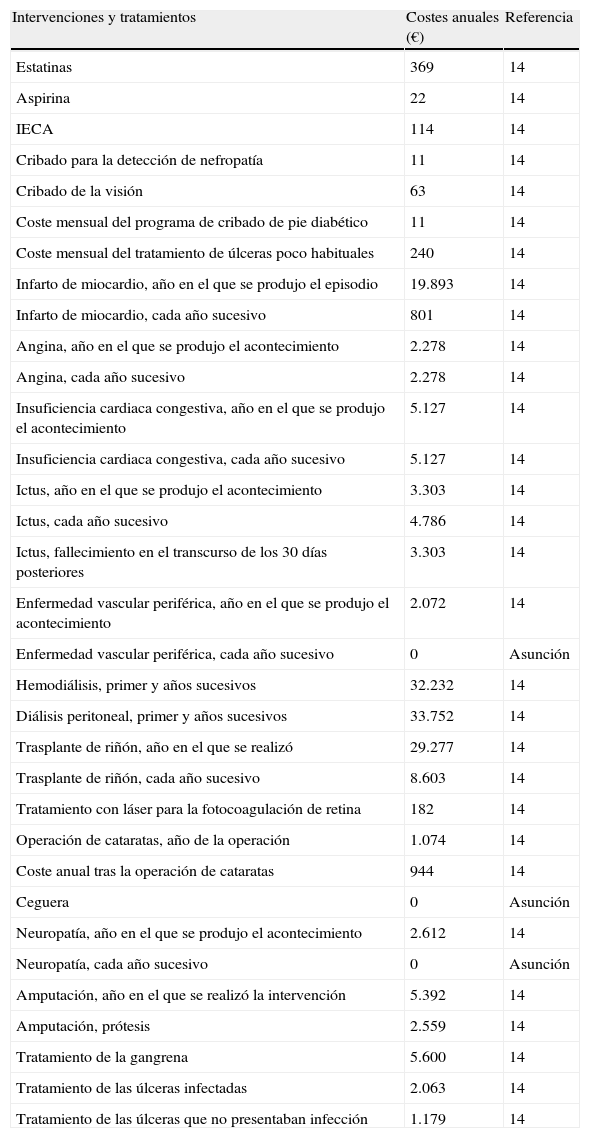
Costes farmacológicos y derivados de complicaciones expresados en euros (€) con respecto al año 2007
| Intervenciones y tratamientos | Costes anuales (€) | Referencia |
| Estatinas | 369 | 14 |
| Aspirina | 22 | 14 |
| IECA | 114 | 14 |
| Cribado para la detección de nefropatía | 11 | 14 |
| Cribado de la visión | 63 | 14 |
| Coste mensual del programa de cribado de pie diabético | 11 | 14 |
| Coste mensual del tratamiento de úlceras poco habituales | 240 | 14 |
| Infarto de miocardio, año en el que se produjo el episodio | 19.893 | 14 |
| Infarto de miocardio, cada año sucesivo | 801 | 14 |
| Angina, año en el que se produjo el acontecimiento | 2.278 | 14 |
| Angina, cada año sucesivo | 2.278 | 14 |
| Insuficiencia cardiaca congestiva, año en el que se produjo el acontecimiento | 5.127 | 14 |
| Insuficiencia cardiaca congestiva, cada año sucesivo | 5.127 | 14 |
| Ictus, año en el que se produjo el acontecimiento | 3.303 | 14 |
| Ictus, cada año sucesivo | 4.786 | 14 |
| Ictus, fallecimiento en el transcurso de los 30 días posteriores | 3.303 | 14 |
| Enfermedad vascular periférica, año en el que se produjo el acontecimiento | 2.072 | 14 |
| Enfermedad vascular periférica, cada año sucesivo | 0 | Asunción |
| Hemodiálisis, primer y años sucesivos | 32.232 | 14 |
| Diálisis peritoneal, primer y años sucesivos | 33.752 | 14 |
| Trasplante de riñón, año en el que se realizó | 29.277 | 14 |
| Trasplante de riñón, cada año sucesivo | 8.603 | 14 |
| Tratamiento con láser para la fotocoagulación de retina | 182 | 14 |
| Operación de cataratas, año de la operación | 1.074 | 14 |
| Coste anual tras la operación de cataratas | 944 | 14 |
| Ceguera | 0 | Asunción |
| Neuropatía, año en el que se produjo el acontecimiento | 2.612 | 14 |
| Neuropatía, cada año sucesivo | 0 | Asunción |
| Amputación, año en el que se realizó la intervención | 5.392 | 14 |
| Amputación, prótesis | 2.559 | 14 |
| Tratamiento de la gangrena | 5.600 | 14 |
| Tratamiento de las úlceras infectadas | 2.063 | 14 |
| Tratamiento de las úlceras que no presentaban infección | 1.179 | 14 |
IECA: inhibidor de la enzima conversora de angiotensina.
Los costes de medicación se obtuvieron de la base de datos del Consejo General de Colegios Oficiales de Farmacéuticos15. El coste asociado a exenatida se basó en el precio de venta al público, que se aplicó de forma uniforme a todos los años de la simulación (1.625,32 € al año), asumiendo una dosis constante de 10μg, dos veces al día. En relación con los pacientes que recibieron IG, se asumió que durante el primer año de tratamiento recibieron 25 UI/día, así como 40 UI/día en los años posteriores (de acuerdo con las distintas recomendaciones16), con un coste anual de 468,60 y 749,47 €, respectivamente (basándose en el precio de venta al público de IG). Considerando la práctica clínica, en ambos tratamientos también se tuvo en cuenta el coste anual de las tiras reactivas para el control de la glucemia. Se asumió un uso de 24,16 y 38,48 tiras reactivas/mes para exenatida e IG, respectivamente, con un coste por tira reactiva de 0,78 €. La frecuencia de uso de las tiras reactivas se obtuvo a partir de una encuesta llevada a cabo entre médicos del Reino Unido17.
Utilidades del estado de saludLas utilidades del estado de salud aplicadas en el modelo se obtuvieron, siempre que fue posible, del estudio United Kingdom Prospective Diabetes Study (UKPDS)18, para reflejar las preferencias de los pacientes con DM2. Cuando se consideró necesario, dichos datos se complementaron con información obtenida a partir de otras fuentes publicadas19,20.
Para intentar explicar los cambios observados en el IMC y los casos de náuseas recogidos en el ensayo clínico, se aplicaron las utilidades en la forma descrita en el análisis de coste-efectividad de exenatida realizado por Ray et al8.
Diagramas de dispersión y disposición a pagarEl análisis farmacoeconómico se realizó utilizando una cohorte simulada de 1.000 pacientes sobre la que se calculó la media y la desviación estándar de los costes, los años de vida ganados (AVG) y los años de vida ganados ajustados por calidad de vida (AVAC). Los resultados promedio de las 1.000 simulaciones incluidas en el caso base del análisis se utilizaron para generar diagramas de dispersión mediante los cuales se compararon las diferencias observadas en relación con los resultados clínicos y los costes asociados con exenatida y su comparador. Dichos diagramas de dispersión se utilizaron para generar curvas de aceptabilidad, calculando la proporción de puntos por debajo de una serie de umbrales de disposición a pagar.
Análisis de sensibilidadSe realizaron análisis de sensibilidad univariantes para identificar las variables principales del análisis, e investigar el impacto que ejerce la incertidumbre sobre parámetros y asunciones clave. A fin de evaluar el grado de incertidumbre en el caso base del análisis, en relación con la cohorte de población y con la eficacia de los tratamientos, las características basales de los pacientes y el efecto de los tratamientos se evaluaron en función de la media y la desviación estándar calculadas a partir de los datos del ensayo clínico.
En el caso base del análisis, se asumió que los valores medios de HbA1c de los pacientes simulados de ambos tratamientos seguían la misma tendencia a largo plazo que la observada en el estudio UKPDS21, al cabo de un año de que se hubieran aplicado los efectos de cada intervención. En 2 análisis de sensibilidad diferentes se asumió que el incremento gradual de los niveles de HbA1c en el grupo de tratamiento con exenatida no se producía hasta el segundo o tercer año de simulación (asunción respaldada por datos de ensayos clínicos abiertos al cabo de 2 y 3 años7,22).
El horizonte temporal de la simulación se redujo a 5 y 10 años.
La tasa de descuento para los resultados clínicos y los costes se varió del 0% al 6% anual.
En el caso base del análisis se realizó una simulación basada en el cambio promedio en los niveles de HbA1c observados en ambos grupos de tratamiento del ensayo clínico. En 4 análisis de sensibilidad llevados a cabo por separado, los efectos derivados de las intervenciones se establecieron en:
- –
El límite superior del intervalo de confianza al 95% para exenatida.
- –
El límite inferior del intervalo de confianza al 95% para exenatida.
- –
El límite superior del intervalo de confianza al 95% para IG.
- –
El límite inferior del intervalo de confianza al 95% para IG.
Se llevó a cabo un análisis de sensibilidad en el que en ninguno de los tratamientos se incluyó ningún coste asociado con el uso de tiras reactivas para el control de glucemia por parte del paciente.
Se realizaron análisis de sensibilidad modificando la asunción del caso base, relativa a la variación de utilidad aplicada en el peso corporal y las náuseas. Se realizaron los siguientes análisis:
- –
Sin incluir utilidades para el cambio de peso y las náuseas.
- –
Incluyendo utilidades para el cambio de peso, equivalentes a los valores recogidos en el estudio CODE-2, y asumiendo que no se produciría ningún episodio de náuseas.
En relación con los costes asociados con la IG que se incluyeron en el análisis de sensibilidad unidireccional, se asumió que: los pacientes recibirían diariamente 40 UI de insulina durante toda la vida.
En el caso base del análisis se incluyó un subgrupo de la población del ensayo clínico de Heine et al5, con un IMC>30kg/m2. En otro análisis de sensibilidad se utilizaron los valores medios de las características de los pacientes y de la eficacia de los tratamientos de ambos grupos para calcular los resultados a largo plazo. No se introdujo ninguna modificación en las asunciones relativas a los costes.
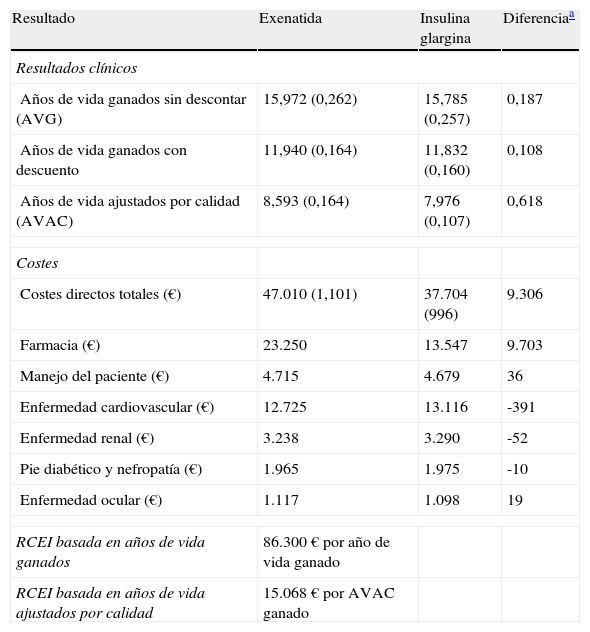
ResultadosEn relación con los pacientes tratados con exenatida, se pronosticó un aumento de AVG y AVAC, en comparación con IG (tabla 4). En el transcurso de la vida del paciente tratado con exenatida, el aumento medio de AVG y AVAC fue de 0,11 y 0,62 años, respectivamente, en comparación con IG.
Resumen de los resultados del caso base exenatida frente a insulina glargina
| Resultado | Exenatida | Insulina glargina | Diferenciaa |
| Resultados clínicos | |||
| Años de vida ganados sin descontar (AVG) | 15,972 (0,262) | 15,785 (0,257) | 0,187 |
| Años de vida ganados con descuento | 11,940 (0,164) | 11,832 (0,160) | 0,108 |
| Años de vida ajustados por calidad (AVAC) | 8,593 (0,164) | 7,976 (0,107) | 0,618 |
| Costes | |||
| Costes directos totales (€) | 47.010 (1,101) | 37.704 (996) | 9.306 |
| Farmacia (€) | 23.250 | 13.547 | 9.703 |
| Manejo del paciente (€) | 4.715 | 4.679 | 36 |
| Enfermedad cardiovascular (€) | 12.725 | 13.116 | -391 |
| Enfermedad renal (€) | 3.238 | 3.290 | -52 |
| Pie diabético y nefropatía (€) | 1.965 | 1.975 | -10 |
| Enfermedad ocular (€) | 1.117 | 1.098 | 19 |
| RCEI basada en años de vida ganados | 86.300 € por año de vida ganado | ||
| RCEI basada en años de vida ajustados por calidad | 15.068 € por AVAC ganado | ||
AVG: año de vida ganado; AVAC: año de vida ajustado por calidad; RCEI: razón coste-efectividad incremental.
Se observó una menor incidencia acumulada de todas las complicaciones cardiovasculares asociadas con exenatida, en comparación con IG, y si bien las proyecciones del modelo respecto a la mayoría de las otras complicaciones seguían una tendencia similar, la incidencia acumulada de retinopatía proliferativa, pérdida grave de la visión, cataratas, muerte relacionada con una nefropatía, recurrencia de úlceras de pie diabético y de una primera amputación fue mayor en el caso de exenatida. En términos de incidencia relativa, se pronosticó un retraso en el tiempo de aparición de todas las complicaciones en los pacientes tratados con exenatida en comparación con IG. El coste total medio por paciente fue de 47.010 € (exenatida) y de 37.704 € (IG), con una diferencia de 9.306 € (tabla 4). Al evaluar la distribución de estos costes, se observó que la principal razón para dicha diferencia entre los tratamientos fue el incremento en los costes farmacológicos asociados con exenatida (23.250 frente a 13.547 €; una diferencia de 9.703 €).
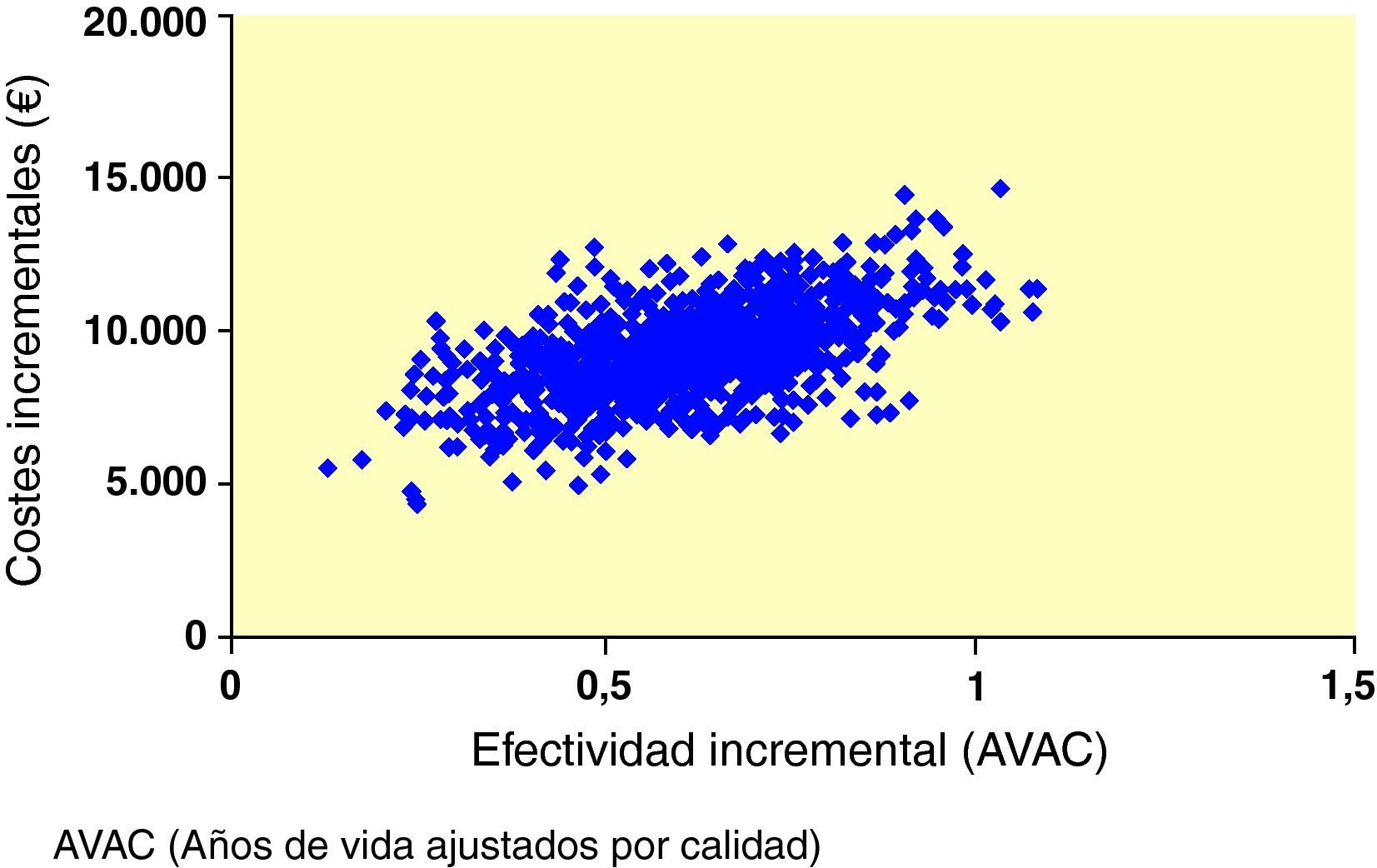
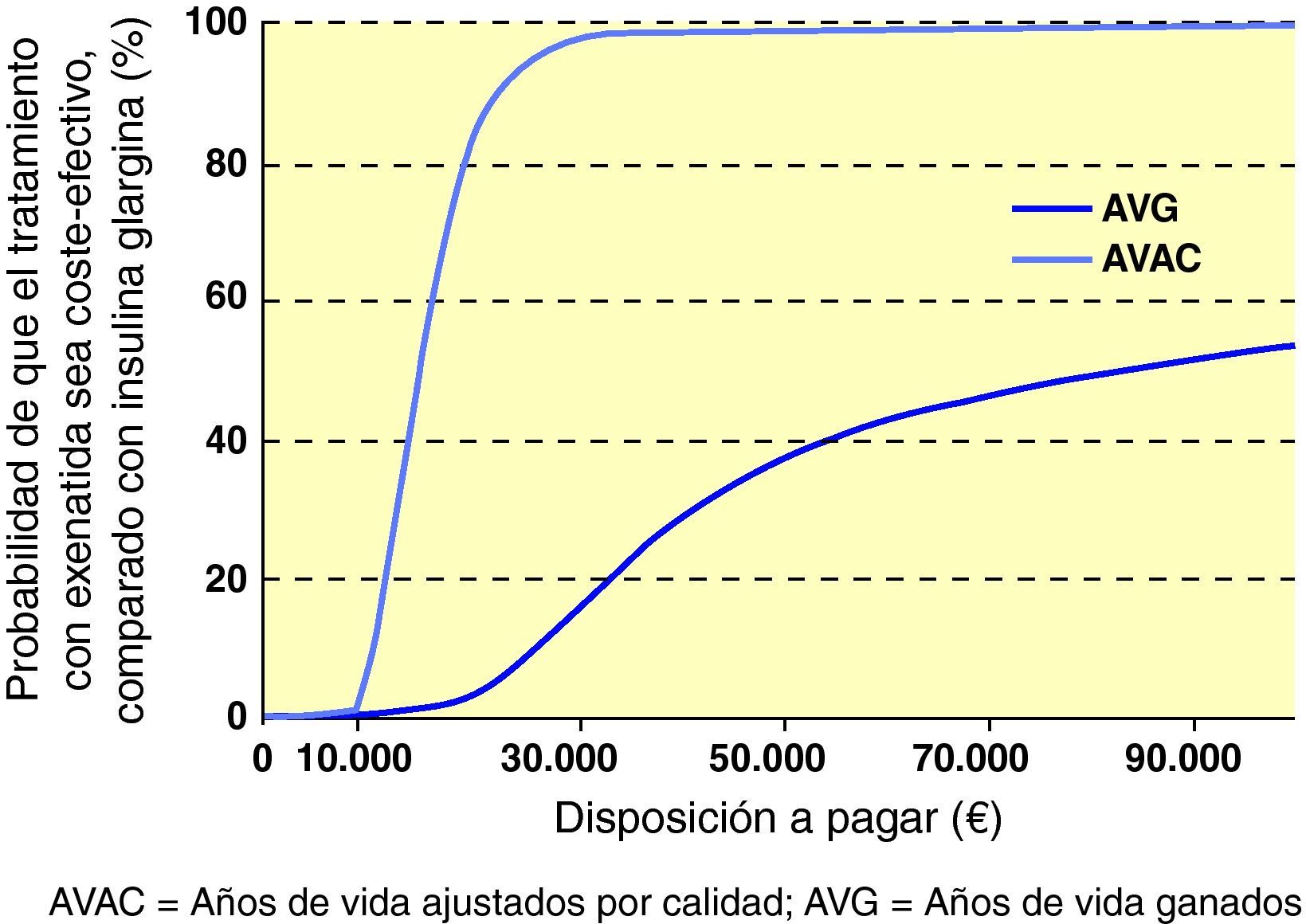
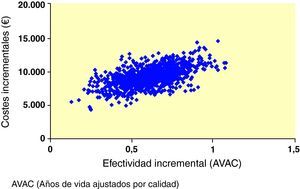
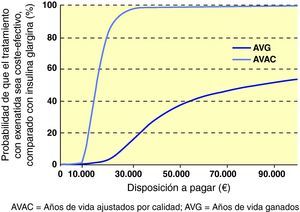
Al interpretar los resultados del caso base del análisis como una razón coste-efectividad incremental (RCEI) se demostró que, al comparar exenatida e IG, la RCEI fue 86.300 € por cada año de vida ganado y de 15.068 €/AVAC ganado. Para representar visualmente los hallazgos de este análisis, se generó un diagrama de dispersión del coste-efectividad incremental. En la representación de los costes y la efectividad incrementales durante toda la vida del paciente todos los puntos se situaron en el cuadrante superior derecho del plano coste-efectividad, lo que indica una mayor efectividad, asociada a un incremento de los costes (fig. 1). Se utilizaron los mismos datos para generar una curva de aceptabilidad, determinando la proporción de puntos del diagrama de dispersión que se situaban por debajo de la línea que representa el rango de valores de disposición a pagar (fig. 2). Cuando se evaluó la relación coste-efectividad en términos de AVAC, estimando un umbral de disposición a pagar de 30.000 €/ AVAC23, existía un 98,6% de probabilidades de que se considerara a exenatida coste-efectiva en comparación con IG.
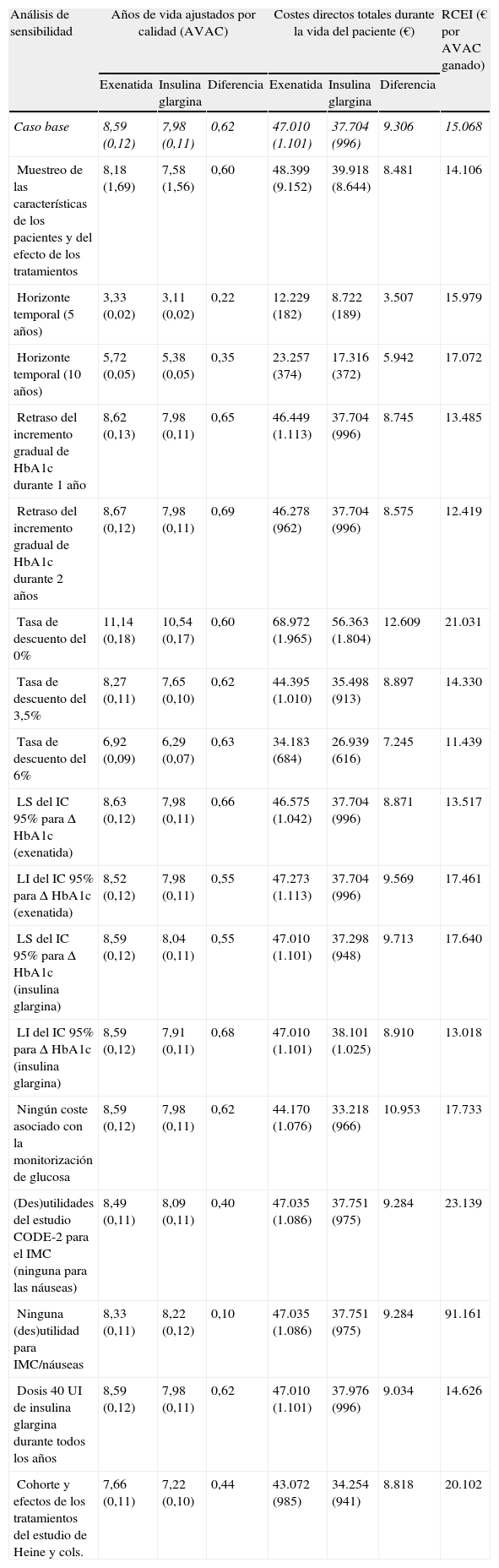
Los diversos análisis de sensibilidad llevados a cabo en este estudio mostraron que los resultados eran más sensibles a los cambios en los valores de utilidad aplicados al cambio en el peso corporal y la incidencia de náuseas, así como a la consideración de los resultados sin la aplicación de la tasa de descuento (tabla 5). La modificación de las distintas asunciones relativas a la modificación del horizonte temporal, los efectos de las intervenciones sobre la concentración de HbA1c, la dosis diaria de IG, la inclusión de los costes asociados con la monitorización de la glucemia por parte de los pacientes y la consideración de los efectos del tratamiento en todos los pacientes del estudio de Heine et al5 ejercieron poco efecto sobre los resultados relativos, observándose una variación de la RCEI de 11.439 € a 20.102/AVAC ganado con exenatida, en comparación con IG. De modo parecido, en un análisis de sensibilidad probabilístico realizado para evaluar la incertidumbre en los parámetros del modelo, la incertidumbre se asoció con una RCEI de 14.106/AVAC ganado para exenatida, en comparación con IG.
Resumen de los resultados del análisis de sensibilidad de exenatida frente a insulina glargina
| Análisis de sensibilidad | Años de vida ajustados por calidad (AVAC) | Costes directos totales durante la vida del paciente (€) | RCEI (€ por AVAC ganado) | ||||
| Exenatida | Insulina glargina | Diferencia | Exenatida | Insulina glargina | Diferencia | ||
| Caso base | 8,59 (0,12) | 7,98 (0,11) | 0,62 | 47.010 (1.101) | 37.704 (996) | 9.306 | 15.068 |
| Muestreo de las características de los pacientes y del efecto de los tratamientos | 8,18 (1,69) | 7,58 (1,56) | 0,60 | 48.399 (9.152) | 39.918 (8.644) | 8.481 | 14.106 |
| Horizonte temporal (5 años) | 3,33 (0,02) | 3,11 (0,02) | 0,22 | 12.229 (182) | 8.722 (189) | 3.507 | 15.979 |
| Horizonte temporal (10 años) | 5,72 (0,05) | 5,38 (0,05) | 0,35 | 23.257 (374) | 17.316 (372) | 5.942 | 17.072 |
| Retraso del incremento gradual de HbA1c durante 1 año | 8,62 (0,13) | 7,98 (0,11) | 0,65 | 46.449 (1.113) | 37.704 (996) | 8.745 | 13.485 |
| Retraso del incremento gradual de HbA1c durante 2 años | 8,67 (0,12) | 7,98 (0,11) | 0,69 | 46.278 (962) | 37.704 (996) | 8.575 | 12.419 |
| Tasa de descuento del 0% | 11,14 (0,18) | 10,54 (0,17) | 0,60 | 68.972 (1.965) | 56.363 (1.804) | 12.609 | 21.031 |
| Tasa de descuento del 3,5% | 8,27 (0,11) | 7,65 (0,10) | 0,62 | 44.395 (1.010) | 35.498 (913) | 8.897 | 14.330 |
| Tasa de descuento del 6% | 6,92 (0,09) | 6,29 (0,07) | 0,63 | 34.183 (684) | 26.939 (616) | 7.245 | 11.439 |
| LS del IC 95% para Δ HbA1c (exenatida) | 8,63 (0,12) | 7,98 (0,11) | 0,66 | 46.575 (1.042) | 37.704 (996) | 8.871 | 13.517 |
| LI del IC 95% para Δ HbA1c (exenatida) | 8,52 (0,12) | 7,98 (0,11) | 0,55 | 47.273 (1.113) | 37.704 (996) | 9.569 | 17.461 |
| LS del IC 95% para Δ HbA1c (insulina glargina) | 8,59 (0,12) | 8,04 (0,11) | 0,55 | 47.010 (1.101) | 37.298 (948) | 9.713 | 17.640 |
| LI del IC 95% para Δ HbA1c (insulina glargina) | 8,59 (0,12) | 7,91 (0,11) | 0,68 | 47.010 (1.101) | 38.101 (1.025) | 8.910 | 13.018 |
| Ningún coste asociado con la monitorización de glucosa | 8,59 (0,12) | 7,98 (0,11) | 0,62 | 44.170 (1.076) | 33.218 (966) | 10.953 | 17.733 |
| (Des)utilidades del estudio CODE-2 para el IMC (ninguna para las náuseas) | 8,49 (0,11) | 8,09 (0,11) | 0,40 | 47.035 (1.086) | 37.751 (975) | 9.284 | 23.139 |
| Ninguna (des)utilidad para IMC/náuseas | 8,33 (0,11) | 8,22 (0,12) | 0,10 | 47.035 (1.086) | 37.751 (975) | 9.284 | 91.161 |
| Dosis 40 UI de insulina glargina durante todos los años | 8,59 (0,12) | 7,98 (0,11) | 0,62 | 47.010 (1.101) | 37.976 (996) | 9.034 | 14.626 |
| Cohorte y efectos de los tratamientos del estudio de Heine y cols. | 7,66 (0,11) | 7,22 (0,10) | 0,44 | 43.072 (985) | 34.254 (941) | 8.818 | 20.102 |
Se muestran los valores medios, junto con la desviación estándar (en paréntesis).
AVAC: año de vida ajustado por calidad; CODE-2: Costes de la Diabetes Tipo 2 en Europa; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; LI: límite inferior del intervalo de confianza al 95%; LS: límite superior del intervalo de confianza al 95%; RCEI: razón coste-efectividad incremental.
Sin embargo, se observó un cambio más importante en la RCEI cuando los costes y los resultados clínicos simulados se expresaron como valores sin descontar. En este caso se observó una pequeña diferencia en relación con el caso base, respecto al AVAC incremental (0,60 frente a 0,62, respectivamente), aunque los costes incrementales medios durante la vida del paciente fueron superiores cuando no se aplicó una tasa de descuento (12.609 €), en comparación con el caso base (9.306 €). Ello se tradujo en una RCEI de 21.031/AVAC ganado para exenatida, en comparación con IG. Cuando el conjunto de valores de utilidad empleados en el caso base del análisis (tomados de Matza et al24 y del estudio CODE-2) se sustituyeron únicamente por los valores del estudio CODE-2 (en relación únicamente con el cambio en el peso, asumiendo que no se producía ningún episodio de náuseas), se observó una reducción de los AVAC, dando como resultado una RCEI de 23.139 €/AVAC ganado para exenatida, en comparación con IG. Cuando se eliminaron del análisis todas las utilidades aplicadas al cambio en el peso y las náuseas, la RCEI para exenatida fue de 91.161 €/AVAC ganado, en comparación con IG.
DiscusiónLos resultados de este análisis demuestran que, en comparación con IG, exenatida se asocia con un incremento de los costes, de los AVAC y de los AVG en pacientes con obesidad y DM2 que no alcanzan un adecuado control con antidiabéticos orales. Al comparar el tratamiento crónico con exenatida e IG en el entorno sanitario español, el tratamiento con exenatida conllevaría un coste-efectividad incremental de 15.068 €/AVAC y de 86.300 €/AVG.
Los análisis de sensibilidad mostraron que el estudio era sólido, y que las conclusiones (principalmente en términos AVAC y costes durante la vida del paciente) en gran parte no se veían afectadas por los cambios en la mayor parte de los parámetros. Los resultados proyectados eran más sensibles a los cambios realizados en la tasa de descuento y en los valores de utilidad aplicados al cambio en el peso corporal y a la presencia de náuseas. En el caso concreto de posibles cambios en el peso corporal o la presencia de náuseas, si bien a partir del estudio CODE-2 y del estudio de Matza et al24, resulta evidente que existen implicaciones significativas en relación con los cambios experimentados en el peso, el análisis de sensibilidad se evaluó en un escenario muy conservador, donde no se aplicó ningún valor de utilidad relacionado con la calidad vida al cambio de peso o a las náuseas. En dicho escenario, exenatida continuó asociándose con una mejoría en los AVAC, con una RCEI de 91.161 €/AVAC ganado, en comparación con IG. La pérdida de peso observada en el tratamiento con exenatida en ensayos clínicos es un factor clave con respecto al impacto potencial sobre variables clínicas al término del estudio y estimaciones de calidad de vida. Si bien en el caso base de este análisis únicamente se evaluaron los resultados en el subgrupo de pacientes obesos de un ensayo clínico más amplio, en un análisis de sensibilidad en el que se incluyeron los datos del conjunto de la población se observaron resultados finales similares (tabla 5). Aunque exenatida se asoció con una mejoría en los resultados (AVG y AVAC), hubo una mayor incidencia de complicaciones relacionadas con la diabetes en comparación con IG. En algunos casos, por ejemplo, en el caso de las muertes de origen renal, ello representa un ejemplo de la paradoja de la supervivencia. Es decir, dado que los pacientes simulados incluidos en el grupo de tratamiento con exenatida tienen un mayor incremento de AVG que aquellos incluidos en el grupo de IG, tienen también un mayor riesgo de experimentar acontecimientos adversos.
En las simulaciones correspondientes al grupo de IG se asumió que los pacientes recibirían 25 UI/día de insulina durante el primer año, y 40 UI/día durante el resto de años, reflejando dicha asunción en los correspondientes costes. Puede considerarse que estas estimaciones son conservadoras, dado que al final del estudio la dosis media de insulina por paciente fue de 28,9 UI. Para evaluar la incertidumbre en torno a este punto, se llevó a cabo un análisis de sensibilidad en el que se aplicó una dosis media de 40 UI tanto para el primer año como para el resto. Ello conllevó un incremento en los costes totales durante la vida del paciente de 272 € (IG), así como una RCEI final de 14.626 €/AVAC ganado para exenatida, en comparación con IG. Aunque no se realizaron simulaciones con dosis más altas de insulina, es posible que en una cohorte de pacientes que, previamente al tratamiento, presentara un IMC medio de 34,30kg/m2, se observara una mayor demanda de insulina que la contemplada en este análisis.
Los hallazgos realizados en este estudio son coherentes con otras evaluaciones farmacoeconómicas en las que se ha comparado exenatida e IG en distintos entornos sanitarios (Reino Unido, Alemania y Suiza)8–10. Si bien los estudios anteriormente descritos no establecieron ningún tipo de restricción en relación con la subpoblación de pacientes con obesidad y DM2 que se incluyeron en los mismos, los resultados fueron similares a los obtenidos en nuestro estudio (con una RCEI en el escenario contemplado en el caso base de 22.420 £, 13.746 € y 19.450 francos suizos por AVAC ganado con el tratamiento de exenatida, respectivamente, en comparación con IG). En un análisis llevado a cabo en el entorno sanitario estadounidense, en el que se comparó el tratamiento con exenatida con la no administración de ningún tipo de tratamiento, se observó una RCEI de 36.133 $/AVAC ganado25. Sin embargo, en la evaluación económica realizada por Woehl et al (2008) se obtuvieron resultados diferentes, siendo IG la opción dominante en todos los casos26. Las diferencias observadas en el estudio realizado por Woehl et al se deben principalmente al uso de diferentes modelos a la hora de predecir los costes y la efectividad a largo plazo, asociados con el tratamiento con exenatida, en comparación con IG, en pacientes con DM2. A pesar de que los resultados del ensayo clínico aleatorizado en los que se comparó exenatida con IG mostraron diferencias estadísticamente significativas entre los grupos de tratamiento, en relación con el cambio observado en el peso corporal, así como ninguna diferencia respecto a la tasa de episodios de hipoglucemia grave, Woehl no aplicó ningún incremento de utilidad para la pérdida de peso asociada con exenatida. Asimismo, estimó que el tratamiento con exenatida se asociaría con un mayor número de episodios hipoglucémicos graves, en comparación con IG. Estos distintos enfoques adoptados por Woehl le llevaron a pronosticar que el tratamiento con exenatida conllevaría un menor número de AVAC que los esperados, así como un mayor número de AVAC para IG.
Existen una serie de limitaciones en el estudio. Los resultados aquí presentados fueron obtenidos de un estudio de modelización, y están por ello sujetos a las limitaciones propias de los mismos. En particular, los resultados a corto plazo se extrapolaron para estimar datos clínicos y costes a largo plazo. Asimismo, no se consideraron los posibles cambios en las pautas de tratamiento que podrían ocurrir durante el horizonte temporal de la modelización. Unido a esto se encuentra el empleo de un modelo de aproximación en un área terapéutica en la que incluso en ensayos clínicos a largo plazo se obtienen resultados inesperados como en el ensayo Medidas para Controlar el Riesgo Cardiovascular en la Diabetes. Aquí, la valoración correspondiente al control glucémico terminó antes de tiempo debido a resultados inesperados27. Esto resalta la necesidad de estudios a largo plazo y refuerza el hecho de que los modelos están sujetos a limitaciones.
La pérdida de peso asociada con el tratamiento con exenatida, constatada en distintos ensayos clínicos, constituye un atributo clave de este tratamiento, en relación con su posible efecto sobre los criterios clínicos de valoración y las estimaciones relativas a la calidad de vida. Ello es especialmente relevante en el entorno sanitario español, en el que, de acuerdo con los datos más recientemente publicados, la prevalencia de la obesidad notificada por el paciente (lo que, posiblemente, conlleve que se notifiquen menos casos de los que realmente se produzcan) se ha incrementado en el período comprendido entre los años 1993 y 2003 (pasando de un 20 a un 29,8%)28. Estos datos concuerdan con otras estimaciones publicadas relativas al entorno sanitario español29,30, y constituyen una observación global habitual.
Como conclusión, cuando se tienen en cuenta costes farmacológicos y costes de las posibles complicaciones, exenatida es considerada una opción eficiente de acuerdo con un umbral de disposición a pagar de 30.000 €/AVAC ganado.
FinanciaciónEli Lilly España financió la totalidad de este estudio.
Conflicto de interesesGordon Goodall y Jayne Smith-Palmer son empleados de IMS Health, a los que Eli Lilly and Company abonó los correspondientes honorarios de consultoría. María Costi, Louise Timlin, Jesús Reviriego, José Sacristán y Tatiana Dilla son empleados de Eli Lilly and Company.