A pesar de los últimos avances acerca de los factores nutricionales que inducen modificaciones epigenéticas, la información en edades tempranas es escasa. El presente trabajo estudió en un modelo experimental a lo largo de dos generaciones las posibles modificaciones en la composición corporal, la posible expresión de cambios epigenéticos, y el resultado del consumo de dietas isocalóricas con niveles de grasa diferentes.
Materiales y métodosRatas Wistar hembras al destete se dividieron en dos grupos que recibieron una dieta con 7 y 15% de grasa (rica en grasa). A los 70 días se aparearon (M1) y sus crías (C1) constituyeron la primera generación; C1 a los 70 días fueron apareadas (M2) y sus crías (C2) constituyeron la segunda generación. Al destete, se evaluaron tanto las madres como las crías (M1, M2 y C1, C2), el peso (P) y composición corporales % de grasa (% Gra), por método químico y contenido mineral óseo de esqueleto total (CMO) por densitometría, expresado como %CMO.
ResultadosAl destete, en los grupos con dieta rica en grasa M2 y C2 (15% Gra) se observó un incremento significativo del P y % Gra (p<0,05), mientras que el aumento en el % Gra ya se observó en C1 y M1 (p<0,001). Por el contrario, el % CMO de M2 y C2 disminuyó significativamente (p<0,001).
Conclusióneste estudio pone de manifiesto la potencial necesidad de modificar ciertos hábitos alimentarios que eviten repetir patrones distorsionados de generación en generación.
Despite recent findings reported on the nutritional factors that induce epigenetic changes, little information is available at early ages. This study analyzed in an experimental model, over two generations, potential changes in body composition and potential expression of epigenetic changes as the result of the intake of isoenergetic diets with different fat levels.
Materials and methodsAt weaning, Wistar female rats were divided into two groups that were fed either a control diet (fat=7% w/w) or a high-fat diet (15% w/w). Rats were mated at 70 days (M1) and their pups (P1) were the first generation; P1 rats were mated at 70 days (M2) and their pups (P2) represented the second generation. At weaning, mothers and pups (M1, M2 and P1, P2) were measured body weight (W) and composition (% body fat, %BF), and total skeleton bone mineral content (BMC), expressed as %BMC, using chemical and DXA methods respectively.
ResultsAt weaning, high-fat diet groups M2 and P2 showed significant increases in W and %BF (p<0.05); increased %BF values were already found in the M1 and P1 groups (p<0.001). By contrast, %BMC significantly decreased in M2 and P2 rats (p<0.001).
ConclusionThis study demonstrates the need to review certain eating habits to avoid perpetuation of unhealthy patterns generation after generation.
Existen evidencias que sugieren que la elección de alimentos que la madre realiza durante el embarazo puede sentar las bases para la aceptación de los mismos en la vida posnatal. El líquido amniótico que rodea al feto, manteniendo la temperatura fetal, constituye una fuente rica de exposición sensorial para el feto. Muchos sabores presentes en la dieta materna lo están en el líquido amniótico1,2 y, dado que el gusto y el olfato ya son funcionales durante la vida fetal, constituyen las primeras experiencias de contacto que ocurren antes de nacer. La exposición a estos sabores «transmisibles» influiría en su aceptación posnatalmente3,4; esta experiencia temprana, que puede proporcionar un «puente de sabor» y familiarizar al feto con sabores de la dieta materna, desempeña un papel clave en la adquisición de alimentos y preferencias4,5.
Al nacer, los padres participan de las primeras experiencias de los niños con los alimentos; la leche materna, portadora de sabores facilita la transición a la dieta del adulto. Como jóvenes omnívoros, están dispuestos a aprender a ingerir la dieta de los adultos y, a pesar de la amplia gama de alimentos que se les ofrece, desarrollan tempranamente la capacidad para repetir el patrón alimentario familiar. Estas preferencias alimentarias adquiridas en la infancia reflejan los alimentos disponibles y accesibles, y lo preparan para constituirse en el modelo de patrón cultural de alimentación de su futura descendencia.
Existe evidencia de que la perturbación metabólica intrauterina puede influenciar la expresión génica y modular el fenotipo del organismo durante la vida adulta. La exposición durante la vida temprana a factores nutricionales inadecuados puede ser crítica en el crecimiento y desarrollo de los tejidos corporales, constituyendo un factor de riesgo potencial de enfermedades debido a patrones alimentarios inapropiados por defecto6,7 o por exceso8. A pesar de los últimos avances acerca de los factores nutricionales que inducen modificaciones epigenéticas, es escasa la información en edades tempranas9.
El presente trabajo estudió en un modelo experimental, a lo largo de dos generaciones, las posibles modificaciones en la composición corporal, resultado del consumo de dietas isocalóricas con niveles de grasa diferentes.
Material y métodosPoblación animalSe estudiaron, desde el destete (22±1 días de edad), 90 ratas hembra de la cepa Wistar con un peso promedio inicial de 44,7±0,7g (media±error estándar, EE), que provenían de la Cátedra de Bioquímica General y Bucal de la Facultad de Odontología de la Universidad de Buenos Aires. El protocolo presentado cumplía con las especificaciones establecidas internacionalmente para el uso y cuidado de los animales de laboratorio10.
Los animales se alojaron en jaulas galvanizadas, con piso de malla y suspendidas, con la finalidad de mantener las condiciones de higiene y evitar la coprofagia. La temperatura ambiente se mantuvo en 21±1°C mediante un sistema termostatizado y la humedad relativa fue de 50-60%. Además, cuenta con un sistema que permite mantener estrictamente los períodos de luz-oscuridad de 12h/12h, ya que modificaciones de los mismos pueden provocar cambios en la conducta del animal y alteraciones en el ritmo de la alimentación11.
Al momento del destete, los animales se dividieron en tres grupos y se verificó que los pesos promedio iniciales no difirieran entre grupos (p>0,05). Un grupo de 10 animales (C0) fue sacrificado para la determinación de los valores basales. Dos grupos de 40 animales cada uno, recibieron a libre demanda durante todo el período experimental una de dos dietas: dieta control, cuyo contenido de grasa fue del 7g/100g de dieta control (7%) y 15g/100g de dieta experimental (15%).
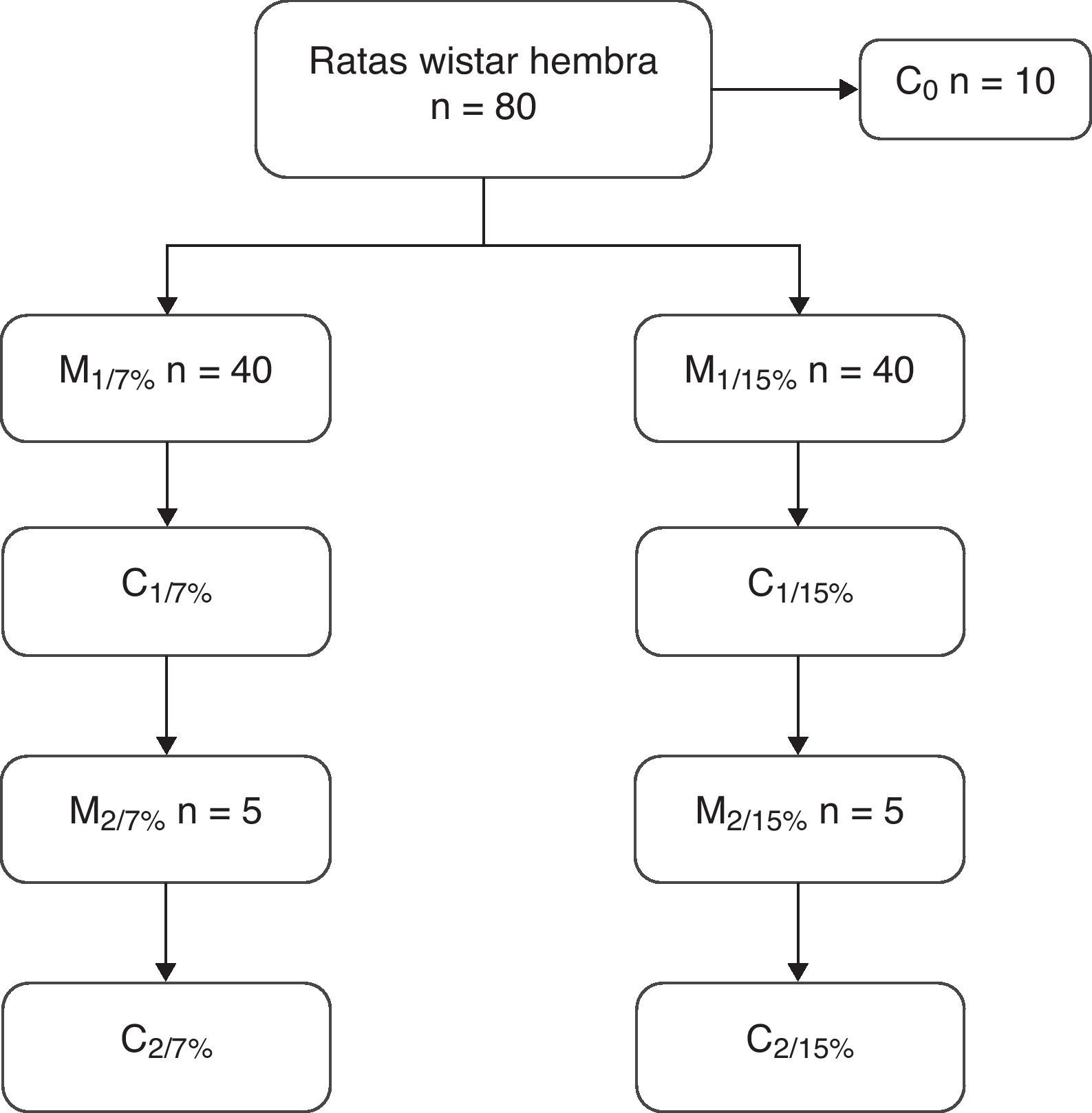
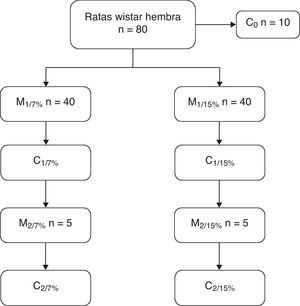
A los 28, 35 y 49 días de edad se sacrificaron 10 animales de cada grupo para la determinación de la composición corporal. A los 70 días de edad, 10 ratas de ambos grupos se aparearon y a los 110 días se destetaron las crías. Las madres de esta primera generación (M1/7% y M1/15%) y un subgrupo de crías (C1/7% y C1/15%) se sacrificaron. El subgrupo restante continuó con la dieta de la generación anterior. A los 70 días fueron apareadas y las crías se destetaron a los 110 días de edad. Las madres (M2/7% y M2/15%) y las crías (C2/7% y C2/15%) fueron sacrificadas (fig. 1).
Diseño del procedimiento seguido en el estudio.
M1: primera generación de madres; M2: segunda generación de madres.
C0: grupo basal; C1: crías de la primera generación; C2: crías de la segunda generación.
Los porcentajes de 7 y 15% indican el contenido de 7g de grasa/100g de dieta y 15g de grasa/100g de dieta, respectivamente.
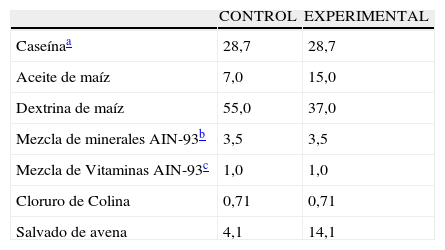
Durante el período experimental los animales recibieron a libre demanda una de las siguientes dietas isocalóricas (4kcal/g) cuya composición se detalla en la tabla 1. El agua de bebida se administró en condiciones de libre demanda asegurando el suministro continuo, dada la estrecha correlación entre la ingesta de líquido y la conducta alimentaria12.
Composición porcentual de las dietas
| CONTROL | EXPERIMENTAL | |
| Caseínaa | 28,7 | 28,7 |
| Aceite de maíz | 7,0 | 15,0 |
| Dextrina de maíz | 55,0 | 37,0 |
| Mezcla de minerales AIN-93b | 3,5 | 3,5 |
| Mezcla de Vitaminas AIN-93c | 1,0 | 1,0 |
| Cloruro de Colina | 0,71 | 0,71 |
| Salvado de avena | 4,1 | 14,1 |
Peso corporal: para su medida se utilizó una balanza analítica Metler PC 4000 con una precisión de±1mg. Las determinaciones se realizaron con un ayuno previo mínimo de 2 horas y máximo de 4 horas. El peso se expresó en gramos.
Composición corporal: el análisis de la composición corporal incluyó el contenido de grasa corporal (% Gra) y el contenido mineral óseo de esqueleto total (expresado como CMO% (g/100g de peso). El contenido de grasa corporal se determinó por método químico sobre la carcasa seca mediante la extracción intermitente con éter de petróleo (Soxhlet, AOAC)13, expresándose los resultados en g de grasa/100g de peso corporal. El contenido mineral óseo de esqueleto total se evaluó por densitometría ex vivo mediante la utilización de un equipo Lunar DPX (DPX Alpha 8034, Small Animal Software, Lunar Radiation Corp. Madison EE.UU.). La precisión del equipo se obtuvo mediante la medición de una misma rata cinco veces con reposición del animal durante el mismo y diferente día. El coeficiente de variación (CV) fue de 3% para el contenido mineral óseo (CMO).
Los resultados se expresaron como la media±EE, y se analizaron estadísticamente por ANOVA para comparar los grupos. Cuando se encontró una diferencia estadísticamente significativa se realizó la prueba de Student-Newman-Keul. En todos los casos se realizaron las pruebas de normalidad (Wilk-Shapiro) y de homoscedasticidad (Bartlett) de las varianzas. Los resultados se consideraron significativos a un nivel del 5%. Los programas empleados fueron el GraphPad Prism versión 3.0 (GraphPad Software, Inc., San Diego, CA, EE. UU.) y el SPSS versión 9.0 (SPSS, Inc., de Chicago, EE. UU.).
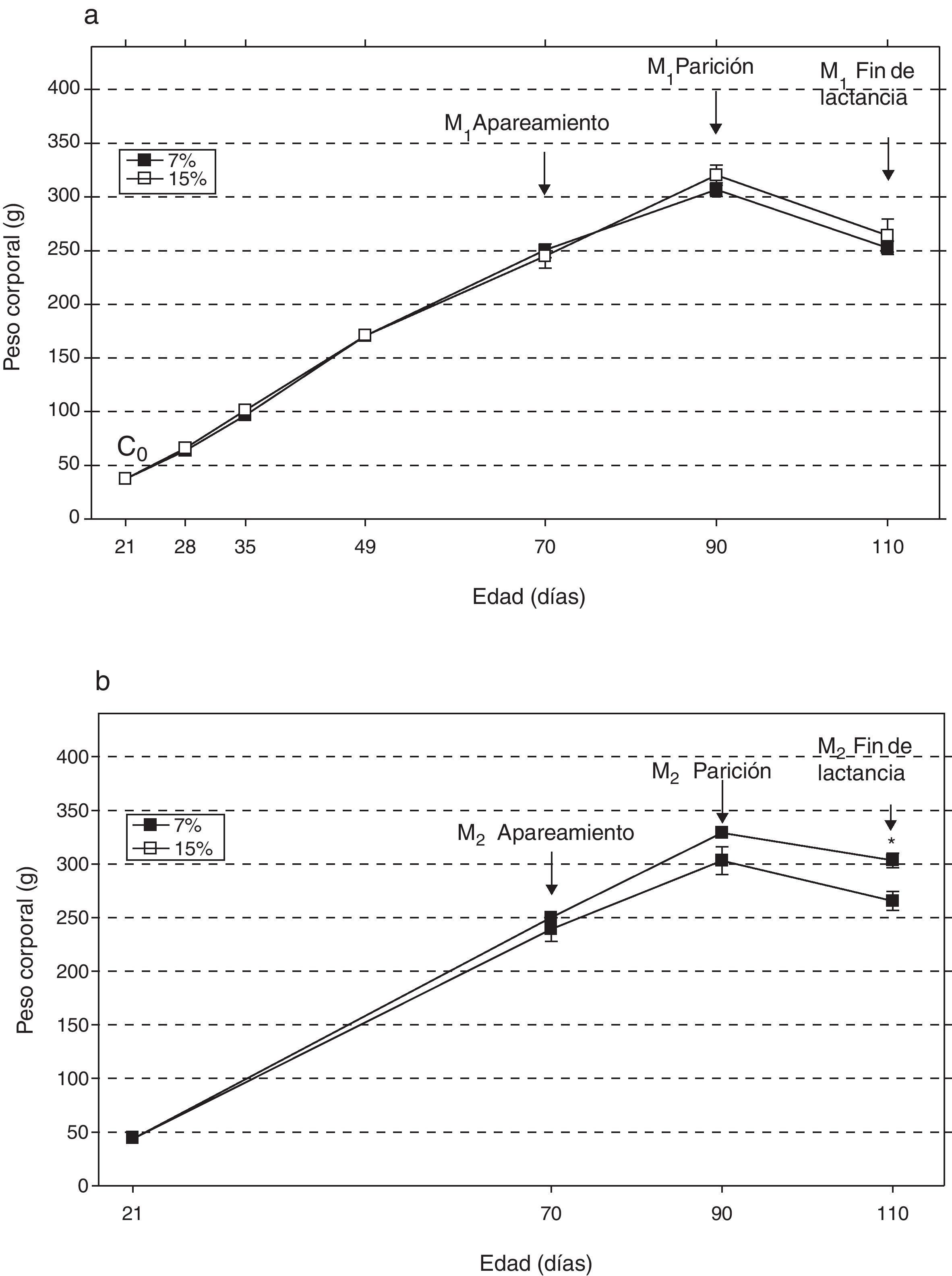
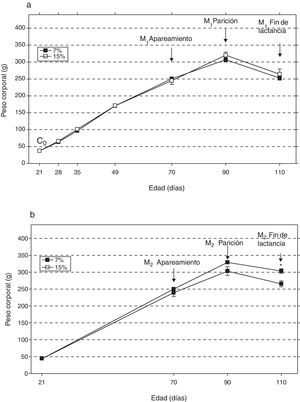
ResultadosAl analizar la evolución del peso corporal de los grupos M1/15% (fig. 2a) y M2/15% (fig. 2b) a lo largo del período experimental, no se observaron diferencias significativas entre los mismos y sus respectivos controles a 28, 35, 49, 70 y 90 días de edad. A los 110 días de edad, solo se observó un incremento significativo del peso corporal en el grupo M2/15% vs. M2/7% (p<0,05).
Evolución del peso corporal (media±error estándar) en función de la edad a lo largo de dos generaciones (1a: primera generación; 1b: segunda generación), correspondiente a animales alimentados con dieta 7% (grupo control) o 15% (grupo experimental) de grasa.
C0: grupo basal; M1: primera generación de madres; M2: segunda generación de madres.
*p<0,05 entre grupo control y experimental.
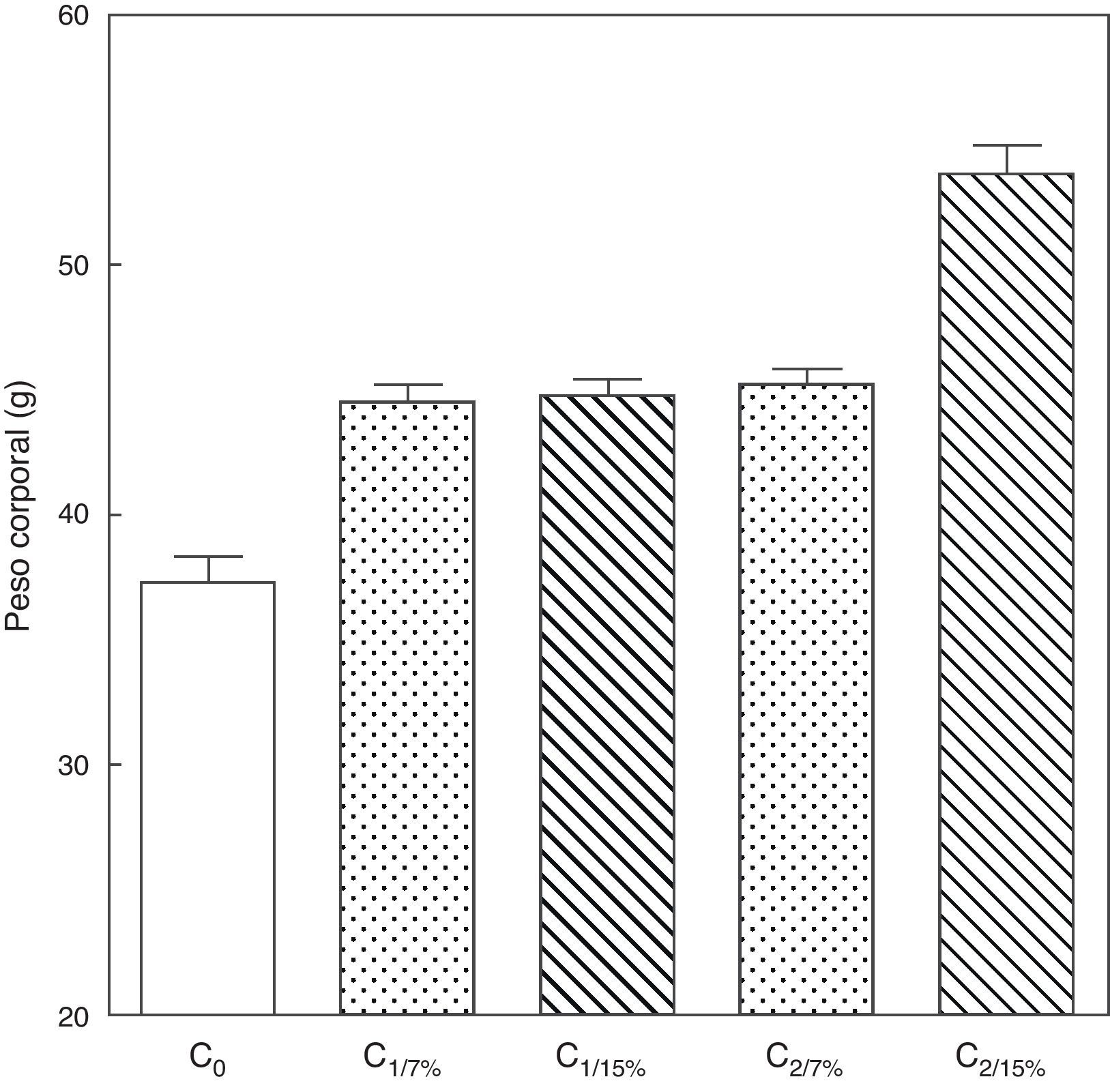
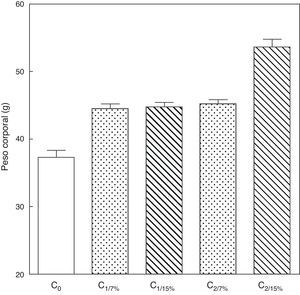
El peso corporal de la crías al destete de la primera (C1/7%, C1/15%) y segunda (C2/7%, C2/15%) generaciones se muestra en la figura 3. Se observa un incremento significativo del peso corporal en la segunda generación de crías (C2/15%) provenientes de madres (M2/15%) que recibieron una dieta con un contenido de grasa del 15%. No se observaron modificaciones significativas en el peso corporal de las crías alimentadas con la dieta control a lo largo de las generaciones (p>0,05).
Peso corporal de las crías correspondiente a dos generaciones de ratas alimentadas con un contenido de grasa en la dieta de 7% (grupo control) o de 15% (grupo experimental).
C0: grupo basal; C1: crías de la primera generación; C2: crías de la segunda generación.
Media ± error estándar
ANOVA, nivel de significación global<0.001; a posteriori la prueba de Student-Newman-Keul determinó las siguientes diferencias entre grupos (letras diferentes indican diferencia significativa entre grupos):
Co vs. C1/7% vs C1/15%; p<0.05; Co vs. C2/7%; p<0.01;
Co vs. C2/15%; p<0.001; C1/7% vs. C2/7%; p>0.05; Co vs. C2/15%; p<0.001; C1/15% vs. C2/7%; p <0.05; C1/15% vs. C2/15%; p<0.001; C2/7% vs. C2/15%; p <0.001.
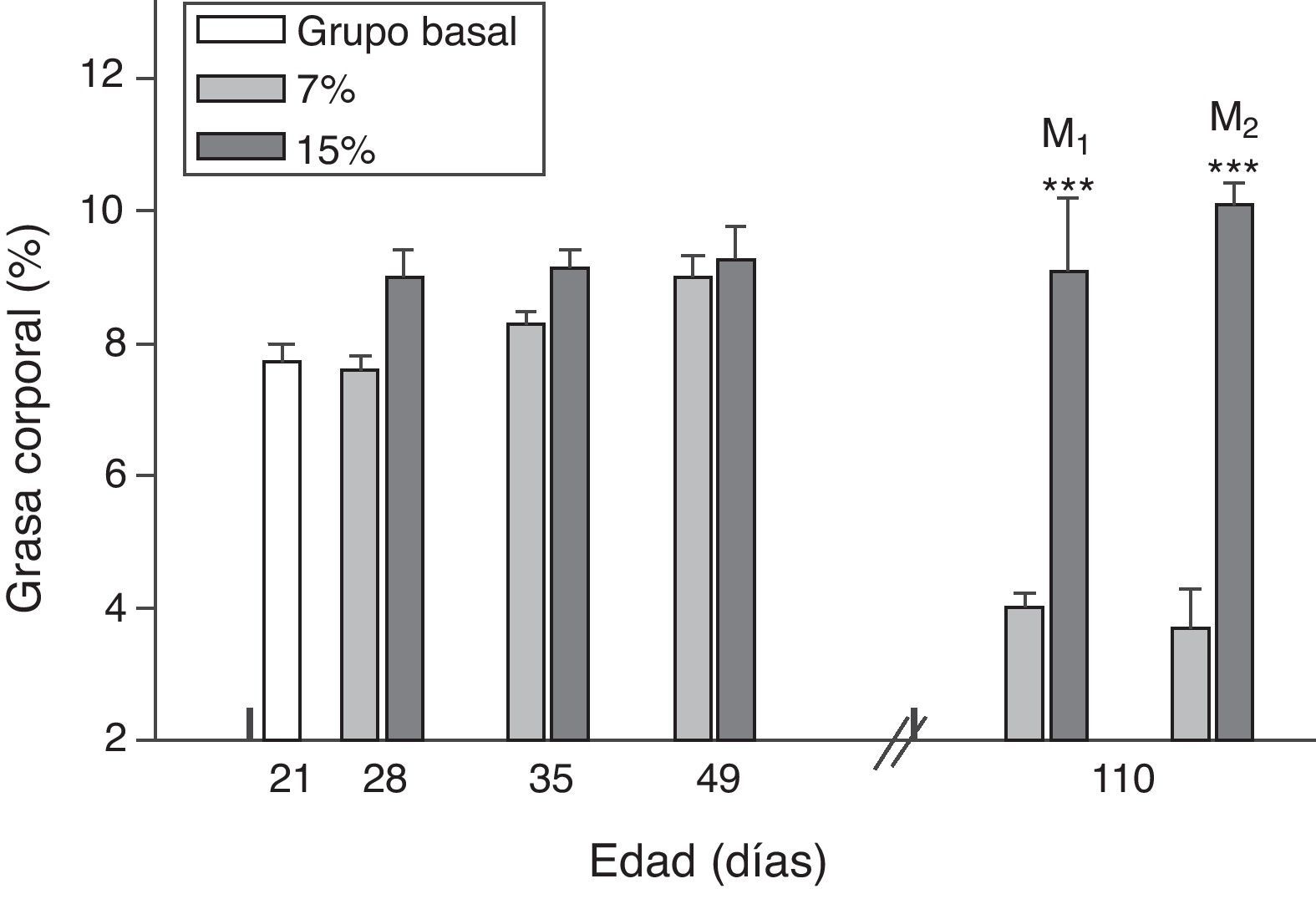
El contenido de grasa corporal resultó significativamente mayor en M1/15% y M2/15% en comparación a sus respectivos controles a los 110 días de edad (p<0,001) (fig. 4).
Grasa corporal (media±error estándar) en función de la edad en animales alimentados con dieta 7% (grupo control) o 15% (grupo experimental) de grasa.
C0: grupo basal; M1: primera generación de madres; M2: segunda generación de madres. T-test entre grupos para cada tiempo experimental. Diferencias entre los grupos indicados: * p<0,05; *** p<0,001.
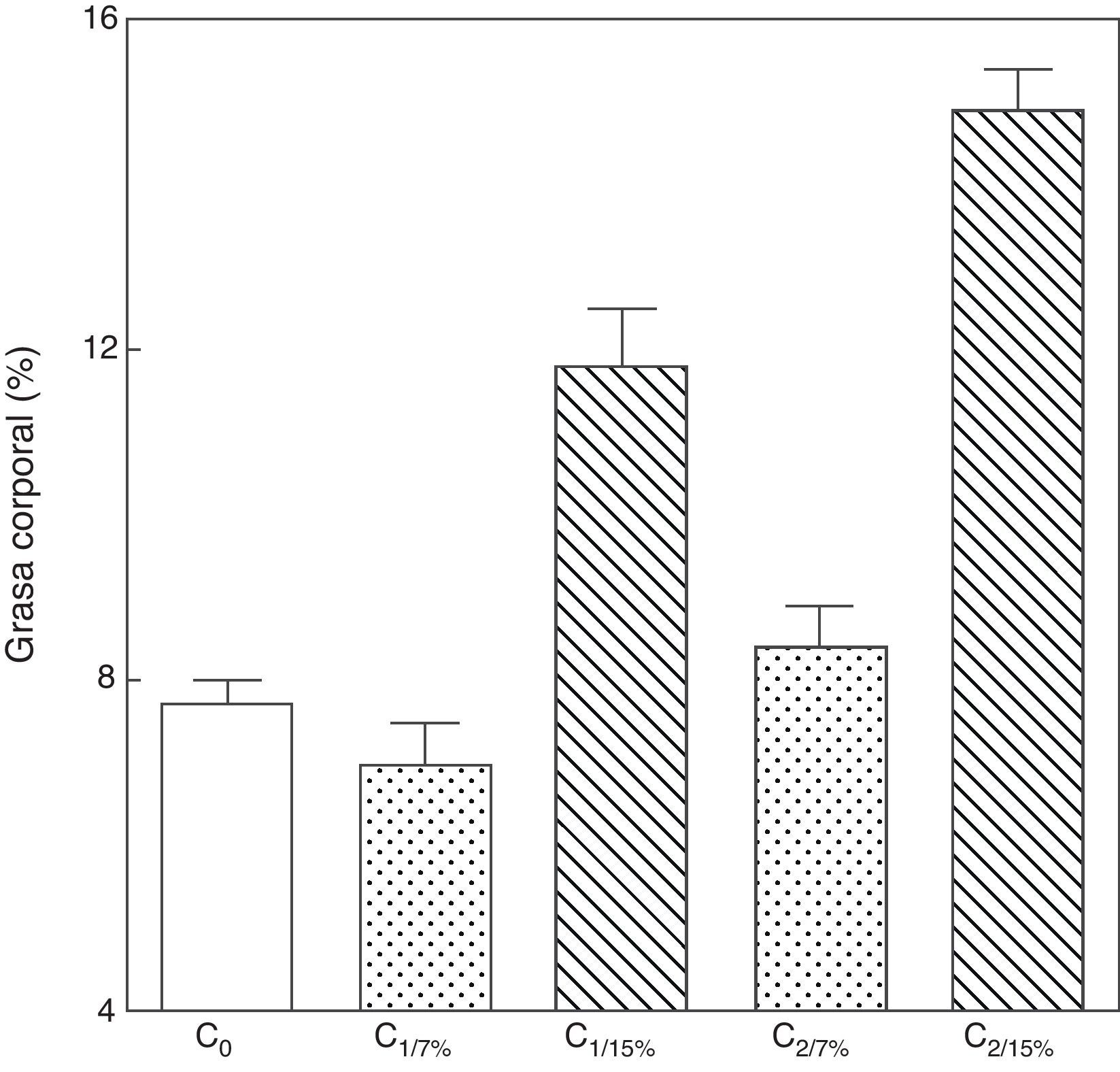
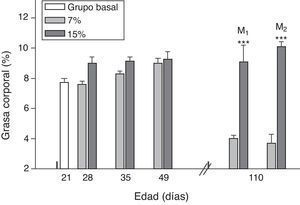
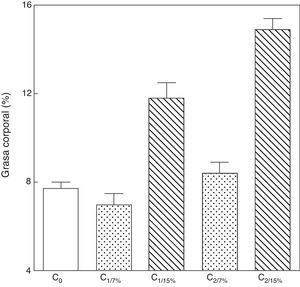
Al analizar la grasa corporal de las crías de la primera y segunda generación al destete, se observó que la misma fue significativamente mayor en C1/15% y en C2/15% procedentes de madres (M1/15% y M2/15%) que recibieron una dieta con un contenido de grasa del 15%. No se observaron modificaciones significativas en grasa corporal de las crías alimentadas con la dieta control a lo largo de las generaciones (p>0,05) respecto de C0 (7,66±1,42%) (fig. 5).
Grasa corporal de las crías correspondiente a dos generaciones de ratas alimentadas de ratas alimentadas con un contenido de grasa en la dieta de 7% (grupo control) o de 15% (grupo experimental).
C0: grupo basal; C1: crías de la primera generación; C2: crías de la segunda generación.
Media ± error estándar.
ANOVA, nivel de significación global<0.001; a posteriori la prueba de Student-Newman-Keul determinó las siguientes diferencias entre grupos (letras diferentes indican diferencia significativa entre grupos):
Co vs. C1/7% vs. C2/7%; p>0.05; Co, C1/7%, C2/7% vs. C1/15%; p<0.001; Co, C1/7%, C2/7% vs. C2/15%; p<0.001; C1/15% vs. C2/15%; p<0.001.
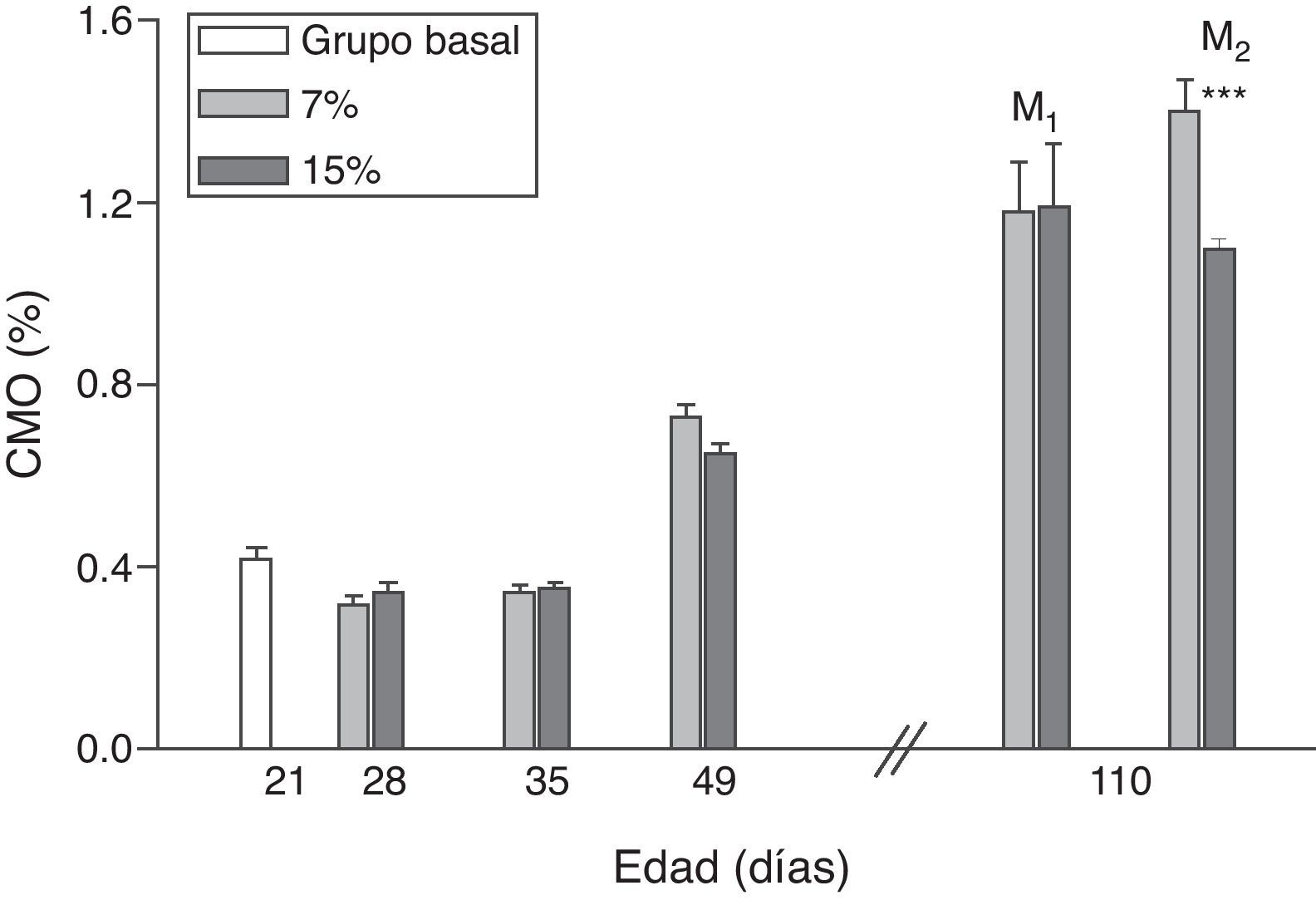
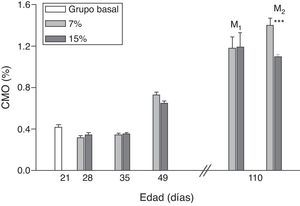
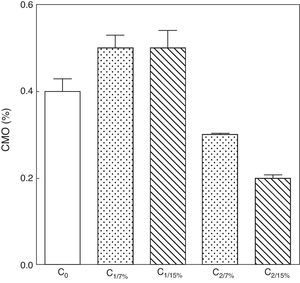
La evolución del contenido mineral óseo de esqueleto total se muestra en las figuras 6 y 7. Si bien no se observaron diferencias significativas en las madres M1/15% vs. M1/7% y entre sus respectivas crías (C1/15% vs. C1/7%), el CMO de M2/15% vs. M2/7% y de C2/15% vs. C2/7% disminuyó significativamente (p<0,001).
Contenido mineral óseo (CMO) de esqueleto total (media±error estándar) en función de la edad, correspondiente a animales alimentados con dieta 7% (grupo control) o 15% (grupo experimental) de grasa.
C0: grupo basal; M1: primera generación de madres; M2: segunda generación de madres.
T-test entre grupos para cada tiempo experimental: * p<0,05; *** p<0,001.
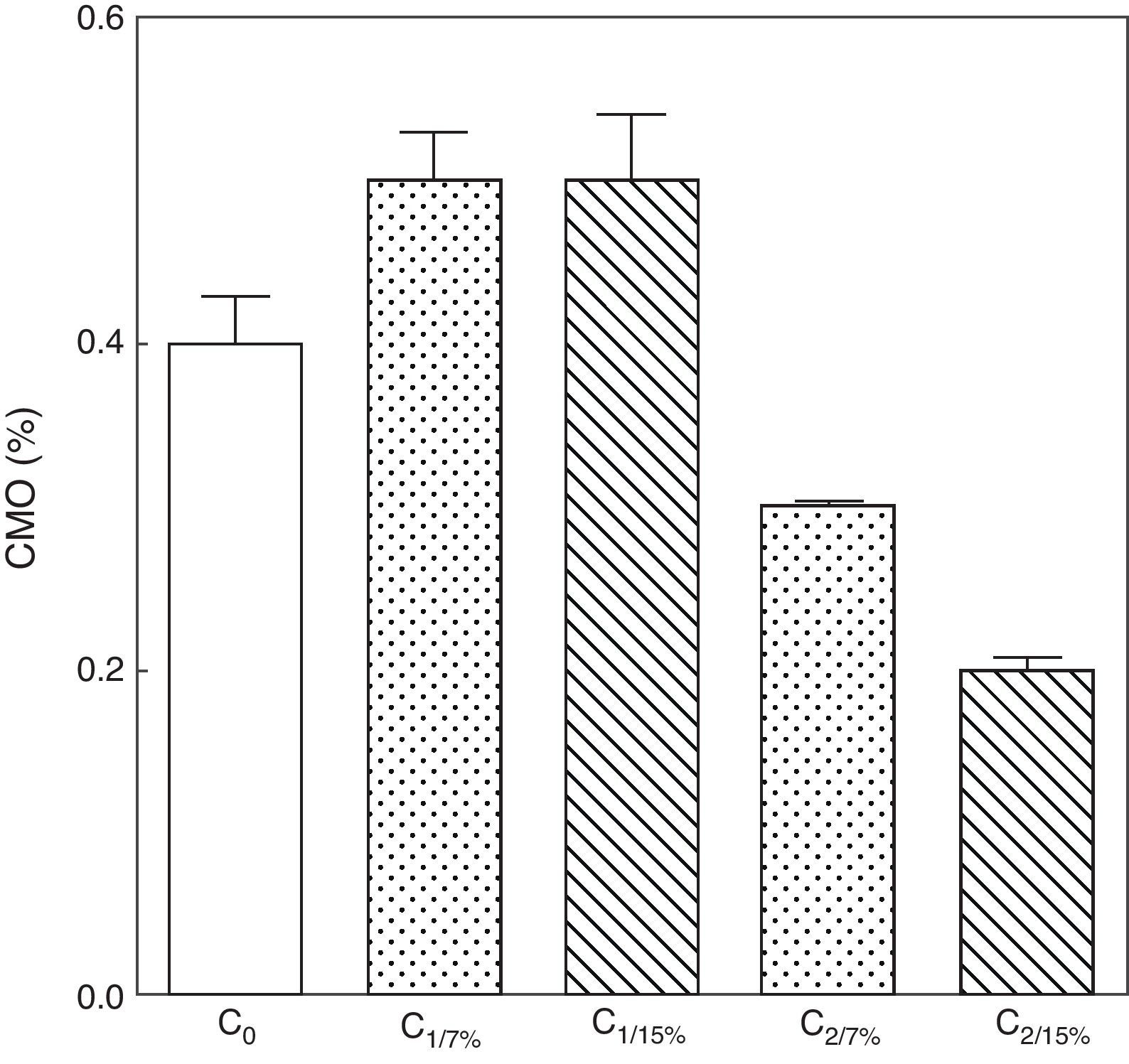
Contenido mineral óseo de esqueleto total de las crías correspondiente a dos generaciones de ratas alimentadas con un contenido de grasa en la dieta de 7% (grupo control) o de 15% (grupo experimental).
C0: grupo basal; C1: crías de la primera generación; C2: crías de la segunda generación.
Media ± error estándar
ANOVA, nivel de significación global<0.001; a posteriori la prueba de Student-Newman-Keul determinó las siguientes diferencias entre grupos (letras diferentes indican diferencia significativa entre grupos):
Co vs. C1/7% vs. C1/15%; p>0.05; Co, C1/7%, C1/15% vs. C2/7%; p<0.001; Co, C1/7%, C1/15% vs. C2/15%; p<0.001; C2/7% vs. C2/15%; p<0.01.
En estudios previos, nuestro grupo de trabajo analizó el efecto de dietas isocalóricas con diferentes niveles de grasa y carbohidratos sobre la composición corporal en ratas en crecimiento a lo largo de una generación14. Sin embargo, no se ha evaluado aún el efecto de dichas dietas, ricas en ácidos grasos poliinsaturados n-6 (AGPI n-6), y las posibles modificaciones de la composición corporal, a lo largo de dos generaciones. Existe evidencia que demuestra que la exposición materna a dietas ricas en colesterol y grasa produce cambios epigenéticos que modulan la expresión de genes con desarrollo de obesidad en la progenie15.
Al comparar los pesos corporales en cada una de las generaciones, siempre resultó mayor en los grupos que consumieron dietas con mayor contenido de lípidos, tanto en madres como en crías16. El aumento del peso fue acompañado de un incremento en el porcentaje de grasa corporal. Esto podría deberse específicamente al desequilibrio en la relación n-6/n-3 a favor de los AGPI n-6 y sus metabolitos; entre ellos, el ácido araquidónico que actúa como potente agente adipogénico precursor de prostaciclinas, aumentando el riesgo de desarrollo excesivo de tejido adiposo17. Otros autores observaron un incremento del tejido adiposo blanco inguinal y en el tamaño de los adipocitos ya en la primera generación18, en concordancia con nuestros resultados que evidencian el impacto en la primera generación que se incrementa en la segunda generación.
El desequilibrio en la relación de los n-6/n-3 y la menor presencia de los AGPI n-3 en el aceite de maíz podrían justificar el incremento de peso y grasa corporales en los animales con dieta experimental. Estos resultados son coincidentes con los obtenidos por otros autores que observaron que un aumento en la ingesta materna de AGPI n-3 conduciría a una reducción de la masa de tejido adiposo en ratas18 y en ratones19. Es sabido que la presencia de los AGPI n-6 en cantidades adecuadas resulta beneficiosa sobre la actividad ósea20 y en la formación de cartílago de crecimiento21.
En el presente estudio, el consumo de la dieta rica en AGPI n-6 mostró una disminución en el % CMO, el cual guardó una relación inversa con la grasa corporal, tanto en las madres como en las crías de la segunda generación. La reducción en el % CMO podría deberse al incremento en la producción de ácido araquidónico, el cual induciría un aumento de prostaglandina E2 en hueso y una disminución sérica del factor de crecimiento insulínico-I22,23, con la consecuente reducción de la tasa de formación ósea24. Contrariamente, las dietas ricas en AGPI n-3, promueven la formación ósea al mantener en el hueso una adecuada concentración de ácido araquidónico23.
El incremento del contenido de lípidos de la dieta, acompañado por un aumento en la grasa corporal, no se vio reflejado en modificaciones del CMO% de las madres y en las crías de la primera generación; en las madres, podría deberse a la preservación de la masa ósea a expensas de una menor velocidad de recambio óseo25.
Estudios en animales de experimentación han demostrado que la exposición a dietas ricas en grasa durante el embarazo y la lactancia predisponen a la cría a desarrollar un fenotipo análogo al síndrome metabólico, y a disfunción endotelial y cardiovascular, entre otras patologías15. Alteraciones en la composición corporal podrían inducir al desarrollo de patologías24-27, tales como accidente cerebrovascular28–30, cáncer31–33, enfermedades inflamatorias y autoinmunes34,35, y enfermedades óseas36. Pequeños cambios en los hábitos alimentarios como el simple agregado de ácido α-linolénico permitiría la reducción de la masa grasa por supresión de la lipogénesis37,38.
Conscientes de la importancia de los patrones culturales en la calidad de vida del individuo y que es de destacar que el aceite de maíz constituye un componente importante en la dieta de la población argentina39, este estudio demuestra la potencial necesidad de modificar ciertos hábitos alimentarios que eviten repetir patrones distorsionados de generación en generación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al Sr. Ricardo Orzuza, técnico de Bioterio por el cuidado de los animales y su soporte técnico. Este trabajo ha sido subsidiado por UBACyT 20020100100613 y C O02.