Los traumatismos craneoencefálicos (TCE) y las hemorragias subaracnoideas (HSA) son enfermedades frecuentes en nuestro medio. Ambos son causa reconocida de hipopituitarismo anterior y su prevalencia varía entre el 20 y el 80% según las últimas series publicadas. No existe consenso sobre la forma de evaluar los diferentes ejes hormonales, aunque sí está claro que se necesitan revisiones periódicas, puesto que el hipopituitarismo puede aparecer hasta transcurrido 1 año del TCE o la HSA. El tratamiento de las posibles deficiencias hormonales facilita el proceso de rehabilitación y disminuye la morbimortalidad.
Traumatic brain injuries and subarachnoid hemorrhage are frequent events in Spain. Both are well recognized causes of anterior hypopituitarism, the prevalence ranging from 20 to 80% according to recent series. Consensus is lacking on how to assess pituitary function after the injury, although periodic assessment is clearly needed because hypopituitarism may appear at any time in the first year after the event. Hormone replacement when necessary helps recovery and reduces morbidity and mortality.
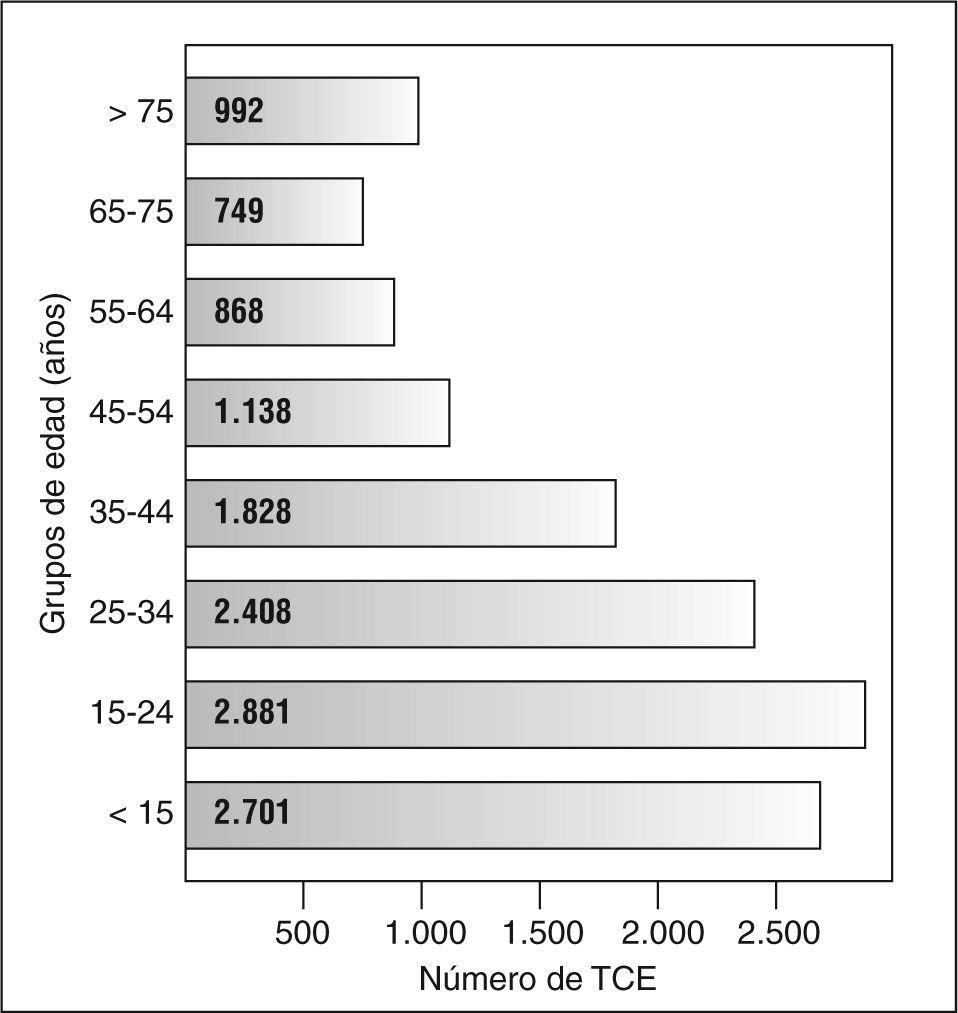
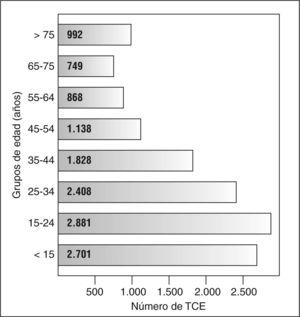
Los traumatismos craneoencefálicos (TCE) y las hemorragias subaracnoideas (HSA) son causa importante de morbimortalidad. Se calcula que los TCE tienen una incidencia de 150 a 300 casos por 100.000 habitantes/año1. Más del 50% son por accidentes de tráfico, y afectan sobre todo a adultos menores de 45 años2 (fig. 1). Por su parte las HSA representan entre el 5 y el 11% de todas las enfermedades vasculares cerebrales3 y se calcula que tienen una incidencia de 10 casos por 100.000 habitantes/año. Teniendo en cuenta la frecuencia de estas dos afecciones y el gasto que supone su tratamiento y rehabilitación, es comprensible el interés que está despertando su asociación con el hipopituitarismo.
Con el inicio del siglo XXI se ha producido un crecimiento exponencial en los conocimientos sobre la función hipofisaria y el daño cerebral y, en la actualidad, los TCE y las HSA son causa reconocida de hipopituitarismo anterior. Recientemente se ha demostrado que los microtraumatismos repetitivos también pueden ser causa de hipopituitarismo anterior en algunas modalidades de pugilismo4. Aunque los primeros estudios rigurosos datan del año 2000, hace décadas que se conoce la implicación de TCE y HSA en el hipopituitarismo anterior. La sospecha de hipopituitarismo en estas afecciones comenzó al observar a pacientes con TCE o HSA que no lograban recuperar por completo su calidad de vida y presentaban una clínica similar a la de los pacientes con hipopituitarismo no tratado. El primer caso de hipopituitarismo por TCE fue publicado en 1918 por Cyran5. Años más tarde, en 1942, Escamilla et al6 hicieron una revisión de casos de hipopituitarismo, y entre ellos incluían 4 por TCE. Poco a poco se fue sumando casuística. En la primera revisión sobre este tema, publicada por Altman et al7 en 1961, había 15 y para la segunda revisión8, del año 1986, ya eran 53. En la revisión de 2000 de Benvenga et al9 se recopilaron 367 casos de la bibliografía.
Las HSA se incorporaron más recientemente a las causas de hipopituitarismo. En 1961 se describió el primer caso10, y no fue hasta el año 2000 cuando se demostró, con pruebas dinámicas validadas, que realmente se podía producir hipopituitarismo después de una HSA11.
FISIOPATOLOGÍALos mecanismos causantes de hipopituitarismo en los accidentes neurológicos graves no se conocen con exactitud. Autopsias realizadas a individuos que habían sobrevivido más de 12h a un TCE mostraron lesiones isquémicas en la región periférica de la hipófisis anterior en un 35% de los casos. Tales lesiones podrían explicarse por un colapso del sistema portahipofisario mayor, secundario a las fuerzas que intervienen en el TCE12. En las HSA, estudios post morten también han encontrado lesiones consistentes en necrosis isquémica; microhemorragias y macrohemorragias que afectaban a la región hipotalámica (núcleos supraóptico y paraventricular). Uno de los mecanismos propuestos para la aparición de estas lesiones es la obstrucción temporal del drenaje venoso como consecuencia de un aumento de presión en la cisterna quiasmática cuando un aneurisma sangra hacia ella. Otro mecanismo sería el daño directo a las arterias perforantes hipotalámicas en el espacio subaracnoideo por la vasoconstricción secundaria a la propia hemorragia o por compresión de sus paredes por el sangrado13.
EPIDEMIOLOGÍALa prevalencia de hipopituitarismo anterior en pacientes con TCE y HSA oscila entre el 20 y el 80%14 (tabla 1). El primer estudio completo de hipopituitarismo en eventos neurológicos graves fue el publicado por Kelly et al11 en el 2000. Recogieron a 22 pacientes que habían sufrido TCE y HSA, y encontraron algún déficit en 8 (36,4%) de ellos11. Al año siguiente, Lieberman et al15 evaluaron retrospectivamente a 70 pacientes que habían sufrido un TCE una media de 13 meses antes del estudio; 48 se sometieron a la prueba de glucagón para estimular la somatotropina (GH), 7 de ellos respondieron de forma deficitaria; 15 de los sujetos tenían alteraciones en los valores basales del eje tiroideo. A 6 de ellos se les practicó una prueba de estimulación con protirrelina (TRH); 3 tuvieron una respuesta de tirotropina (TSH) deficitaria. En cuanto al eje hipofisosuprarrenal, 32/70 tenían concentraciones de cortisol basal disminuidas y, tras el estímulo con Synacthen®, 5 de ellos presentaron concentraciones de cortisol menores de 18μg/dl. No se encontraron alteraciones en el eje hipofisogonadal.
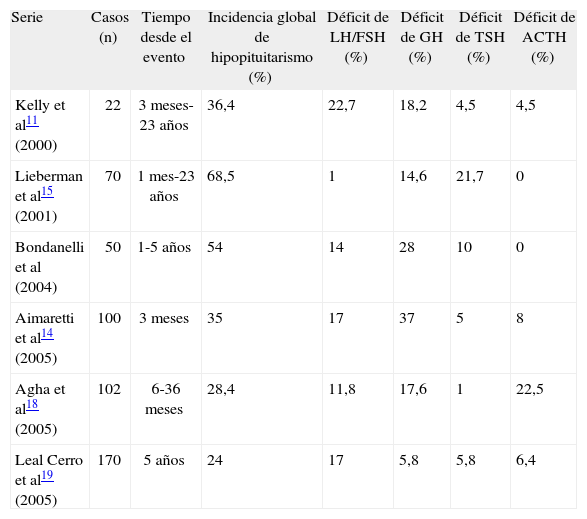
Resumen de los principales estudios publicados sobre prevalencia de hipopituitarismo anterior en TCE y HSA
| Serie | Casos (n) | Tiempo desde el evento | Incidencia global de hipopituitarismo (%) | Déficit de LH/FSH (%) | Déficit de GH (%) | Déficit de TSH (%) | Déficit de ACTH (%) |
| Kelly et al11 (2000) | 22 | 3 meses-23 años | 36,4 | 22,7 | 18,2 | 4,5 | 4,5 |
| Lieberman et al15 (2001) | 70 | 1 mes-23 años | 68,5 | 1 | 14,6 | 21,7 | 0 |
| Bondanelli et al (2004) | 50 | 1-5 años | 54 | 14 | 28 | 10 | 0 |
| Aimaretti et al14 (2005) | 100 | 3 meses | 35 | 17 | 37 | 5 | 8 |
| Agha et al18 (2005) | 102 | 6-36 meses | 28,4 | 11,8 | 17,6 | 1 | 22,5 |
| Leal Cerro et al19 (2005) | 170 | 5 años | 24 | 17 | 5,8 | 5,8 | 6,4 |
ACTH: corticotropina; FSH: folitropina; GH: somatotropina; HSA: hemorragia subaracnoidea; LH: lutropina; TCE: traumatismo craneoencefálico; TSH: tirotropina.
En los siguientes años se multiplicó el número de estudios en este campo, tanto de corte transversal como prospectivos. En las HSA, Kreitschmann-Andermahr et al16 y Dimopoulou et al17 encontraron una prevalencia de hipopituitarismo del 43 y el 47%, respectivamente. Aimaretti et al14 realizaron un estudio prospectivo secuencial y multicéntrico de la incidencia de hipopituitarismo en 102 pacientes que habían sufrido TCE o HSA. Las pruebas de función hipofisaria se realizaron a los 3 y los 12 meses del evento neurológico. En la evaluación inicial a los 3 meses, se encontró una incidencia de algún grado de hipopituitarismo del 32,8% para TCE y del 46,8% para HSA. El hallazgo más frecuente en TCE y HSA fue déficit grave de GH (el 22,8 y el 25%, respectivamente). En la siguiente evaluación a los 12 meses el porcentaje de pacientes con algún grado de hipopituitarismo era del 22,7% en el caso de los TCE y del 37,5% en las HSA; nuevamente el más frecuente fue el de GH (el 20 y el 21,8%, respectivamente).
En la misma línea del estudio citado, Agha et al18 evaluaron la función hipofisaria en 50 casos con TCE en fase aguda, a los 6 y los 12 meses. En la fase aguda, 9 presentaban déficit de GH. A los 6 meses, 5 pacientes se habían recuperado, pero aparecieron 2 casos nuevos y a los 12 meses, 1 de los pacientes se recuperó; 5 (10%) quedaron con déficit de GH permanente. En cuanto al eje hipofisosuprarrenal en la fase aguda, 8 (16%) pacientes tuvieron una respuesta de cortisol por debajo de los límites de la normalidad. A los 6 meses, 5 habían normalizado la función suprarrenal, pero aparecieron 5 casos nuevos. Finalmente, en la reevaluación a los 12 meses persistían 9 (18%) casos; 40 pacientes tenían déficit de gonadotropinas en la fase aguda, 29 de ellos se recuperaron a los 6 meses, y 5 más lo hicieron a los 12 meses; tan sólo persistieron 6 (12%) casos de hipogonadismo. Sólo un caso presentó déficit de TSH en la fase aguda, pero se recuperó a los 6 meses. En esta reevaluación apareció un nuevo caso que persistía a los 12 meses.
En España Leal-Cerro et al19 evaluaron la función hipofisaria en 170 pacientes que habían sufrido un TCE grave en los 5 años previos al estudio; se encontró déficit de TSH en 10 (5,8%) pacientes, de corticotropina (ACTH) en 11 (6,4%), de gonadotropinas en 29 (17%) y de GH en 10 (5,8%), además 15 (8,8%) casos presentaron déficit combinados.
En el momento de escribir esta revisión el último estudio publicado al respecto20 evalúa la función hipofisaria de 76 pacientes que habían sufrido un TCE una media de 20 meses antes del estudio; encontraron hipopituitarismo en el 24% de los pacientes, y las deficiencias hormonales más frecuentes fueron la de GH (8%) y el hipogonadismo secundario (17%).
Nuestro grupo está realizando un estudio transversal en el que, por el momento, han sido incluidos 56 pacientes (46 con TCE y 10 con HSA). Ninguno de los sujetos ha mostrado alteraciones en el eje hipofisosuprarrenal ni en el hipofisotiroideo. En el grupo de las HSA 7/10 pacientes han presentado déficit de GH en respuesta a la prueba de estimulación con glucagón o hipoglucemia insulínica (según situación clínica) con pico de GH inferior a 3ng/ml en 4 de ellos. En el grupo de TCE 9/46 presentaron déficit de GH con pico inferior a 3ng/ml en 5 de ellos. En 3/46 pacientes con TCE hemos constatado déficit de gonadotropinas, que no se ha objetivado en ninguno de los casos de HSA. En nuestros pacientes las deficiencias hormonales más frecuentes afectan a los ejes hipofisosomatotropo e hipofisogonadotropo, al igual que en la mayoría de los estudios citados21.
CÓMO EVALUAR LA FUNCIÓN HIPOFISARIA EN TCE Y HSANo hay acuerdo sobre el modo de evaluar la función hipofisaria después de eventos neurológicos graves. En los estudios previamente citados cada autor emplea técnicas y estrategias diferentes, que van desde el uso sistemático de pruebas de estimulación hasta el estudio inicial con determinaciones hormonales basales, completándolo con pruebas dinámicas sólo cuando las basales están alteradas. Así, Agha et al22, en el primer estudio transversal de prevalencia de hipopituitarismo en TCE, realizaban como primera prueba de evaluación de los ejes somatotropo y suprarrenal un estímulo con glucagón intramuscular y comprobaban los resultados anormales con la prueba de hipoglucemia insulínica (en caso de que estuviera contraindicada estimulaban con arginina + somatorrelina [GHRH] para GH y estímulo con Synacthen® para cortisol). El resto de los ejes se evaluaban con valores basales. Otros autores, sin embargo, emplean directamente pruebas dinámicas, como Kreitschmann-Andermahr et al, que usan el estímulo combinado con TRH-gonadorrelina (LHRH)-arginina e hipoglucemia insulínica de forma sistemática. A continuación se exponen las recomendaciones sobre diagnóstico de hipopituitarismo recogidas en una reciente revisión23 (tabla 2).
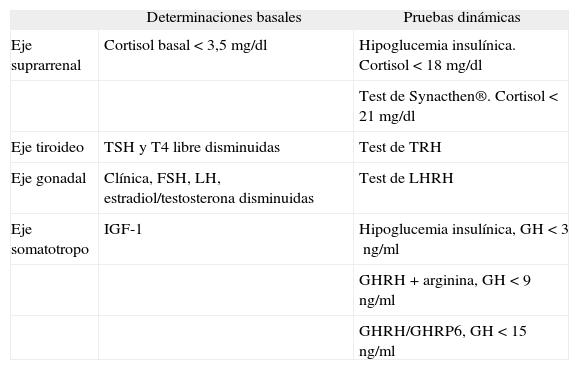
Resumen de las pruebas para el estudio de función hipofisaria usadas por diferentes autores, con algunos de sus valores de referencia
| Determinaciones basales | Pruebas dinámicas | |
| Eje suprarrenal | Cortisol basal < 3,5mg/dl | Hipoglucemia insulínica. Cortisol < 18mg/dl |
| Test de Synacthen®. Cortisol < 21mg/dl | ||
| Eje tiroideo | TSH y T4 libre disminuidas | Test de TRH |
| Eje gonadal | Clínica, FSH, LH, estradiol/testosterona disminuidas | Test de LHRH |
| Eje somatotropo | IGF-1 | Hipoglucemia insulínica, GH < 3ng/ml |
| GHRH + arginina, GH < 9ng/ml | ||
| GHRH/GHRP6, GH < 15ng/ml |
FSH: folitropina; GH: somatotropina; GHRH: somatorrelina; IGF-1: factor de crecimiento insulínico tipo 1; LH: lutropina; LHRH: luliberina; T4: tiroxina; TRH: protirrelina; TSH: tirotropina.
Se recomienda comenzar con la determinación de cortisol basal a las 9h, que se considera normal por encima de 18μg/dl y diagnóstico de insuficiencia suprarrenal por debajo de 3,5μg/dl. Cuando el cortisol basal se encuentra entre 3,5 y 18μg/dl, se recomienda realizar pruebas dinámicas: estímulo con Synacthen® 250μg intravenoso (respuesta normal, cortisol mayor de 21μg/dl), o bien hipoglucemia insulínica (respuesta normal, cortisol mayor de 18μg/dl, si se ha alcanzado glucemia de menos de 40mg/dl).
Eje hipofisotiroideoSe diagnostica hipotiroidismo de origen hipofisario cuando hay concentraciones de tiroxina (T4) libre disminuidas con concentraciones inadecuadamente normales o disminuidas de TSH.
Eje hipofisogonadalEn mujeres premenopáusicas la amenorrea indica diagnóstico de hipogonadismo, independientemente de las concentraciones de folitropina (FSH), lutropina (LH) y estradiol. En varones el diagnóstico se hace al objetivar concentraciones bajas de testosterona con concentraciones inadecuadamente normales o disminuidas de gonadotropinas.
Eje somatotropoLa evaluación de este eje requiere pruebas dinámicas. Un tercio de los pacientes con factor de crecimiento similar a insulina tipo 1 (IGF-1) en el rango de la normalidad tienen en realidad déficit de GH. La prueba de referencia para diagnosticar el déficit de GH es la hipoglucemia insulínica, y se considera indicativa de deficiencia grave la respuesta con valores menores de 3ng/ml. La prueba de glucagón, tradicionalmente considerada como alternativa a la hipoglucemia insulínica, está perdiendo protagonismo en favor del estímulo con GHRH + arginina (valor normal por encima de 9ng/ml) y, últimamente, se está empleando el estímulo con GHRH/GHRP-6. Esta prueba se realiza mediante la infusión intravenosa de 1μg de cada sustancia, y después, de forma seriada, se determinan los valores de GH durante 120min. Se considera normal una cifra mayor de 15ng/ml.
¿CUÁNDO Y A QUIÉN ESTUDIAR?La gravedad del accidente neurológico no se relaciona con la aparición de hipopituitarismo24, pero la mayoría de los afectados presentaban eventos de gravedad moderada o intensa en las series publicadas. Además, estos casos son los que suelen presentar deficiencias persistentes, por lo que parece razonable recomendar en ellos el cribado sistemático de hipopituitarismo25.
En cuanto al momento del estudio, está demostrado que la disfunción hipofisaria puede aparecer en cualquier momento desde el evento hasta un año después26, por lo que los pacientes deberían ser evaluados periódicamente hasta transcurrido un año del TCE o la HSA12. Como la incidencia de TCE y HSA es muy elevada, algunos autores proponen hacer determinaciones de cortisol basal ya en la fase aguda y tratar a aquellos que presenten insuficiencia suprarrenal para posteriormente reevaluar la función hipofisaria.
TRATAMIENTOLa sustitución de las deficiencias hormonales se realizará de acuerdo con las guías clínicas internacionales. El tratamiento sustitutivo con GH está indicado en los pacientes que presenten un déficit moderado o grave27,28. Existe evidencia de que la omisión de tratamiento sustitutivo retrasa la recuperación e impide alcanzar resultados óptimos en la rehabilitación. Un reciente estudio29 ha demostrado mayor frecuencia de mortalidad precoz, sobre todo por enfermedad cardiovascular, en pacientes con hipopituitarismo anterior no tratado.
CONCLUSIONESEl hipopituitarismo anterior es una complicación frecuente de TCE y HSA, que se debe reconocer y tratar adecuadamente con el fin de mejorar el proceso de rehabilitación y la calidad de vida. Es necesario establecer consensos para homogeneizar las pruebas de estudio de función hipofisaria y los criterios diagnósticos de hipopituitarismo anterior en estos pacientes.