El objetivo de esta revisión es evaluar la efectividad para disminuir los eventos adversos clínicos y la seguridad de la insulinoterapia en régimen bolo-basal-corrector o basal-corrector frente a la insulinoterapia en «pauta deslizante», en pacientes con diabetes o con hiperglucemia de reciente diagnóstico ingresados en una planta de hospitalización convencional, no críticos, tanto médica como quirúrgica.
MétodoSe realizó búsqueda en Medline. La odds ratio fue la medida resumen principal. Se empleó un modelo de efectos aleatorios con la técnica de Mante-Haenszel.
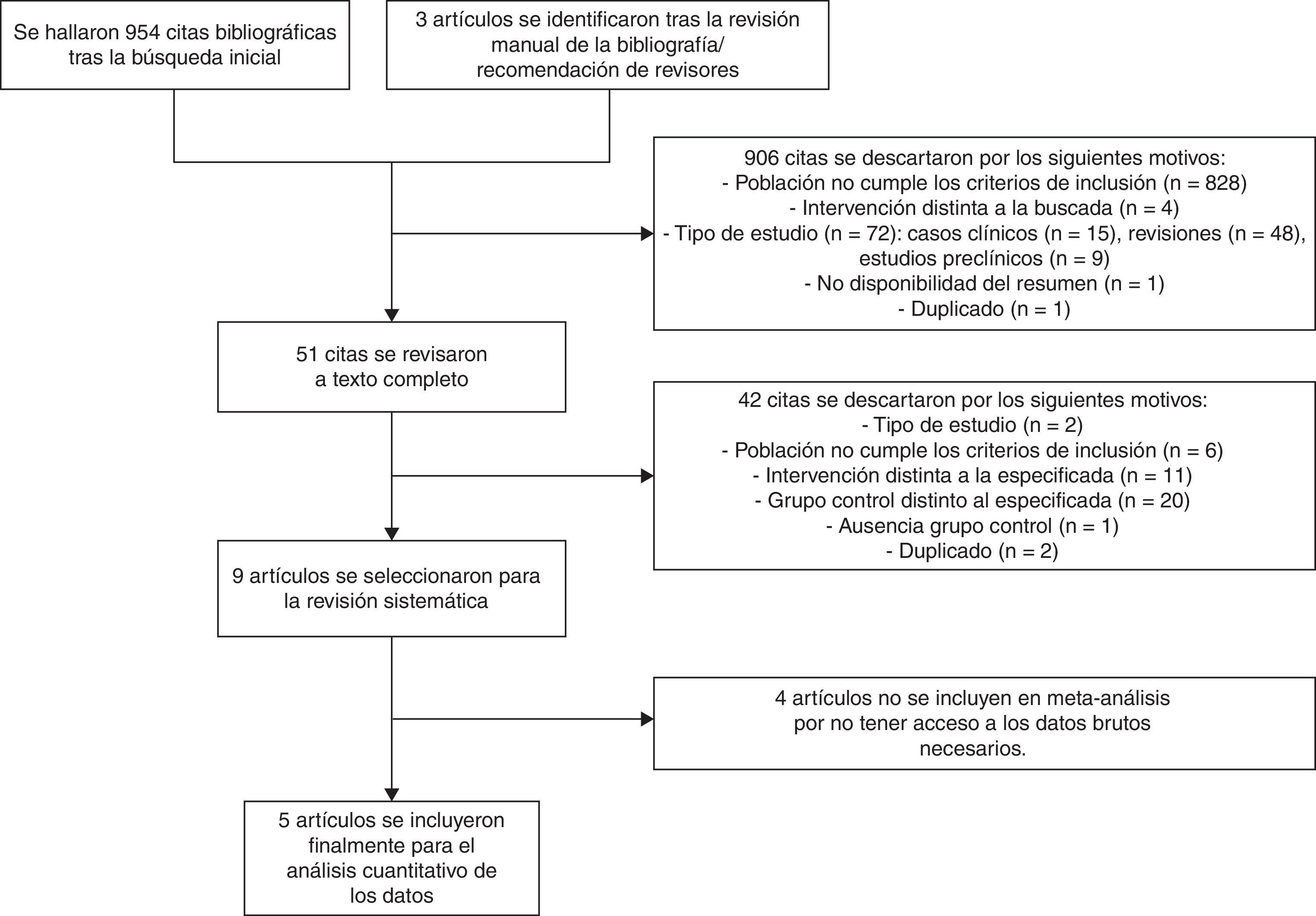
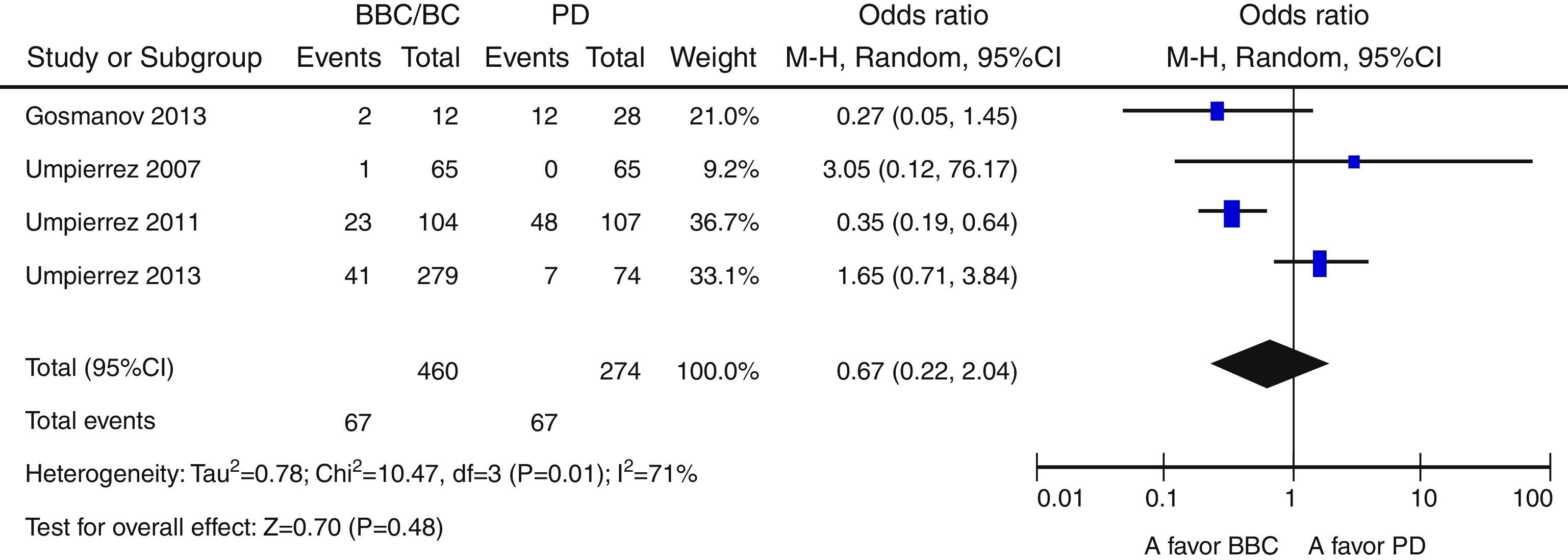
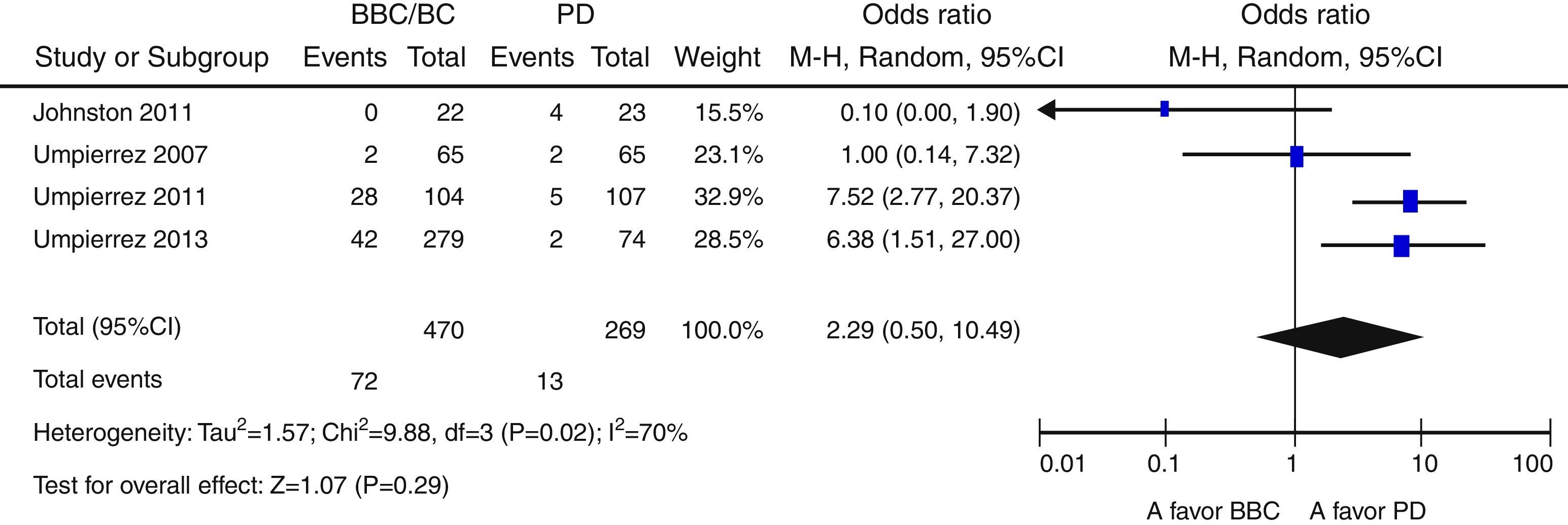
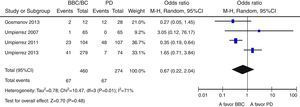
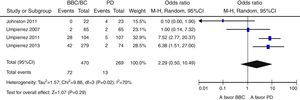
ResultadosNovecientas cincuenta y siete citas de las cuales 9 fueron finalmente incluidas en la revisión sistemática. Los pacientes en el grupo BB tuvieron un mejor control glucémico que aquellos con PD. Globalmente, se objetiva una tendencia no significativa hacia un menor riesgo de eventos adversos en el grupo BB frente a PD (OR 0,67 —IC 95%: 0,22-2,04— [I2=71%]). Existe una tendencia no significativa hacia un mayor riesgo de hipoglucemia en el grupo BB (OR: 2,29; IC 95% 0,50-10,49 [I2=70%]).
ConclusiónA pesar de su beneficio para el control glucémico durante la hospitalización, esta revisión no ha objetivado que el uso de la pauta BB disminuya eventos clínicos en pacientes hospitalizados en planta convencional. Debido a la heterogeneidad en los resultados, consideramos que se requieren ensayos clínicos que contemplen su efecto en subgrupos de pacientes en los que la pauta BB se pueda usar de forma segura y con períodos de seguimiento más prolongados.
The aim of this review was to assess the effectiveness to reduce clinical adverse events and safety of insulin administered in basal-bolus-corrector or basal-corrector regimens (BB) versus a sliding scale scheme (SS) in patients with diabetes or newly diagnosed hyperglycemia admitted to a conventional (not critical) medical or surgical hospital ward.
MethodA Medline search was conducted. The Odds ratio was the main summary measure. A random effects model with the Mantel-Haenszel procedure was used.
ResultsA total of 957 citations were collected, of which nine were finally included in the systematic review. Patients in the BB group had better blood glucose control than those with SS. Overall, there was a nonsignificant trend to a lower risk of adverse events in the BB as compared to the SS group (OR 0.67 [95% CI 0.22 to 2.04], [I2=71%]). There was a nonsignificant trend to an increased risk of hypoglycemia in the BB group (OR 2.29 [95% CI 0.50 to 10.49] [I2=70%]).
ConclusionDespite its benefit for glycemic control during hospitalization, this review did not show that use of the BB scheme decreases clinical events in patients hospitalized in a conventional ward. Because of heterogeneity of the results, we think that clinical trials are needed addressing its effect in patient subgroups in which the BB scheme may be used safely and with longer follow-up periods.
La diabetes mellitus (DM) es una enfermedad con una prevalencia creciente y un fuerte impacto en los sistemas de salud de la mayoría de los países, con un desarrollo económico estable. En España se estima que el 14%1 de la población sufre DM, lo que supone un total de 5.809 millones de euros en costes directos y 17.650 millones de euros en costes indirectos (incluyendo en este aspecto el absentismo laboral, bajas, jubilaciones precoces y mortalidad anticipada)2. Asimismo, la diabetes ocasiona un amplio abanico de complicaciones, tanto agudas como crónicas, lo que conlleva que su prevalencia en población hospitalizada sea aún mayor. Un estudio transversal realizado en nuestro país establece que hasta un 26% de los pacientes hospitalizados, tanto en áreas médicas como quirúrgicas, presentan hiperglucemia durante la hospitalización3, y esta cifra puede ascender hasta el 38% en registros provenientes de Estados Unidos4.
Fisiopatológicamente la hiperglucemia conduce al daño celular y genera una disfunción inmune mediante varios mecanismos (liberación de citoquinas proinflamatorias, alteración de la función de los neutrófilos, liberación de radicales libres de oxígeno, entre otros)5. Así, está establecido el efecto deletéreo de la hiperglucemia durante la hospitalización en diversos escenarios clínicos, tanto en pacientes críticos como no críticos4. Hay una mayor tasa de complicaciones (incluyendo infecciones) y mortalidad en el postoperatorio en pacientes con mal control glucémico al ingreso6,7 y es un factor predictor de mortalidad en pacientes ingresados por un infarto de miocardio8 o por un ictus9. Además, la hiperglucemia se relaciona con una mayor tasa de infecciones en pacientes sometidos a trasplante de médula ósea10 y con una menor duración de la remisión completa y mayor mortalidad en pacientes ingresados para tratamiento de una leucemia linfoblástica aguda11, entre otros ejemplos.
Clásicamente, el control de la hiperglucemia en la hospitalización se realizaba mediante las conocidas como «pautas deslizantes» (PD), que consistían en la administración de insulina regular únicamente en función de los controles glucémicos previos a las comidas. La utilidad de esta pauta, alejada de la secreción fisiológica de insulina, ha sido refutada ampliamente12. En estudios observacionales no se ha demostrado su eficacia para el control de la glucemia13,14, y en ensayos clínicos más recientes se ha probado su inferioridad frente a las denominadas pautas bolo-basal (BB)15,16. A pesar de lo previo, dada su simpleza y, probablemente, por el miedo a la hipoglucemia de los clínicos, continúan siendo ampliamente utilizadas hoy en día. En nuestro medio hasta un 65% de los pacientes con diabetes hospitalizados están en tratamiento exclusivamente con PD3.
A raíz de esta situación, han surgido en la última década varios estudios destinados a comprobar la efectividad de otras pautas de tratamiento para el control glucémico durante la hospitalización. Como se ha citado previamente, las pautas BB, en las que parte de la insulina se administra como insulina lenta o ultralenta para cubrir la hiperglucemia de ayuno, han demostrado su eficacia para alcanzar un control glucémico adecuado durante la hospitalización15–17, sin embargo la evidencia sobre su efecto en el pronóstico clínico de los pacientes es más escasa18. Hasta el momento solo se ha podido demostrar que el uso de pautas BB reduce las tasas de infección en pacientes quirúrgicos16,19.
El objetivo de esta revisión es evaluar la efectividad para disminuir los eventos adversos clínicos y la seguridad de la insulinoterapia en régimen bolo-basal-corrector o basal-corrector frente a la insulinoterapia en «pauta deslizante», en pacientes con diabetes o con hiperglucemia de reciente diagnóstico ingresados en una planta de hospitalización convencional, no críticos, tanto médica como quirúrgica.
Material y métodosEsta revisión se ha realizado siguiendo las directrices PRISMA20,21, y se adjunta como material suplementario la lista de comprobación en el anexo 1 (tabla A1 del anexo 1).
Se contempla como pauta bolo-basal-correctora o basal-correctora (BB) que el paciente reciba una insulina lenta o ultra-lenta a dosis fija (basal) junto con bolos de insulina ultrarrápida asociados a la ingesta (estos pueden ser fijos —prandiales— y/o dependientes de la glucemia previa a la ingesta —correctores—). Se denomina «pauta deslizante» (PD) a que el paciente reciba exclusivamente bolos de insulina en función de los controles de glucemia capilar previa a las comidas. Se considera un evento adverso cualquier complicación registrada, incluyendo la mortalidad, durante el periodo de seguimiento definido en los distintos estudios, así como el número de hipoglucemias detectadas.
Se llevó a cabo una búsqueda en la base de datos de Medline a través del motor de búsqueda PubMed, desde el origen hasta 26 de septiembre de 2014, y se repitió dicha búsqueda antes de realizar el análisis de los datos (15 de marzo de 2015). Se revisó también la bibliografía de los artículos relevantes manualmente. Se emplearon los términos sliding scale, basal bolus, non-critically ill, inpatients, hospitalizated patients, hyperglycemia y diabetes mellitus. La cadena de búsqueda completa se incluye en el anexo 1 (tabla A2 del anexo 1).
Se seleccionaron los artículos que cumplían los siguientes criterios de inclusión: ensayos clínicos y estudios de cohortes, tanto prospectivos como retrospectivos, que incluyeran pacientes con hiperglucemia de reciente diagnóstico y/o diagnóstico previo de diabetes (independientemente del tipo), hospitalizados en una planta convencional. La intervención debía incluir tratamiento con BB y debía existir un grupo control que recibiera únicamente insulina mediante el esquema PD. Finalmente, debían recoger datos de mortalidad y/o complicaciones intrahospitalarias o durante el seguimiento (infección nosocomial, complicaciones cardiovasculares, estancia media) y/o datos de seguridad (hipoglucemia). Se consideraron criterios de exclusión los siguientes: pacientes menores de 18 años, ingresados en unidades de críticos, tratamiento con insulinoterapia intravenosa y/o la presencia de complicaciones agudas de la diabetes (estado hiperglucémico hiperosmolar/cetoacidosis diabética) al ingreso. Se excluyeron también los estudios publicados en un idioma distinto al inglés o el español. Un único autor fue el responsable de la revisión y selección final de los artículos.
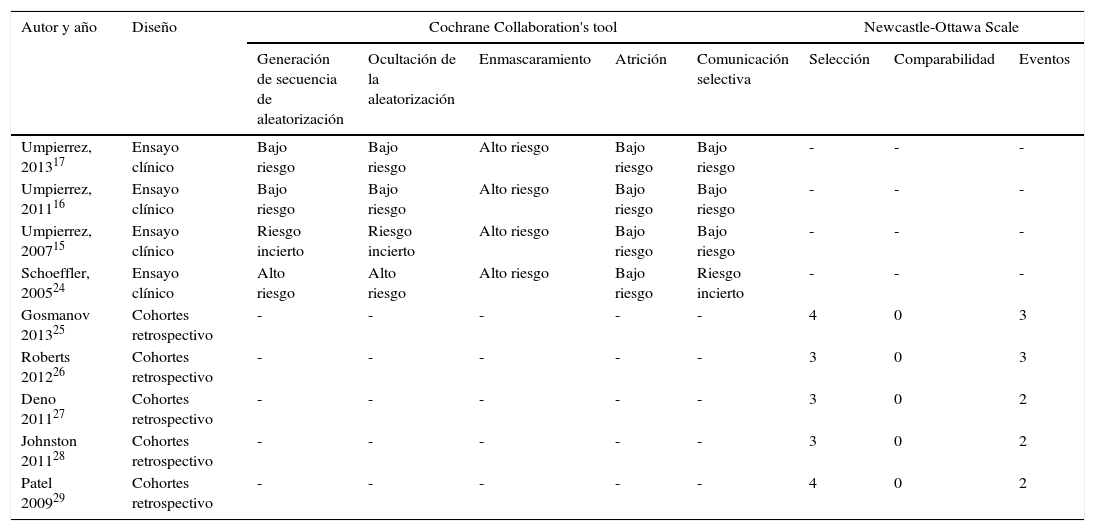
Se empleó la herramienta de The Cochrane Collaboration's para la evaluación del riesgo de sesgo en los ensayos clínicos22. Se empleó la escala de calidad de Newcastle-Ottawa para la evaluación de la calidad de los estudios de cohortes23. No se estableció a priori un límite en la calidad de los artículos para ser incluidos en la revisión o en el posterior metaanálisis.
Se extrajeron las siguientes variables de los artículos seleccionados mediante un formulario prediseñado: autor, año de publicación, localización y período del estudio, diseño, edad y sexo, presencia de diabetes previa y su tipo, hiperglucemia de estrés, motivo de ingreso, ingreso en área médica o quirúrgica, uso de corticoides, tipo y dosis de corticoides, tratamiento para la diabetes previo al ingreso, criterios de exclusión del estudio, HbA1c, uso de pauta BB en el brazo de intervención, uso de PD en el grupo control, tipo y dosis de insulinas empleadas en ambos grupos y tipo de pauta y su ajuste, número de inyecciones de insulina rápida en el grupo con PD, uso de antidiabéticos orales durante la hospitalización, objetivo de control glucémico en el estudio, objetivos primario y secundarios del estudio, definición de evento adverso, control glucémico, número de eventos adversos, mortalidad e hipoglucemia en cada grupo y período de seguimiento.
Se empleó la odds ratio (OR) como principal medida de efecto para cada uno de los objetivos. La efectividad de la intervención se valoró mediante un objetivo compuesto que incluía todos los eventos adversos con significación clínica registrados en los estudios, incluyendo la mortalidad. La seguridad se determinó mediante el número de hipoglucemias registradas. Se ha decidido utilizar la técnica de Mantel-Haenszel (MH) con un modelo de efectos aleatorios. Los resultados se expresan mediante forest plot. Se ha realizado el análisis de heterogeneidad empleando el estadístico I2. Se planeó llevar a cabo un análisis de sensibilidad de los resultados de los ensayos clínicos de forma aislada. Se analizó el sesgo de publicación mediante la realización de gráficos en embudo.
Se utilizó el programa Microsoft Excel (2010) para la selección de artículos, evaluación del riesgo de sesgo y extracción de datos. Para la gestión de referencias bibliográficas se empleó el programa Mendeley Desktop (Versión 1.13.8) y el análisis de datos se llevó a cabo mediante el programa: RevMan (Review Manager. Versión 5.2. Copenhagen: TheNordic Cochrane Centre, The Cochrane Collaboration, 2012).
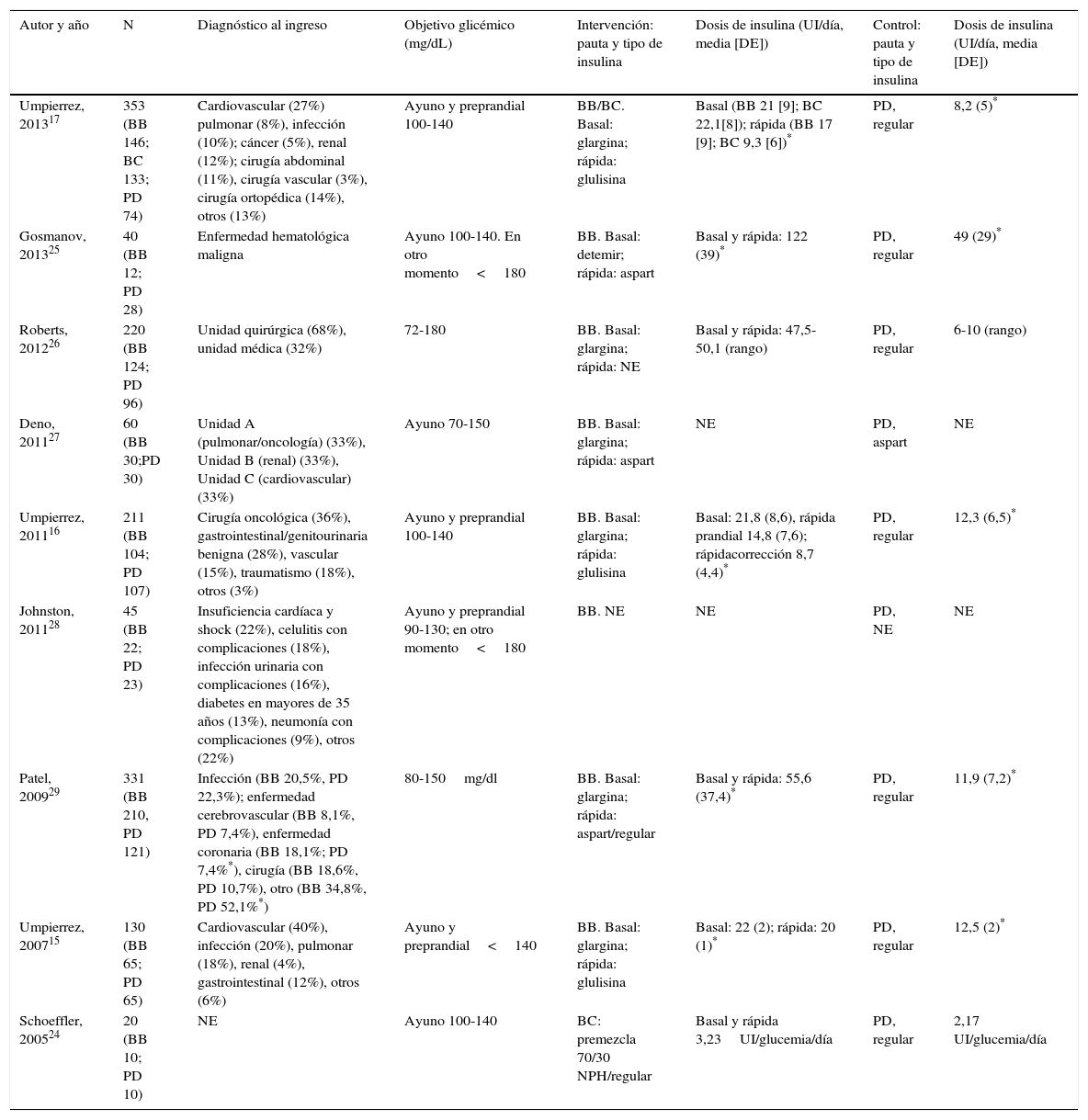
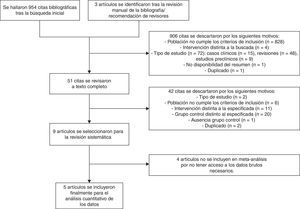
ResultadosSe identificaron un total de 957 citas, de las cuales 9 (4 ensayos clínicos15–17,24 y 5 estudios de cohortes retrospectivos25–29) cumplieron finalmente los criterios de inclusión en la revisión sistemática. Los estudios de Roberts et al.26, Deno et al.27, Schoeffler et al.24 y Patel et al.29 no se incluyeron finalmente en el metaanálisis por no tener acceso a los datos brutos necesarios para ello (fig. 1).
El resumen de la evaluación del riesgo de sesgo de los estudios incluidos aparece en la tabla 1. Las características de los estudios se detallan en la tabla 2. Todos los estudios se realizaron en Estados Unidos, salvo el de Roberts et al.26 (Australia). Todos incluyen pacientes con diagnóstico previo de DM tipo 2, salvo el de Deno et al.27, que incluye pacientes con hiperglucemia de estrés, y Patel et al.29 que incluye pacientes con DM tipo 1 e hiperglucemia de estrés, si bien la mayoría de los pacientes incluidos en este estudio tenían diagnóstico previo de DM tipo 2. La proporción de varones incluidos en los diferentes estudios oscila entre un 32-72% y la edad media varía entre 55,6 (DE 7,3) y 75,7 (DE 10) años. El uso de esteroides constituye un criterio de exclusión en todos los estudios, salvo en el de Gosmanov et al.25, en el que el uso de dexametasona es un criterio de inclusión. Finalmente, en lo que respecta a la población incluida, existe una amplia variedad de diagnósticos al ingreso en los estudios incluidos (tabla 2). Todos, salvo Schoeffler et al.24—que emplean una mezcla de NPH/regular— y Jonhston et al.28—que no lo detallan— emplean como basal una insulina ultralenta (glargina15–17,26,27 o detemir25) y como prandial/correctora insulina ultrarrápida (aspart o glulisina) o regular29. La insulina empleada en el grupo control es regular en la mayoría de los estudios15–17,24–26,29. De manera constante, las dosis diarias de insulina empleadas en el grupo BB son mayores que en el PD a lo largo de todos los estudios incluidos15–17,24–26,29. Los antidiabéticos orales fueron retirados durante la hospitalización en los ensayos clínicos15–17, pero se permitieron en la mayoría de los estudios observacionales24,26,28.
Evaluación del riesgo de sesgo de los artículos incluidos
| Autor y año | Diseño | Cochrane Collaboration's tool | Newcastle-Ottawa Scale | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Generación de secuencia de aleatorización | Ocultación de la aleatorización | Enmascaramiento | Atrición | Comunicación selectiva | Selección | Comparabilidad | Eventos | ||
| Umpierrez, 201317 | Ensayo clínico | Bajo riesgo | Bajo riesgo | Alto riesgo | Bajo riesgo | Bajo riesgo | - | - | - |
| Umpierrez, 201116 | Ensayo clínico | Bajo riesgo | Bajo riesgo | Alto riesgo | Bajo riesgo | Bajo riesgo | - | - | - |
| Umpierrez, 200715 | Ensayo clínico | Riesgo incierto | Riesgo incierto | Alto riesgo | Bajo riesgo | Bajo riesgo | - | - | - |
| Schoeffler, 200524 | Ensayo clínico | Alto riesgo | Alto riesgo | Alto riesgo | Bajo riesgo | Riesgo incierto | - | - | - |
| Gosmanov 201325 | Cohortes retrospectivo | - | - | - | - | - | 4 | 0 | 3 |
| Roberts 201226 | Cohortes retrospectivo | - | - | - | - | - | 3 | 0 | 3 |
| Deno 201127 | Cohortes retrospectivo | - | - | - | - | - | 3 | 0 | 2 |
| Johnston 201128 | Cohortes retrospectivo | - | - | - | - | - | 3 | 0 | 2 |
| Patel 200929 | Cohortes retrospectivo | - | - | - | - | - | 4 | 0 | 2 |
Características de los estudios incluidos: descripción de la población incluida e intervención
| Autor y año | N | Diagnóstico al ingreso | Objetivo glicémico (mg/dL) | Intervención: pauta y tipo de insulina | Dosis de insulina (UI/día, media [DE]) | Control: pauta y tipo de insulina | Dosis de insulina (UI/día, media [DE]) |
|---|---|---|---|---|---|---|---|
| Umpierrez, 201317 | 353 (BB 146; BC 133; PD 74) | Cardiovascular (27%) pulmonar (8%), infección (10%); cáncer (5%), renal (12%); cirugía abdominal (11%), cirugía vascular (3%), cirugía ortopédica (14%), otros (13%) | Ayuno y preprandial 100-140 | BB/BC. Basal: glargina; rápida: glulisina | Basal (BB 21 [9]; BC 22,1[8]); rápida (BB 17 [9]; BC 9,3 [6])* | PD, regular | 8,2 (5)* |
| Gosmanov, 201325 | 40 (BB 12; PD 28) | Enfermedad hematológica maligna | Ayuno 100-140. En otro momento<180 | BB. Basal: detemir; rápida: aspart | Basal y rápida: 122 (39)* | PD, regular | 49 (29)* |
| Roberts, 201226 | 220 (BB 124; PD 96) | Unidad quirúrgica (68%), unidad médica (32%) | 72-180 | BB. Basal: glargina; rápida: NE | Basal y rápida: 47,5-50,1 (rango) | PD, regular | 6-10 (rango) |
| Deno, 201127 | 60 (BB 30;PD 30) | Unidad A (pulmonar/oncología) (33%), Unidad B (renal) (33%), Unidad C (cardiovascular) (33%) | Ayuno 70-150 | BB. Basal: glargina; rápida: aspart | NE | PD, aspart | NE |
| Umpierrez, 201116 | 211 (BB 104; PD 107) | Cirugía oncológica (36%), gastrointestinal/genitourinaria benigna (28%), vascular (15%), traumatismo (18%), otros (3%) | Ayuno y preprandial 100-140 | BB. Basal: glargina; rápida: glulisina | Basal: 21,8 (8,6), rápida prandial 14,8 (7,6); rápidacorrección 8,7 (4,4)* | PD, regular | 12,3 (6,5)* |
| Johnston, 201128 | 45 (BB 22; PD 23) | Insuficiencia cardíaca y shock (22%), celulitis con complicaciones (18%), infección urinaria con complicaciones (16%), diabetes en mayores de 35 años (13%), neumonía con complicaciones (9%), otros (22%) | Ayuno y preprandial 90-130; en otro momento<180 | BB. NE | NE | PD, NE | NE |
| Patel, 200929 | 331 (BB 210, PD 121) | Infección (BB 20,5%, PD 22,3%); enfermedad cerebrovascular (BB 8,1%, PD 7,4%), enfermedad coronaria (BB 18,1%; PD 7,4%*), cirugía (BB 18,6%, PD 10,7%), otro (BB 34,8%, PD 52,1%*) | 80-150mg/dl | BB. Basal: glargina; rápida: aspart/regular | Basal y rápida: 55,6 (37,4)* | PD, regular | 11,9 (7,2)* |
| Umpierrez, 200715 | 130 (BB 65; PD 65) | Cardiovascular (40%), infección (20%), pulmonar (18%), renal (4%), gastrointestinal (12%), otros (6%) | Ayuno y preprandial<140 | BB. Basal: glargina; rápida: glulisina | Basal: 22 (2); rápida: 20 (1)* | PD, regular | 12,5 (2)* |
| Schoeffler, 200524 | 20 (BB 10; PD 10) | NE | Ayuno 100-140 | BC: premezcla 70/30 NPH/regular | Basal y rápida 3,23UI/glucemia/día | PD, regular | 2,17 UI/glucemia/día |
BB: bolo-basal-corrección; BC: basal-corrección; DE: desviación estándar; DM: diabetes mellitus; NE: no especificado; PD: pauta deslizante.
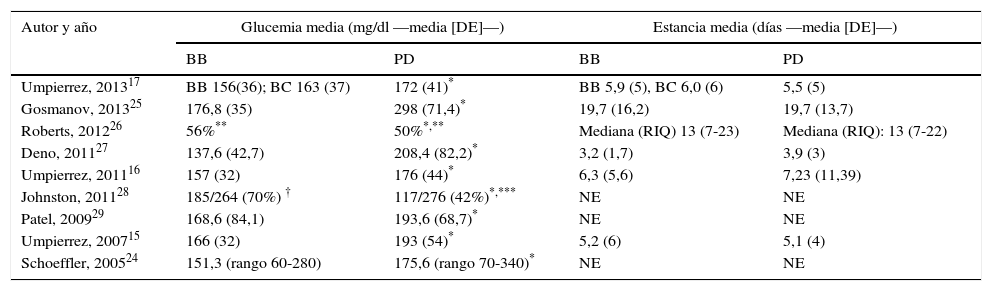
En la tabla 3 se resume los resultados de los estudios incluidos. No hay diferencia significativa en la estancia media entre el grupo BB y el PD en ninguno de los estudios incluidos. Salvo en Jonhston et al.28 los pacientes en el grupo BB tienen un mejor control glucémico que aquellos que reciben exclusivamente insulina según el esquema PD (tabla 4).
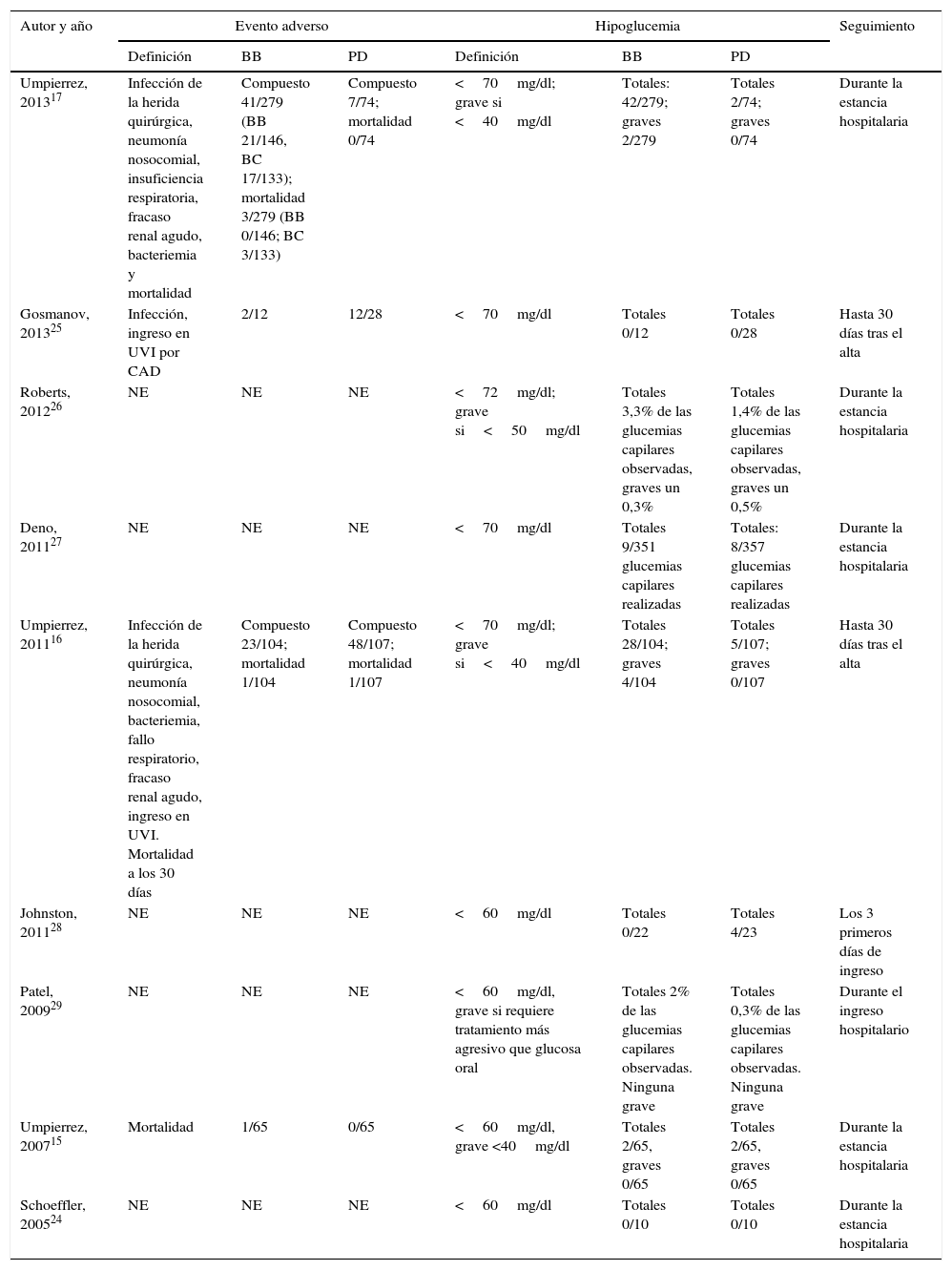
Resultados de los estudios individuales: eventos adversos e hipoglucemias
| Autor y año | Evento adverso | Hipoglucemia | Seguimiento | ||||
|---|---|---|---|---|---|---|---|
| Definición | BB | PD | Definición | BB | PD | ||
| Umpierrez, 201317 | Infección de la herida quirúrgica, neumonía nosocomial, insuficiencia respiratoria, fracaso renal agudo, bacteriemia y mortalidad | Compuesto 41/279 (BB 21/146, BC 17/133); mortalidad 3/279 (BB 0/146; BC 3/133) | Compuesto 7/74; mortalidad 0/74 | <70mg/dl; grave si <40mg/dl | Totales: 42/279; graves 2/279 | Totales 2/74; graves 0/74 | Durante la estancia hospitalaria |
| Gosmanov, 201325 | Infección, ingreso en UVI por CAD | 2/12 | 12/28 | <70mg/dl | Totales 0/12 | Totales 0/28 | Hasta 30 días tras el alta |
| Roberts, 201226 | NE | NE | NE | <72mg/dl; grave si<50mg/dl | Totales 3,3% de las glucemias capilares observadas, graves un 0,3% | Totales 1,4% de las glucemias capilares observadas, graves un 0,5% | Durante la estancia hospitalaria |
| Deno, 201127 | NE | NE | NE | <70mg/dl | Totales 9/351 glucemias capilares realizadas | Totales: 8/357 glucemias capilares realizadas | Durante la estancia hospitalaria |
| Umpierrez, 201116 | Infección de la herida quirúrgica, neumonía nosocomial, bacteriemia, fallo respiratorio, fracaso renal agudo, ingreso en UVI. Mortalidad a los 30 días | Compuesto 23/104; mortalidad 1/104 | Compuesto 48/107; mortalidad 1/107 | <70mg/dl; grave si<40mg/dl | Totales 28/104; graves 4/104 | Totales 5/107; graves 0/107 | Hasta 30 días tras el alta |
| Johnston, 201128 | NE | NE | NE | <60mg/dl | Totales 0/22 | Totales 4/23 | Los 3 primeros días de ingreso |
| Patel, 200929 | NE | NE | NE | <60mg/dl, grave si requiere tratamiento más agresivo que glucosa oral | Totales 2% de las glucemias capilares observadas. Ninguna grave | Totales 0,3% de las glucemias capilares observadas. Ninguna grave | Durante el ingreso hospitalario |
| Umpierrez, 200715 | Mortalidad | 1/65 | 0/65 | <60mg/dl, grave <40mg/dl | Totales 2/65, graves 0/65 | Totales 2/65, graves 0/65 | Durante la estancia hospitalaria |
| Schoeffler, 200524 | NE | NE | NE | <60mg/dl | Totales 0/10 | Totales 0/10 | Durante la estancia hospitalaria |
BB: bolo-basal-corrección; BC: basal-corrección; CAD: cetoacidosis diabética; NE: no especificado; PD: pauta deslizante; UVI: unidad de vigilancia intensiva.
Resultados de los estudios incluidos: control glucémico y estancia media
| Autor y año | Glucemia media (mg/dl —media [DE]—) | Estancia media (días —media [DE]—) | ||
|---|---|---|---|---|
| BB | PD | BB | PD | |
| Umpierrez, 201317 | BB 156(36); BC 163 (37) | 172 (41)* | BB 5,9 (5), BC 6,0 (6) | 5,5 (5) |
| Gosmanov, 201325 | 176,8 (35) | 298 (71,4)* | 19,7 (16,2) | 19,7 (13,7) |
| Roberts, 201226 | 56%** | 50%*,** | Mediana (RIQ) 13 (7-23) | Mediana (RIQ): 13 (7-22) |
| Deno, 201127 | 137,6 (42,7) | 208,4 (82,2)* | 3,2 (1,7) | 3,9 (3) |
| Umpierrez, 201116 | 157 (32) | 176 (44)* | 6,3 (5,6) | 7,23 (11,39) |
| Johnston, 201128 | 185/264 (70%) † | 117/276 (42%)*,*** | NE | NE |
| Patel, 200929 | 168,6 (84,1) | 193,6 (68,7)* | NE | NE |
| Umpierrez, 200715 | 166 (32) | 193 (54)* | 5,2 (6) | 5,1 (4) |
| Schoeffler, 200524 | 151,3 (rango 60-280) | 175,6 (rango 70-340)* | NE | NE |
BB: bolo-basal-corrección; BC basal-corrección; DE: desviación estándar; NE: no especifica; PD: pauta deslizante; RIQ: recorrido intercuartílico.
Globalmente, se objetiva una tendencia no significativa hacia un menor riesgo de eventos adversos en el grupo BB frente a PD (OR 0,67 [IC 95%: 0,22-2,04], I2=71%) (fig. 2). Este resultado es similar cuando se analizan de forma independiente los ensayos clínicos15–17 (OR 0,89 [IC 95%: 0,23-3,50], I2=79%); así como cuando se analizan únicamente las complicaciones infecciosas (OR 0,5 [IC 95%: 0,17-1,49],I2=54%)16,17,25. Asimismo, existe una tendencia no significativa hacia un mayor riesgo de hipoglucemia en el grupo BB (OR 2,29, IC 95%: 0,50-10,49 [I2=70%]) (fig. 3), que se confirma cuando se analizan por separado los resultados de los ensayos clínicos15–17 (OR 4,72, IC 95%: 1,68-13,2, I2=38%). De forma exploratoria se ha llevado un análisis del riesgo de hipoglucemia grave en ambos grupos, no existiendo diferencias significativas entre ellos (OR 3,73, IC 95%: 0,45-30,88, I2=0%), aunque este dato solo lo aportan 2 estudios16,17.
Por último, se realizó una evaluación del sesgo de publicación mediante gráficos en embudo, mostrando una importante asimetría de los estudios que analizan el riesgo de hipoglucemia. Esto sugiere que pueden existir estudios no incluidos en nuestra revisión. De hecho, 3 de los estudios seleccionados24,26,27 no pudieron incluirse finalmente en el análisis por falta de datos a nivel del paciente.
DiscusiónLa pauta BB ha demostrado mejorar el control glucémico durante la hospitalización frente al uso de la PD, así en la revisión actual el control glucémico es significativamente mejor en el grupo BB en la mayoría de los estudios incluidos15–17,24,25,27,29,26. Sin embargo, en nuestra revisión no se ha podido demostrar que el mejor control glucémico derivado del uso de una pauta BB disminuya los eventos adversos de significación clínica frente al uso de PD. Este resultado es similar al extraído por otras revisiones realizadas previamente18,19. Así, en la revisión de Murad et al.19, en la que comparan el efecto del control intensivo de la glucemia (usando BB o infusión intravenosa de insulina) frente al control habitual en pacientes hospitalizados en planta convencional, no objetivan reducción de la mortalidad, incidencia de ictus o infarto agudo de miocardio. Sin embargo, sí que existe una menor tasa de infección en el grupo de control intensivo, a expensas fundamentalmente de los estudios realizados en áreas quirúrgicas.
La primera limitación del presente estudio es que el número de estudios prospectivos realizados en el ámbito de la hospitalización convencional con insulina subcutánea es muy escaso. De hecho, una revisión previa realizada en 2011 por Kansaga et al.18 no incluye ningún estudio en planta médica convencional, y solo se registran 5 estudios que empleen insulina subcutánea en régimen BB en plantas de hospitalización convencional en la revisión de Murad et al.19. De los 9 estudios incluidos en nuestra revisión 616,17,25,27,28,26 se han realizado en los últimos 5 años, lo que transmite la preocupación creciente por el problema de la hiperglucemia en la planta de hospitalización convencional. No obstante, la mayoría de los estudios incluidos provienen del mismo grupo de investigación15–17, por lo que la generabilidad de los resultados puede verse restringida.
Por otro lado, ninguno de los estudios incluidos contemplaba la incidencia de eventos adversos como objetivo primario, salvo Umpierrez et al., 201116 (que aporta la mayor parte de los eventos), por lo que la potencia de cada uno de los estudios individuales para detectar diferencias puede ser insuficiente.
Otra limitación del presente estudio, compartida con revisiones previas19, es la marcada heterogeneidad objetivada en el análisis. A nuestro entender, esta heterogeneidad estadística traduce la existencia de importantes diferencias en el diseño de los estudios incluidos. En primer lugar, la inclusión tanto de estudios observacionales como ensayos clínicos contemplada en el protocolo inicial puede suponer la primera fuente de heterogeneidad. Por otra parte, la definición de evento adverso no es homogénea entre los estudios incluidos y, como se ha señalado previamente, solo en Umpierrez et al., 201116 el análisis de los eventos clínicos era un objetivo primario. Además, hay diferencias reseñables en la duración del seguimiento, lo que puede suponer que ciertas complicaciones sean infradiagnosticadas en los estudios con períodos de seguimiento más corto (la infección nosocomial, por ejemplo, puede aparecer en los siguientes 30 días tras el alta hospitalaria).
Respecto a la hipoglucemia, en la actual revisión hemos evidenciado una tendencia hacia un mayor riesgo en el grupo BB, que se confirma en el análisis independiente de los ensayos clínicos. Este hallazgo es similar al referido por Murad et al.19, con un riesgo relativo de hipoglucemia de 1,58 (IC 95%: 0,97-2,57) en el grupo de la intervención. El efecto negativo de la hipoglucemia en pacientes ingresados en planta de hospitalización convencional ha sido evaluado en varios estudios30,31. Así, en Turchin et al.30 se establece una relación entre la hipoglucemia durante la hospitalización y la mortalidad en el año siguiente. Más recientemente Kim et al.31 muestran cómo la hipoglucemia, tras ajustar por otras variables, dobla el riesgo de sufrir un evento adverso (ingreso en unidad de cuidados intensivos, infección nosocomial o fracaso renal agudo) en pacientes con diabetes durante su hospitalización en una planta médica convencional. Si bien la tendencia a la hipoglucemia en el grupo BB puede enmascarar el efecto beneficioso de la intervención, consideramos necesario hacer 2 matizaciones de los resultados. En primer lugar, aunque en ciertos estudios se ha asociado la hipoglucemia a un incremento de los eventos adversos, otros32,33 señalan que este efecto nocivo puede atribuirse a las hipoglucemias espontáneas, pero no a las que aparecen en el seno del tratamiento de la hiperglucemia. Por otro lado, en el estudio de Boucai et al.33 se pone de manifiesto cómo la asociación con la mortalidad de la hipoglucemia espontánea desaparece tras ajustar por comorbilidad, argumentando los autores que es la carga de esta comorbilidad, y no la hipoglucemia per se, la responsable del exceso de mortalidad. Con todo ello, dada la incertidumbre sobre el papel de la hipoglucemia, algunos autores34 recomiendan adoptar estrategias para evitar la hipoglucemia junto con un control moderado de glucemia en pacientes más susceptibles a los efectos negativos de las mismas, como es la población con enfermedad cardiovascular. La representación de pacientes con enfermedad cardiovascular en los estudios incluidos en la revisión actual es variable, lo que puede suponer otro condicionante para los resultados obtenidos. Así, el de Umpierrez et al., 201116 y el de Gosmanov et al.25 son los únicos estudios que no incluyen pacientes con enfermedad cardiovascular como motivo de ingreso, y en ambos se observa una disminución del riesgo de eventos en el grupo de BB (aunque en Gosmanov et al.25 no alcanza la significación estadística).
A pesar de las limitaciones expuestas, nuestro estudio es el primero que evalúa el beneficio clínico de la pauta BB en pacientes hospitalizados y la intervención (tipo y dosis de insulina) es similar en los distintos estudios.
En conclusión, a pesar de su beneficio para el control glucémico durante la hospitalización, esta revisión no ha objetivado que el uso de la pauta BB disminuya eventos clínicos en pacientes hospitalizados en planta convencional. Sin embargo, estos resultados deben ser analizados con cautela. Debido a la heterogeneidad en los resultados, consideramos que se requieren ensayos clínicos que contemplen su efecto en subgrupos de pacientes en los que la pauta BB se pueda usar de forma segura y con períodos de seguimiento más prolongados, y así poder determinar el beneficio real del uso de la pauta BB durante la hospitalización.
Conflicto de interesesLos autores declaran que no hay conflicto de intereses.
Al personal de la Biblioteca del Hospital Universitario 12 de Octubre.
Directrices PRISMA
| Sección | Ítem | Comprobación | Registrado en página |
|---|---|---|---|
| Título | |||
| Título | 1 | Identificación del artículo como una revisión sistemática, metaanálisis o ambos | 1 |
| Resumen | |||
| Resumen estructurado | 2 | Existe un resumen estructurado, que incluye, siempre que sea aplicable, introducción, objetivos, fuente de datos, criterios de inclusión de los estudios, participantes, intervenciones, método, resultados, limitaciones, conclusiones y aplicabilidad de los hallazgos clave, número de registro de la revisión sistemática | 13-14 |
| Introducción | |||
| Razón | 3 | Describe la razón de realizar la revisión en el contexto de lo ya conocido | 2 |
| Objetivo | 4 | Exponer de forma explícita la pregunta de investigación detallando los participantes, intervenciones, grupo de comparación, eventos y diseño de los estudios (PICOS) | 3-4 |
| Métodos | |||
| Protocolo y registro | 5 | Indicar si existe un protocolo de la revisión, y si se puede acceder al mismo (por ejemplo página Web) y, si está disponible, información sobre el registro del mismo | 5-7 |
| Criterios de inclusión | 6 | Especificar las características del estudio (PICOS, duración del seguimiento…) y las características del artículo (fecha de publicación, idioma, estado de publicación) usados como criterios de inclusión, de forma razonada | 5-7 |
| Fuentes de información | 7 | Describir todas las fuentes de información (bases de datos, con fechas incluidas, si se ha contactado con los autores de los artículos) incluidas en la búsqueda y la fecha de la última búsqueda | 5-7 |
| Búsqueda | 8 | Mostrar la estrategia de búsqueda electrónica al menos de una de las bases de datos, incluyendo los límites empleados, para que pueda ser repetida | 5-7 |
| Selección de estudios | 9 | Establecer el proceso para la selección de los estudios (cribado, elección para la revisión sistemática y metaanálisis si procede) | 5-7 |
| Recogida de datos | 10 | Describe el método empleado para extraer los datos (uso de un formulario probado, independientemente, por duplicado) y cualquier proceso para obtener y confirmar los datos empleado por los investigadores | 5-7 |
| Categorías de datos | 11 | Enumerar y definir todas las variables revisadas en los datos y cualquier asunción o simplificación realizada | 5-7 |
| Riesgo de sesgo de los estudios individuales | 12 | Describir los métodos empleados para evaluar el riesgo de sesgo de los estudios individuales y cómo esta información se empleó para la síntesis de los datos | 5-7 |
| Medidas de resumen | 13 | Establece la principal medida de resumen | 5-7 |
| Síntesis de resultados | 14 | Describir los métodos empleados para combinar los resultados de los distintos estudios y si se han hecho medidas de consistencia (por ejemplo I2) para cada metaanálisis | 5-7 |
| Riesgo de sesgo del conjunto de los estudios | 15 | Especificar las medidas de riesgo de sesgo que puedan afectar a la evidencia acumulada (por ejemplo sesgo de publicación, sesgo de comunicación dentro de los estudios) | 5-7 |
| Análisis adicionales | 16 | Describe los métodos de cualquier análisis adicional (subgrupos, análisis de sensibilidad, metarregresión…) y si estaba especificado previamente | 5-7 |
| Resultados | |||
| Selección de estudios | 17 | Proporcionar el número de estudios cribados, elegidos para revisión detallada e incluidos en la revisión, con las razones de exclusión en cada fase, idealmente mediante un diagrama de flujo | 8, fig. 1 |
| Características de los estudios incluidos | 18 | Mostrar los datos extraídos de cada estudio y las correspondientes citas | Tabla 2 |
| Riesgo de sesgo de cada estudio | 19 | Presentar la evaluación del riesgo de sesgo de cada estudio, y, si está disponible, su repercusión a nivel de eventos | Tabla 1 |
| Resultados de los estudios individuales | 20 | Para todos los objetivos considerados (beneficio o daño) presente en cada estudio (a) resumen de datos para grupo de intervención y (b) efecto estimado con los intervalos de confianza, idealmente mediante un forestplot | Tablas 3 y 4, figs. 2 y 3 |
| Riesgo de sesgo de publicación | 22 | Mostrar en los resultados cualquier evaluación del riesgo de evaluación | 9 |
| Análisis adicionales | 23 | Dar los resultados de cualquier análisis adicional realizado (sensibilidad, subgrupos, metarregresión) | 9 |
| Discusión | |||
| Resumen de la evidencia | 24 | Resume los principales hallazgos para cada uno de los objetivos principales, considera su relevancia | 10-11 |
| Limitaciones | 25 | Discute las limitaciones de los estudios al nivel de los objetivos y al nivel de revisión | 10-11 |
| Conclusiones | 26 | Interpretación general de los resultados en función de la evidencia e implicaciones para estudios futuros | 10-11 |
Cadena de búsqueda completa
| (((((«sliding scales») OR (((«basal bolus» OR «basal bolus approach» OR «basal bolus combination» OR «basal bolus concept» OR «basal bolus correction» OR «basal bolus group» OR «basal bolus insulin» OR «basal bolus insulin delivery» OR «basal bolus insulin delivery regimen» OR «basal bolus insulin dosing» OR «basal bolus insulin protocol» OR «basal bolus insulin regimen» OR «basal bolus insulin regimens» OR «basal bolus insulin scheme» OR «basal bolus insulin therapy» OR «basal bolus insulins» OR «basal bolus multiple daily» OR «basal bolus regime» OR «basal bolus regimen» OR «basal bolus regimens» OR «basal bolus scheme» OR «basal bolus suBButaneous insulin» OR «basal bolus system» OR «basal bolus technique» OR «basal bolus therapy» OR «basal bolus treated» OR «basal bolus treated patients» OR «basal bolus treatment»)))) OR «basal bolus insulin therapy») OR «basal insulin»)) AND ((((((((((«surgical patients») OR «medical patients») OR «non critically ill») OR «hospitalized patients») OR «inpatients»[MeSH Major Topic]) OR «inpatient») AND «hyperglycemia»[MeSH Major Topic]) OR «hyperglycemia») OR «diabetes mellitus»[MeSH Major Topic]) OR «diabetes mellitus») |