Analizar la eficacia y la seguridad de empagliflozina en combinación con otros hipoglucemiantes orales en pacientes con diabetes mellitus tipo 2.
MétodosAnálisis de 3 ensayos fase iii en pacientes con diabetes mellitus tipo 2 (n=1.801) que recibieron placebo, empagliflozina 10 o 25mg, una vez al día, durante 24 semanas, en combinación con metformina, metformina+sulfonilurea o pioglitazona±metformina.
ResultadosEmpagliflozina redujo significativamente la HbA1c (reducción media ajustada vs. placebo con empagliflozina 10mg: –0,58% [IC 95%: –0,66; –0,49]; p<0,0001 y con empagliflozina 25mg –0,62% [IC 95%: –0,70; –0,53], p<0,0001), el peso (reducción media ajustada vs. placebo con empagliflozina 10mg: –1,77kg [IC 95%: –2,05; –1,48]; p<0,0001 y con empagliflozina 25mg: –1,96kg [IC 95%: –2,24; –1,67], p<0,0001) y la presión arterial sistólica y diastólica. La frecuencia de efectos adversos fue del 64% con placebo, del 63,9% con empagliflozina 10mg y del 60,9% con empagliflozina 25mg. Las hipoglucemias confirmadas (≤70mg/dl y/o requiriendo asistencia) ocurrieron en un 3,9% de los pacientes con placebo, un 6,9% con empagliflozina 10mg y un 5,3% con empagliflozina 25mg. Las infecciones del tracto urinario acontecieron en un 9,4% con placebo, un 10,2% con empagliflozina 10mg y un 8,3% con empagliflozina 25mg. Las infecciones genitales se comunicaron en un 1,0% de los pacientes con placebo, un 4,6% con empagliflozina 10mg y un 3,5% con empagliflozina 25mg.
ConclusionesEmpagliflozina en combinación con otros tratamientos orales vs. placebo disminuyó significativamente la HbA1c, el peso corporal y la presión arterial sistólica/diastólica, con un buen perfil de seguridad y tolerancia.
To analyze the efficacy and safety of empagliflozin combined with other oral hypoglycemic agents in patients with type 2 diabetes mellitus.
MethodsPooled analysis of three phase III trials in patients with type 2 diabetes mellitus (n=1,801) who received placebo or empagliflozin 10 or 25mg once daily for 24 weeks, in combination with metformin, metformin+sulphonylurea or pioglitazone ± metformin.
ResultsEmpagliflozin significantly decreased HbA1c (adjusted mean reduction vs placebo with empagliflozin 10mg: –0.58% [95% CI: –0.66; –0.49]; P<.0001, and with empagliflozin 25mg: –0.62% [95% CI: –0.70; –0.53], P<.0001), weight (adjusted mean reduction vs placebo with empagliflozin 10mg: –1.77kg [95% CI: –2.05; –1.48]; P<.0001, and with empagliflozin 25mg: –1.96kg [95% CI: –2.24; –1.67], P<.0001), and systolic and diastolic blood pressure (SBP/DBP). Adverse effect rates were 64% with placebo, 63.9% with empagliflozin 10mg, and 60.9% with empagliflozin 25mg. Documented episodes of hypoglycemia (≤70mg/dL and/or requiring care) occurred in 3.9% of patients with placebo, 6.9% of patients with empagliflozin 10mg, and 5.3% of patients with empagliflozin 25mg. Urinary tract infections developed in 9.4% of patients with placebo, 10.2% of patients with empagliflozin 10mg, and 8.3% of patients with empagliflozin 25mg. Genital infections were reported in 1.0% of patients with placebo, 4.6% of patients with empagliflozin 10mg, and 3.5% of patients with empagliflozin 25mg.
ConclusionsEmpagliflozin combined with other oral treatments decreased HbA1c, body weight, and SBP/DBP as compared to placebo, with a good safety and tolerability profile.
Para conseguir un control glucémico adecuado la metformina es el tratamiento farmacológico de primera elección en pacientes con diabetes mellitus tipo 2 (DMT2), en combinación con la terapia nutricional y el incremento de la actividad física1. Sin embargo, con el tiempo este tratamiento resulta insuficiente debido al deterioro progresivo de la secreción de insulina de las células β-pancreáticas. El estudio UKPDS demostró que, tras 2 años de tratamiento con metformina, el 40-50% de los pacientes no alcanzaba los objetivos terapéuticos2,3, llegando al 70% a los 3 años4. Las recomendaciones actuales indican utilizar doble e incluso triple terapia cuando no se consigue alcanzar o mantener los objetivos terapéuticos con metformina1. Aunque existen opciones farmacológicas de eficacia similar, estas presentan ciertas limitaciones como: riesgo de hipoglucemia, incremento de peso, edemas, efectos gastrointestinales, etc. y/o contraindicaciones específicas5. Adicionalmente, los agentes que estimulan la secreción de insulina pierden eficacia cuando esta resulta deficiente por la pérdida de la función β-pancreática con la progresión de la enfermedad6,7. En consecuencia, existe la necesidad de desarrollar agentes que disminuyan efectivamente la hiperglucemia a través de nuevos mecanismos de acción, independientes de la secreción de insulina y que no estén asociados per se con un incremento de peso ni con el riesgo de hipoglucemia. Estos son algunos de los factores que contribuyen a que una proporción importante de pacientes con DMT2 no alcancen o mantengan los objetivos de control glucémico8.
Los inhibidores del cotransportador de sodio/glucosa tipo 2 (SGLT2) representan una nueva familia de fármacos antihiperglucemiantes en el tratamiento de la DMT2. Su mecanismo de acción consiste en inhibir la reabsorción de glucosa a nivel renal, favoreciendo la eliminación urinaria de glucosa, independientemente de la secreción remanente de insulina. Estos fármacos tienen un riesgo bajo de hipoglucemia y se asocian con reducciones del peso corporal y la presión arterial9.
Empagliflozina es un inhibidor altamente selectivo del SGLT210, con demostrada eficacia en la reducción de la HbA1c mediante la disminución de la glucosa plasmática en ayunas y posprandial, y con descensos significativos del peso corporal y la presión arterial sistólica (PAS) y diastólica (PAD). Empagliflozina es eficaz tanto en monoterapia como en combinación con otros medicamentos hipoglucemiantes, incluyendo la insulina9,11–13.
El objetivo del presente análisis post-hoc fue evaluar la eficacia y seguridad de empagliflozina en combinación con otros agentes orales, en pacientes con DMT2 e insuficiente control glucémico en monoterapia o doble terapia.
Materiales y métodosDiseñoAnálisis post-hoc de 3 ensayos clínicos de fase iii, multicéntricos, aleatorizados, doble-ciego y controlados con placebo9,12,13. En todos ellos se comparó la eficacia y la seguridad en pacientes con DMT2 de empagliflozina (10mg/día o 25mg/día) frente a placebo, en terapia combinada y durante 24 semanas. El diseño y la metodología de los estudios fueron descritos en los manuscritos originales9,12,13. Los pacientes incluidos en los estudios recibieron tratamiento previo a la inclusión con metformina12, metformina+sulfonilurea13 o pioglitazona±metformina9, durante al menos las 12 semanas prealeatorización. Los pacientes mantuvieron el tratamiento inicial y fueron asignados aleatoriamente a una dosis diaria de placebo, empagliflozina 10mg o empagliflozina 25mg.
Todos los ensayos clínicos se desarrollaron de acuerdo con los principios éticos de la Declaración de Helsinki, fueron consistentes con las buenas prácticas clínicas y los requerimientos regulatorios pertinentes. Todos ellos recibieron la aprobación de las instituciones regulatorias correspondientes y de comités éticos independientes. Los pacientes incluidos fueron informados adecuadamente, formularon sus dudas libremente y firmaron la hoja de consentimiento informado previamente a su participación en los ensayos.
Población en estudioTodos los pacientes incluidos en el presente análisis cumplieron todos los criterios de inclusión y ninguno de exclusión, tal como se encuentra especificado en cada ensayo clínico9,12,13. Se reclutaron pacientes ≥18 años, con DMT2 no controlada (HbA1c 7-10%) a pesar de la dieta, ejercicio físico y un régimen estable de tratamiento hipoglucemiante durante más de 12 semanas, y con un IMC≤45kg/m2. Los principales criterios de exclusión fueron hiperglucemia no controlada (glucemia en ayunas>240mg/dl, confirmada mediante una segunda medición), síndrome coronario agudo, infarto o accidente isquémico transitorio durante los 3 meses previos al consentimiento e insuficiencia renal o hepática, entre otros.
Variables del estudioLa variable principal de todos los estudios fue el cambio observado en los niveles de HbA1c, desde la visita basal hasta la semana 24 de tratamiento. Además, se evaluaron los cambios de peso corporal y de PAS y PAD, desde el inicio del estudio hasta las 24 semanas de tratamiento. También se evaluó el porcentaje de pacientes que, después de 24 semanas de tratamiento, alcanzaron una HbA1c inferior al 7%.
La seguridad y la tolerabilidad de empagliflozina se analizó a partir de los efectos adversos (EA) reportados durante el estudio y hasta 7 días después de la última dosis (según el Medical Dictionary for Drug Regulatory Activities versión 15.0). También se registraron diversas pruebas de laboratorio, electrocardiogramas y constantes vitales. Asimismo, se evaluó la incidencia de ciertos EA de interés como hipoglucemia confirmada (glucosa plasmática ≤70mg/dl y/o con necesidad de asistencia), infecciones del tracto urinario (ITU) e infecciones genitales.
Análisis estadísticoEl análisis estadístico de eficacia se realizó sobre aquellos pacientes aleatorizados que habían recibido una o más dosis de la medicación en estudio y que contaban con una medición basal de la HbA1c (grupo completo de análisis). El análisis principal de eficacia, definido como el cambio de los niveles de HbA1c tras 24 semanas de tratamiento, fue realizado mediante el análisis de la covarianza, utilizando la HbA1c basal como covariable lineal. La tasa de filtrado glomerular basal estimada calculada según la ecuación Modification of Diet in Renal Disease, la región geográfica y el tratamiento se consideraron efectos fijos en el modelo. Para el resto de variables continuas se utilizó el mismo modelo, considerando el valor basal de cada variable como covariable lineal adicional. En la comparación entre los grupos de tratamiento con empagliflozina (10 y 25mg) y el grupo placebo se calcularon los intervalos de confianza al 95% y los valores de p; con la excepción de la comparación para el porcentaje de pacientes con una HbA1c basal ≥7,0%, que consiguen alcanzar una HbA1c<7,0% a las 24 semanas de tratamiento, donde se consideró un análisis descriptivo. Los pacientes que no completaron el estudio fueron considerados como fracaso terapéutico.
En el análisis de seguridad se consideraron todos los pacientes que tomaron al menos una dosis de la medicación de estudio (población tratada) y los resultados se expresaron en valores absolutos y frecuencia de aparición.
ResultadosCaracterísticas de los pacientesEl número de pacientes incluidos en el análisis post-hoc fue de 1.801 (596 con placebo, 606 con empagliflozina 10mg y 599 con empagliflozina 25mg). De estos 1.656 completaron el estudio.
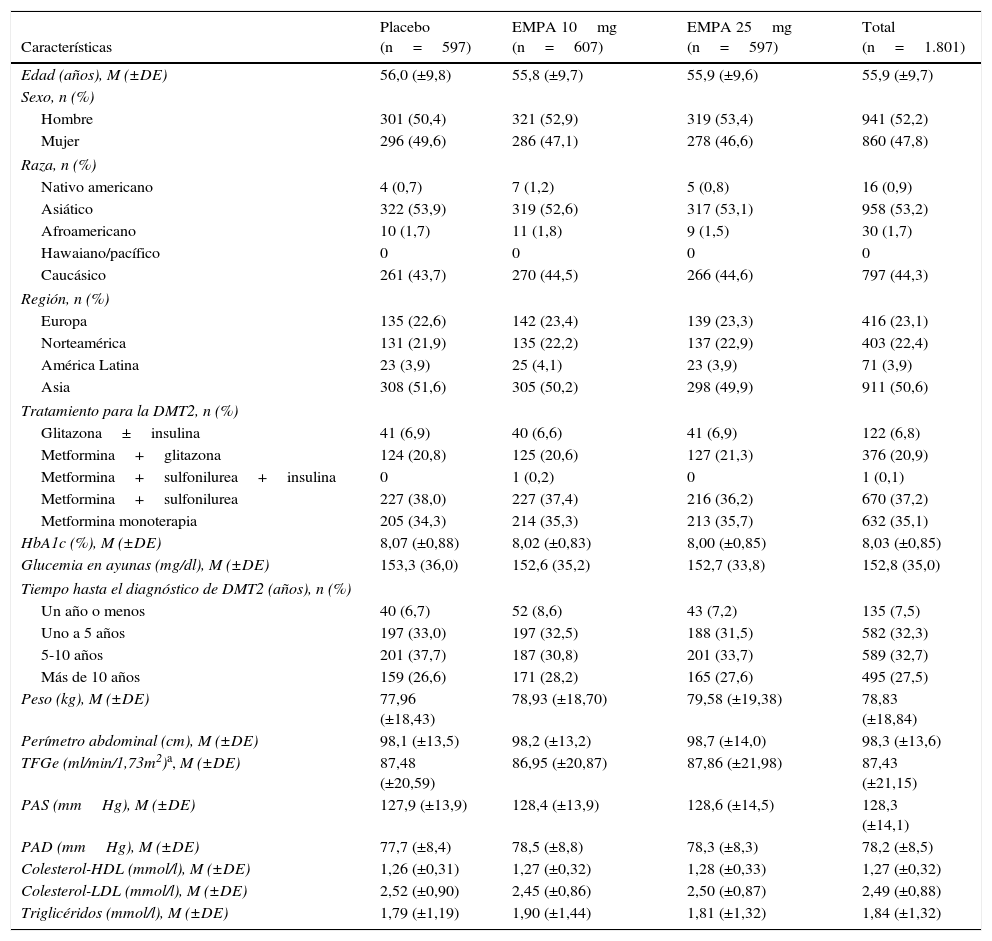
Las características demográficas y clínicas de los pacientes incluidos fueron similares en todos los grupos de tratamiento (tabla 1). El 52,2% de la población total fueron varones, siendo la edad media de 55,9±9,7 años (media±DE; rango: 19-85) y la HbA1c basal media de 8,03±0,85%. La mayoría de los pacientes recibieron metformina como tratamiento de base, bien en monoterapia (35,1%; n=632), en combinación con una sulfonilurea (37,3%, n=671), bien en combinación con pioglitazona (20,9%; n=376). Un 60,2% de los pacientes (n=1.084) había sido diagnosticado de DMT2 al menos 5 años antes de la inclusión en el estudio.
Características demográficas y basales de la población incluida (GCA)
Características | Placebo (n=597) | EMPA 10mg (n=607) | EMPA 25mg (n=597) | Total (n=1.801) |
|---|---|---|---|---|
| Edad (años), M (±DE) | 56,0 (±9,8) | 55,8 (±9,7) | 55,9 (±9,6) | 55,9 (±9,7) |
| Sexo, n (%) | ||||
| Hombre | 301 (50,4) | 321 (52,9) | 319 (53,4) | 941 (52,2) |
| Mujer | 296 (49,6) | 286 (47,1) | 278 (46,6) | 860 (47,8) |
| Raza, n (%) | ||||
| Nativo americano | 4 (0,7) | 7 (1,2) | 5 (0,8) | 16 (0,9) |
| Asiático | 322 (53,9) | 319 (52,6) | 317 (53,1) | 958 (53,2) |
| Afroamericano | 10 (1,7) | 11 (1,8) | 9 (1,5) | 30 (1,7) |
| Hawaiano/pacífico | 0 | 0 | 0 | 0 |
| Caucásico | 261 (43,7) | 270 (44,5) | 266 (44,6) | 797 (44,3) |
| Región, n (%) | ||||
| Europa | 135 (22,6) | 142 (23,4) | 139 (23,3) | 416 (23,1) |
| Norteamérica | 131 (21,9) | 135 (22,2) | 137 (22,9) | 403 (22,4) |
| América Latina | 23 (3,9) | 25 (4,1) | 23 (3,9) | 71 (3,9) |
| Asia | 308 (51,6) | 305 (50,2) | 298 (49,9) | 911 (50,6) |
| Tratamiento para la DMT2, n (%) | ||||
| Glitazona±insulina | 41 (6,9) | 40 (6,6) | 41 (6,9) | 122 (6,8) |
| Metformina+glitazona | 124 (20,8) | 125 (20,6) | 127 (21,3) | 376 (20,9) |
| Metformina+sulfonilurea+insulina | 0 | 1 (0,2) | 0 | 1 (0,1) |
| Metformina+sulfonilurea | 227 (38,0) | 227 (37,4) | 216 (36,2) | 670 (37,2) |
| Metformina monoterapia | 205 (34,3) | 214 (35,3) | 213 (35,7) | 632 (35,1) |
| HbA1c (%), M (±DE) | 8,07 (±0,88) | 8,02 (±0,83) | 8,00 (±0,85) | 8,03 (±0,85) |
| Glucemia en ayunas (mg/dl), M (±DE) | 153,3 (36,0) | 152,6 (35,2) | 152,7 (33,8) | 152,8 (35,0) |
| Tiempo hasta el diagnóstico de DMT2 (años), n (%) | ||||
| Un año o menos | 40 (6,7) | 52 (8,6) | 43 (7,2) | 135 (7,5) |
| Uno a 5 años | 197 (33,0) | 197 (32,5) | 188 (31,5) | 582 (32,3) |
| 5-10 años | 201 (37,7) | 187 (30,8) | 201 (33,7) | 589 (32,7) |
| Más de 10 años | 159 (26,6) | 171 (28,2) | 165 (27,6) | 495 (27,5) |
| Peso (kg), M (±DE) | 77,96 (±18,43) | 78,93 (±18,70) | 79,58 (±19,38) | 78,83 (±18,84) |
| Perímetro abdominal (cm), M (±DE) | 98,1 (±13,5) | 98,2 (±13,2) | 98,7 (±14,0) | 98,3 (±13,6) |
| TFGe (ml/min/1,73m2)a, M (±DE) | 87,48 (±20,59) | 86,95 (±20,87) | 87,86 (±21,98) | 87,43 (±21,15) |
| PAS (mmHg), M (±DE) | 127,9 (±13,9) | 128,4 (±13,9) | 128,6 (±14,5) | 128,3 (±14,1) |
| PAD (mmHg), M (±DE) | 77,7 (±8,4) | 78,5 (±8,8) | 78,3 (±8,3) | 78,2 (±8,5) |
| Colesterol-HDL (mmol/l), M (±DE) | 1,26 (±0,31) | 1,27 (±0,32) | 1,28 (±0,33) | 1,27 (±0,32) |
| Colesterol-LDL (mmol/l), M (±DE) | 2,52 (±0,90) | 2,45 (±0,86) | 2,50 (±0,87) | 2,49 (±0,88) |
| Triglicéridos (mmol/l), M (±DE) | 1,79 (±1,19) | 1,90 (±1,44) | 1,81 (±1,32) | 1,84 (±1,32) |
DMT2: diabetes mellitus tipo 2; EMPA: empagliflozina; DE: desviación estándar; GCA: grupo completo de análisis; HDL: high density lipoprotein; LDL: low density lipoprotein; M: media; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtración glomerular estimada.
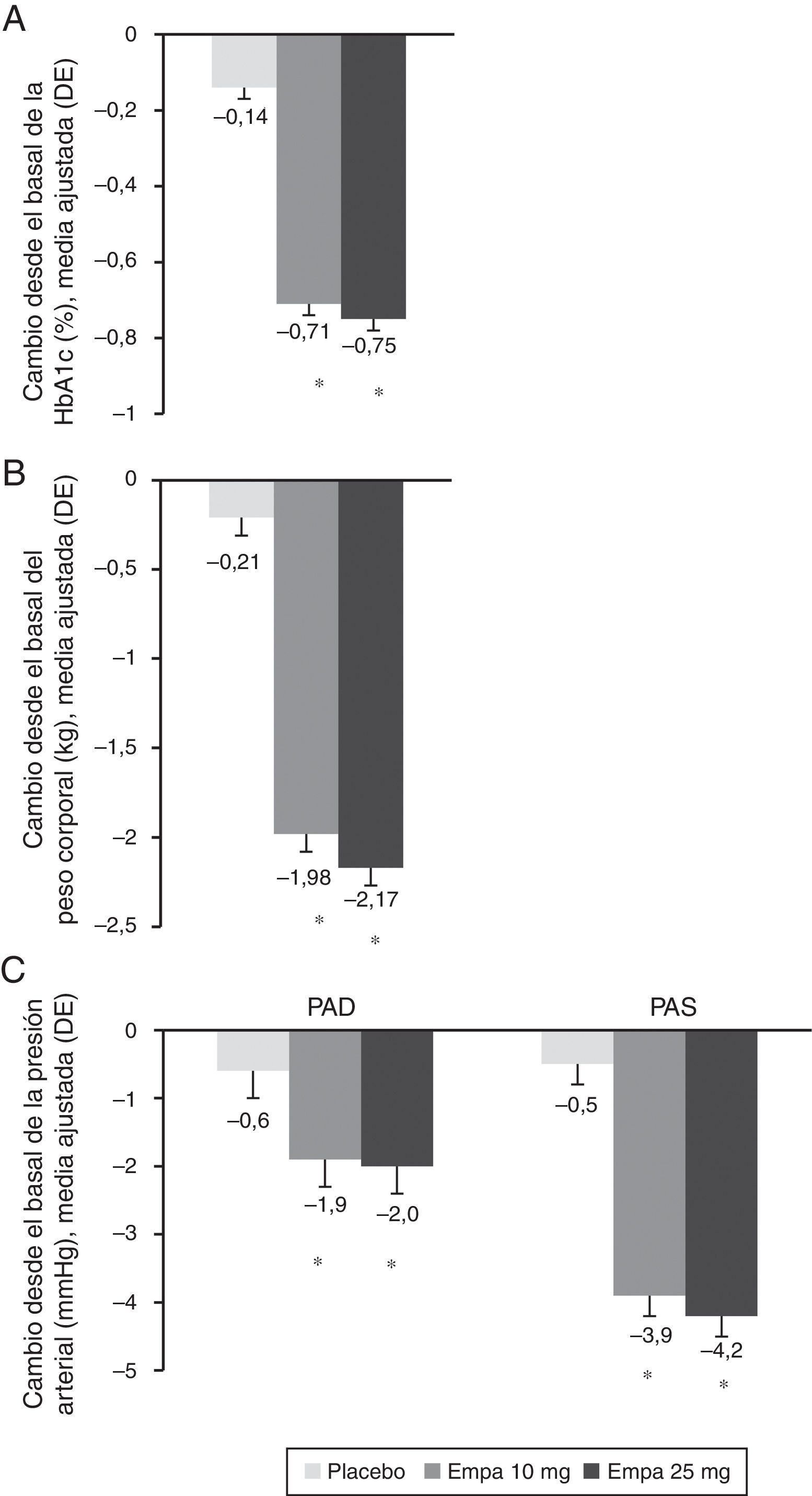
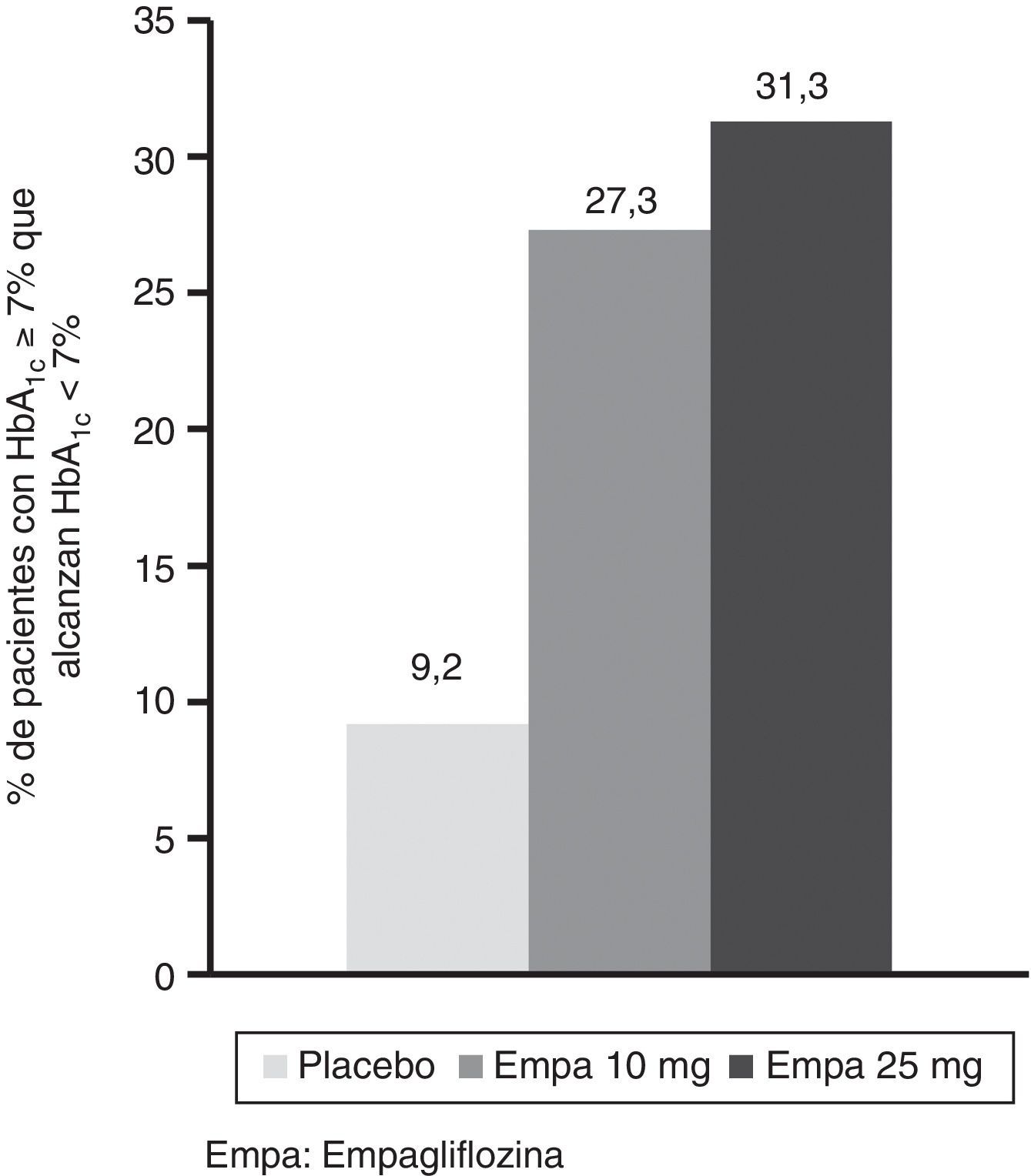
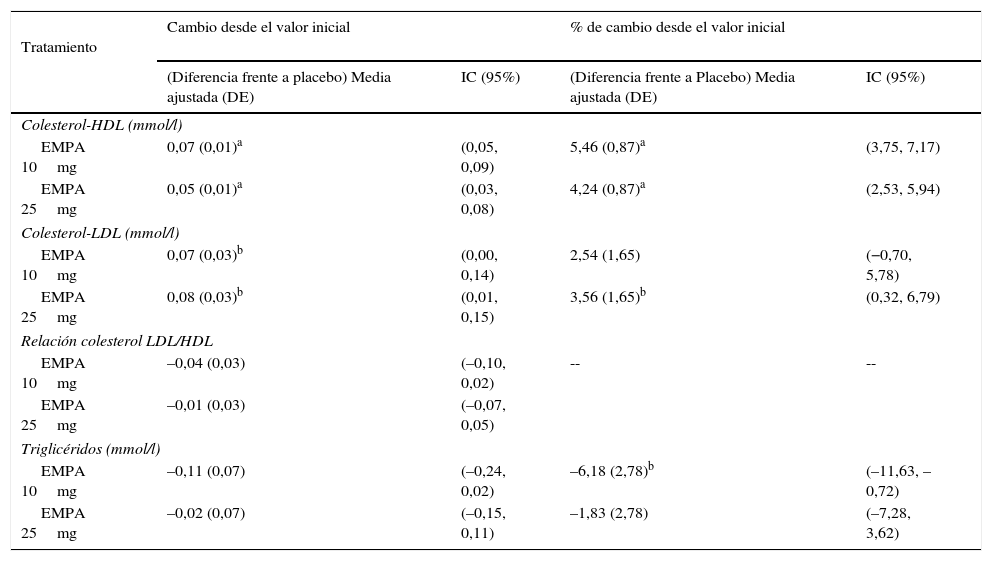
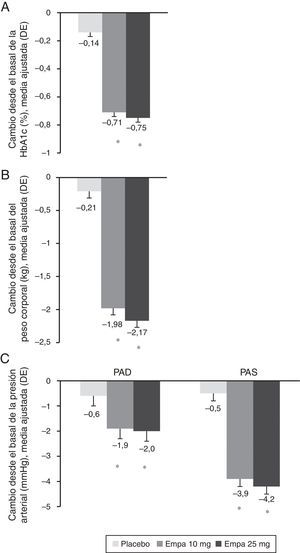
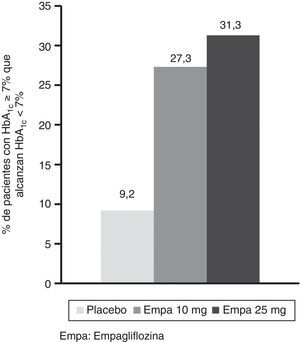
Entre la visita basal y las 24 semanas de tratamiento se observó una reducción estadísticamente significativa en ambos brazos de tratamiento de los niveles de HbA1c con empagliflozina (10 y 25mg) frente a placebo (fig. 1A). La diferencia del valor medio ajustado entre placebo y empagliflozina 10mg fue de –0,58% ([IC 95%: –0,66; –0,49], p<0,0001) y de –0,62% ([IC 95%: –0,70; –0,53], p<0,0001) con la dosis de 25mg de empagliflozina. Entre los pacientes con HbA1c basal igual o mayor al 7% el porcentaje que logró reducirla por debajo del 7% fue mayor con empagliflozina 10mg y 25mg (27,3% y 31,3%, respectivamente) que con placebo (9,2%) (fig. 2).
Cambio en el porcentaje de HbA1c (A), el peso (B) y la PAS y la PAD (C) a las 24 semanas respecto al inicio del estudio y en toda la población. Los resultados se muestran como el cambio en la media ajustada (ANCOVA) junto a la desviación estándar y el cálculo del p-valor.
Empa: emplagliflozina; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
*p<0,001 (diferencia vs. placebo).
Al comparar ambas dosis de empagliflozina con placebo se observó una reducción estadísticamente significativa del peso corporal (fig. 1B), la PAS y la PAD (fig. 1C). La diferencia en el valor medio de peso ajustado comparado con placebo fue de –1,77kg ([IC 95%: –2,05; –1,48], p<0,0001) con empagliflozina 10mg y de –1,96kg ([IC 95%: –2,24; –1,67], p<0,0001) con empagliflozina 25mg. La reducción del valor medio de PAS ajustado frente a placebo fue de 3,5mmHg con 10mg de empagliflozina ([IC 95%: –4,7; –2,3], p<0,0001) y de 3,8mmHg ([IC 95%: –5,0; –2,6], p<0,0001) con 25mg de empagliflozina. Respecto a la reducción del valor medio de la PAD frente a placebo, esta fue de 1,3mmHg con 10mg de empagliflozina ([IC 95%: –2,1; –0,5], p<0,001) y de 1,4mmHg con 25mg de empagliflozina ([IC 95%: –2,1; –0,6], p<0,001).
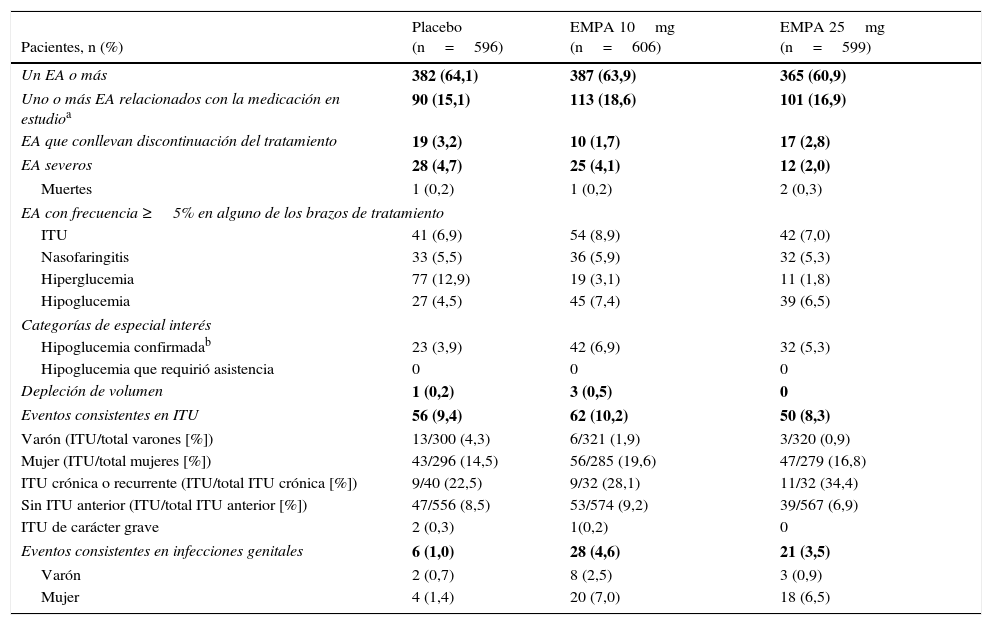
SeguridadEn el presente estudio la incidencia de uno o más EA fue similar en los 3 brazos de tratamiento (tabla 2). El porcentaje de pacientes que discontinuaron el tratamiento debido a la aparición de un EA fue ligeramente menor con empagliflozina 10mg (1,7%) que con empagliflozina 25mg (2,8%) o placebo (3,2%).
Resumen de los efectos adversos (PT)
Pacientes, n (%) | Placebo (n=596) | EMPA 10mg (n=606) | EMPA 25mg (n=599) |
|---|---|---|---|
| Un EA o más | 382 (64,1) | 387 (63,9) | 365 (60,9) |
| Uno o más EA relacionados con la medicación en estudioa | 90 (15,1) | 113 (18,6) | 101 (16,9) |
| EA que conllevan discontinuación del tratamiento | 19 (3,2) | 10 (1,7) | 17 (2,8) |
| EA severos | 28 (4,7) | 25 (4,1) | 12 (2,0) |
| Muertes | 1 (0,2) | 1 (0,2) | 2 (0,3) |
| EA con frecuencia ≥5% en alguno de los brazos de tratamiento | |||
| ITU | 41 (6,9) | 54 (8,9) | 42 (7,0) |
| Nasofaringitis | 33 (5,5) | 36 (5,9) | 32 (5,3) |
| Hiperglucemia | 77 (12,9) | 19 (3,1) | 11 (1,8) |
| Hipoglucemia | 27 (4,5) | 45 (7,4) | 39 (6,5) |
| Categorías de especial interés | |||
| Hipoglucemia confirmadab | 23 (3,9) | 42 (6,9) | 32 (5,3) |
| Hipoglucemia que requirió asistencia | 0 | 0 | 0 |
| Depleción de volumen | 1 (0,2) | 3 (0,5) | 0 |
| Eventos consistentes en ITU | 56 (9,4) | 62 (10,2) | 50 (8,3) |
| Varón (ITU/total varones [%]) | 13/300 (4,3) | 6/321 (1,9) | 3/320 (0,9) |
| Mujer (ITU/total mujeres [%]) | 43/296 (14,5) | 56/285 (19,6) | 47/279 (16,8) |
| ITU crónica o recurrente (ITU/total ITU crónica [%]) | 9/40 (22,5) | 9/32 (28,1) | 11/32 (34,4) |
| Sin ITU anterior (ITU/total ITU anterior [%]) | 47/556 (8,5) | 53/574 (9,2) | 39/567 (6,9) |
| ITU de carácter grave | 2 (0,3) | 1(0,2) | 0 |
| Eventos consistentes en infecciones genitales | 6 (1,0) | 28 (4,6) | 21 (3,5) |
| Varón | 2 (0,7) | 8 (2,5) | 3 (0,9) |
| Mujer | 4 (1,4) | 20 (7,0) | 18 (6,5) |
EA: efecto adverso; EMPA: empagliflozina; ITU: infecciones del tracto urinario; PT: población tratada.
La incidencia de ITU fue similar entre placebo y 25mg de empagliflozina (6,9% y 7,0% respectivamente), aunque superior en los pacientes tratados con 10mg de empagliflozina (8,9%). En los 3 brazos de tratamiento la proporción de ITU fue mayor en mujeres que en hombres, y también fue mayor en aquellos pacientes con ITU crónica o recurrente frente a los que no referían ITU previa. La gran mayoría de las ITU registradas fueron de carácter leve. Solo 2 pacientes con placebo y uno con empagliflozina 10mg reportaron ITU de carácter grave.
El porcentaje de pacientes que presentaron infecciones genitales fue mayor con empagliflozina 10mg y 25mg que con placebo (4,6% y 3,5% vs. 1%). El número de mujeres tratadas con empagliflozina en las que se notificaron infecciones genitales fue mayor que en el de hombres (7,0% y 2,5% para empagliflozina 10mg, respectivamente; 6,5% y 0,9%, para empagliflozina 25mg, respectivamente). Todos los eventos fueron de intensidad leve o moderada y en la mayoría de casos el fármaco no fue discontinuado. La frecuencia de hipoglucemias confirmadas fue mayor en los pacientes tratados con empagliflozina que en los que recibieron placebo (6,9%, 5,3% y 3,9% con empagliflozina 10mg, 25mg y placebo; respectivamente) y ocurrieron predominantemente en pacientes tratados con sulfonilureas. No se registró ningún episodio de carácter grave o que necesitara asistencia.
Los efectos sobre el perfil lipídico se resumen en la tabla 3. Para el colesterol-HDL el porcentaje medio ajustado de cambio desde el valor inicial fue de +5,57% con empagliflozina 10mg, +4,35% con empagliflozina 25mg y +0,11% con placebo (p<0,0001), mientras que para el colesterol-LDL fue de +6,75% y +7,76%, con empagliflozina 10mg y 25mg, respectivamente, frente a +4,21% con placebo (p=0,031 para empagliflozina 25mg vs. placebo). No se observaron cambios significativos en los valores medios ajustados frente a placebo de la ratio colesterol LDL/HDL, ni en el nivel de triglicéridos.
Cambios en los parámetros lipídicos con empagliflozina respecto a placebo (PT)
Tratamiento | Cambio desde el valor inicial | % de cambio desde el valor inicial | ||
|---|---|---|---|---|
| (Diferencia frente a placebo) Media ajustada (DE) | IC (95%) | (Diferencia frente a Placebo) Media ajustada (DE) | IC (95%) | |
| Colesterol-HDL (mmol/l) | ||||
| EMPA 10mg | 0,07 (0,01)a | (0,05, 0,09) | 5,46 (0,87)a | (3,75, 7,17) |
| EMPA 25mg | 0,05 (0,01)a | (0,03, 0,08) | 4,24 (0,87)a | (2,53, 5,94) |
| Colesterol-LDL (mmol/l) | ||||
| EMPA 10mg | 0,07 (0,03)b | (0,00, 0,14) | 2,54 (1,65) | (−0,70, 5,78) |
| EMPA 25mg | 0,08 (0,03)b | (0,01, 0,15) | 3,56 (1,65)b | (0,32, 6,79) |
| Relación colesterol LDL/HDL | ||||
| EMPA 10mg | –0,04 (0,03) | (–0,10, 0,02) | -- | -- |
| EMPA 25mg | –0,01 (0,03) | (–0,07, 0,05) | ||
| Triglicéridos (mmol/l) | ||||
| EMPA 10mg | –0,11 (0,07) | (–0,24, 0,02) | –6,18 (2,78)b | (–11,63, –0,72) |
| EMPA 25mg | –0,02 (0,07) | (–0,15, 0,11) | –1,83 (2,78) | (–7,28, 3,62) |
DE: desviación estándar;EMPA: empagliflozina; HDL: high density lipoprotein; IC: intervalo de confianza; LDL: low density lipoprotein.
Este análisis post-hoc basado en 3 estudios en fase iii demuestra que empagliflozina, en combinación con otros hipoglucemiantes orales, es eficaz en la reducción de la HbA1c en pacientes con DMT2 tratados previamente con monoterapia o doble terapia e insuficiente control glucémico. Asimismo, el tratamiento con empagliflozina se asoció con una reducción del peso corporal y de la presión arterial, y todo ello con un buen perfil de seguridad y tolerabilidad. Estos hechos hacen que empagliflozina se consolide como una opción terapéutica adecuada, en segunda o tercera línea, en el tratamiento de la DMT2.
En el presente análisis el tratamiento con empagliflozina redujo la HbA1c entre el 0,57% y el 0,61%, y el peso de entre 1,77kg y 1,96kg; así como también la PAS y la PAD, en comparación con placebo. Estos hallazgos son consistentes con los descritos previamente con los inhibidores del SGLT214–17.
El mecanismo de acción antihiperglucemiante de la empagliflozina es la reducción de la reabsorción de glucosa. La cantidad de glucosa eliminada por el riñón mediante este mecanismo es dependiente de los niveles de glucemia, lo que condiciona una mayor excreción urinaria de glucosa en aquellos pacientes con concentraciones plasmáticas de glucosa más elevadas18. Ello justifica que las reducciones de la HbA1c más pronunciadas se observen en los pacientes peor controlados11. Por otro lado, en el 60% de los pacientes que tenían un tiempo de evolución de la DMT2 de ≥5 años, y en consecuencia una mayor disfunción β-pancreática6, la eficacia de la empagliflozina no disminuyó. El mecanismo de acción independiente de la secreción de la insulina justificaría la persistencia de la eficacia hipoglucemiante de la empagliflozina en las etapas más evolucionadas de la DMT2, lo que representa un aspecto diferenciador frente a otras familias de fármacos hipoglucemiantes.
Confirmando los datos de otros estudios, el perfil de seguridad y la tolerancia de la empagliflozina fueron buenos. La frecuencia de EA fue similar entre los brazos de tratamiento con placebo, empagliflozina 10mg y 25mg. Como era de esperar, las infecciones genitales fueron más frecuentes en los pacientes tratados con empagliflozina, siendo más prevalentes en mujeres y en pacientes con historia previa de candidiasis recurrente19,20. Las ITU registradas fueron en su mayoría de carácter leve y su incidencia fue solo ligeramente superior con el tratamiento de empagliflozina 10mg, pero similar entre los pacientes tratados con empagliflozina 25mg y placebo. Aunque los inhibidores de SGLT2 no causan intrínsecamente hipoglucemia9,16,17, la incidencia de los episodios de hipoglucemia puede incrementarse al optimizar el control glucémico, en particular cuando se asocian con sulfonilureas u otros fármacos que inducen hipoglucemia21–23. Sin embargo, en el presente análisis no se registraron episodios de hipoglucemia grave o que requiriesen asistencia. Finalmente, el aumento del colesterol-HDL y, en menor medida, del colesterol-LDL observado con el tratamiento con empagliflozina, concuerda con los descritos en estudios previos con los inhibidores de SGLT224,25. La fisiopatología de estas modificaciones no se conoce y su significado clínico también está por definir, pero no modifican el índice aterogénico de colesterol LDL/HDL.
Entre las limitaciones de este análisis se ha de destacar que se trata de un análisis post-hoc. Asimismo, la aplicabilidad de los resultados queda circunscrita a las características de la población de pacientes incluida en los ensayos clínicos en los que está basado. En este sentido, sería interesante contrastar los efectos derivados de la adición de empagliflozina al tratamiento en pacientes con DMT2 con menos restricciones. También se debe considerar que los estudios son de solo 24 semanas de duración, por lo que la durabilidad de los efectos descritos podría no ser extrapolable. Cabe destacar que el gran tamaño muestral de este análisis confiere mayor solidez a sus conclusiones.
En la actualidad, en la mayoría de pacientes con DMT2, el fracaso de la monoterapia con metformina2–4 obliga a la progresión de la terapia hacia un tratamiento doble e incluso triple1 que puede resultar, dependiendo del agente elegido, en un riesgo adicional de hipoglucemia o asociarse con un incremento del peso corporal5. En este sentido, los resultados descritos en este estudio confirman la eficacia del tratamiento con empagliflozina en combinación con otros hipoglucemiantes orales en la reducción de la HbA1c, del peso corporal y de la presión arterial con un buen perfil general de seguridad y tolerabilidad.
Responsabilidades éticasProtección de personas y animales en investigaciónLos autores declaran que en esta investigación no se han llevado a cabo experimentos con humanos ni animales. Los autores declaran que los procedimientos seguidos en los estudios referenciados cumplían los reglamentos del comité ético de investigación clínica responsable y de Asociación Médica Mundial y la Declaración de Helsinki.
Protección de datos de pacientesNo aplica.
Derecho a la privacidad y consentimiento informadoNo aplica.
FinanciaciónCon respecto a los estudios parentales contenidos en este análisis, la participación de Boehringer Ingelheim incluyó el diseño del estudio, la colección de datos y su análisis. La involucración de Eli Lilly and Company se limitó a la cofinanciación de estos estudios. Boehringer Ingelheim y Eli Lilly and Company se implicaron en los análisis y la preparación del presente manuscrito.
AutoríaLa Dra. Irene Romera, el Dr. Bernat Ariño, el Dr. Francisco Javier Ampudia-Blasco y el Dr. Antonio Pérez han participado en la concepción y diseño del manuscrito e interpretación de los datos. Egon Pfarr, la Dra. Sanja Giljanovic Kis y el Dr. Ebrahim Naderali han participado en el análisis e interpretación de los resultados. Todos los autores han participado en la redacción, revisión y aprobación del manuscrito remitido.
Conflicto de interesesIrene Romera, Sanja Giljanovic Kis y Ebrahim Naderali son empleados a tiempo completo en Eli Lilly and Company. Bernat Ariño y Egon Pfarr son empleados a tiempo completo en Boehringer Ingelheim. Francisco Javier Ampudia-Blasco y Antonio Pérez han recibido honorarios por parte de Boehringer-Ingelheim y Eli Lilly and Company por tareas de consultoría y conferencias.
A BCNscience, S.L. por la asistencia en la redacción médica.