Evaluar la seguridad y la eficacia de la insulina aspartato bifásica 30/70 en pacientes con diabetes mellitus tipo 2 (DM2).
Material y métodosEstudio observacional, multicéntrico y prospectivo.Participaron en el estudio 3.054 pacientes con DM2 procedentes de atención primaria y especializada en tratamiento con insulina aspartato bifásica 30/70 (iniciado en los 15 días previos a la inclusión). De todos ellos se disponía de la siguiente información previa al inicio del tratamiento con dicha insulina: glucohemoglobina (HbA1c), glucemia en ayunas (GA), perfil de glucosa 4 puntos (antes y 90 min después de desayuno y cena) y número de hipoglucemias/semana; 2.887 completaron el estudio (26 ± 1 semana). Las variables analizadas fueron: frecuencia de acontecimientos adversos, hipoglucemias/semana, HbA1c, GA y perfil glucémico de 4 puntos.
ResultadosEl 10,7% de los pacientes presentaron algún acontecimiento adverso (el 2,3% relacionados con el tratamiento y el 1,4%, graves).Hubo un descenso significativo (final del estudio frente a basal, p < 0,0001en todas las comparaciones) de las cifras de HbA1c (el 7,3 y el 8,9%,respectivamente), media de hipoglucemias/semana menores (0,3 y 0,5) ymayores (0,02 y 0,07), GA (145 y 207 mg/dl) y glucemia posprandial (162 y225 mg/dl). La mejoría en el control metabólico se consiguió tanto en pacientes tratados previamente con antidiabéticos orales como con insulina. El número de hipoglucemias disminuyó en los tratados previamente con insulina.
ConclusionesEl tratamiento con insulina aspartato bifásica 30/70 en pacientes con DM2 mejora el control glucémico con independencia del tratamiento previo, con una tasa baja de acontecimientos adversos y un número menor de hipoglucemias que en los tratados previamente con insulina.
To assess the safety and efficacy of biphasic insulin aspart 30/70 in patients with type 2 diabetes mellitus (DM2).
Material and methodsWe performed an observational, multicenter, prospective study in 3,054 DM2 patients from primary care and specialized settings, treated with biphasic insulin aspart 30/70 (started within 15 days prior to inclusion). In all patients,the following information was available before starting insulin treatment: HbA1c
levels, fasting plasma glucose (FPG), 4-point glucose profile (before and 90 minutes after breakfast and dinner) and number of hypoglycemic episodes/week. A total of 2,887 patients completed the study (26 ± 1 week). The variables evaluated were rate of adverse events (AE), number of hypoglycemic episodes/week, HbA1c, FPG and 4-point glucose profile.
ResultsAt least one AE occurred in 10.7% of the patients (2.3% related to the study drug and 1.4% severe). There was a significant decrease (end of study vs baseline; p < 0.0001 for all the comparisons) in HbA1c (7.3% and 8.9%, respectively), the mean number of minor (0.3/0.5) and major (0.02/0.07) hypoglycemic episodes/week, FPG (145/207 mg/dl) and postprandial glycemia (162/225 mg/dl). The improvement in metabolic control was achieved both in patients previously treated with oral antidiabetic drugs and in those treated with insulin. The number of hypoglycemic episodes decreased in patients previously treated with insulin.
ConclusionsTreatment with biphasic insulin aspart 30/70 in patients with DM2 improves glycemic control, irrespective of previous treatment, with a low rate of AE and fewer hypoglycemic episodes in patients previously treated with insulin.
La diabetes mellitus (DM) es uno de los principales problemas de salud mundial debido a su alta prevalencia y al elevado coste que supone para cualquier sistema sanitario por sus complicaciones y el número de muertes prematuras que produce1. El adecuado control glucémico de los pacientes con DM conlleva una reducción en el riesgo de complicaciones asociadas a esta enfermedad2. Por la propia naturaleza progresiva de la DM, este control se hace más complejo con los años de evolución3. En la DM tipo 2 (DM2) el tratamiento inicial con antidiabéticos orales (ADO) requiere de la función residual de las células beta4. Con el paso del tiempo, la pérdida de masa funcional de estas células hace que el tratamiento oral aislado sea ineficaz, lo que obliga a iniciar el tratamiento con insulina. La elección más habitual es una insulina de acción intermedia5, aunque las formulaciones bifásicas, que contienen una insulina de acción intermedia y otra de acción rápida, también han demostrado ser eficaces en este contexto6.
La insulina aspartato bifásica 30/70 es una mezcla realizada con un 30% de insulina aspartato soluble y un 70% de insulina aspartato retardada con protamina7. La insulina aspartato es un análogo de insulina que presenta un pico rápido de concentración máxima y una duración de acción más corta que la insulina humana8. Su curva farmacocinética se asemeja más al pico de glucosa en sangre experimentado tras la ingesta de alimento, en comparación con la insulina humana9. Por otra parte, al mezclarse la insulina aspartato de acción corta con la insulina aspartato retardada con protamina, las acciones de una y otra no se solapan prácticamente, con lo que se consigue una absorción bifásica. Ello podría explicar una disminución del riesgo de hipoglucemias en relación con el uso de mezclas de insulina humana, donde hay una mayor superposición de acciones entre la insulina de acción rápida y la retardada10.
El objetivo principal de este estudio es evaluar la seguridad y la eficacia de la insulina aspartato bifásica 30/70 en pacientes con DM2.
MATERIAL Y MÉTODOSSe trata de un estudio multicéntrico, observacional y prospectivo. Se llevó a cabo siguiendo los principios de la declaración de Helsinki sobre investigación clínica en humanos y las normas de buena práctica clínica. Todos los pacientes dieron su consentimiento por escrito para participar en el estudio. Éste fue evaluado y aprobado por el comité ético autonómico de ensayos clínicos de la Junta de Andalucía.
Los criterios de inclusión fueron: pacientes con DM2, mayores de 18 años que habían empezado un tratamiento con insulina aspartato bifásica 30/70 en los últimos 15 días por criterios médicos y que disponían de los siguientes datos en el mes previo a comenzar dicho tratamiento: glucohemoglobina (HbA1c), perfil de glucosa de 4 puntos (antes del desayuno y la cena y 90 min tras desayuno y cena), glucemia en ayunas (GA) y número de hipoglucemias por semana. Los pacientes procedían de consultas de atención primaria y especializada.
El estudio estaba dividido en 3 visitas: visita 1 o basal en la que se tomaron datos demográficos, constantes vitales, historia diabetológica (fecha de diagnóstico, complicaciones, tratamiento anterior a la insulina aspartato bifásica 30/70, tratamiento actual), datos sobre control glucémico (glucemia en ayunas, HbA1c, dos perfiles de glucosa de 4 puntos realizados en 2 días diferentes en las 2 semanas previas a la visita) y número de hipoglucemias por semana (menores y mayores) antes de iniciar el tratamiento con insulina aspartato bifásica. En la visita 2 (13 semanas ± 7 días) se registraron las constantes vitales, el tratamiento actual, glucosa en ayunas, HbA1c, 2 perfiles de glucosa de 4 puntos realizados en las 2 semanas previas a la visita y número de hipoglucemias menores y mayores por semana, obtenidas a partir de registros del propio paciente. En la visita 3 o final (26 semanas ± 7 días) se recogió la misma información que en la visita 2.
La insulina aspartato bifásica 30/70 fue administrada antes del desayuno y la cena a las dosis establecidas por el investigador según los criterios de la práctica local.
Los objetivos de seguridad se evaluaron mediante la frecuencia y la clasificación de las reacciones adversas y el número de hipoglucemias menores y mayores por semana. Se consideró hipoglucemia mayor la que cursaba con síntomas graves del sistema nervioso central, en la que el paciente era incapaz de tratarse a sí mismo y con glucosa sanguínea < 60 mg/dl o reversión de los síntomas tras la ingestión de alimento o la administración de glucagón o de glucosa intravenosa. Hipoglucemia menor en caso de glucosa sanguínea < 60 mg/dl con síntomas que el propio paciente pudo controlar o bien cualquier valor de glucosa sanguínea < 60 mg/dl sin síntomas. Los objetivos de eficacia se evaluaron mediante la HbA1c, el perfil de glucosa de 4 puntos y la GA.
Análisis estadísticoSe utilizó el sistema SAS versión 8.2 como software para el análisis estadístico. Los acontecimientos adversos fueron codificados con el diccionario MedDRA 7.0. Se describen las frecuencias y los porcentajes de aparición de forma global, por gravedad, relación con el tratamiento e intensidad (leve, moderado y grave).
Se presentan los descriptivos (media, desviación estándar, intervalo de confianza) de las variables de eficacia y seguridad (hipoglucemias menores y mayores). Las posibles diferencias entre las visitas en estas variables fueron analizadas mediante el test de rangos signados de Wilcoxon. Se realizó además una estratificación para las variables de eficacia y seguridad (hipoglucemias) en función del tratamiento previo. Se efectuó un análisis de la covariancia (ANCOVA) para valorar la posible influencia de este factor en la evolución de estas variables a lo largo del estudio.
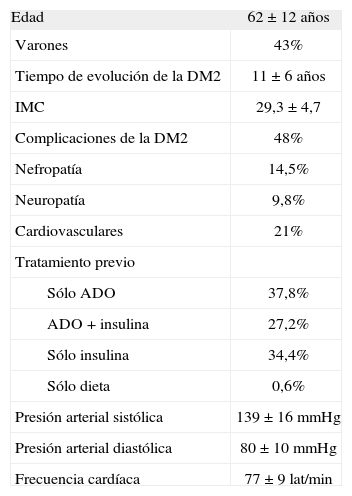
RESULTADOSDatos demográficos y características basalesSe incluyó en el estudio a 3.054 pacientes. Las características basales se muestran en la tabla 1. El 95,4% de los pacientes finalizó el estudio. Aquellos que no llegaron a completarlo lo hicieron fundamentalmente por violación del protocolo (31,5%), terapia ineficaz (4,8%) u otros motivos (36,4%).
Características basales de la población del estudio
| Edad | 62 ±12 años |
| Varones | 43% |
| Tiempo de evolución de la DM2 | 11 ±6 años |
| IMC | 29,3 ± 4,7 |
| Complicaciones de la DM2 | 48% |
| Nefropatía | 14,5% |
| Neuropatía | 9,8% |
| Cardiovasculares | 21% |
| Tratamiento previo | |
| Sólo ADO | 37,8% |
| ADO + insulina | 27,2% |
| Sólo insulina | 34,4% |
| Sólo dieta | 0,6% |
| Presión arterial sistólica | 139 ±16 mmHg |
| Presión arterial diastólica | 80 ±10 mmHg |
| Frecuencia cardíaca | 77 ± 9 lat/min |
ADO: antidiabéticos orales; DM2: diabetes mellitus tipo 2; IMC: índice de masa corporal.
El 10,7% de los pacientes presentaron al menos un acontecimiento adverso (AA). En la mayoría de los casos (6%) este AA fue único. El 2,3% de los pacientes tuvieron al menos un AA relacionado con el tratamiento. De ellos, los más frecuentes fueron los trastornos del metabolismo y la nutrición (38%), incluidas hiperglucemias e hipoglucemias, seguidos de los trastornos del sistema nervioso (35%) que incluían inestabilidad y temblor como AA más frecuentes. Los AA, a su vez, se clasificaron en leves (5,3%), moderados (4,8%) y graves (1,4%).
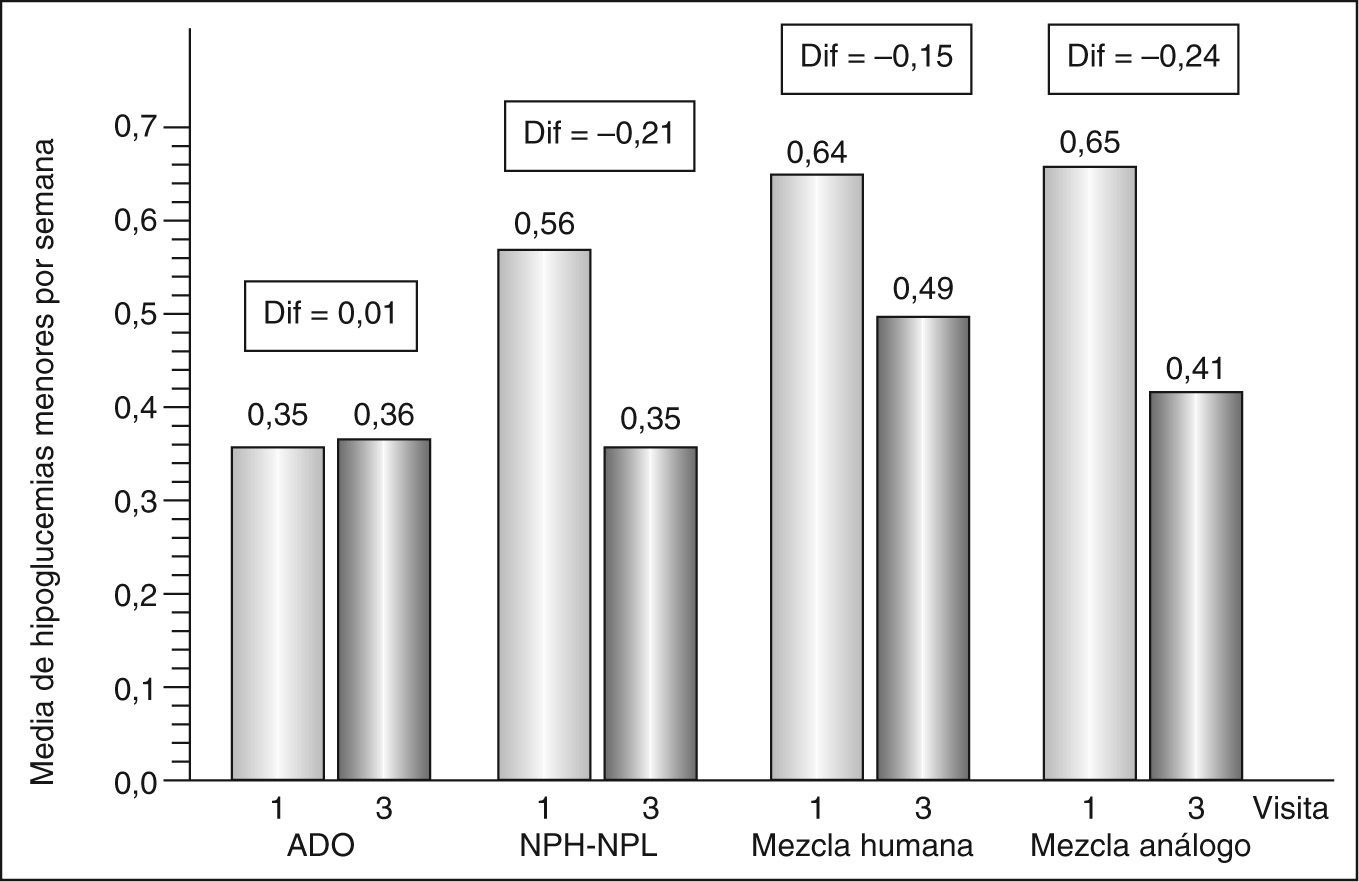
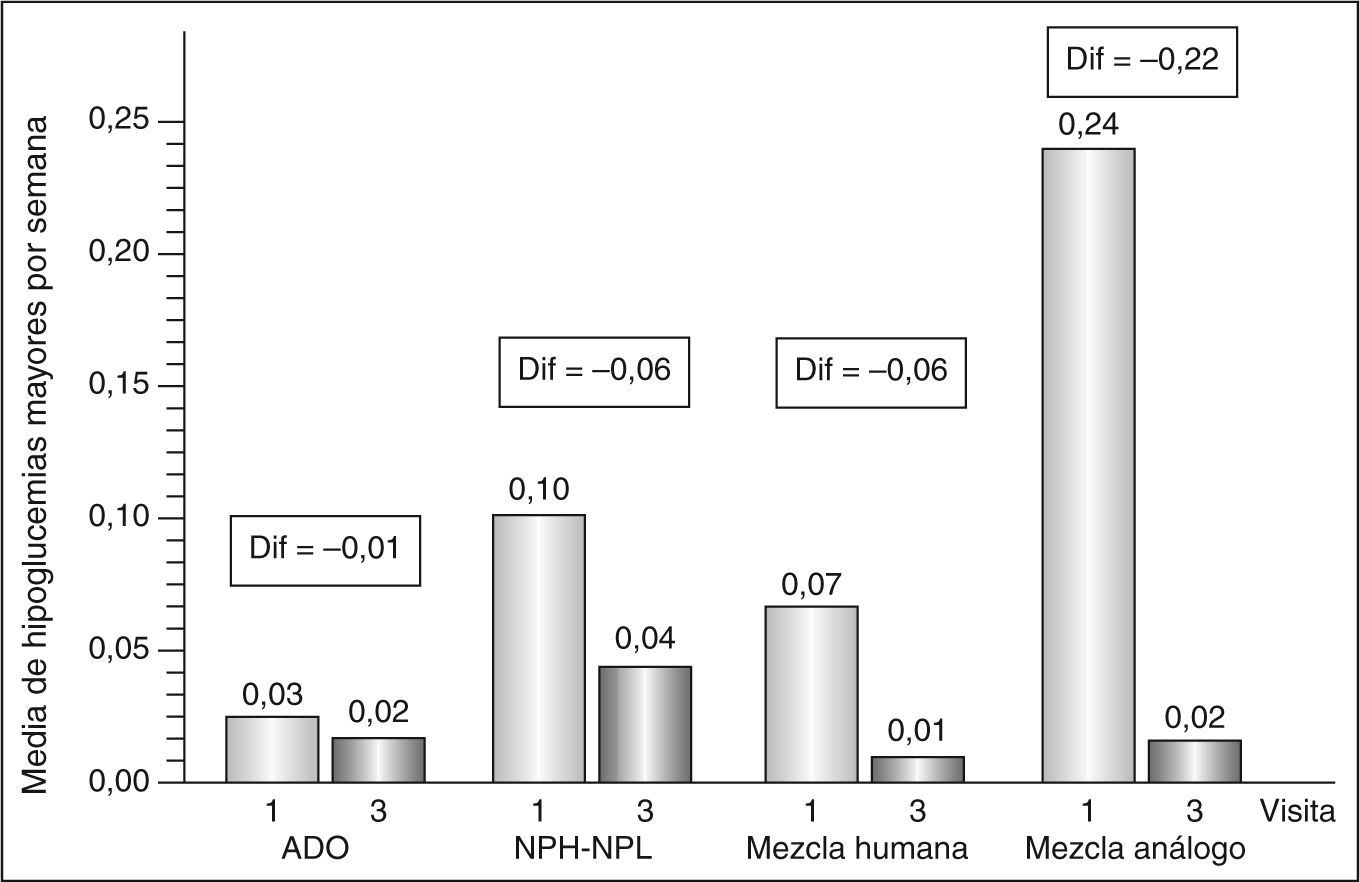
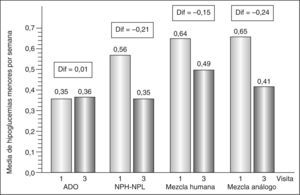
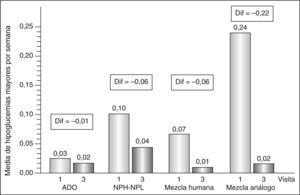
El número medio de episodios hipoglucémicos/semana disminuyó (visita final frente a visita basal) tanto en las hipoglucemias mayores (0,02; intervalo de confianza [IC] del 95%, 0,02-0,03, frente a 0,07; IC del 95%, 0,06-0,08; p < 0,0001) como en las menores (0,3; IC del 95%, 0,35-0,42, frente a 0,5; IC del 95%, 0,46-0,53; p < 0,0001). Las figuras 1 y 2 muestran la evolución de las hipoglucemias durante el estudio en función del tratamiento previo a la insulina aspartato bifásica 30/70.
Evolución de la media de hipoglucemias menores por semana entre las visitas 1 y 3 en función del tratamiento previo a la insulina aspartato bifásica 30/70. ADO: antidiabéticos orales; Dif: diferencia entre las medias; mezcla humana: mezcla de insulina humana; mezcla análogo: mezcla de análogos de insulina. Diferencias estadísticamente significativas (p < 0,0001) en todos los grupos excepto en el de ADO.
Evolución de la media de hipoglucemias mayores por semana entre las visitas 1 y 3 en función del tratamiento previo a la insulina aspartato bifásica 30/70. ADO: antidiabéticos orales; Dif: diferencia entre las medias; mezcla humana: mezcla de insulina humana; mezcla análogo: mezcla de análogos de insulina. Se muestra la media de hipoglucemias mayores por semana para cada visita. Diferencias estadísticamente significativas (p < 0,0001) en todos los grupos excepto en el de ADO.
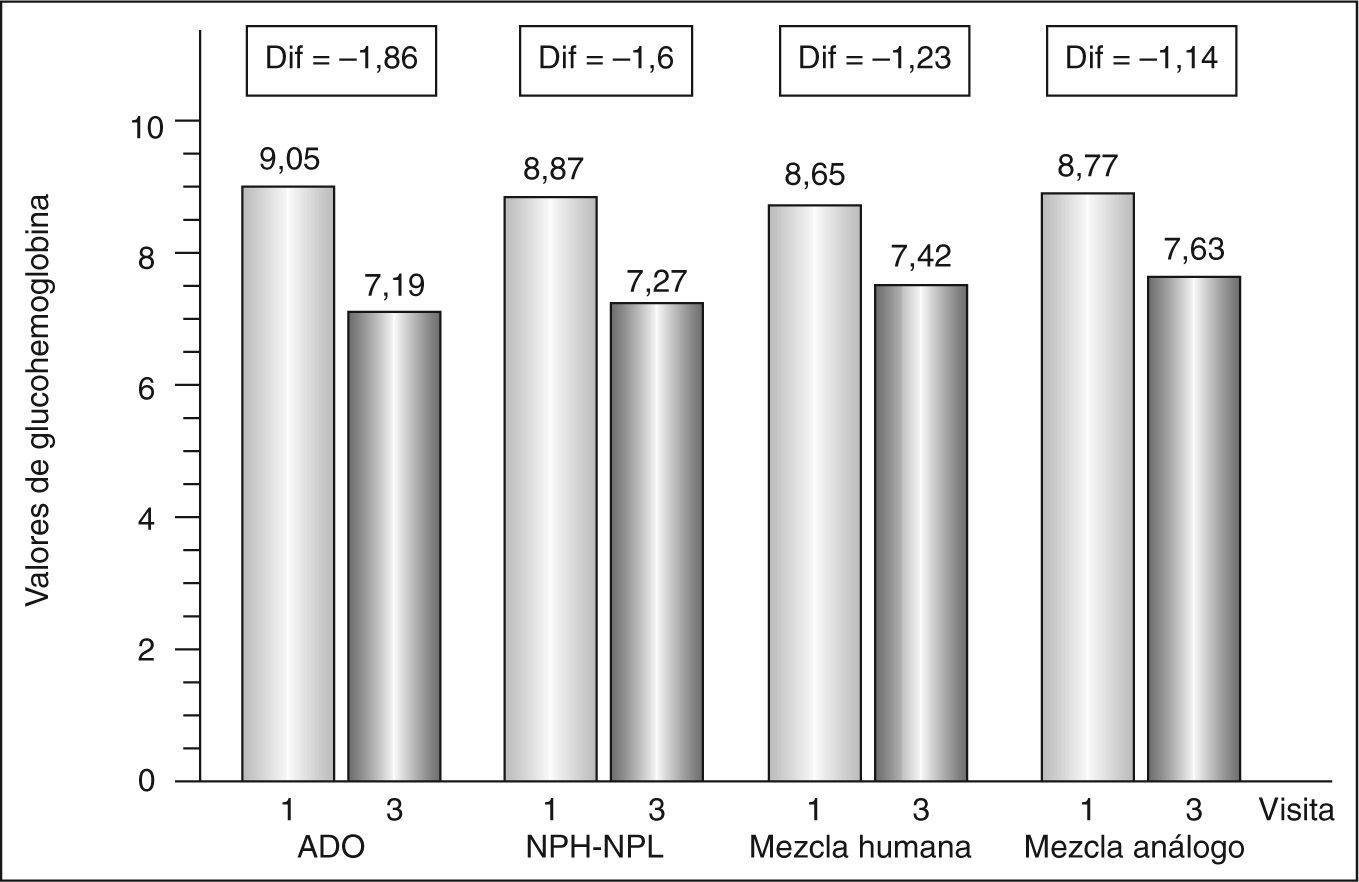
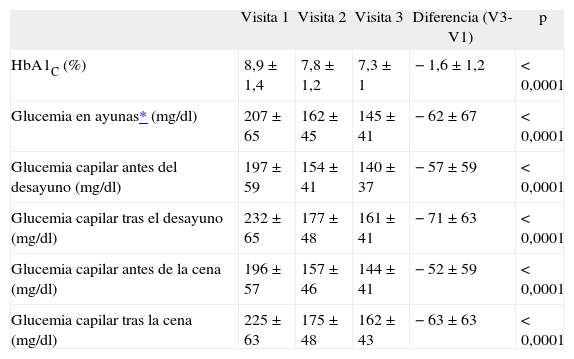
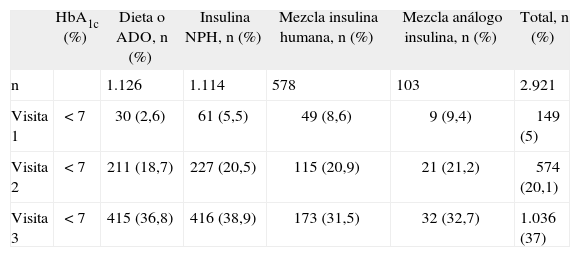
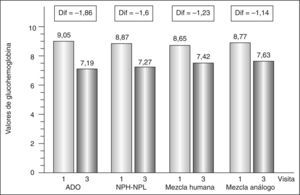
La tabla 2 recoge la evolución de las variables de eficacia entre la visita basal y la final. En la tabla 3 se muestra el porcentaje de pacientes que alcanzó unos valores de HbA1c < 7% al final del estudio frente a la visita basal por grupo de tratamiento previo a la insulina aspartato bifásica 30/70. Al analizar la evolución de la HbA1c en función del tratamiento previo, se encontró también una mejoría significativa del control metabólico al finalizar el estudio (fig. 3). El análisis de la covariancia detectó diferencias entre los distintos grupos de tratamiento en la evolución de las variables de eficacia a lo largo del estudio, pero no se llevó a cabo comparaciones 2 a 2 debido al elevado número de estratos o tratamientos, ya que los resultados no serían muy fiables.
Glucohemoglobina (HbA1c), glucemia capilar preprandial y posprandial y glucemia en ayunas en visitas 1, 2 y 3
| Visita 1 | Visita 2 | Visita 3 | Diferencia (V3-V1) | p | |
| HbA1C (%) | 8,9 ±1,4 | 7,8 ±1,2 | 7,3 ± 1 | −1,6 ±1,2 | < 0,0001 |
| Glucemia en ayunas* (mg/dl) | 207 ± 65 | 162 ± 45 | 145 ±41 | −62 ±67 | < 0,0001 |
| Glucemia capilar antes del desayuno (mg/dl) | 197 ± 59 | 154 ±41 | 140 ± 37 | −57 ± 59 | < 0,0001 |
| Glucemia capilar tras el desayuno (mg/dl) | 232 ± 65 | 177 ± 48 | 161 ±41 | −71 ±63 | < 0,0001 |
| Glucemia capilar antes de la cena (mg/dl) | 196 ± 57 | 157 ± 46 | 144 ±41 | −52 ± 59 | < 0,0001 |
| Glucemia capilar tras la cena (mg/dl) | 225 ± 63 | 175 ± 48 | 162 ± 43 | −63 ±63 | < 0,0001 |
Los valores reflejan la media ± desviación típica.
Número y porcentaje de pacientes con glucohemoglobina (HbA1c) menor del 7% en las visitas 1, 2 y 3 en función del tratamiento previo
| HbA1c (%) | Dieta o ADO, n (%) | Insulina NPH, n (%) | Mezcla insulina humana, n (%) | Mezcla análogo insulina, n (%) | Total, n (%) | |
| n | 1.126 | 1.114 | 578 | 103 | 2.921 | |
| Visita 1 | < 7 | 30 (2,6) | 61 (5,5) | 49 (8,6) | 9 (9,4) | 149 (5) |
| Visita 2 | < 7 | 211 (18,7) | 227 (20,5) | 115 (20,9) | 21 (21,2) | 574 (20,1) |
| Visita 3 | < 7 | 415 (36,8) | 416 (38,9) | 173 (31,5) | 32 (32,7) | 1.036 (37) |
ADO: antidiabéticos orales.
Evolución de los valores de glucohemoglobina (HbA1c) entre las visitas 1 y 3 en función del tratamiento previo a la insulina aspartato bifásica 30/70. ADO: antidiabéticos orales; Dif: diferencia entre las medias; mezcla humana: mezcla de insulina humana; mezcla análogo: mezcla de análogos de insulina. Las cifras de HbA1c se expresan en porcentaje. Diferencias estadísticamente significativas (p < 0,0001) en todos los casos.
El objetivo principal en el tratamiento de los pacientes con DM2 es la normalización de las concentraciones de glucosa y la reducción de las complicaciones cardiovasculares. Las medidas higienicodietéticas (dieta y ejercicio físico) son la base para conseguir esos objetivos. A ello se añade habitualmente un tratamiento farmacológico, generalmente con ADO. Se calcula que cada año aproximadamente un 5-10% de los pacientes con DM2 en tratamiento con ADO requerirá inicio de insulina11 ante la imposibilidad de alcanzar los objetivos de control glucémico recomendados (HbA1c < 7%12 o < 6,5%13). A la hora de iniciar el tratamiento con insulina la elección se centra en el uso de insulinas humanas o de análogos de insulina. Estudios previos han demostrado un mejor control de la glucemia posprandial con insulina aspartato bifásica en comparación con insulina humana bifásica14–16 o con NPH17, con una tasa similar de hipoglucemias. El control de la glucemia posprandial supone entre un 50 y en 70% del control glucémico general en función de las concentraciones de HbA1c18. En comparación con insulina glargina, en pacientes con DM2 mal controlada con ADO, el inicio de insulina aspartato bifásica 30/70 fue más eficaz en alcanzar los valores objetivo de HbA1c19.
En el presente estudio, en pacientes con mal control metabólico general (media de HbA1c basal del 8,9%) previamente tratados con ADO o con otros tipos de insulina, el inicio del tratamiento con insulina aspartato bifásica 30/70 se asoció con una mejoría del control metabólico con un descenso significativo de los valores de HbA1c. El porcentaje de pacientes con cifras de HbA1c < 7% aumentó del 5-10% basal (en función del tratamiento previo) hasta el 30-40% al final del estudio. A su vez hubo una mejoría del resto de los parámetros de eficacia analizados (GA y perfil de glucemia preprandial y posprandial) con cifras, al final del estudio, más cercanas a los objetivos marcados por las guías clínicas12,13. Aunque el control metabólico fue mejor al final del estudio, los cambios detectados en las variables de eficacia no fueron uniformes en función del tipo de tratamiento previo.
La mejoría en el control metabólico se consiguió con una tasa baja de acontecimientos adversos, de los cuales sólo el 2,3% estuvo relacionado con el tratamiento. A su vez, la tasa media de hipoglucemias disminuyó al final del tratamiento con respecto a la cifra basal en todos los grupos, excepto en el de tratamiento previo sólo con dieta, en que aumentó, y en el de ADO, en que se mantuvo. Estos resultados son acordes con datos publicados previamente en la literatura científica20.
Se trata de un estudio observacional con las limitaciones propias de su diseño. No obstante, la información derivada de este tipo de estudios, que suelen incluir a pacientes de edad más avanzada y con mayor comorbilidad que los ensayos clínicos controlados, refleja mejor la realidad de la práctica clínica diaria.
En conclusión, el tratamiento con insulina aspartato bifásica 30/70 en pacientes con DM2 produjo una mejoría notable del control metabólico, con un mayor porcentaje de pacientes que alcanzaron el objetivo de HbA1c < 7% con una tasa baja de acontecimientos adversos. Dicha mejoría en el control metabólico se consiguió con un número similar o menor de hipoglucemias que al inicio del tratamiento.
En el capítulo “Importancia de mantener una suficiente concentración sérica de T4 materna en el primer trimestre del embarazo”, publicado en Endocrinol Nutr. 2008;55 Supl 1:54-60, se ha detectado el siguiente error:
En la página 58, columna izquierda, línea 11, después de un punto y seguido, donde dice “En las madres se previene la bociogénesis como resultado (…)” debería decir “En las madres proviene la bociogénesis como resultado (…)”.