Entre los factores moduladores de prevalencia de carcinoma diferenciado de tiroides (CDT) destacan la concentración plasmática de TSH, la nodularidad tiroidea y la asociación con la autoinmunidad. La TSH estimula la proliferación de células foliculares normales y neoplásicas. Los anticuerpos contra el receptor de TSH (TSI), por su acción TSH-like, deberían estimular el crecimiento del CDT. El objetivo fue comparar la prevalencia de CDT incidental en pacientes tiroidectomizados por enfermedad benigna.
Pacientes y métodosSe estudió la anatomía patológica de 372 pacientes con diagnósticos prequirúrgicos de bocio multinodular normofuncionante (BMN) o hipertiroidismo. La gammagrafía, y/o presencia de TSI diferenció entre bocio multinodular hiperfuncionante (BMH) y enfermedad de Graves (EG). Se comparó la prevalencia de CDT en cada categoría (χ2).
ResultadosSe encontraron 221 sujetos con BMN, 125 con EG y 26 con BMH. Se hallaron 58 CDT con la siguiente distribución: BMN, 49 (22,2%); EG, 8 (6,4%) y BMH, 1 (3,8%). La diferencia de prevalencia de CDT entre los grupos fue estadísticamente significativa (p<0,001). Ajustando por edad, el BMN tiene mayor prevalencia de CDT respecto a EG, con OR de 4,17 (p<0,001). El tamaño (mm) tumoral (media±DE) fue: 6,92±11,26; 1,97±1,85 y 9,0 en BMN, EG y BMH respectivamente (p=0,017).
ConclusionesLa prevalencia de CDT incidental es menor en EG que en BMN, siendo el resultado independiente de la edad. Este hallazgo puede indicar una predisposición hacia el desarrollo de CDT en pacientes con enfermedad nodular tiroidea y/o que la reacción autoinmunitaria puede resultar un factor protector contra el desarrollo de enfermedad neoplásica.
Risk factors for differentiated thyroid carcinoma (DTC) are poorly understood, but serum TSH levels, thyroid nodularity, and presence of autoimmunity are well-recognized factors that modulate DTC prevalence. TSH stimulates proliferation of both normal and neoplastic follicular cells. Consequently, thyroid-stimulating immunoglobulins (TSI), because of its TSH-like action, should induce DTC progression in patients with Graves’ disease (GD). The study objective was to compare the prevalence of incidental DTC in patients undergoing thyroidectomy for benign thyroid disease.
MethodsThe pathology reports of 372 patients with preoperative diagnosis of euthyroid multinodular goiter (EMG) or hyperthyroidism were reviewed. Scintigraphy results and serum TSI levels were used to diagnosed either GD or hyperactive MG (HMG) to hyperthyroid subjects. Prevalence of DTC in each category was calculated using a Chi-square test.
ResultsEMG, GD, and HMG were diagnosed in 221, 125, and 26 patients. There were 58 DTCs, distributed as follows [n (%)]: EMG, 49 (22.2%); GD, 8 (6.4%), and HMG, 1 (3.8%). Difference in prevalence of incidental DTC between the groups was statistically significant (p<0.001). After adjustment for age, patients with EMG had a greater DTC prevalence than GD patients, with an OR of 4.17 (p<0.001). Tumor size (mm, mean±SD) was 6.92±11.26, 1.97±1.85, and 9.0 for EMG, GD and HMG respectively (p=0.017).
ConclusionsIncidental DTC was less prevalent in GD as compared to EMG irrespective of age. This finding may suggest a predisposition to develop DTC in patients with thyroid nodular disease and/or a potential effect of autoimmunity to protect against development of neoplastic disease.
Las causas que predisponen al desarrollo de cáncer diferenciado de tiroides (CDT) no son bien conocidas, si bien existen varios factores tales como la autoinmunidad, la concentración circulante de tirotropina (TSH) y la presencia de nódulos, que parecen modular su prevalencia.
La posible asociación entre autoinmunidad y desarrollo CDT es un tema abierto, objeto de intensa investigación1–6. Varios autores han estudiado la posible asociación del CDT tanto con la enfermedad de Graves (EG) como con la tiroiditis de Hashimoto, obteniendo resultados controvertidos1,2,7. Mientras que algunos trabajos parecen señalar que la presencia de autoinmunidad es un factor de riesgo para desarrollar CDT1,7, otros datos apuntan hacia un posible papel protector frente al mismo2.
Por otro lado también se ha sugerido que existe una relación lineal entre las concentraciones en suero de TSH y la frecuencia de CDT entre las personas con nódulos tiroideos7–9. En este sentido la presencia de autoanticuerpos estimuladores del tiroides (TSI), por su acción TSH-like, debería favorecer el aumento de la prevalencia de CDT en los pacientes con EG.
Por último otros autores han puesto el énfasis en subrayar que el riesgo para desarrollar CDT es mayor entre los sujetos con nodularidad tiroidea que en los que carecen de esta alteración10–14.
Teniendo en cuenta estos tres posibles factores moduladores de la frecuencia de CDT, diseñamos un estudio con el objetivo de comparar la prevalencia de CDT hallado incidentalmente en la pieza quirúrgica de pacientes intervenidos de tiroidectomía total por enfermedad tiroidea benigna en nuestro centro. Las categorías que nos propusimos estudiar fueron: enfermedad de Graves (EG), bocio multinodular normofuncionante (BMN) o bocio multinodular hiperfuncionante (BMH).
Material y métodosPoblación en estudioRecogimos información de un total de 372 pacientes que fueron intervenidos de tiroidectomía total en nuestro centro durante un periodo de 11 años (octubre 1998 - septiembre 2008). Los diagnósticos prequirúrgicos fueron EG, BMN o BMH.
La clasificación de sus respectivos diagnósticos prequirúrgicos se basó en el examen clínico, bioquímico, inmunológico, gammagráfico y ecográfico. Los criterios diagnósticos de hipertiroidismo fueron el hallazgo de una concentración sérica baja de TSH con concentraciones normales o elevadas de tiroxina (T4) circulante y, en ocasiones, concentración elevada de triyodotironina (T3). El diagnóstico diferencial de los casos de hipertiroidismo lo proporcionó el resultado de la gammagrafía: hipercaptación difusa para EG y unifocal o multifocal para BMH. En la mayoría de los casos el diagnóstico de la EG se confirmó también por el hallazgo de concentraciones de TSI elevadas. En casos seleccionados se dispuso de información proporcionada por la ecografía-doppler. El tiroides de pacientes con EG presentaba generalmente un flujo doppler aumentado. Los pacientes con bocio y nódulos en el estudio ecográfico, acompañado de concentraciones de TSH y hormonas tiroideas dentro de los límites de la normalidad e hipocaptación de las áreas nodulares con parénquima bien conservado en la gammagrafía, fueron incluidos en el grupo BMN.
En todos los casos se revisó el informe de anatomía patológica (AP) de las piezas quirúrgicas y se registró la aparición de carcinoma de tiroides incidental, prestando especial atención al tamaño tumoral y multifocalidad del CDT. La información de la anatomía patológica (AP) reafirmó el diagnóstico clínico.
Los criterios de exclusión fueron el tratamiento previo con radioterapia o yodo radioactivo. El diseño, por ser de naturaleza retrospectiva, no pudo registrar el consumo de yodo.
MétodosLa técnica y equipo de laboratorio empleados en el departamento de Bioquímica de nuestro centro para determinar T3 libre, T4 libre y TSH fue el inmunoensayo de electroquimioluminiscencia, con el analizador Modular Analytics E170 (Roche), y para los anticuerpos antirreceptor de TSH (TSI) el Radioinmunoanálisis, Riazen TSH-R Ab (ZenTech). Los límites de referencia fueron 0,38-4,7μU/mL (TSH), 9,1-23,9pmol/L (T4 libre), 2,3-5,3pmol/L (T3 libre) y positividad para anticuerpos anti-receptor de TSH (TSI)>14 U/L, considerando límite el intervalo 9 – 14 U/L.
Estudio estadísticoSe realizó un análisis crudo mediante Chi cuadrado comparando la prevalencia de CDT en los grupos de pacientes con diagnósticos de EG, BMN y BMH. Para las comparaciones de medias entre los grupos EG y BMN, se verificó la normalidad de la distribución utilizando las pruebas de normalidad de Kolmogorov-Smirnov y Shapiro-Wilk, y a continuación se realizó la prueba de la T de Student o cuando procedía su equivalente no paramétrico, la prueba exacta de U Mann Whitney. Las frecuencias fueron comparadas por el test de la χ2 o por el test exacto de Fisher cuando una de las frecuencias absolutas era menor de cinco. Posteriormente se calculó la odds ratio, y se realizó regresión logística no condicional para ajustar por edad y sexo. Los datos se muestran como frecuencias absolutas (n) o relativas (%), y medias con su desviación estándar (DE).
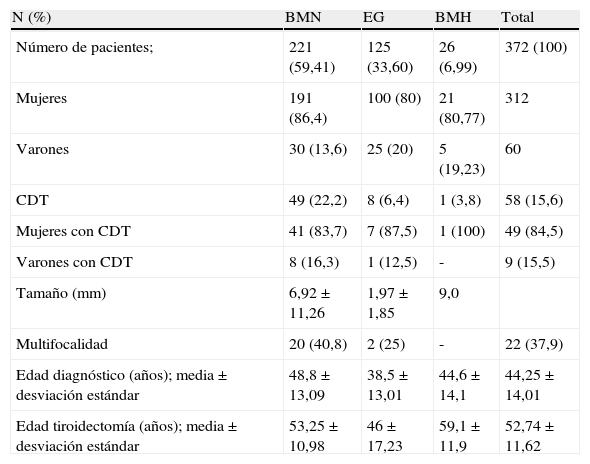
ResultadosUn total de 376 pacientes cumplían los criterios para revisar los especímenes de AP. Tras la revisión se excluyeron 4 casos por el hallazgo de carcinoma medular (n=3) y carcinoma anaplásico (n=1), quedando 372 para el análisis. Las características de los pacientes se resumen en la tabla 1.
Características de los pacientes intervenidos de tiroidectomía total con diagnóstico previo de enfermedad tiroidea benigna.
| N (%) | BMN | EG | BMH | Total |
| Número de pacientes; | 221 (59,41) | 125 (33,60) | 26 (6,99) | 372 (100) |
| Mujeres | 191 (86,4) | 100 (80) | 21 (80,77) | 312 |
| Varones | 30 (13,6) | 25 (20) | 5 (19,23) | 60 |
| CDT | 49 (22,2) | 8 (6,4) | 1 (3,8) | 58 (15,6) |
| Mujeres con CDT | 41 (83,7) | 7 (87,5) | 1 (100) | 49 (84,5) |
| Varones con CDT | 8 (16,3) | 1 (12,5) | - | 9 (15,5) |
| Tamaño (mm) | 6,92±11,26 | 1,97±1,85 | 9,0 | |
| Multifocalidad | 20 (40,8) | 2 (25) | - | 22 (37,9) |
| Edad diagnóstico (años); media±desviación estándar | 48,8±13,09 | 38,5±13,01 | 44,6±14,1 | 44,25±14,01 |
| Edad tiroidectomía (años); media±desviación estándar | 53,25±10,98 | 46±17,23 | 59,1±11,9 | 52,74±11,62 |
BMH: bocio multinodular hiperfuncionante; BMN: bocio multinodular normofuncionante; CDT: carcinoma diferenciado de tiroides; EG: enfermedad de Graves.
La edad al diagnóstico en pacientes con EG era menor que en los pacientes con BMN (p<0,001). La edad de la tiroidectomía total fue 53,25±10,9; 46±17,2 y 59,1±11,9 años para BMN, EG y BMH, respectivamente (p<0,001); siendo significativamente inferior en la EG que en el resto de enfermedades tiroideas estudiadas.
El número de CDT incidentalmente hallados en la muestra total de las piezas quirúrgicas extraídas de la tiroidectomía total fue de 58. La distribución por grupos fue, en BMN: 49 (22,2%); en EG: 8 (6,4%) y en BMH: 1 (3,8%). Se encontró que solo un paciente con BMH presentaba CDT, por lo que se excluyó este grupo del análisis. La comparación de la prevalencia de CDT incidental entre BMN y EG mostró diferencias estadísticamente significativas, siendo más frecuente en el BMN (p<0,001). Ajustando por edad, los pacientes con BMN tienen mayor prevalencia de CDT respecto a EG con una odds ratio de 4,17 (p<0,001).
Se analizó la relación entre la edad de diagnóstico de la enfermedad tiroidea y la aparición de CDT, encontrando diferencias significativas. Los pacientes con CDT se diagnosticaron con una edad media (años) de 48,23±11,60, mientras que la edad media del diagnóstico en los que no presentaron CDT fue de 43,49±14,31; (p=0,04).
También se analizó la posible influencia del sexo. Tal como era de esperar, la enfermedad tiroidea resultó más frecuente entre el sexo femenino. Sin embargo el hallazgo de CDT incidental tanto en BMN como EG entre los estratos de nuestra muestra distribuidos por sexos no obtuvo diferencias significativas. El porcentaje de CDT entre las mujeres fue de 83,67% en los BMN y 14,29% en EG; y entre varones fue de 88,89% en BMN y 11,11% en EG; odds ratio varón/mujer: 1,01 (tabla 1).
Las medidas obtenidas del tamaño tumoral (mm) de los CDT fueron: 6,92±11,26; 1,97±1,85 y 9,0 en BMN, EG y BMH respectivamente; (p=0,017). La comparación de estos datos mostró diferencias con significación estadística, y se señalaba un menor tamaño en los CDT incidental hallados en EG que en BMN. Asimismo estudiamos la presencia de multifocalidad en los CDT extirpados y se constató una mayor prevalencia de multifocalidad en los BMN: 20 (40,82%), mientras que solo 2 (25%) con EG presentaban este rasgo y 0 (0%) para BMH, siendo estadísticamente significativa la diferencia en la prevalencia (p<0,001), sin que se obtuvieran diferencias significativas (p=0,27) en la multifocalidad (tabla 1).
DiscusiónEl CDT incidental tras cirugía por enfermedad tiroidea benigna no es un hallazgo inusual14, a pesar de que la frecuencia de CDT entre los nódulos tiroideos es menor del 5%. No obstante, por fortuna, en la mayoría de casos, el incidentaloma es un microcarcinoma de muy baja agresividad15. En nuestro país también se observa la tendencia universal del aumento de la incidencia del CDT en los últimos años. Esto es debido al incremento de carcinomas papilares de pequeño tamaño16,17.
El factor de riesgo mejor conocido para el desarrollo de CDT es la radiación ionizante13,18. Sin embargo la aparición de CDT también se ha relacionado con otros factores como bocio nodular13, valores elevados de TSH circulante7–9, presencia de reacción autoinmunitaria1,19, el sexo femenino20 o la obesidad21.
Estudios previos han demostrado que existe una mayor prevalencia de CDT en los pacientes con el diagnóstico de bocio nodular y se asocia en mayor medida con los BMN que con los BMH13,14. Se especula que la menor frecuencia en estos últimos pueda estar relacionada con la abolición del efecto trófico de la TSH sobre las células foliculares tiroideas. De hecho, se considera que el hipertiroidismo es un factor protector contra el desarrollo de CDT. Tanto es así que las directrices de las recientes Guías de la ATA sobre el manejo del CDT no aconsejan hacer estudios citológicos sistemáticos en los pacientes hipertiroideos con enfermedad nodular22. No obstante, en nuestro medio, esta recomendación hay que tomarla con cautela23, ya que algunos datos aconsejan llevar a cabo punción y aspiración con aguja fina también en pacientes hipertiroideos24.
La información sobre la posible asociación de hipotiroidismo y CDT es más abundante. En un estudio en el que se incluyeron 1.500 pacientes la prevalencia de malignidad aumentó desde 2,8% cuando TSH se encontraba menor de 0,4 mU/L hasta 29,7% cuando TSH era mayor de 5,5 mU/L8. Un estudio posterior mostró que los pacientes diagnosticados de CDT en fases más avanzadas tenían concentraciones superiores de TSH9.
Por otro lado, está igualmente descrito que la infiltración linfocitaria, característica de los procesos autoinmunitarios del tiroides, es un factor protector frente al desarrollo de CDT, o cuando menos se asocia a buen pronóstico de la enfermedad19,25–27. En este sentido también es interesante señalar que se ha descrito que el microquimerismo, fenómeno asociado a un alto porcentaje de las enfermedades autoinmunitarias del tiroides28,29; se relaciona con una menor presencia de células malignas, jugando un papel relevante como factor protector en el CDT30. No obstante otras investigaciones han sugerido que, además de las concentraciones séricas de TSH, la presencia de anticuerpos antitiroglobulina positivos eran un predictor independiente de malignidad en pacientes con nódulos tiroideos, a pesar de la presencia simultánea de enfermedad tiroidea autoinmunitaria4,7. El análisis de estos trabajos con resultados divergentes resulta difícil porque, si bien la tiroiditis de Hashimoto y la EG comparten el posible efecto asociado al papel modulador del trastorno autoinmunitario sobre la oncogénesis, su presentación funcional es contrapuesta. Mientras que EG cursa con hipertiroidismo, los pacientes con tiroiditis de Hashimoto acaban desarrollando hipofunción tiroidea. Así, los trabajos que muestran un aumento de la prevalencia de CDT en EG señalan que su hallazgo puede estar en relación con la acción TSH-like de los anticuerpos TSI y se atribuye a estos la capacidad de estimular la proliferación de las células foliculares neoplásicas31.
Nuestros resultados están en sintonía con otros hallazgos anteriores13,14. Sin embargo, existe cierta discrepancia con otros estudios32 cuyos resultados concluyen con una mayor incidencia del cáncer de tiroides en EG que en el BMN. No obstante, en nuestra muestra se halló CDT incidental en un solo paciente con BMH, lo que no nos ha permitido hacer comparaciones entre la prevalencia en EG y BMH. Se puede asumir que la existencia de multicentricidad aparece como consecuencia de la influencia de factores estimuladores o de riesgo para desarrollar CDT. En nuestra serie el CDT incidental fue multicéntrico en solo 2 de los 8 pacientes con EG y CDT. Este dato no resultó suficiente para llevar a cabo el análisis estadístico adecuado y compararlo con la presencia de este rasgo entre los CDT incidentales hallados entre los casos de BMN. No obstante, se observa que existe una mayor tendencia a la multifocalidad en BMN, lo que está en sintonía con el hallazgo del mayor tamaño y prevalencia de CDT en estos casos (tabla 1).
En conclusión, nuestros resultados sugieren que la prevalencia del CDT incidental es menor en EG que en BMN y este resultado es independiente de la edad. Este hallazgo puede indicar dos tendencias: la existencia de cierta predisposición hacia CDT en pacientes con enfermedad nodular y/o que la reacción autoinmunitaria puede resultar un factor protector contra el desarrollo de enfermedad neoplásica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.