Las alteraciones tiroideas son frecuentes en la gestación y pueden ser nocivas para el desarrollo del recién nacido. El objetivo del presente estudio fue valorar la prevalencia de enfermedad tiroidea y el estado nutricional de yodo de un grupo de mujeres en su primer trimestre de embarazo.
Pacientes y métodoEstudio observacional descriptivo, realizado en una zona de salud de Toledo. La población del estudio estaba formada por las embarazadas de dicha zona y un grupo control de mujeres no gestantes de edad similar. En ambos grupos se realizó una ecografía tiroidea y se determinó la yoduria; en embarazadas, además, tirotropina (TSH), T4 libre y anticuerpos antiperoxidasa (TPO).
ResultadosParticiparon 199 embarazadas y 169 controles. La mediana de yoduria fue 135 (rango intercuartílico [RI], 240-65) μg/l en embarazadas y 150 (RI, 200-90) μg/l en controles. Las medias±desviación estándar de TSH y T4 en embarazadas fueron 1,95±1,62 y 1,03±0,15 μU/ml, respectivamente. La prevalencia de hipotiroidismo en embarazadas fue del 9,5% (intervalo de confianza del 95%, 6,0-14,7). El volumen tiroideo resultó mayor en embarazadas (12,2±5,6ml) que en controles (10,7±4,0ml) (p=0,005). Se encontraron nódulos tiroideos en el 38,5% de los controles y en el 33,2% de las embarazadas (p=0,290).
ConclusionesExiste un deficiente estado de yodación en nuestras embarazadas. La prevalencia de hipotiroidismo es alta y similar a la de otros trabajos españoles. Debería valorarse la determinación de hormonas tiroideas y anticuerpos anti-TPO en el primer control gestacional. La prevalencia de nódulos es similar en controles y embarazadas en el primer trimestre. Debería solicitarse una ecografía tiroidea en las gestantes que presenten en la exploración física bocio y/o nódulos tiroideos.
Thyroid alterations are frequent during pregnancy and can be harmful to the development of the newborn. The objective of this study was to assess the prevalence of thyroid disorders as well as iodine nutritional status in pregnant women in the first trimester of pregnancy.
Patients and methodWe performed a descriptive observational survey in a health area of Toledo (Spain). Participants consisted of pregnant women in this area and a control group of non-pregnant women of similar age. Both groups underwent thyroid ultrasonography and urinary iodine concentration test. Thyrotropin, free T4 and anti-thyroid peroxidase antibodies (anti-TPO Ab) levels were also measured in pregnant women.
ResultsA total of 199 expectant women and a control group of 169 non-pregnant women participated. The median urinary iodine concentration was 135 μg/l (IR, 240-65) in pregnant women and 150μg/l (IR, 200-90) in the control group. The mean values for TSH and free T4 in pregnant women were 1.95±1.62 and 1.03±0.15μU/ml, respectively. The prevalence of hypothyroidism in expectant women was 9.5% (95% CI, 6.0-14.7). Thyroid volume was larger in pregnant women (12.2±5.6mL) than in controls (10.7±4.0mL) (p=0.005). Thyroid nodules were found in 38.5% of the women in the control group and in 33.2% of pregnant women (p = 0.290).
ConclusionsIodine status was deficient in our group of pregnant women. In agreement with the results of other studies performed in Spain, the prevalence of hypothyroidism was high. Thyroid hormones and anti-TPO Ab tests should be evaluated in the first prenatal visit. The prevalence of nodules was similar in pregnant women in the first trimester of pregnancy and in controls. Thyroid ultrasonography should be performed in pregnant women whenever a goiter and/or thyroid nodules are detected during clinical examination.
Las alteraciones tiroideas son frecuentes durante la gestación y pueden tener consecuencias nocivas en ésta y en el desarrollo neurológico y psicomotor del recién nacido. Unas concentraciones adecuadas de tiroxina son indispensables para el correcto desarrollo del cerebro fetal, dependiente de esta hormona materna, sobre todo en las primeras semanas de la gestación. De hecho, la hipotiroxinemia materna en esta primera fase del embarazo se correlaciona con retrasos cognitivos y motores en el recién nacido, objetivables, algunos de ellos, ya en las primeras semanas de vida1.
Se requiere una ingesta adecuada de yodo por parte de la madre para hacer frente al aumento de las necesidades de este micronutriente que se produce durante el embarazo. La mayoría de los casos de hipotiroxinemia se deberían a una deficiencia relativa de yodo durante la gestación, fácilmente corregible con un adecuado suplemento de este micronutriente2. Existe también evidencia de que los hijos nacidos de madres hipotiroideas no tratadas durante su gestación presentan coeficientes intelectuales más bajos que los nacidos de madres no hipotiroideas o hipotiroideas tratadas3.
En España diversos estudios4,5 demuestran un insuficiente estado nutricional de yodo en las gestantes, con una prevalencia de hipotiroidismo clínico y subclínico similar a la referida en otros países2,3.
Por otra parte, las alteraciones morfológicas del tiroides durante la gestación han sido poco estudiadas, ya que hay escasos trabajos que estimen su prevalencia y algunas discrepancias en cuanto al abordaje y manejo de la enfermedad nodular en esta fase de la vida de la mujer.
El objetivo del presente trabajo ha sido evaluar la prevalencia de enfermedad tiroidea (tanto funcional como morfológica) y el estado nutricional de yodo de un grupo de embarazadas sanas en las fases iniciales del embarazo (primer trimestre).
PACIENTES Y MÉTODOSe trata de un estudio observacional descriptivo, realizado en la zona de salud de Santa María de Benquerencia, en el polígono industrial de la ciudad de Toledo (España), entre octubre de 2004 y octubre de 2005.
La población del estudio la formaron las embarazadas de dicha zona de salud. Su captación se realizó en la primera visita del programa de control de embarazo que, desde hace años, se viene realizando en esta zona de salud. A todas se las invitó a participar en el estudio, previa firma de un documento de consentimiento informado elaborado según las recomendaciones del Comité Ético y de Investigación del Hospital Virgen de la Salud de Toledo, que revisó y aprobó el proyecto.
De manera similar, se formó un grupo control con mujeres no embarazadas de edad similar y sin antecedentes de enfermedad tiroidea, seleccionadas de forma aleatoria entre las que acudían a las consultas del centro de salud por cualquier motivo (la primera y la última paciente citadas cada día).
En todas las mujeres se recogieron datos de talla y peso (utilizados para el cálculo del índice de masa corporal [IMC] = peso en kg / talla2, en metros), edad, consumo de tabaco, edad de la menarquia, fecha de la última menstruación (utilizada para calcular la edad gestacional), consumo previo de anticonceptivos orales y embarazos anteriores.
A las embarazadas se les determinó la tirotropina (TSH), la tiroxina libre (T4) y los anticuerpos antiperoxidasa (TPO) mediante inmunoanálisis quimioluminiscente de micropartículas de 2 pasos con anticuerpos monoclonales de ratón en un analizador Architect i2000 (Abbott Laboratories). Los límites de normalidad para la TSH, la T4 y los anticuerpos anti-TPO, para la población no gestante, estaban establecidos, respectivamente, en: 0,5-4 μU/ml, 0,8-2ng/dl y 0-16 U/ml. Se consideró como hipotiroidismo el valor de TSH mayor de 4 μU/ml (subclínico si no había alteración de la T4 y clínico si, además, había disminución); hipertiroidismo, un valor de TSH menor de 0,4 μU/ml (clínico o subclínico en función de que hubiera o no elevación de T4, respectivamente) y anticuerpos anti-TPO positivos cuando éstos superaban el valor de 16 U/ml.
Se recogió una muestra aislada de orina de todas las mujeres, siempre a la misma hora de la mañana, para determinar la yoduria mediante el método de Benotti6. Las muestras se congelaban y eran remitidas a la Universidad Autónoma de Madrid (Instituto de Investigaciones Biomédicas Alberto Sols) para su análisis.
Aunque a todas las embarazadas se les recomendaba el consumo de un preparado comercial polivitamínico con 200μg de yoduro sódico, no todas siguieron esta recomendación y algunas suspendieron la ingesta por intolerancia digestiva. Esto permitió definir 2 subgrupos en función de si se realizó o no la suplementación de yodo en los días previos a la determinación de la yoduria. En el grupo de suplementación con yodo, el tiempo medio transcurrido desde su inicio hasta el momento de la determinación de yoduria fue de 3 semanas, aproximadamente.
Posteriormente, se citó a todas las mujeres para una ecografía tiroidea que se efectuaba en la consulta del centro de salud y por un único médico de atención primaria con amplia experiencia. Se utilizó un ecógrafo modelo Nemio de la marca Toshiba (Toshiba Medical Systems, Japón) con una sonda lineal de 7MHz, con la paciente en decúbito supino y el cuello hiperextendido mediante la colocación de una almohada debajo de sus hombros.
Se evaluaba la posible existencia de nódulos, clasificándolos dentro de alguno de los siguientes grupos:
- –
0: sin nódulos.
- –
I (uninodular grande): un nódulo único ≥ 10mm.
- –
II (uninodular pequeño): un nódulo único < 10mm.
- –
III (multinodular): varios nódulos con al menos uno de ellos ≥ 10mm.
- –
IV (micronodular): varios nódulos, todos < 10mm.
Se decidió esta manera de clasificarlos porque 10mm representa el tamaño mínimo a partir del cual se pueden plantear actuaciones diagnósticas o terapéuticas adicionales7.
El volumen tiroideo (VT) se estimó mediante un corte ecográfico transversal y otro longitudinal de cada lóbulo tiroideo (desestimando el istmo) y se determinó, en ellos, los diámetros máximos anteroposterior (A), transverso (B) y longitudinal (C), mediante la fórmula: VT = [A1 × B1 × C1 × FC] + [A2 × B2 × C2 × FC], donde el subíndice 1 hace referencia al lóbulo derecho y el 2 al izquierdo y donde FC representa un factor de corrección con un valor no claramente establecido en la literatura; nosotros utilizamos el valor de 0,524 (π / 6)8.
Los datos fueron introducidos en una base informatizada del programa SPSS 12.0 para Windows que fue utilizado para el análisis posterior; se empleó la prueba de la χ2 de Pearson, para comparación de porcentajes, y la U de Mann-Whitney para comparación de medias, una vez valorada la normalidad de las variables mediante la prueba de Kolmogorov-Smirnov. Para la correlación entre variables se empleó el coeficiente ρ de Spearman.
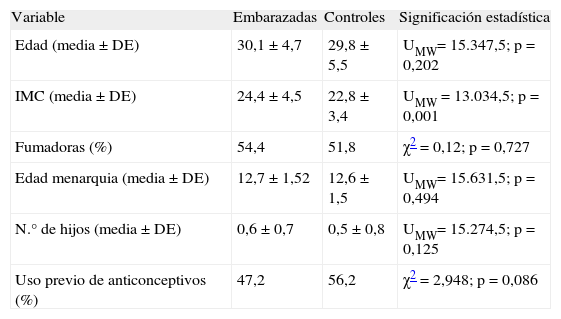
RESULTADOSAceptaron participar en el estudio 199 embarazadas (el 83,4% del total de embarazadas de la zona de salud en el período estudiado), con una edad gestacional entre 4 y 18 semanas (media, 9,3). Como grupo control se incluyó a 169 mujeres no embarazadas. Los datos de edad, índice de masa corporal (IMC), menarquia, consumo de tabaco, toma de anticonceptivos y número de hijos previos se recogen, para los 2 grupos, en la tabla I. Sólo hubo diferencia estadísticamente significativa en el IMC que fue mayor en las embarazadas.
Características basales de ambos grupos
| Variable | Embarazadas | Controles | Significación estadística |
| Edad (media ± DE) | 30,1 ±4,7 | 29,8 ± 5,5 | UMW= 15.347,5; p = 0,202 |
| IMC (media ± DE) | 24,4 ±4,5 | 22,8 ±3,4 | UMW = 13.034,5; p = 0,001 |
| Fumadoras (%) | 54,4 | 51,8 | χ2 = 0,12; p = 0,727 |
| Edad menarquia (media ± DE) | 12,7 ±1,52 | 12,6 ±1,5 | UMW= 15.631,5; p = 0,494 |
| N.° de hijos (media ± DE) | 0,6 ± 0,7 | 0,5 ±0,8 | UMW= 15.274,5; p = 0,125 |
| Uso previo de anticonceptivos (%) | 47,2 | 56,2 | χ2 = 2,948; p = 0,086 |
DE: desviación estándar; IMC: índice de masa corporal; UMW:U de Mann-Whitney.
La yoduria sólo se pudo determinar en 146 embarazadas y 147 controles. La mediana de las yodurias fue 135 (rango intercuartílico [RI], 240-65) μg/l en las embarazadas y 150 (RI, 200-90) μg/l en el grupo control (p = 0,341). El 34,8% de las primeras y el 25,8% de los controles excretaban menos de 100μg/l (p = 0,116).
Por subgrupos, las embarazadas con suplemento de yodo (n = 98) presentaban una yoduria (mediana) de 162,5 (RI, 260-83,75) μg/l frente a 90 (RI, 150-52,5) μg/l de las que no lo recibieron (n = 48) (p = 0,000).
Concentraciones de TSH, T4 y anticuerpos anti-TPO. Prevalencia de hipotiroidismo e hipertiroidismoLa media ± desviación estándar de los valores de TSH y de T4 de las embarazadas fue de 1,95 ±1,6 μU/ml y de 1,03 ± 0,15ng/dl, respectivamente. Una (0,6%) embarazada presentó hipertiroidismo subclínico, mientras que 19 tuvieron hipotiroidismo, también subclínico (con cifras de TSH mayores de 4 μU/ml).
De estas últimas, 14 eran casos nuevos y 5, conocidos con anterioridad al embarazo, aunque sólo 2 de ellas estaban controladas por este motivo y recibían tratamiento sustitutivo. Los casos nuevos y los conocidos con anterioridad pero no tratados recibieron tratamiento con tiroxina en el momento de ser detectados. La prevalencia de hipotiroidismo en embarazadas se estimó, por tanto, en el 9,5% (intervalo de confianza [IC] del 95%, 6-14,7). Los anticuerpos anti-TPO fueron positivos en el 13% de las embarazadas. Ese porcentaje fue del 50% en embarazadas hipotiroideas frente al 9,7% del resto de las embarazadas (p = 0,000).
Volumen tiroideo. Prevalencia de nódulos tiroideosEl volumen tiroideo resultó mayor en las embarazadas (12,2 ± 5,6ml) que en los controles (10,7 ± 4,0ml) (p = 0,005). No se hallaron diferencias en el volumen tiroideo entre las embarazadas con suplemento de yodo (11,9 ± 5,8ml) y las sin suplemento (12,5 ± 5,4ml) (p = 0,442).
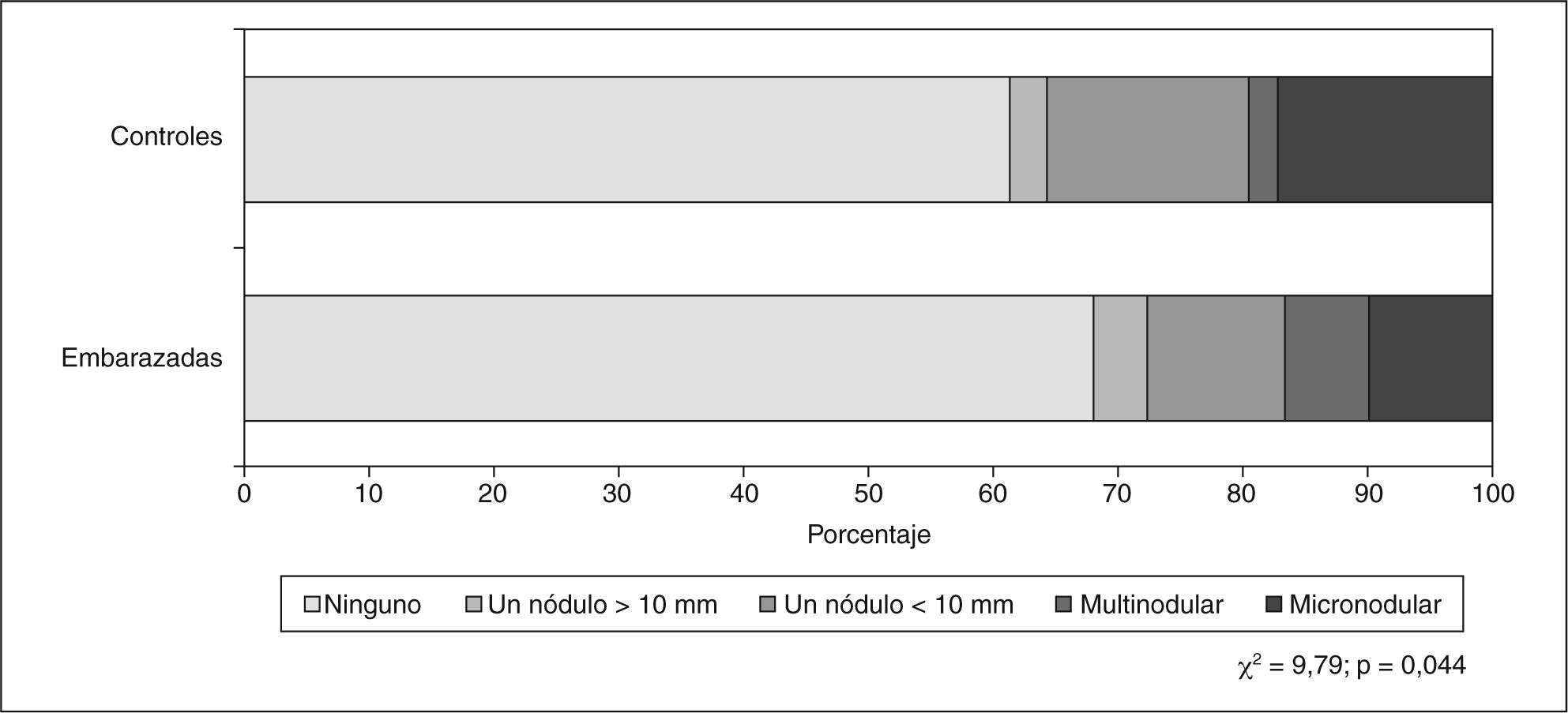
La correlación entre las concentraciones de TSH y el volumen tiroideo fue muy baja y negativa (ρ = –0,235; p < 0,01). Se encontraron nódulos tiroideos en el 38,5% de los controles y en el 33,2% de las embarazadas (p = 0,290). La distribución de los tipos de nódulos en ambos grupos puede apreciarse en la figura 1. También se observaron con mayor frecuencia nódulos en mujeres que habían tenido algún hijo (el 42 frente al 31,2%) (p = 0,033).
DISCUSIÓNEspaña se considera, al igual que otros países europeos, un país deficiente en yodo9 y los trabajos realizados en embarazadas así lo confirman5,10,11. En la mujer embarazada y debido a su mayor diuresis, la ingesta de 200-250μg/día de yodo se correspondería con yodurias de 150-166μg/l9. Cifras inferiores a 150μg/l indicarían un estado de yodación insuficiente durante el embarazo, mientras que en la población no embarazada se considerarían normales valores por encima de 100μg/l. Nuestros resultados indican que nuestra población (grupo control) presenta un buen estado de yodación, con una mediana de yodurias de 150μg/l, pero deficiente durante el embarazo (135μg/l). Al diferenciar entre las embarazadas que recibían suplemento de yodo y las que no lo recibían se observa una adecuada eliminación de yodo en las primeras (mediana de 162,5μg/l) y un estado de yodación todavía más deficiente en las segundas (mediana de 90μg/l). Aunque estos resultados deben analizarse con cautela, de ellos se puede deducir que, a pesar de que las mujeres de nuestra zona de salud llegan a la gestación con una concentración de yodo suficiente, es posible que sea necesario el suplemento adicional de dicho elemento para mantener sus requerimientos diarios durante esta etapa de su vida. Además, el consumo de sal yodada antes o durante la gestación influye de forma decisiva en el estado nutricional de yodo de cualquier población de mujeres embarazadas9 y nosotros no disponemos de dicho dato en nuestro trabajo, lo que puede suponer una limitación adicional del estudio.
Es destacable la alta prevalencia de hipotiroidismo detectada (9,5%), muy superior a la referida en otros trabajos, que oscila entre el 2 y el 2,5%12-15, realizados, sobre todo, en Estados Unidos, Japón y Europa central. No encontramos justificación a esta alta prevalencia, aunque es posible que diferencias poblacionales o la distinta sensibilidad del método de medida empleado en la determinación de las hormonas tiroideas pudieran explicarla en parte. En ese sentido, la prevalencia detectada está en línea con la de otros trabajos españoles5,16.
Por otra parte, el diagnóstico de las alteraciones tiroideas que acontecen durante la gestación resulta a veces complicado, debido a la inespecificidad de muchos de los síntomas, el estado hipermetabólico del embarazo y las alteraciones séricas de las hormonas tiroideas que los cambios fisiológicos de aquel imponen en la mujer17. Por eso, muchos autores abogan por investigar y redefinir valores de referencia de TSH específicos durante los distintos trimestres del embarazo15,18 y diferentes a los que se aplican en la población general, teniendo en cuenta que en las primeras semanas de gestación (sobre todo alrededor de la décima semana) y como consecuencia de la secreción placentaria de gonadotropina coriónica se produce un descenso de las concentraciones de TSH. En un estudio observacional prospectivo realizado en mas de 13.000 embarazadas19 se establecieron límites específicos para cada semana de gestación; la mayoría de los valores máximos eran menores de 4mU/l, considerado, habitualmente, como valor de referencia normal. No aplicar valores específicos de TSH en el embarazo podría alterar los resultados de los estudios de prevalencia de problemas tiroideos durante la gestación18. En el caso del hipotiroidismo, podría infravalorar su prevalencia.
La prevalencia de hipertiroidismo encontrada en nuestro trabajo fue, sin embargo, similar a la recogida en la literatura20.
Todavía hay controversia en cuanto a recomendar el examen sistemático de la función tiroidea a todas las embarazadas o sólo a aquellas consideradas de "alto riesgo" (historia personal o familiar de enfermedades tiroideas, historia personal de diabetes mellitus de tipo 1 u otras enfermedades autoinmunitarias, manifestaciones clínicas indicativas de afección tiroidea). Un reciente consenso21 (promovido por la American Thyroid Association, la American Association of Clinical Endocrinologists y la Endocrine Society) recomienda evaluar precozmente la función tiroidea en este último grupo, aunque hay trabajos que demuestran que haciéndolo así se dejaría de diagnosticar un tercio de los casos (que presentarían alteraciones en sus concentraciones de TSH y/o T4 en el primer trimestre de sugestación)22. El cribado universal es apoyado y justificado, sin embargo y a título individual, por otros autores3.
Uno de los cambios homeostáticos que el embarazo impone en las mujeres es el aumento de la excreción urinaria de yodo que, sobre todo en áreas de yododeficiencia, lleva aparejado un aumento de tamaño del tiroides. Este incremento de tamaño también puede hacerse evidente en zonas yodosuficientes en las que la embarazada no recibe suplemento de yodo4. Creemos que estos cambios fisiológicos de la gestación serían la causa en nuestro trabajo de las diferencias de volumen tiroideo entre casos y controles.
Los datos de prevalencia de anticuerpos anti-TPO positivos son similares a los de otros trabajos3,4,23. Aunque pueden estar presentes también en sujetos eutiroideos, un título elevado se correlaciona claramente con disfunción tiroidea, va paralelo al grado de infiltración linfocitaria de la glándula tiroides y es un claro factor de riesgo para el desarrollo de hipotiroidismo. Su presencia en embarazadas eutiroideas hace que se conviertan en un grupo de especial riesgo para desarrollar hipotiroidismo durante la gestación (en nuestro trabajo el 50% de las hipotiroideas tenían anticuerpos positivos) y presentar disfunción tiroidea posparto23.
Respecto a la prevalencia de nódulos tiroideos detectada en nuestro estudio, es similar en embarazadas y controles, lo que a priori parecería indicar una influencia escasa del embarazo en la nodulogénesis, pero hay que tener en cuenta que la ecografía se realizaba en una fase muy precoz de la gestación. Además, en el análisis univariable y contabilizando en conjunto a embarazadas y controles, hubo una relación positiva entre embarazos previos y la existencia de nódulos. Creemos que son necesarias más observaciones a este respecto, teniendo en cuenta la discrepancia entre los trabajos con resultados similares24,25 y los que no encuentran correlación significativa entre paridad y prevalencia de nódulos tiroideos26.
Aunque se presupone que la prevalencia de nódulos en el embarazo debe ser superior al 10%27, no hemos encontrado estudios publicados que hagan referencia a este dato en el primer trimestre de la gestación por lo que no podemos comparar nuestros resultados. En un trabajo realizado en Alemania28, en una zona con buenos valores de yodación, se encontró una prevalencia de nódulos del 31,9% en mujeres no embarazadas con una media de edad de 35,4 años, datos que podrían considerarse semejantes a los nuestros.
No existe acuerdo en cuanto a recomendar el cribado sistemático de nódulos tiroideos en poblaciones no seleccionadas, dado lo frecuente de su presentación (hasta un 67% si se utiliza la ecografía en su diagnóstico)29 y su bajo porcentaje de malignidad. Este planteamiento puede trasladarse al embarazo, si se tiene en cuenta, además, que el impacto del embarazo en el cáncer de tiroides parece ser mínimo30. De todo ello podría deducirse que el manejo de la enfermedad nodular tiroidea durante la gestación, tanto desde el punto de vista diagnóstico como terapéutico, debería ser similar al del resto de la población.
De los resultados de nuestro trabajo se podría desprender una serie de actuaciones, fácilmente incluibles dentro de las que habitualmente realizan los médicos de atención primaria que suelen ser, además, los primeros profesionales sanitarios que entran en contacto con la embarazada. Éstas podrían resumirse de la siguiente manera:
- 1.
En nuestra zona de salud sería conveniente administrar suplemento de yoduro potásico a todas las embarazadas, incluso desde el momento en que la mujer empezara a planificar su gestación31.
- 2.
Podría ser apropiado incluir la determinación de TSH, T4 y anticuerpos anti-TPO dentro de la primera determinación analítica que se realice como consecuencia del embarazo, e iniciar tratamiento sustitutivo con tiroxina lo más precozmente posible si fuera necesario. Si la mujer estuviera planificando su embarazo, la determinación de los valores hormonales indicados debería realizarse en la época preconcepcional.
- 3.
Debería solicitarse una ecografía tiroidea sólo en el caso de que en la exploración física de la embarazada durante la primera visita se detecte bocio y/o nódulos tiroideos.