Analizar la relación entre adiponectina, interleucina (IL) 18 y ghrelina y la densidad mineral ósea (DMO) en un grupo de mujeres intervenidas 1 año antes de bypass gástrico por obesidad mórbida.
MétodosSe incluyó a 41 pacientes intervenidas de bypass gástrico, con una media de edad de 46 ± 9 años y un índice de masa corporal (IMC) inicial de 49,5 ± 7,6. Se estudiaron variables antropométricas y de composición corporal por absorciometría mediante rayos X de doble energía (DEXA) y se determinaron, antes y después de la cirugía, las concentraciones plasmáticas de paratirina (PTH), 25(OH)-vitamina D, factor de crecimiento insulínico I (IGF-I), adiponectina, IL-18 y ghrelina. Se analizó la DMO al año del bypass gástrico mediante DEXA.
ResultadosAl año de la cirugía se observó una pérdida del 36,2% del peso inicial, que se asoció a una mejoría del perfil inflamatorio reflejada por una reducción significativa de las concentraciones plasmáticas de IL- 18 e incremento de adiponectina. En el estudio univariable la DMO se correlacionó negativamente con la edad (r = −0,287; p = 0,008) y con la masa magra (r = 0,318; p = 0,043), pero no con las concentraciones de adiponectina, IL-18 y ghrelina. Las concentraciones de PTH se correlacionaron positivamente con el peso (r = 0,362; p = 0,030), la masa grasa (r = 0,372; p = 0,039) e inversamente con las concentraciones plasmáticas de calcio (r = −0,48; p = 0,003) y de 25(OH)-vitamina D (r = −0,44; p = 0,014). El calcidiol plasmático se correlacionó negativamente con la suma de masa grasa y masa magra medida por DEXA (r = −0,210; p = 0,043). En el análisis de regresión múltiple, la DMO mantuvo relación únicamente con la masa no grasa (β = 0,193; p = 0,016).
ConclusionesNuestro estudio no halla efecto directo del tejido adiposo en el metabolismo óseo a través de la secreción de adiponectina. Del mismo modo, la falta de relación entre la citocina inflamatoria IL-18 y la ghrelina con la DMO cuestiona su implicación en la regulación ósea.
Analysis of the relationship between adiponectin, interleukin-18 (IL-18) and ghrelin and bone mineral density (BMD), in a group of women that had undergone a gastric- bypass for morbid obesity a year before.
MethodsForty-one morbidly obese patients aged 46 ± 9 years and with an initial body mass index of 49.5 ± 7.6 were included in the study and a gastric by-pass operation was performed in all of them. Anthropometric variables, body composition measured with dual energy X-ray absorptiometry (DEXA) and plasma concentrations of parathormone (PTH), 25(OH) vitamin D, insulin growth factor (IGF-I), adiponectin, IL-18 and ghrelin were determined before and a year after surgery. BMD was evaluated with DEXA 12 months after bariatric surgery.
ResultsA year after surgery 36.2% of inicial body weight was lost and this was associated with an improvement of the inflammatory profile reflected by a significant reduction of IL-18 and a increase of adiponectin plasma concentrations. In the univariate analysis BMD inversely correlated with age (r = −0.287, p = 0.008) and with lean mass (r = 0.318, p = 0.043) but not with adiponectin, IL-18 and ghrelin concentrations. PTH showed a positive correlation with weight (r = 0.362, p = 0.03), lean mass (r = 0.372, p = 0.039), and a negative association with plasma concentrations of calcium (r = −0.48, p = 0.003) and 25(OH) vitamin D (r = −0.44, p = 0.014). Plasma 25(OH) vitamin D correlated negatively with the sum of fat mass and lean mass measured with DEXA (r = -0.210, p = 0.043). In the multiple regression analysis BMD remained associated only with lean mass (β = 0.193, p = 0.016).
ConclusionsOur study does not support the existance of a direct effect of adipose tissue on bone metabolism through the secretion of adiponectin. The absence of association between inflammatory cytokine IL-18 and ghrelin with BMD also argues against their implication in bone regulation.
La obesidad protege contra la osteoporosis1,2, pero los mecanismos por los que el aumento de peso puede influir en la densidad mineral ósea (DMO) no son bien conocidos. El efecto protector de la obesidad puede deberse al aumento de la aromatización de los andrógenos a estrógenos en el tejido graso3, la disminución de las concentraciones de globulina transportadora de los esteroides sexuales o los efectos directos de la formación de hueso inducida por las concentraciones elevadas de insulina4 o de la acción del factor de crecimiento insuliníco I (IGF-I), que es el factor de crecimiento más prevalente en el hueso5,6. Recientemente se ha especulado que la relación entre DMO y grasa podría estar mediada por factores hormonales secretados por los adipocitos como la leptina y la adiponectina, citocinas inflamatorias y ghrelina7-9. La adiponectina puede estar involucrada en la modulación de la DMO debido a su estructura similar a Rank-L y a la osteoprotegerina 2, proteínas relacionadas con la regulación de la osteoclastogénesis; además se ha demostrado que la adiponectina puede activar o inhibir el factor de necrosis kappa B (NF-κB) un factor de transcripción esencial para la osteoclastogénesis10,11. Los estudios que han analizado la relación entre adiponectina y DMO en humanos han obtenidos resultados discordantes12-15.
Recientemente se ha mostrado que mediadores inmunitarios como las citocinas inflamatorias —factor de necrosis tumoral e interleucina (IL) 18, entre otros, que están aumentadas en la obesidad— están implicados en el metabolismo óseo16,17. Estudios in vitro han observado que la IL-18 inhibe la osteoclastogénesis17. Sin embargo, no existen estudios que hayan analizado esta relación en humanos.
El papel de la ghrelina en el metabolismo óseo se ha mostrado en el estudio de Maccarinelli et al18, que demostraron un incremento en la proliferación de los osteoblastos después de la administración de ghrelina18. También se ha descrito un estímulo directo en la formación ósea y un incremento en la DMO en ratas con la administración de ghrelina19. Sin embargo, los trabajos en humanos que han estudiado la relación entre las concentraciones de ghrelina plasmática y hueso han obtenido resultados contradictorios14,20,21. El objetivo de nuestro estudio es analizar, en un grupo de mujeres intervenidas 1 año antes de bypass gástrico por obesidad mórbida, la relación entre las concentraciones plasmáticas de adiponectina, IL-18 y ghrelina y la DMO obtenida por densitometría de rayos X de doble energía (DEXA).
PACIENTES Y MÉTODOLas pacientes con obesidad mórbida fueron reclutadas de la consulta de obesidad del Servicio de Endocrinología y Nutrición del Hospital Universitario de Bellvitge (L'Hospitalet de Llobregat, Barcelona). Todas ellas cumplían los criterios de inclusión para la realización de cirugía bariátrica según el protocolo de nuestro centro. Se excluyó a las pacientes con un evento cardiovascular agudo en los 6 meses previos, proceso infeccioso reciente o presente, historia de enfermedad cancerosa o tratamiento con fármacos antiinflamatorios o insulina; también a las mujeres con osteoporosis conocida o con enfermedad que pudiera influir en el metabolismo óseo. Se incluyó un total de 41 mujeres caucásicas con obesidad mórbida y se realizó a todas las pacientes un bypass gástrico según las modificaciones del método descritas por Capella et al22. Este tipo de cirugía consiste en una desconexión gástrica creando un reservorio gástrico de 20-30ml vertical, a expensas de la curvatura menor, que favorece la saciedad precoz y reduce la producción local de ácido clorhídrico. El reservorio gástrico se une a un asa de yeyuno con reconstrucción en Y de Roux, y la anastomosis mide 12mm de diámetro interno. El asa alimentaria o de Roux asciende por la vía antecólica y antegástrica y tiene una longitud aproximada de 100-120cm; el tramo común mide aproximadamente 300cm.
Todas las participantes firmaron el consentimiento informado para su inclusión en el estudio, que fue aprobado por el comité ético de nuestro hospital.
Medidas antropométricasSe determinó el peso, la talla y el índice de masa corporal (IMC = peso en kilogramos / cuadrado de la talla en metros). El índice cintura/cadera se calculó como el cociente entre las circunferencias de la cintura y de la cadera en centímetros. La obesidad se clasificó de acuerdo con los criterios de la Organización Mundial de la Salud23.
La DMO (g/cm2) se midió al año de la cirugía a nivel de la columna lumbar (L1-L4) y en la cadera por DEXA (Hologic QDR 4500; Hologic Inc., Waltham, Missouri, Estados Unidos).
La composición corporal (porcentaje total de masa grasa y masa no grasa) se evaluó mediante DEXA. El examen se realizó con el paciente en ropa interior después de retirar todos los artefactos metálicos y con una duración de la prueba de 7min.
Métodos analíticosBasalmente y al año de la cirugía, se realizaron las siguientes determinaciones analíticas.
Las muestras de sangre fueron extraídas de cada paciente antes del desayuno entre las ocho y las nueve de la mañana. Todas las muestras se guardaron a –80°C hasta la realización de las determinaciones analíticas.
La paratirina (PTH) intacta se determinó mediante análisis inmunorradiométrico (Diagnostic System Laboratories, Webster, Texas, Estados Unidos); los coeficientes de variación intraanalítica e interanalítica fueron del 10 y el 11%, respectivamente.
Las concentraciones de 25(OH)-vitamina D se determinaron por radioinmunoanálisis (DiaSorin, Stillwater, Minnesota, Estados Unidos).
Las concentraciones séricas de IGF-I después de la extracción con ácido etanol se determinaron por radioinmunoanálisis (Nichols, San Juan de Capistrano, California, Estados Unidos), con coeficientes de variación intraanalítica e interanalítica del 5,2 y el 9,4%, respectivamente.
Las concentraciones plasmáticas de adiponectina y ghrelina se determinaron mediante radioinmunoanálisis (Linco Research, Missouri, Estados Unidos). Para la adiponectina, la sensibilidad de la prueba fue de 1ng/ml en una muestra de 100μl, con unos límites de 1-200ng/ml. Todas las muestras fueron diluidas a 1/500. Los coeficientes de variación intraanalítica e interanalítica fueron del 8 y el 12%, respectivamente. Para la ghrelina humana, la prueba tenía un anticuerpo específico para la ghrelina total y no requería la presencia del grupo octanoil en la serina 3. La sensibilidad fue de 100pg/ml en una muestra de 100μl, con unos límites de 100-10.000pg/ml. La especificidad del análisis fue del 100% para ghrelina humana, ghrelina 14-28 y desacilghrelina. Los coeficientes de variación intraanalítica e interanalítica fueron del 5,6 y el 16%, respectivamente.
Las concentraciones plasmáticas de IL-18 se determinaron por enzimoinmunoanálisis (ELISA; Medical & Biological Laboratories Co. Ltd., Japón). La sensibilidad de la prueba fue de 12,5pg/ml. Los coeficientes de variación intraanalítica e interanalítica fueron del 10,8 y el 10,7%, respectivamente.
Análisis estadísticoSe utilizaron los paquetes estadísticos SPSS (SPSS para Windows versión 12, SPSS Inc., Chicago, Illinois, Estados Unidos) para el análisis de los datos. Las estadísticas descriptivas se presentan como media ± desviación estándar para las variables con distribución normal, y las variables que no seguían una distribución normal se expresan como mediana [percentil 75]. La prueba de la t de Student se utilizó para comparar variables con distribución normal y la de Mann-Whitney para las variables sin distribución normal. Las relaciones entre variables se analizaron mediante las correlaciones de Spearman o de Pearson en función de la normalidad de distribución de las variables. Se realizó un análisis multivariable de regresión múltiple para identificar los factores independientes que afectaban a la DMO y estimar los predictores finales de su variabilidad. Se consideró estadísticamente significativo un valor de p < 0,05.
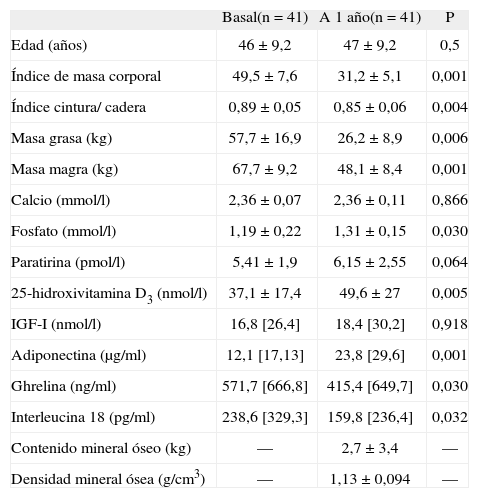
RESULTADOSLa tabla 1 muestra las características antropométricas, de composición corporal y bioquímicas de las pacientes estudiadas. Se estudió a un total de 41 pacientes con IMC inicial de 49,5 ± 7,6 y 46 ± 9 años de edad. El 42% de las participantes estudiadas eran menopáusicas. Al año de la cirugía se observó una pérdida de peso masiva (el 36,2% del peso inicial) y una pérdida del 54,4% de la masa grasa.
Características clínicas, antropométricas, de composición corporal, de metabolismo fosfocálcico, adipocitocinas, ghrelina y densidad mineral ósea en pacientes con obesidad mórbida antes y después del bypass gástrico
| Basal(n = 41) | A 1 año(n = 41) | P | |
| Edad (años) | 46 ± 9,2 | 47 ± 9,2 | 0,5 |
| Índice de masa corporal | 49,5 ± 7,6 | 31,2 ± 5,1 | 0,001 |
| Índice cintura/ cadera | 0,89 ± 0,05 | 0,85 ± 0,06 | 0,004 |
| Masa grasa (kg) | 57,7 ± 16,9 | 26,2 ± 8,9 | 0,006 |
| Masa magra (kg) | 67,7 ± 9,2 | 48,1 ± 8,4 | 0,001 |
| Calcio (mmol/l) | 2,36 ± 0,07 | 2,36 ± 0,11 | 0,866 |
| Fosfato (mmol/l) | 1,19 ± 0,22 | 1,31 ± 0,15 | 0,030 |
| Paratirina (pmol/l) | 5,41 ± 1,9 | 6,15 ± 2,55 | 0,064 |
| 25-hidroxivitamina D3 (nmol/l) | 37,1 ± 17,4 | 49,6 ± 27 | 0,005 |
| IGF-I (nmol/l) | 16,8 [26,4] | 18,4 [30,2] | 0,918 |
| Adiponectina (μg/ml) | 12,1 [17,13] | 23,8 [29,6] | 0,001 |
| Ghrelina (ng/ml) | 571,7 [666,8] | 415,4 [649,7] | 0,030 |
| Interleucina 18 (pg/ml) | 238,6 [329,3] | 159,8 [236,4] | 0,032 |
| Contenido mineral óseo (kg) | — | 2,7 ± 3,4 | — |
| Densidad mineral ósea (g/cm3) | — | 1,13 ± 0,094 | — |
IGF-I: factor de crecimiento insuliníco I.
Los datos expresan media ± desviación estándar o mediana [percentil 75].
Los cambios en las concentraciones plasmáticas de adiponectina, IL-18 y ghrelina se resumen en la tabla 1. La mejoría del perfil inflamatorio tras la cirugía bariátrica se vio en una reducción significativa en las concentraciones de IL-18 y un incremento de la adiponectina.
Al año de la cirugía, en el estudio univariable la adiponectina se correlacionó negativamente con el IMC (r = 0,241; p = 0,026). No se hallaron correlaciones entre las variables antropométricas y de composición corporal estudiadas con la ghrelina y la IL-18.
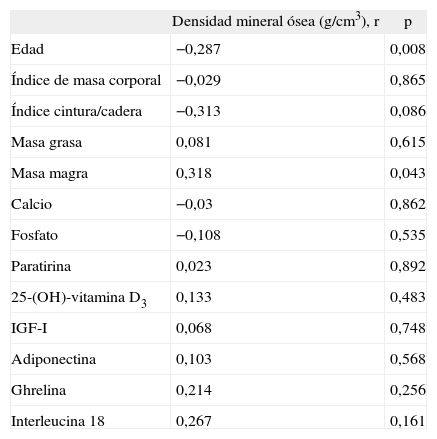
La DMO se correlacionó negativamente con la edad (r = -0,287; p = 0,008) y con la masa magra (r = 0,318; p = 0,043). No se hallaron correlaciones entre la DMO y las concentraciones de adiponectina, ghrelina e IL-18 (tabla 2).
Análisis univariable entre la densidad mineral ósea postoperatoria y parámetros antropométricos y bioquímicos, adipocitocinas y ghrelina
| Densidad mineral ósea (g/cm3), r | p | |
| Edad | −0,287 | 0,008 |
| Índice de masa corporal | −0,029 | 0,865 |
| Índice cintura/cadera | −0,313 | 0,086 |
| Masa grasa | 0,081 | 0,615 |
| Masa magra | 0,318 | 0,043 |
| Calcio | −0,03 | 0,862 |
| Fosfato | −0,108 | 0,535 |
| Paratirina | 0,023 | 0,892 |
| 25-(OH)-vitamina D3 | 0,133 | 0,483 |
| IGF-I | 0,068 | 0,748 |
| Adiponectina | 0,103 | 0,568 |
| Ghrelina | 0,214 | 0,256 |
| Interleucina 18 | 0,267 | 0,161 |
IGF-I: factor de crecimiento insulínico I.
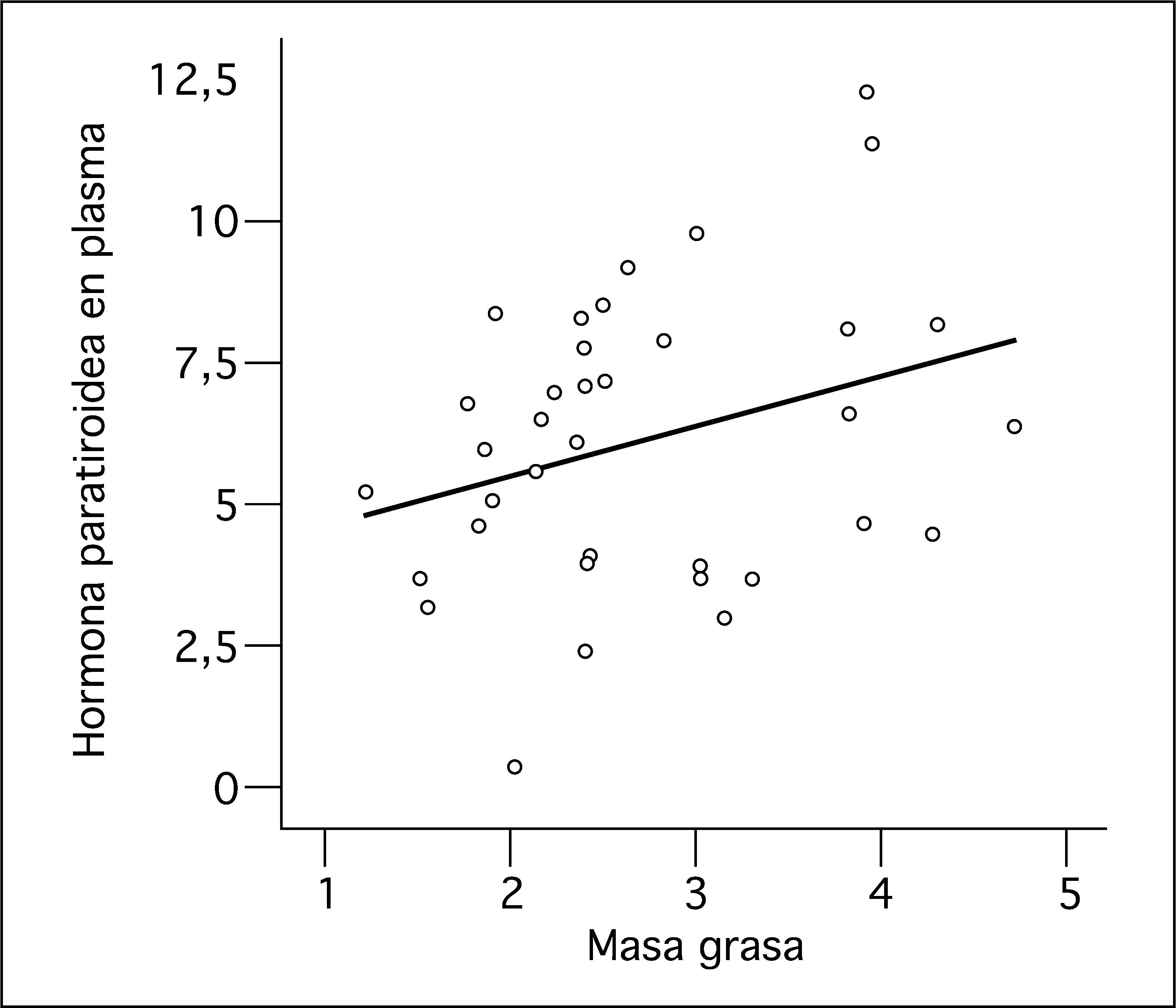
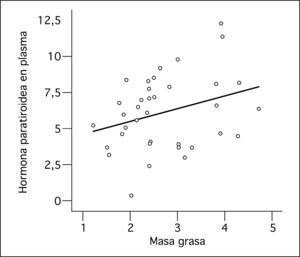
Las concentraciones de PTH se correlacionaron positivamente con el peso (r = 0,362; p = 0,030) y la masa grasa (r = 0,372; p = 0,039) (fig. 1) e inversamente con las concentraciones plasmáticas de calcio (r = -0,48; p = 0,003) y con las concentraciones de 25(OH)-vitamina D (r = -0,44; p = 0,014). El calcidiol plasmático se correlacionó negativamente con la suma de masa grasa y masa magra medida por DEXA (r = -0,210; p = 0,043). El IGF-I se correlacionó positivamente con el contenido mineral óseo (r = 0,502; p = 0,015).
No se hallaron diferencias significativas en el análisis univariable entre las mujeres con y sin menopausia.
Se realizó un análisis de regresión múltiple para estudiar los determinantes de la DMO introduciendo en el modelo las variables edad, IMC, masa no grasa, concentraciones de adiponectina, ghrelina e IL-18 y concentraciones de IGF-I, PTH y 25(OH)-vitamina D. La DMO se mantuvo asociada únicamente a la masa no grasa (β = 0,193; p = 0,016).
DISCUSIÓNLos mecanismos por los que la grasa corporal influye en la DMO no son bien conocidos, pero se ha señalado que tal influencia podría estar mediada por las hormonas y citocinas secretadas por los adipocitos8. En este sentido, la hormona antiinflamatoria adiponectina posee unas características que hacen plausible su implicación en la modulación del metabolismo óseo. La adiponectina es estructuralmente muy similar a Rank-L y osteoprotegerina, proteínas que regulan la osteoclastogénesis y son capaces de activar e inhibir el factor de transcripción NF-κB esencial para la producción de osteoclastos10,11. Existen pocos estudios que hayan analizado la asociación de adiponectina con la DMO en humanos, y los resultados obtenidos han sido contradictorios. Varios trabajos que incluyeron a pacientes diabéticos12,24 y mujeres premenopáusicas y posmenopáusicas13,25,26 han mostrado una correlación inversa entre adiponectina y DMO. Sin embargo, un estudio realizado en pacientes no diabéticos de origen coreano14 y otros en mujeres sanas perimenopáusicas15 y en varones de edad avanzada27 no detectaron ninguna correlación. Aunque la asociación entre adiponectina y DMO no fue significativa en nuestro estudio, serán necesarios más trabajos que examinen el efecto de la adiponectina en el metabolismo óseo, ante la diversidad de los resultados obtenidos. Un dato que destacar es que los estudios que han descrito una asociación positiva habían incluido a pacientes con diabetes mellitus y pacientes procedentes de Europa del este.
La diferenciación y la función de los osteoclastos están reguladas por señales celulares y citocinas que también tienen un papel importante en el sistema inmunitario. En este contexto, la IL-18 —un miembro de la superfamilia de la IL-1— tiene un papel relevante en las respuestas inmunitarias innata y adaptativa y, por lo tanto, en los procesos inflamatorios28. Además, estudios in vitro han mostrado que puede modular la función de los osteoclastos tanto estimulándola como inhibiéndola17. Estudios realizados con ratones transgénicos han mostrado que el incremento de la expresión de IL-18 se asocia a un hueso cortical deformado y una disminución del recambio del hueso trabecular lumbar29. También se ha descrito un aumento de la expresión de IL-18 en células osteoblásticas de rata en respuesta a la PTH, lo que indica que esta citocina podría estar implicada en las acciones anabólicas de la PTH30. A pesar de todos los datos previos en ratones, nuestro trabajo es el primero en analizar la asociación de esta interleucina y el metabolismo óseo en humanos. La ausencia de correlación hallada en nuestro estudio entre IL-18 y la DMO y con parámetros bioquímicos como la PTH cuestiona la implicación de esta citocina en la regulación del metabolismo óseo en humanos.
Parece que la ghrelina, además de sus acciones de estimular el apetito, promover la adipogénesis y disminuir el metabolismo energético, tiene una gran variedad de funciones en el cerebro y los tejidos periféricos31. El hecho que sus receptores estén en muchos órganos (estómago, corazón, pulmones, páncreas, intestino, riñones, testículos, ovarios, etc.), así como en el hipotálamo y en el tejido adiposo, respalda esta hipótesis. Su papel en el metabolismo óseo fue señalado inicialmente por los trabajos de Maccarinelli et al18, que mostraron un incremento de la proliferación de osteoblastos después de la administración de ghrelina in vitro. Posteriormente, estudios realizados en ratas mostraron que la administración de ghrelina estimulaba la formación ósea y aumentaba la DMO19. En humanos los resultados obtenidos han sido contradictorios. Si bien algunos autores han descrito que la ghrelina se asocia positivamente a la DMO en la columna lumbar y en las caderas de mujeres adolescentes sanas20, en otros trabajos que han estudiado amplias cohortes de varones y mujeres posmenopáusicas21 y a varones coreanos de mediana edad, no se hallaron correlaciones entre DMO y ghrelina14, en concordancia con nuestros resultados. Recientemente, se ha descrito una asociación inversa entre DMO en las caderas y ghrelina en una cohorte de mujeres menores de 51 años32. La diversidad de los resultados obtenidos podría explicarse por las diferencias de edad en las poblaciones estudiadas, puesto que los trabajos que encontraron algún tipo de asociación las hallaron en mujeres jóvenes.
Los sujetos con obesidad presentan concentraciones séricas de 25(OH)-vitamina D inferiores y de PTH superiores que en sujetos en normopeso33-37. Una de las causas indicadas es una menor biodisponibilidad de la vitamina D procedente de la dieta y de la piel por un mayor depósito de esta vitamina en el tejido adiposo38. La relación entre adiposidad y vitamina D ha sido objeto de varios estudios, y en su mayoría se ha encontrado una asociación inversa entre grasa corporal y concentraciones séricas de vitamina D39-41. De acuerdo con las publicaciones anteriores, en nuestro estudio la composición corporal total se correlaciona negativamente con la vitamina D y positivamente con las concentraciones de PTH.
Nuestros datos muestran que el determinante más importante de la DMO, tras ajustar por edad, grasa corporal, concentraciones plasmáticas de adiponectina, IL-18, ghrelina y vitamina D, fue la masa no grasa. En concordancia con nuestros resultados, estudios previos han descrito una relación más estrecha entre la masa no grasa —respecto a la masa grasa— y la DMO en ambos sexos42-45. Sin embargo, en situaciones clínicas como en la obesidad mórbida, se ha objetivado que las influencias en el hueso de la masa grasa y la no grasa son similares9.
Nuestro estudio no confirma que haya un efecto directo del tejido adiposo en el metabolismo óseo a través de la secreción de adiponectina. Del mismo modo, tampoco hemos mostrado relación entre la citocina inflamatoria IL-18 y la ghrelina con la DMO, lo que cuestiona su implicación en la regulación ósea. Serán necesarios más estudios en humanos para explicar el posible papel regulador de estas hormonas y citocinas en la homeostasis ósea.