Diferentes tipos de células producen óxido nítrico mediante la acción de la enzima óxido nítrico sintetasa (NOS). Existen cuatro isoformas de la enzima NOS, la neuronal, la endotelial, la mitocondrial y la inducible (iNOS). La producción de NO puede tener un papel importante en la patogenia de la inflamación y el daño de tejidos que no ha sido explorado adecuadamente en la enfermedad tiroidea autoinmunitaria.
ObjetivoEstudiar la expresión de iNOS, tanto en proteína como en el ARNm, en las enfermedades tiroideas autoinmunitarias.
Pacientes y métodoSe evaluó la expresión de iNOS en los tiroides de 10 pacientes con enfermedad de Graves (EG), 5 con tiroiditis de Hashimoto (TH) y 10 controles sanos, mediante inmunohistoquímica y transcripción inversa-reacción en cadena de la polimerasa (RT-PCR).
ResultadosSe encontró un incremento en la expresión de iNOS en la glándula tiroides de pacientes con EG y con TH tanto por PCR como mediante inmunohistoquímica. Esta expresión fue mayor en pacientes con EG. Por el contrario, en la glándula tiroides de sujetos sanos no se observó expresión de iNOS. La expresión de iNOS, tanto en EG como en TH, se detectó en células foliculares tiroideas, principalmente en las próximas al infiltrado inflamatorio. Asimismo, se observó expresión de iNOS en células endoteliales y células mononucleares del infiltrado inflamatorio en EG y TH.
ConclusionesLa expresión prominente de iNOS en la enfermedad tiroidea autoinmunitaria indica que el NO puede tener un papel importante en la patogenia del fenómeno inflamatorio y el daño del tejido que ocurre en esta afección.
Nitric oxide is synthesized by different cell types through the action of the enzyme nitric oxide synthase (NOS). There are four isoforms of this enzyme: the neuronal, the endothelial, the mitochondrial, and the inducible (iNOS) forms. Although NO production may play an important role in the pathogenesis of inflammation and tissue damage, its possible role in autoimmune thyroiditis has not been adequately explored.
ObjectiveTo study protein and mRNA expression of iNOS in human autoimmune thyroid disorders (AITD).
Patients and methodWe evaluated the expression of iNOS in thyroid gland specimens from 10 patients with Graves’ disease (GD), from five patients with Hashimoto's thyroiditis (HT) and from 10 controls by immunohistochemical and reverse transcription-polymerase chain reaction (RT-PCR).
ResultsBoth immunohistochemistry and PCR techniques showed up-regulated expression of iNOS in the thyroid glands of patients with GD and HT. iNOS expression was higher in GD than in HT. In contrast, no iNOS expression was detected in normal thyroid tissue. In both GD and HT, iNOS was detected in thyrocytes, mainly in those localized in areas close to the inflammatory cell infiltrate. In addition, upregulated expression of iNOS was observed in endothelial cells and thyroidinfiltrating mononuclear cells in both GD and HT.
ConclusionsThe enhanced expression of iNOS in autoimmune thyroiditis suggests that NO synthesis may play an important role in the inflammatory phenomena and tissue damage observed in this disease.
Las enfermedades tiroideas autoinmunitarias (ETAI) son un grupo de entidades nosológicas que incluyen, principalmente, la tiroiditis de Hashimoto (TH) y la enfermedad de Graves (EG). Mientras que la TH se caracteriza por un infiltrado inflamatorio constituido principalmente por células mononucleares y destrucción de los folículos tiroideos1, la EG está mediada principalmente por autoanticuerpos dirigidos contra el receptor de la tirotropina (TSH) y se acompaña de hiperplasia de las células tiroideas, con un infiltrado inflamatorio variable2. Aunque la fisiopatología de las ETAI no se ha definido aún por completo, hay múltiples evidencias de que diferentes subpoblaciones de linfocitos y macrófagos tienen un papel clave en ella debido a la síntesis de citocinas3-5. Asimismo, parece que las células foliculares tiroideas (CFT) también tienen un papel activo en estas enfermedades actuando no sólo como células presentadoras de antígeno, sino también como fuente de sustancias proinflamatorias que pueden ser importantes para la progresión del daño en la glándula tiroides6.
El óxido nítrico se sintetiza a partir de la L-arginina por la enzima NO sintetasa (NOS)7. La isoforma inducible de esta enzima (iNOS, también denominada NOS2) no requiere Ca2+ para su función y se expresa en diversos tipos celulares, principalmente macrófagos y células endoteliales (CE). Por otra parte, las tres isoformas constitutivas son dependientes del Ca2+ y corresponden a la neuronal (nNOS o NOS1), la endotelial (eNOS o NOS3) y la mitocondrial (mtNOS o NOS4)8. Las isoformas constitutivas eNOS y nNOS producen pequeñas cantidades de NO, importante durante la homeostasis como agente neurotransmisor y como regulador de la vasodilatación y la permeabilidad vascular9. En contraste, iNOS permite que las células liberen grandes cantidades de NO en respuesta a citocinas como el interferón (IFN) gamma, el factor de necrosis tumoral (TNF) alfa y la interleucina (IL) 110. Este NO es capaz de mediar algunos de los efectos citotóxicos y citostáticos del sistema inmunitario. Aunque se ha descrito que la actividad citotóxica del NO por sí misma es débil, esta molécula es capaz de reaccionar con aniones superóxido producidos por macrófagos activados, lo cual genera peróxidos de nitritos, que a su vez causan daño al tejido11.
Varios estudios han demostrado la sobreexpresión de iNOS en enfermedades inflamatorias crónicas (p. ej., esclerosis múltiple, enfermedad inflamatoria intestinal, cirrosis primaria biliar, hepatitis autoinmunitaria)12-14, así como en diversos tumores (cáncer de ovario, mama, estómago y tiroides), en los que participa en procesos clave como la angiogénesis y la apoptosis15-17.
El presente trabajo tuvo el propósito de estudiar la expresión y la distribución tisular in situ de la enzima iNOS en muestras de tiroides de pacientes con TH y EG.
MATERIAL Y MÉTODOMuestrasSe obtuvieron muestras de glándula tiroides de 10 pacientes con TH y 5 con EG que fueron sometidos a tiroidectomía unilateral o total por razones médicas en el Hospital Universitario de La Princesa (Madrid, España). Como control se utilizó tejido tiroideo no afectado de glándulas con adenoma único tiroideo. La porción del tejido extraído por cirugía se recogió en solución salina y se congeló inmediatamente en medio OCT (Ames Co., Miles Laboratories, Elkhart, Indiana, Estados Unidos) enfriado por nitrógeno líquido, y se almacenó a −80°C. El diagnóstico de la enfermedad fue establecido mediante examen histopatológico y criterios clínicos. En todos los casos se obtuvo un consentimiento informado. El estudio fue aprobado por el Comité de Bioética del Hospital Universitario de La Princesa.
Se determinaron por métodos sistemáticos las concentraciones séricas de TSH y tiroxina no unida a proteína (T4L); además, se midieron los títulos de los autoanticuerpos antitiroglobulínicos, antiperoxidasa y antirreceptor de la TSH mediante la técnica de enzimoinmunoanálisis (ELISA) y radioinmunoanálisis (RIA).
Los anticuerpos monoclonales utilizados fueron antiiNOS (IgG2a; Transduction Laboratories, Lexington, Kentucky, Estados Unidos), que no es reactivo contra eNOS y nNOS, así como anticuerpos anti-factor VIII (Dako Cytomation, Dinamarca) y antitiroglobulínicos (Dako Cytomation, Dinamarca). Como control negativo se utilizó el sobrenadante de mieloma murino P3X63.
InmunohistoquímicaSe obtuvieron cortes congelados de las glándulas tiroides de 4μm de grosor en un criostato, que se fijaron en acetona y se tiñeron mediante el método de inmunoperoxidasa indirecta. Previamente, se bloquearon los receptores Fc con un suero anti-Fc humano producido en cabra y diluido 1/50 en tampón TBS durante 10min. Después, los cortes fueron incubados durante 1h con el anticuerpo monoclonal correspondiente a una concentración de 1μg/ml. Al cabo de este tiempo, se realizaron tres lavados con TBS y se incubaron con un anticuerpo antiinmunoglobulina de ratón marcado con biotina, seguido de estreptavidina-peroxidasa (Envision Dako Cytomation, Dinamarca), durante 30min, se lavaron las muestras con TBS y se expusieron a una solución de 3,3-diamino benzidina hasta aparición de color. Finalmente, las muestras fueron contrateñidas con hematoxilina y montadas por métodos sistemáticos.
El grado de expresión del antígeno estudiado se estimó mediante el método semicuantitativo descrito por Sinicrope et al18, basado en el porcentaje de células positivas para el marcador determinado. Los grados de expresión fueron los siguientes: 0, todas las células negativas; 1, menos del 25% de células positivas; 2, 25-50% de células positivas; 3, 51-75% de células positivas; 4, más del 75% de células positivas. La intensidad de expresión fue clasificada en cuatro categorías: 0, negativo; 1, débil; 2, moderado; 3, fuerte.
RT-PCREl ARN total de las glándulas tiroides de pacientes con EG y HT se aisló mediante el empleo del reactivo Ultraspec, de acuerdo con las instrucciones del fabricante (Bioctecx Laboratories Inc., Houston, Texas, Estados Unidos). Posteriormente, 2μg de ARN fueron sometidos a retrotranscripción con el empleo de la transcriptasa inversa del virus Moloney de leucemia murina M-MLV (Promega), en las siguientes condiciones: 70°C 5min; 4°C 5min; 25°C 10min; 37°C 90min y 94°C 5min. El ADNc producto de la reacción fue amplificado por PCR con el empleo de oligonucleótidos específicos para iNOS: 5'-TGCCAGATGGCAGCATCAGA-3' (forward) y 5'-ACTTCCTCCAGGATGTTGTA-3' (reverse) (Perkin-Elmer Corp.), obteniendo un producto de 370bp. Como control interno se utilizaron oligonucleótidos específicos para el gen de HPRT-3: 5'-AAAGCCGCTCGCAAGAGTGCG-3' (forward) y 5' -ACTTGCCTCCTGCAAAGCAC-3' (reverse) (Roche Applied Science). La amplificación para iNOS se realizó en las siguientes condiciones: 40 ciclos de PCR, con desnaturalización a 95°C 30s; alineamiento a 60°C 30s y extensión a 72°C 45s. Las reacciones de amplificación para HPRT-3 fueron: 30 ciclos de 95°C 30s; alineamiento a 60°C 30s, y extensión a 72°C 42s. Finalmente, los productos de PCR fueron separados en geles de agarosa al 2% y visualizados con bromuro de etidio. La semicuantificación fue realizada mediante densitometría con el empleo de un sistema de fotodocumentación (Kodak).
Análisis estadísticoLos datos se muestran como la media aritmética ± desviación estándar. La comparación estadística entre grupos fue realizada mediante las pruebas no paramétricas de Kruskal-Wallis con la corrección de Duna, empleando el programa SPSS versión 16.0. Se consideró significación si p ≤ 0,05.
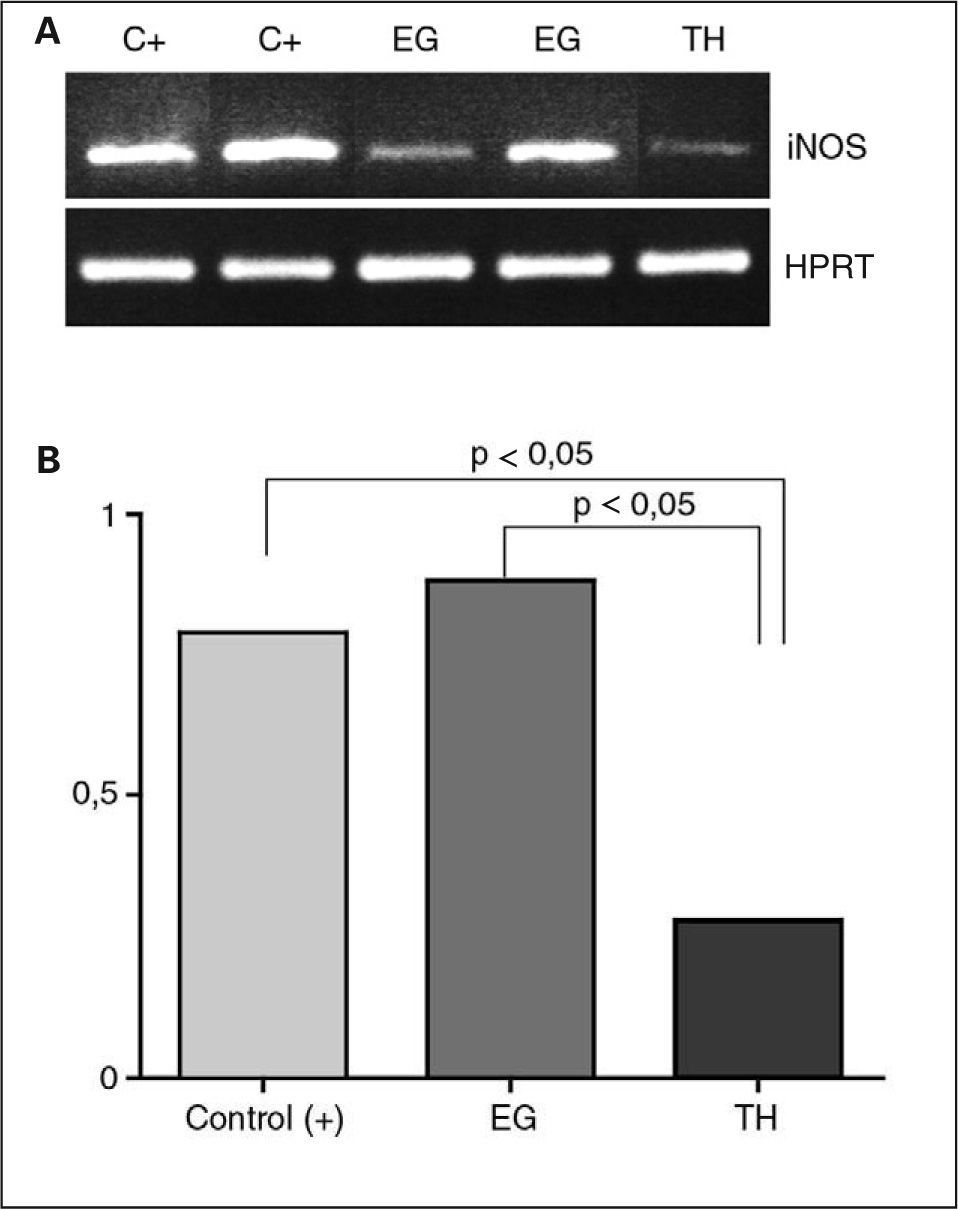
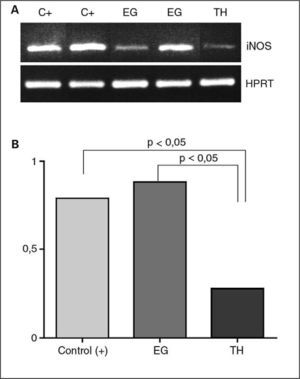
RESULTADOSRT-PCRSe encontraron concentraciones de ARNm de iNOS significativamente más altos en las muestras de tiroides procedentes de pacientes con ETAI. La expresión en muestras de pacientes con EG fue mayor que en las de TH (fig. 1A). Al analizar de forma individual la expresión del ARNm de iNOS y las características histopatológicas, se encontró una correlación significativa entre los primeros y se correlacionó tanto con el grado de hiperplasia de las CFT como con el grado de inflamación (p < 0,05 en ambos casos). En la figura 1B se muestra la expresión del ARNm de iNOS en las muestras estudiadas.
Expresión de iNOS en tejido tiroideo de muestras del tiroides de pacientes con tiroiditis de Hashimoto (TH) y enfermedad de Graves (EG) y controles positivos de hepatitis que expresan iNOS (C) mediante RT-PCR. Datos representativos de los tres grupos de tejido tiroideo. A: se observa máxima expresión de iNOS en el tiroides de pacientes con EG. B: densitometría del producto de la PCR de todas las muestras estudiadas, definida como densidad óptica referida al control interno (HPRT).
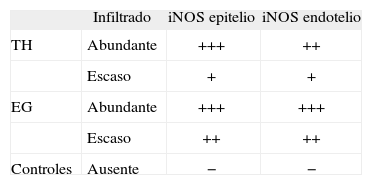
La tabla 1 muestra la relación entre el grado de inflamación del tiroides y la expresión de iNOS en pacientes con TH y EG.
Grado de expresión de la NO sintetasa inducible (iNOS) por inmunohistoquímica en las muestras de tiroides de pacientes con enfermedad tiroidea autoinmunitaria (ETAI)
| Infiltrado | iNOS epitelio | iNOS endotelio | |
| TH | Abundante | +++ | ++ |
| Escaso | + | + | |
| EG | Abundante | +++ | +++ |
| Escaso | ++ | ++ | |
| Controles | Ausente | − | − |
EG: enfermedad de Graves; TH: tiroiditis de Hashimoto. −: sin expresión de iNOS; +: débil expresión de iNOS; ++: moderada expresión de iNOS; +++: intensa expresión de iNOS.
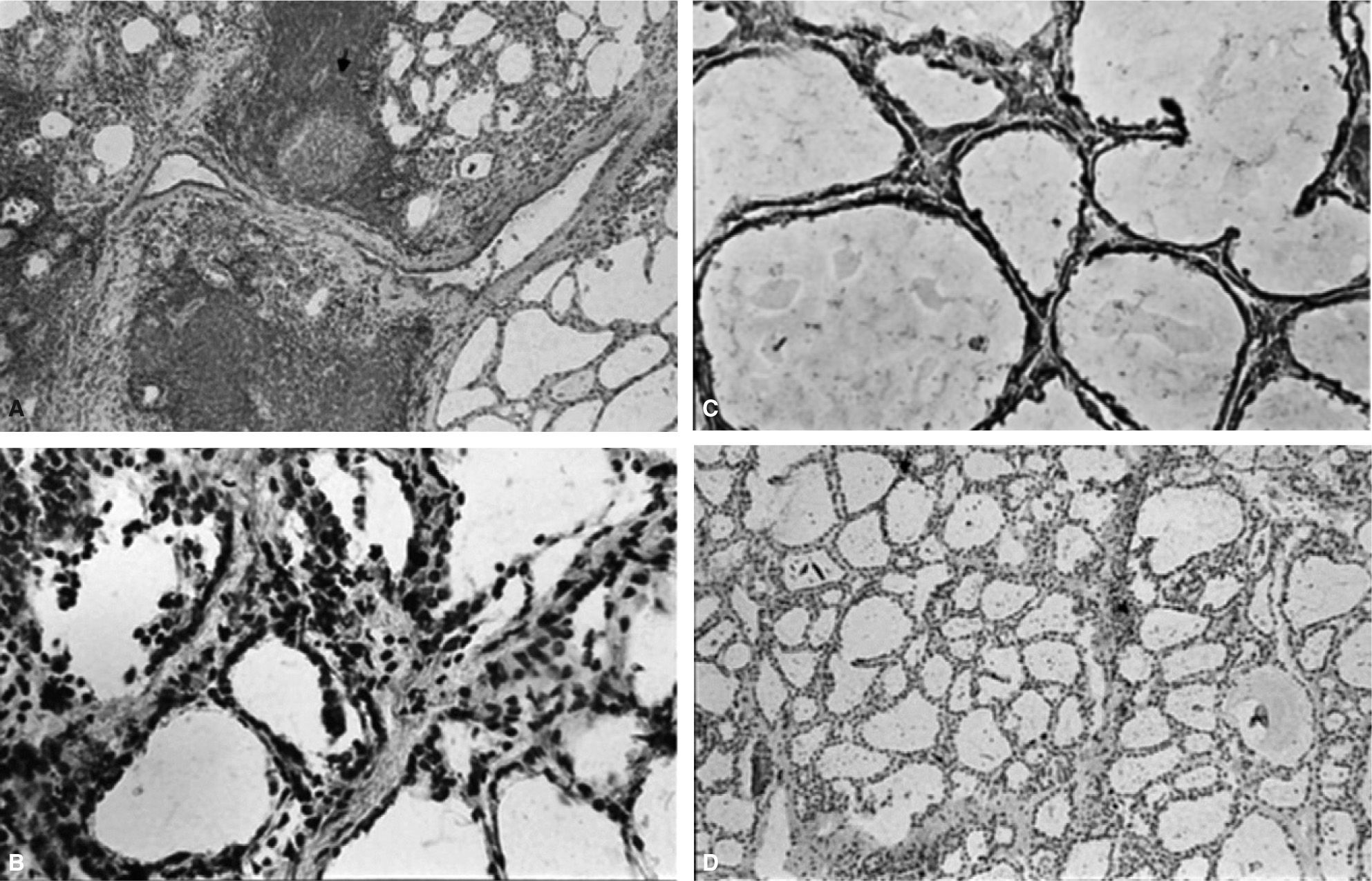
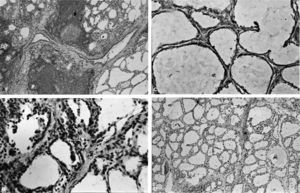
Se detectó la expresión de iNOS en CFT tanto en EG como en TH (fig. 2A y B). La expresión fue más intensa en las CFT hiperplásicas en glándulas de pacientes con EG (fig 2B). Además, la expresión de iNOS fue más prominente en las CFT que se encontraban en la proximidad del infiltrado inflamatorio (fig. 2D, flecha). Por el contrario, no se encontró inmunotinción para iNOS en las glándulas normales (fig. 2C).
Expresión de la iNOS en cortes de tiroides teñidos con inmunoperoxidasa en pacientes con tiroiditis de Hashimoto (TH), enfermedad de Graves (EG) y controles. A: marcada expresión de iNOS de novo en tirocitos de zonas adyacentes al infiltrado inflamatorio en un paciente con TH (flecha) (×250). B: expresión de iNOS en tirocitos en un caso de EG (flecha) (×500). C: en tejido tiroideo normal, no se observa inmunotinción para iNOS (×500). D: la doble marcación para iNOS y tiroglobulina demuestra la expresión de iNOS en tirocitos (flecha) en un paciente con EG (×500).
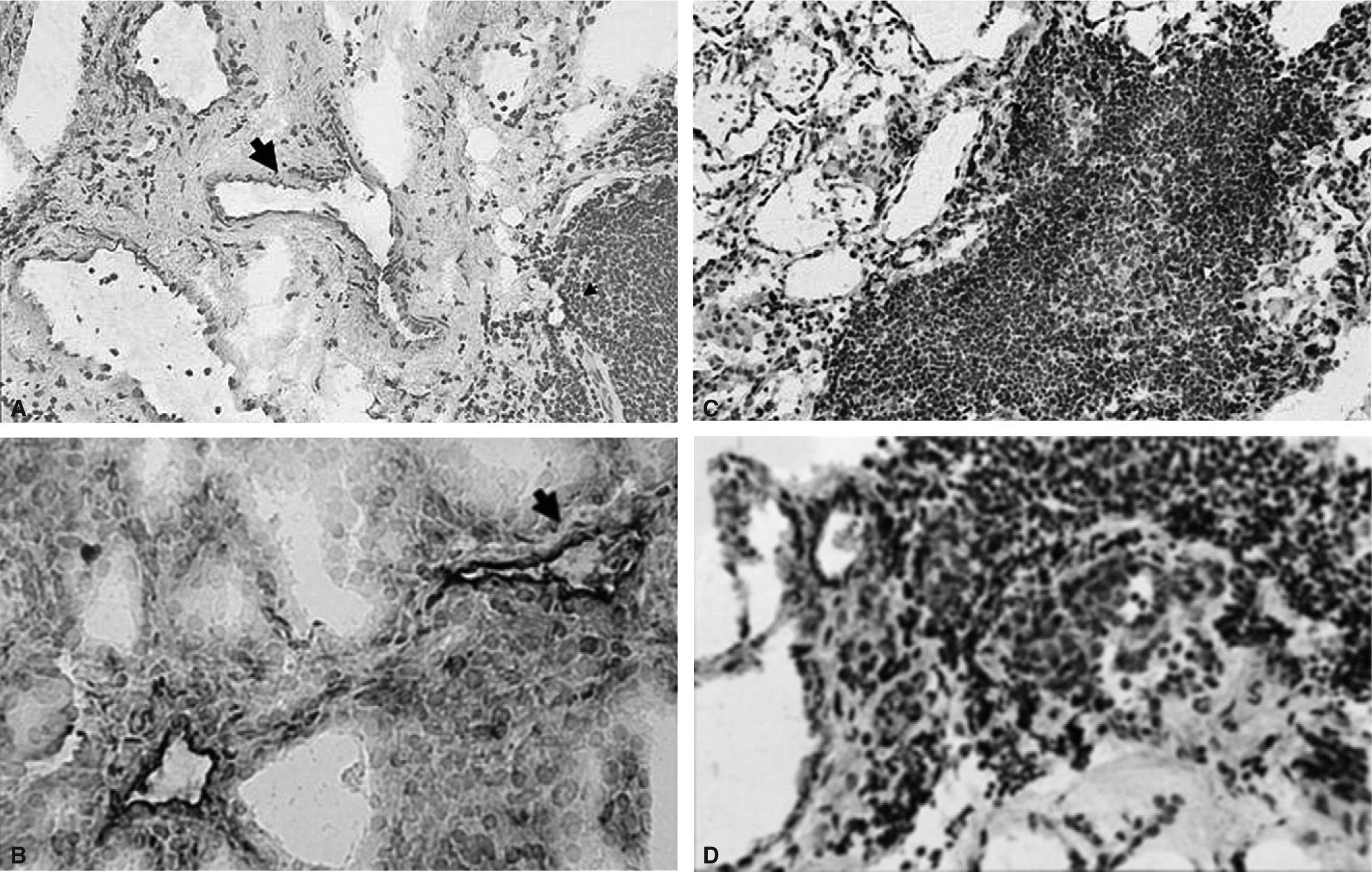
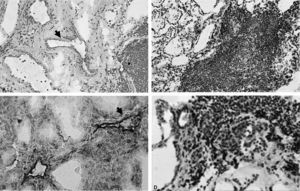
Asimismo, se detectó un aumento en la expresión de iNOS en las células endoteliales de tiroides de pacientes con ETAI, fundamentalmente de aquellos con EG (fig. 3A), en contraste con el escaso número de vasos con tinción positiva para iNOS en tiroides normal (datos no mostrados). Esta inmunotinción positiva fue más prominente en los vasos de mediano calibre y en menor proporción en las CE de las vénulas poscapilares. La expresión de iNOS por las CE se confirmó mediante tinción simultánea para el factor VIII, que es un conocido marcador de endotelio (fig. 3B). Otro hallazgo interesante fue la prominente expresión de iNOS en las células del infiltrado inflamatorio que se encontraban en la vecindad de los vasos sanguíneos que también mostraron una tinción positiva para esta enzima (fig. 3C y D).
Patrón de expresión de la iNOS en endotelio y células mononucleares intratiroideas. A: marcada expresión de iNOS en células endoteliales (CE) perifoliculares en un paciente con EG (flecha) (×50). B: la doble marcación para iNOS y factor VIII demuestra la expresión de iNOS en CE (flecha) (×500). C: células mononucleares positivas para iNOS en agregados linfoides en proximidad a CE positivas para iNOS en tiroides de pacientes con TH (×50). D: expresión de iNOS en el infiltrado inflamatorio de pacientes con enfermedad de Graves (EG) (×500).
En este trabajo exploramos la expresión de la enzima iNOS en tiroides procedentes de pacientes con ETAI, y observamos una expresión de esta enzima en CFT de pacientes con TH y EG. Asimismo, se detectó iNOS tanto en el infiltrado inflamatorio como en el endotelio, y esta expresión fue también más evidente en glándulas de pacientes con ETAI que en tiroides normal. Es de interés mencionar que este aumento en la expresión de iNOS, más evidente en EG, se correlacionó tanto con el grado de inflamación como con el grado de hiperplasia de las CFT. Aunque se ha estudiado ya la expresión de iNOS en varias enfermedades tumorales benignas y malignas tiroideas, sólo un trabajo ha analizado la expresión de esta enzima en biopsias de pacientes con ETAI19. En ese trabajo se utilizaron exclusivamente técnicas inmunohistoquímicas y no se encontraron diferencias claras entre las diversas enfermedades estudiadas.
El aumento de expresión de iNOS, más marcado en EG, podría estar relacionado con la hiperplasia/hipertrofia de la glándula característico de esta enfermedad. Ello podría estar mediado por el fenómeno de angiogénesis, ya que se ha descrito que el NO induce vasodilatación, incremento en la permeabilidad vascular, proliferación de CE y su migración. Además, también se ha informado de que el NO tiene un papel crítico en la movilización de células progenitoras endoteliales de la médula ósea, todo lo cual está relacionado con la neoformación de vasos sanguíneos, fenómeno necesario para la hiperplasia glandular. A lo anterior contribuirían tanto la iNOS sintetizada por las CFT como la expresada por el infiltrado inflamatorio, en los casos en que éste es prominente. A este respecto, se ha descrito que las CFT son efectivamente capaces de producir NO20. Por otra parte, en el caso de la TH, la expresión de iNOS y la síntesis de NO podrían estar relacionadas más bien con el fenómeno inflamatorio y las destrucción del tejido glandular. Se ha observado un aumento de la expresión de esta enzima en distintas enfermedades inflamatorias crónicas, como la artritis reumatoide21, la colitis ulcerosa22 o la infección por Helicobacter pylori23. En el caso de las ETAI, la expresión aumentada de iNOS podría ser secundaria a un aumento de las concentraciones de determinados elementos en el microambiente tiroideo24. Así, se sabe que varias citocinas, principalmente IFNγ y TNFα, incrementan la expresión de iNOS y que la producción de estas citocinas proinflamatorias ocurre en la ETAI, principalmente en la TH25. Lo respalda el hallazgo de mayor expresión de iNOS en las zonas próximas al infiltrado inflamatorio, sitio en que se conseguiría la máxima concentración de IFNγ26. Además, se ha descrito que las CFT son capaces de producir citocinas proinflamatorias y que estas células en cultivo in vitro producen tanto IL-1 como TNFα. Es evidente que esta producción de citocinas por las CFT podría contribuir en forma significativa a la síntesis de iNOS y la perpetuación del fenómeno inflamatorio27.
Es interesante que hayamos encontrado una correlación positiva y significativa entre el aumento en la expresión intratiroidea de iNOS y la gravedad del daño tisular del tiroides, lo que además indica que el NO también podría contribuir a la patogenia de las ETAI, tanto por su efecto en el fenómeno inflamatorio como por la generación de metabolitos tóxicos, como los peroxinitritos28. En estas condiciones, la formación de peroxinitritos representaría el evento final de una interacción entre varios tipos celulares como los macrófagos, que son fuente de citocinas como IL-1 y TNFα, las células T activadas, como fuente de IFNγ, y las CFT y CE, todos ellos contribuyendo a la síntesis de iNOS y la producción de NO. En este sentido, se ha observado en determinados modelos experimentales de otras enfermedades autoinmunitarias con animales que los inhibidores de NOS pueden prevenir la enfermedad, así como conseguir reducción o retraso en su progresión29.
En resumen, nuestros datos sobre la prominente expresión de iNOS en ETAI indican que el NO podría contribuir a la hiperplasia de la glándula en la EG y al fenómeno inflamatorio y la destrucción del tejido en la TH. Estos hallazgos son importantes para comprender más adecuadamente la patogenia de la ETAI y pueden tener implicaciones terapéuticas.
Becas del Fondo de Investigación Sanitaria (04/2257, 07/1119) y de la Fundación de la Mutua Madrileña.