Determinar la frecuencia del síndrome metabólico (SM) y de resistencia a la insulina (RI) en familiares de primer grado de personas con diabetes tipo 1 (FPG1) y su relación con algunas características clínicas, bioquímicas e inmunológicas.
Sujetos y métodosSe estudiaron 289 sujetos: 193 niños y adolescentes y 96 adultos. Se les determinó peso, talla, perímetros de cintura y cadera, presión arterial, glucemia, insulina, colesterol, triglicéridos, colesterol ligado a lipoproteínas de alta densidad y autoanticuerpos antidescarboxilasa del ácido glutámico (AGAD) y antitirosina fosfatasa, así como la RI mediante el índice de RI. Se aplicó la definición de SM según los criterios de la Organización Mundial de la Salud para los adultos y la del Consenso Cubano para niños y adolescentes.
ResultadosEn los FPG1 niños y adolescentes la frecuencia de SM fue del 5,7% (11/193) y la de RI fue del 24,9% (48/193). En los FPG1 adultos, la frecuencia de SM fue del 6,2% (6/96) y la de RI fue del 14,6% (14/96). Es interesante notar que en los niños y adolescentes FPG1 no existió asociación entre la RI y la presencia del SM, mientras que sí se asoció en los adultos. La RI fue más frecuente en niños y adolescentes que en adultos (p<0,05). La presencia de AGAD está asociada con la RI pero no con el SM (p<0,05).
ConclusionesLa frecuencia de SM en niños y adolescentes FPG1 es similar a la encontrada en población general en estudios que han utilizado definiciones semejantes. En cambio, en los adultos la frecuencia de SM es inferior a la reportada en Cuba para familiares de primer grado de personas con diabetes tipo 2. La RI en los FPG1 no está únicamente asociada al SM. La asociación de la RI con la presencia de los AGAD quizás refleja el hecho de que la hiperactividad de las células β incrementa la expresión de los autoantígenos.
To determine the frequency of metabolic syndrome (MS) and insulin resistance (IR) in first-degree relatives of type 1 diabetic patients (FDR1) and to study the relationship between these two disorders and some clinical, biochemical and immunological characteristics.
Subjects and methodsWe studied 289 persons, of which 193 were children/adolescents and 96 were adults. Weight, height, waist and hip circumference, blood pressure, blood glucose, insulin, cholesterol, triglycerides, high-density lipoprotein-cholesterol, glutamic acid decarboxylase autoantibodies (GADA) and tyrosine phosphatase autoantibodies were determined. IR was assessed through the insulin resistance index (HOMA-IR). The criteria of the World Health Organization for adults and the Cuban consensus for children and adolescents were used to define MS.
ResultsThe prevalence of MS in child and adolescent FDR1 was 5.7% (11/193) while IR was found in 24.9% (48/193). For adult FDR1, the frequency of MS was 6.2% (6/96) and that of IR was 14.6% (14/96). Interestingly, an association was found between IR and MS in adults but not in children and adolescents. IR was more frequent in children and adolescents than in adults (p<0.05). The presence of GADA was associated with IR but not with MS (p<0.05).
ConclusionsThe frequency of MS in child and adolescent FDR1 was similar to that found in the general population according to studies using similar definitions of MS. In contrast, the frequency of MS in adults was lower than that reported in Cuba for the first-degree relatives of patients with type 2 diabetes. IR was not only associated with MS in first-degree relatives. The association of IR with the presence of GADA may reflect the fact that β cell hyperactivity increases autoantigen expression.
La diabetes mellitus tipo 1 (DM1) es una enfermedad autoinmune organoespecífica, en la cual la deficiencia de insulina es el resultado de la destrucción de las células β de los islotes pancreáticos, mediada por una respuesta inmunológica contra estas células a consecuencia de la interacción entre la susceptibilidad genética y diversos factores ambientales1,2. Previo a la presentación de los síntomas y signos de la enfermedad, acontece una fase preclínica caracterizada por la presencia de autoanticuerpos contra las células β, los cuales son comúnmente utilizados como marcadores preclínicos de la enfermedad3–5.
En contraste con lo que ocurre en la diabetes mellitus tipo 2 (DM2), el deterioro de la acción de la insulina o resistencia a la insulina (RI) no había sido involucrado como un elemento de importancia en la patogénesis de la DM1. Sin embargo, la RI ha mostrado ser un factor de riesgo para su progresión5. Recientemente, se ha encontrado que la RI presente en familiares de primer grado de personas con diabetes tipo 1 (FPG1) precede al desarrollo de DM15.
El síndrome metabólico (SM) se ha definido como la asociación de varios factores de riesgo de enfermedad cardiovascular arteriosclerótica y de DM27,8. Este concepto fue unificado por Reaven en 1988, quien observó que algunos factores de riesgo, como dislipidemia, hipertensión e hiperglucemia, solían aparecer comúnmente agrupados, y denominó a esta asociación «síndrome X». Reaven postuló, además, que la RI y la hiperinsulinemia compensadora desempeñaban un papel primordial en su fisiopatología9. Posteriormente, otras organizaciones y asociaciones (Organización Mundial de la Salud [OMS], el European Group for Study of Insulin Resistance, la Asociación Americana de Endocrinólogos Clínicos, el National Colesterol Education Program [NCEP]–Adult Treatment Panel III [ATP III] y la Federación Internacional de Diabetes) han aportado experiencias para la definición del SM10,11.
Aunque son cada vez más numerosas las publicaciones que hablan de la presencia del SM durante la infancia, hasta la fecha no existe una definición unificada que evalúe esta entidad en niños y adolescentes. La mayoría de los estudios utiliza modificaciones de las definiciones del SM propuestas por el NCEP-ATPIII12–15 y la OMS15. En Cuba, durante el Primer Consenso Cubano sobre dislipoproteinemias, que tuvo lugar en noviembre de 2005, se establecieron los criterios para el diagnóstico del SM en niños y adolescentes a partir de modificaciones de la definición propuesta por el NCEP-ATPIII16, que tiene la ventaja de utilizar las tablas cubanas de índice de masa corporal (IMC), índice cintura-cadera (ICC) y presión arterial (PA) para la edad pediátrica.
Basado en la presencia del SM en los adultos con DM117,18 y en la carencia de estudios orientados a la búsqueda de este en los FPG1, así como en la ausencia de investigaciones que relacionen la RI con la presencia del SM en esta entidad, nos planteamos los siguientes problemas de investigación: ¿cuán frecuente es el SM y/o la RI en los FPG1?, ¿podría relacionarse el SM y la RI con la presencia de autoanticuerpos asociados a DM1 en estos sujetos?
El propósito del presente estudio fue determinar la frecuencia del SM y de la RI en los FPG1 y su relación con algunas características clínicas, bioquímicas e inmunológicas.
Sujetos y métodosSe realizó un estudio descriptivo transversal que incluyó a 289 FPG1 (no diabéticos) registrados en el proyecto cubano de predicción y prevención de la DM13, con edades comprendidas entre 2–65 años.
De los 289 FPG1, 193 eran niños y adolescentes (el 66,8%, con edades entre 2–19 años, incluyendo esta última) y 96 eran adultos (el 33,2%, con edad superior a 19 años). De los 193 niños y adolescentes, 105 eran del sexo femenino y 88 eran del sexo masculino, 146 presentaban color de piel blanca y la edad promedio fue de 10,2±5,2 años (media±desviación estándar). De los 96 adultos estudiados, 58 eran del sexo femenino y 38 eran del sexo masculino, 84 tenían color de piel blanca y la edad promedio fue de 35,49±11,06 años.
Todos los sujetos o sus progenitores, en el caso de los menores, dieron su consentimiento para participar en este estudio. El comité local de ética aprobó el protocolo de investigación.
Datos biográficosA todos los participantes se les realizó una encuesta previa donde se recogían por escrito las siguientes variables: edad, sexo, color de la piel, presencia de acantosis nigricans, historia familiar de primer grado de enfermedad cardiovascular, DM2, hipertensión arterial, dislipidemia y obesidad, antecedentes de otras enfermedades y consumo actual de medicamentos.
Parámetros antropométricosSe realizó a todos los sujetos una exploración física en la que se recogieron los siguientes parámetros antropométricos: peso, talla, perímetro de cintura (PC) y perímetro de cadera. Se calculó el IMC (calculado como talla en kg/altura en m2). La medida del PC se realizó con una cinta métrica flexible, con el sujeto colocado de pie, en espiración, tomando el punto medio entre el borde inferior de la última costilla y la cresta ilíaca a cada lado. En los casos de abdómenes péndulos, la medición se realizó en decúbito supino, en el punto más prominente del abdomen. El perímetro de cadera se tomó con el sujeto en posición de pie, con la cinta métrica flexible totalmente horizontal rodeando la máxima protrusión de los glúteos a nivel del trocánter mayor del fémur a cada lado, que en general coincide con la sínfisis pubiana. Se calculó el ICC (calculado como PC/perímetro de cadera).
Medición de la presión arterialSe realizó la medición de la PA tres veces en el brazo derecho con el paciente sentado, con intervalo de 5min, previo un reposo en silla durante 10min, utilizando un esfigmógrafo con manguito de tamaño adecuado para el diámetro del brazo. Se utilizó el valor promedio de las tres.
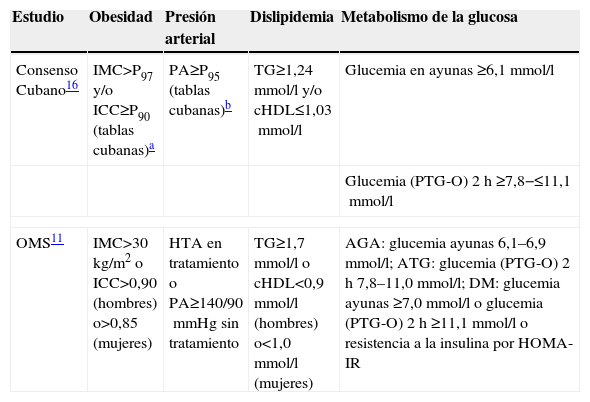
Definición de síndrome metabólicoLos sujetos fueron divididos en niños/adolescentes y adultos, y se determinó la presencia del SM utilizando las definiciones del Consenso Cubano16 y la OMS11, respectivamente. Los criterios diagnósticos se presentan en la tabla 1.
Síndrome metabólico. Definición y criterios
| Estudio | Obesidad | Presión arterial | Dislipidemia | Metabolismo de la glucosa |
| Consenso Cubano16 | IMC>P97 y/o ICC≥P90 (tablas cubanas)a | PA≥P95 (tablas cubanas)b | TG≥1,24mmol/l y/o cHDL≤1,03mmol/l | Glucemia en ayunas ≥6,1mmol/l |
| Glucemia (PTG-O) 2h ≥7,8−≤11,1mmol/l | ||||
| OMS11 | IMC>30kg/m2 o ICC>0,90 (hombres) o>0,85 (mujeres) | HTA en tratamiento o PA≥140/90mmHg sin tratamiento | TG≥1,7mmol/l o cHDL<0,9mmol/l (hombres) o<1,0mmol/l (mujeres) | AGA: glucemia ayunas 6,1–6,9mmol/l; ATG: glucemia (PTG-O) 2h 7,8–11,0mmol/l; DM: glucemia ayunas ≥7,0mmol/l o glucemia (PTG-O) 2h ≥11,1mmol/l o resistencia a la insulina por HOMA-IR |
AGA: alteración de la glucemia en ayunas; ATG: alteración de la tolerancia a la glucosa; cHDL: colesterol ligado a lipoproteínas de alta densidad; DM: diabetes mellitus; HOMA-IR: índice de resistencia a la insulina; HTA: hipertensión arterial; ICC: índice cintura/cadera; IMC: índice de masa corporal; OMS: Organización Mundial de la Salud; P: percentil; PA: presión arterial; PC: perímetro de cintura; PTG-O: prueba de tolerancia oral a la glucosa; TG: triglicéridos.
Consenso Cubano: deben cumplirse 3 o más criterios diagnósticos.
OMS: debe cumplirse el criterio glucosa/insulina y dos criterios diagnósticos más.
Las determinaciones de los análisis bioquímicos se realizaron a cada sujeto en el momento de obtención de la primera muestra de sangre (basal), luego de aproximadamente 8–12h de ayuno. Se midieron las concentraciones plasmáticas de glucosa, insulina y lípidos (colesterol, triglicéridos, colesterol ligado a lipoproteínas de alta densidad) en los FPG1. A todos los sujetos se les determinó glucemia e insulinemia en dos ocasiones separadas, basal y a los 5min. En el caso del cálculo del índice de RI (HOMA-IR) se promediaron los dos valores de glucemia e insulina basal y a los 5min. A todos los FPG1 se les determinó autoanticuerpos asociados a DM1 (autoanticuerpos antidescarboxilasa del ácido glutámico [AGAD] y antitirosina fosfatasa [AIA-2]).
Parámetros analíticosGlucosa en ayunas: la concentración de glucosa en ayunas se determinó por el método de glucosa oxidasa19.
Insulina en ayunas: la concentración de insulina en muestra de sangre venosa (plasma) se determinó por radioinmunoensayo20.
Índice de resistencia a la insulina: el índice de RI se determinó por el modelo homeostático de Mathews (HOMA-IR) (insulina en ayunas μU/ml×glucosa en ayunas mmol/l/22,5)21. La RI se definió según el valor del índice HOMA-IR. Ante la existencia de imprecisiones en los puntos de corte de insulinemia y HOMA-IR en los diferentes estudios sobre SM y RI en niños y adolescentes, y teniendo en cuenta que la mayoría de los autores utiliza puntos de corte obtenidos de cohortes propias (valores de HOMA-IR≥75 percentil)8, se estableció estadísticamente un valor de corte de índice HOMA-IR en 400 niños y adolescentes FPG1 según los grupos de edad que forman parte del estudio de predicción y prevención de la DM13. Se consideró RI tomando los valores de índice HOMA-IR iguales o mayores que el percentil 75 para cada grupo de edad. De acuerdo con este criterio, se asumió RI a partir de valores de HOMA-IR iguales o superiores a 1,14, 1,67, 2,53 y 2,52 para los grupos de edades (años) de 2–5; 5,1–10; 10,1–15 y 15,1–19, respectivamente; mientras que para los adultos se consideró todo valor de HOMA-IR igual o superior a 2,6422.
Lípidos: se midió colesterol total, triglicéridos y colesterol ligado a lipoproteínas de alta densidad basales mediante la utilización de métodos enzimáticos23.
Autoanticuerpos antidescarboxilasa del ácido glutámico: los anticuerpos contra la isoforma 65KD de la proteína descarboxilasa del ácido glutámico (GAD) se detectaron por la técnica de radioinmunoprecipitación, utilizando GAD65 humana recombinante marcada con 125I y proteína A-sefarosa para separar la GAD65 libre de la unida a los anticuerpos (anticuerpo-GAD65 marcada), empleando un juego de reactivos comercial (Schering S.A., CIS Bio International, Francia)24. En 200 sujetos normales sin historia familiar de diabetes se observó que el 99,5% presentaba una concentración de AGAD inferior a 1U/ml. Valores superiores a 1U/ml de AGAD fueron considerados como positivos.
Autoanticuerpos antitirosina fosfatasa: las determinaciones de los AIA-2 se realizaron por la técnica de radioinmunoprecipitación en fase fluida, utilizando IA-2 humana recombinante marcada con 125I y proteína A-sefarosa para separar la IA-2 libre de la unida a los anticuerpos (anticuerpo-IA-2 marcada) empleando un juego de reactivos comercial (Schering S.A., CIS Bio International, Francia)25. En 200 sujetos normales sin historia familiar de diabetes se observó que el 100% presentaba una concentración de AIA-2 inferior a 1U/ml. Valores superiores a 1U/ml de AIA-2 fueron considerados como positivos.
Análisis estadísticoPara los cálculos estadísticos se utilizó el programa SPSS versión 12.0. Se realizó un análisis descriptivo de la muestra de sujetos expresado con la media y la desviación estándar. En el análisis bivariado, para la comparación de subgrupos en cuanto a variables continuas, se utilizó la prueba t de Student para muestras independientes (en el caso de n>30 y distribución simétrica) y la prueba U de Mann-Whitney (en el caso contrario). En cuanto a las variables cualitativas o categóricas, se usó la prueba exacta de Fisher. Se consideró que las diferencias eran estadísticamente significativas para una p<0,05.
ResultadosCaracterísticas del síndrome metabólico y sus componentesLa frecuencia del SM según la definición del Consenso Cubano en los niños y adolescentes FPG1 fue del 5,7% (11/193), mientras que en los adultos se obtuvo una frecuencia del 6,2% (6/96) atendiendo a los criterios de la OMS (tablas 2 y 3).
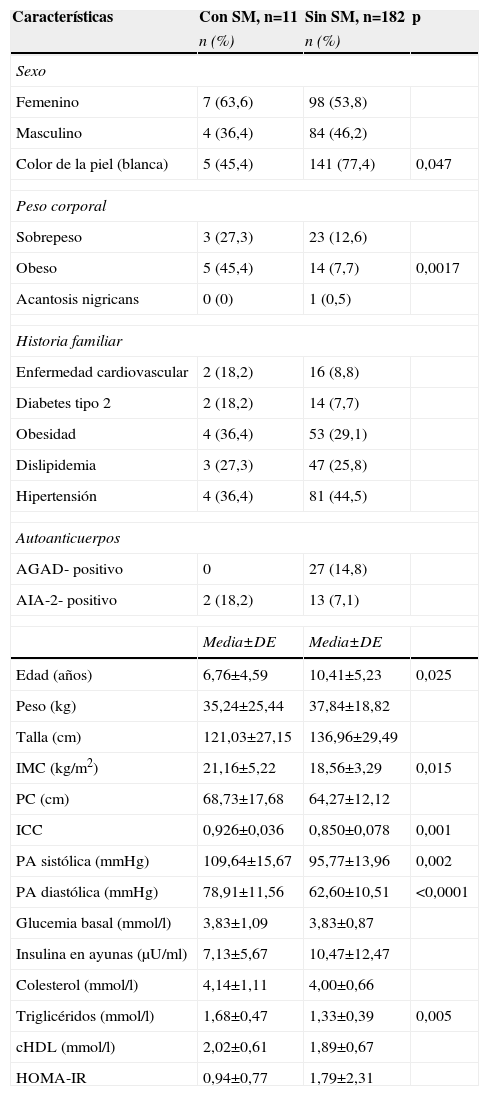
Comparación entre los niños y adolescentes familiares de primer grado de personas con diabetes tipo 1 con y sin síndrome metabólico según Consenso Cubano
| Características | Con SM, n=11 | Sin SM, n=182 | p |
| n (%) | n (%) | ||
| Sexo | |||
| Femenino | 7 (63,6) | 98 (53,8) | |
| Masculino | 4 (36,4) | 84 (46,2) | |
| Color de la piel (blanca) | 5 (45,4) | 141 (77,4) | 0,047 |
| Peso corporal | |||
| Sobrepeso | 3 (27,3) | 23 (12,6) | |
| Obeso | 5 (45,4) | 14 (7,7) | 0,0017 |
| Acantosis nigricans | 0 (0) | 1 (0,5) | |
| Historia familiar | |||
| Enfermedad cardiovascular | 2 (18,2) | 16 (8,8) | |
| Diabetes tipo 2 | 2 (18,2) | 14 (7,7) | |
| Obesidad | 4 (36,4) | 53 (29,1) | |
| Dislipidemia | 3 (27,3) | 47 (25,8) | |
| Hipertensión | 4 (36,4) | 81 (44,5) | |
| Autoanticuerpos | |||
| AGAD- positivo | 0 | 27 (14,8) | |
| AIA-2- positivo | 2 (18,2) | 13 (7,1) | |
| Media±DE | Media±DE | ||
| Edad (años) | 6,76±4,59 | 10,41±5,23 | 0,025 |
| Peso (kg) | 35,24±25,44 | 37,84±18,82 | |
| Talla (cm) | 121,03±27,15 | 136,96±29,49 | |
| IMC (kg/m2) | 21,16±5,22 | 18,56±3,29 | 0,015 |
| PC (cm) | 68,73±17,68 | 64,27±12,12 | |
| ICC | 0,926±0,036 | 0,850±0,078 | 0,001 |
| PA sistólica (mmHg) | 109,64±15,67 | 95,77±13,96 | 0,002 |
| PA diastólica (mmHg) | 78,91±11,56 | 62,60±10,51 | <0,0001 |
| Glucemia basal (mmol/l) | 3,83±1,09 | 3,83±0,87 | |
| Insulina en ayunas (μU/ml) | 7,13±5,67 | 10,47±12,47 | |
| Colesterol (mmol/l) | 4,14±1,11 | 4,00±0,66 | |
| Triglicéridos (mmol/l) | 1,68±0,47 | 1,33±0,39 | 0,005 |
| cHDL (mmol/l) | 2,02±0,61 | 1,89±0,67 | |
| HOMA-IR | 0,94±0,77 | 1,79±2,31 | |
AGAD: autoanticuerpos antidescarboxilasa del ácido glutámico; AIA-2: autoanticuerpos antitirosina fosfatasa; cHDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; FPG1: familiares de primer grado de personas con diabetes tipo 1; HOMA-IR: índice de resistencia a la insulina; ICC: índice cintura/cadera; IMC: índice de masa corporal; PA: presión arterial; PC: perímetro de cintura; SM: síndrome metabólico.
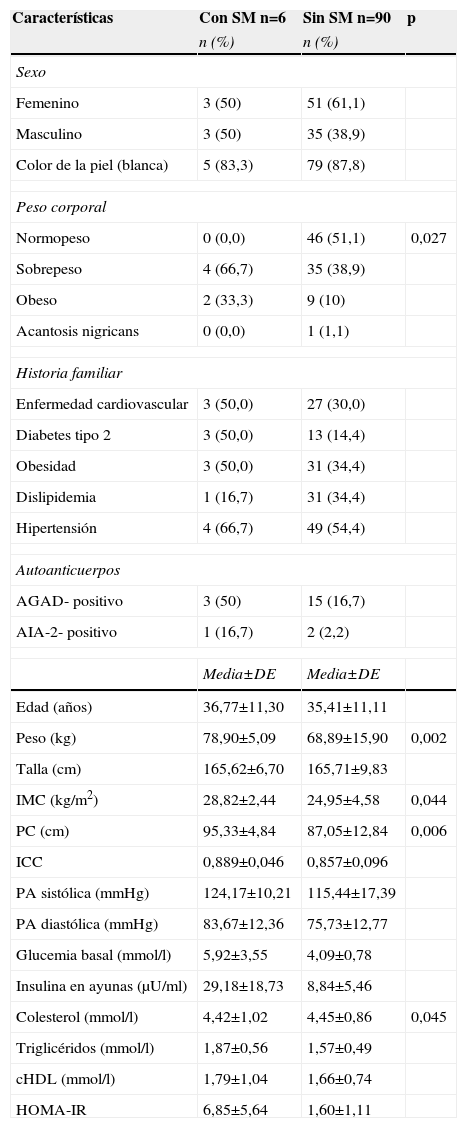
Comparación entre los adultos familiares de primer grado de personas con diabetes tipo 1 con y sin síndrome metabólico según la definición de la Organización Mundial de la Salud
| Características | Con SM n=6 | Sin SM n=90 | p |
| n (%) | n (%) | ||
| Sexo | |||
| Femenino | 3 (50) | 51 (61,1) | |
| Masculino | 3 (50) | 35 (38,9) | |
| Color de la piel (blanca) | 5 (83,3) | 79 (87,8) | |
| Peso corporal | |||
| Normopeso | 0 (0,0) | 46 (51,1) | 0,027 |
| Sobrepeso | 4 (66,7) | 35 (38,9) | |
| Obeso | 2 (33,3) | 9 (10) | |
| Acantosis nigricans | 0 (0,0) | 1 (1,1) | |
| Historia familiar | |||
| Enfermedad cardiovascular | 3 (50,0) | 27 (30,0) | |
| Diabetes tipo 2 | 3 (50,0) | 13 (14,4) | |
| Obesidad | 3 (50,0) | 31 (34,4) | |
| Dislipidemia | 1 (16,7) | 31 (34,4) | |
| Hipertensión | 4 (66,7) | 49 (54,4) | |
| Autoanticuerpos | |||
| AGAD- positivo | 3 (50) | 15 (16,7) | |
| AIA-2- positivo | 1 (16,7) | 2 (2,2) | |
| Media±DE | Media±DE | ||
| Edad (años) | 36,77±11,30 | 35,41±11,11 | |
| Peso (kg) | 78,90±5,09 | 68,89±15,90 | 0,002 |
| Talla (cm) | 165,62±6,70 | 165,71±9,83 | |
| IMC (kg/m2) | 28,82±2,44 | 24,95±4,58 | 0,044 |
| PC (cm) | 95,33±4,84 | 87,05±12,84 | 0,006 |
| ICC | 0,889±0,046 | 0,857±0,096 | |
| PA sistólica (mmHg) | 124,17±10,21 | 115,44±17,39 | |
| PA diastólica (mmHg) | 83,67±12,36 | 75,73±12,77 | |
| Glucemia basal (mmol/l) | 5,92±3,55 | 4,09±0,78 | |
| Insulina en ayunas (μU/ml) | 29,18±18,73 | 8,84±5,46 | |
| Colesterol (mmol/l) | 4,42±1,02 | 4,45±0,86 | 0,045 |
| Triglicéridos (mmol/l) | 1,87±0,56 | 1,57±0,49 | |
| cHDL (mmol/l) | 1,79±1,04 | 1,66±0,74 | |
| HOMA-IR | 6,85±5,64 | 1,60±1,11 | |
AGAD: autoanticuerpos antidescarboxilasa del ácido glutámico; AIA-2: autoanticuerpos antitirosina fosfatasa; cHDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; FPG1: familiares de primer grado de personas con diabetes tipo 1; HOMA-IR: índice de resistencia a la insulina; ICC: índice cintura/cadera; IMC: índice de masa corporal; PA: presión arterial; PC: perímetro de cintura; SM: síndrome metabólico.
En la tabla 2 se comparan los niños y adolescentes con y sin SM. Se encontraron diferencias significativas entre los grupos en cuanto al IMC, al ICC y a la PA. Las concentraciones plasmáticas de triglicéridos fueron superiores en los sujetos con SM, siendo, además, este grupo, de menor edad que los niños y adolescentes sin SM. La obesidad predominó en los sujetos con SM (45,4%) respecto a los sujetos sin SM (7,7%; p=0,0017). La frecuencia de SM en individuos obesos fue del 26,3%. Los niños y adolescentes con SM eran, en la mayoría, mestizos o negros (p=0,047). La historia familiar de enfermedad cardiovascular, DM2, obesidad, dislipidemia e hipertensión arterial no estuvo relacionada con la presencia del SM en los niños y adolescentes, así como tampoco la presencia de anticuerpos asociados a DM1 (AGAD y AIA-2) (tabla 2).
Al estimar la frecuencia de los componentes del SM en los niños y adolescentes FPG1 con y sin SM, la obesidad (el 90,9 vs. el 32,4%; p=0,0002), los triglicéridos elevados (el 90,9 vs. el 53,3%; p=0,0245) y la hipertensión arterial (el 100 vs. el 5,5; p<0,0001) fueron más frecuentes en los sujetos con SM que en los sujetos sin SM.
En la tabla 3 se comparan algunas de las características clínicas, bioquímicas e inmunológicas de los adultos con y sin SM. Los sujetos con SM mostraron valores superiores de peso, IMC, PC e insulina en ayunas. Se encontró diferencia significativa (p=0,027) en la distribución de los individuos con normopeso entre los dos grupos, predominando esta condición entre los adultos sin SM, mientras que todos los FPG1 con SM tenían sobrepeso u obesidad. La frecuencia del SM en los adultos FPG1 obesos fue del 18,2%. En los adultos FPG1, la historia familiar de enfermedad cardiovascular, DM2, obesidad, dislipidemia e hipertensión arterial no se asoció al SM según la definición de la OMS. La presencia de anticuerpos asociados a DM1 (AGAD y AIA-2) tampoco se relacionó con el diagnóstico del SM en estos sujetos (tabla 3).
Al compararse la frecuencia de los componentes del SM en los adultos FPG1 con y sin SM para la definición de la OMS, se observó que la obesidad (el 100 vs. el 43,3%; p=0,0088) y la hiperglucemia (el 33,3 vs. el 2,2%; p=0,0186) fueron los componentes que mostraron diferencias significativas entre los grupos, siendo más frecuentes en los sujetos con SM. El 23,6% de los niños y adolescentes sin SM para la definición del Consenso Cubano cumplía dos de los criterios diagnósticos de SM, mientras que el 37,8% de los adultos sin SM mostraba dos de los criterios de la clasificación de la OMS.
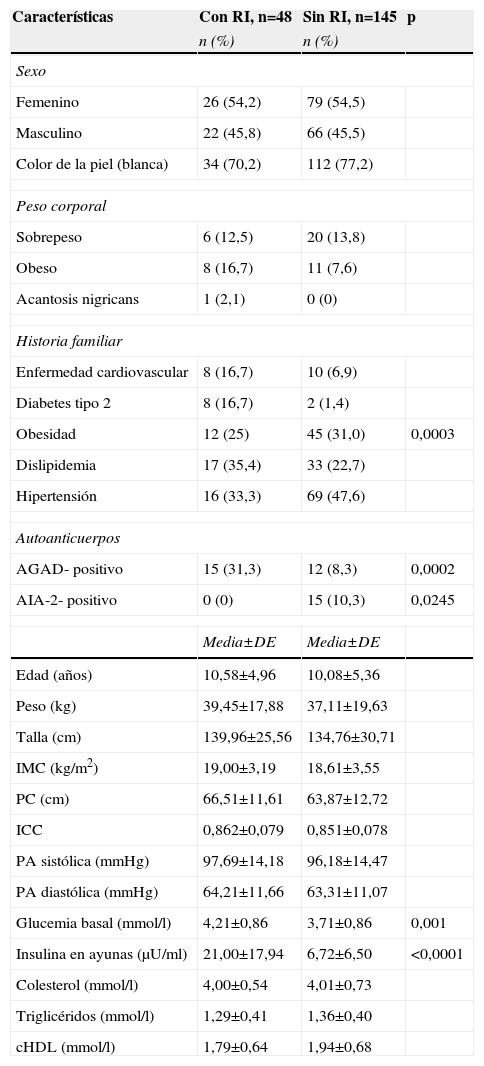
Resistencia a la insulinaLa frecuencia de RI en los niños y adolescentes fue del 24,9%. La tabla 4 presenta una comparación de las características clínicas, bioquímicas e inmunológicas de los niños y adolescentes FPG1 con y sin RI. Los individuos con RI tuvieron concentraciones superiores de glucemia y de insulina en ayunas. No se encontró asociación de los componentes clínicos ni bioquímicos del SM con la RI. La historia familiar de DM2 fue más frecuente en los niños y adolescentes FPG1 con RI (p=0,0003). La presencia de los AGAD (p=0,0002) se asoció con la RI; en cambio, los AIA-2 se relacionaron con la ausencia de RI (p=0,0245) (tabla 4).
Comparación entre los niños y adolescentes familiares de primer grado de personas con diabetes tipo 1 con y sin resistencia a la insulina
| Características | Con RI, n=48 | Sin RI, n=145 | p |
| n (%) | n (%) | ||
| Sexo | |||
| Femenino | 26 (54,2) | 79 (54,5) | |
| Masculino | 22 (45,8) | 66 (45,5) | |
| Color de la piel (blanca) | 34 (70,2) | 112 (77,2) | |
| Peso corporal | |||
| Sobrepeso | 6 (12,5) | 20 (13,8) | |
| Obeso | 8 (16,7) | 11 (7,6) | |
| Acantosis nigricans | 1 (2,1) | 0 (0) | |
| Historia familiar | |||
| Enfermedad cardiovascular | 8 (16,7) | 10 (6,9) | |
| Diabetes tipo 2 | 8 (16,7) | 2 (1,4) | |
| Obesidad | 12 (25) | 45 (31,0) | 0,0003 |
| Dislipidemia | 17 (35,4) | 33 (22,7) | |
| Hipertensión | 16 (33,3) | 69 (47,6) | |
| Autoanticuerpos | |||
| AGAD- positivo | 15 (31,3) | 12 (8,3) | 0,0002 |
| AIA-2- positivo | 0 (0) | 15 (10,3) | 0,0245 |
| Media±DE | Media±DE | ||
| Edad (años) | 10,58±4,96 | 10,08±5,36 | |
| Peso (kg) | 39,45±17,88 | 37,11±19,63 | |
| Talla (cm) | 139,96±25,56 | 134,76±30,71 | |
| IMC (kg/m2) | 19,00±3,19 | 18,61±3,55 | |
| PC (cm) | 66,51±11,61 | 63,87±12,72 | |
| ICC | 0,862±0,079 | 0,851±0,078 | |
| PA sistólica (mmHg) | 97,69±14,18 | 96,18±14,47 | |
| PA diastólica (mmHg) | 64,21±11,66 | 63,31±11,07 | |
| Glucemia basal (mmol/l) | 4,21±0,86 | 3,71±0,86 | 0,001 |
| Insulina en ayunas (μU/ml) | 21,00±17,94 | 6,72±6,50 | <0,0001 |
| Colesterol (mmol/l) | 4,00±0,54 | 4,01±0,73 | |
| Triglicéridos (mmol/l) | 1,29±0,41 | 1,36±0,40 | |
| cHDL (mmol/l) | 1,79±0,64 | 1,94±0,68 | |
AGAD: autoanticuerpos antidescarboxilasa del ácido glutámico; AIA-2: autoanticuerpos antitirosina fosfatasa; cHDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; FPG1: familiares de primer grado de personas con diabetes tipo 1; ICC: índice cintura/cadera; IMC: índice de masa corporal; PA: presión arterial; PC: perímetro de cintura; RI: resistencia a la insulina.
Al analizar la frecuencia de RI en los niños y adolescentes con y sin SM se encontró que los sujetos con RI se distribuían de manera similar en ambos grupos (el 18,2 vs. el 25,3%, respectivamente), al emplearse la definición del Consenso Cubano.
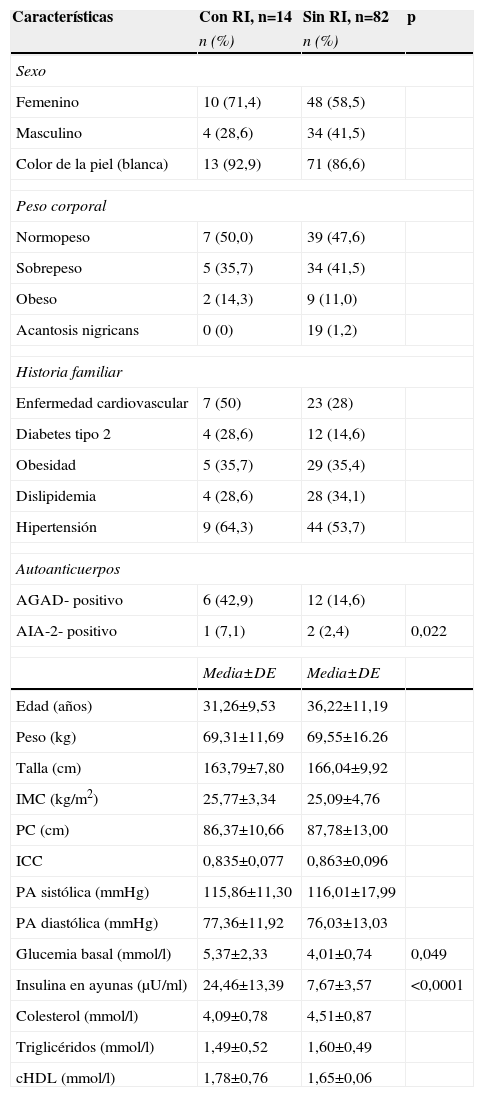
El 14,6% de los adultos mostró RI. La comparación de las características de los adultos FPG1 con y sin RI se muestra en la tabla 5. Los sujetos con RI tuvieron concentraciones superiores de glucemia e insulina en ayunas. La historia familiar de enfermedad cardiovascular, DM2, obesidad, dislipidemia e hipertensión arterial no estuvo relacionada con la presencia de RI. La presencia de los AGAD se asoció con la RI (p=0,022), no así los AIA-2 (tabla 5).
Comparación entre los adultos familiares de primer grado de personas con diabetes tipo 1 con y sin resistencia a la insulina
| Características | Con RI, n=14 | Sin RI, n=82 | p |
| n (%) | n (%) | ||
| Sexo | |||
| Femenino | 10 (71,4) | 48 (58,5) | |
| Masculino | 4 (28,6) | 34 (41,5) | |
| Color de la piel (blanca) | 13 (92,9) | 71 (86,6) | |
| Peso corporal | |||
| Normopeso | 7 (50,0) | 39 (47,6) | |
| Sobrepeso | 5 (35,7) | 34 (41,5) | |
| Obeso | 2 (14,3) | 9 (11,0) | |
| Acantosis nigricans | 0 (0) | 19 (1,2) | |
| Historia familiar | |||
| Enfermedad cardiovascular | 7 (50) | 23 (28) | |
| Diabetes tipo 2 | 4 (28,6) | 12 (14,6) | |
| Obesidad | 5 (35,7) | 29 (35,4) | |
| Dislipidemia | 4 (28,6) | 28 (34,1) | |
| Hipertensión | 9 (64,3) | 44 (53,7) | |
| Autoanticuerpos | |||
| AGAD- positivo | 6 (42,9) | 12 (14,6) | |
| AIA-2- positivo | 1 (7,1) | 2 (2,4) | 0,022 |
| Media±DE | Media±DE | ||
| Edad (años) | 31,26±9,53 | 36,22±11,19 | |
| Peso (kg) | 69,31±11,69 | 69,55±16.26 | |
| Talla (cm) | 163,79±7,80 | 166,04±9,92 | |
| IMC (kg/m2) | 25,77±3,34 | 25,09±4,76 | |
| PC (cm) | 86,37±10,66 | 87,78±13,00 | |
| ICC | 0,835±0,077 | 0,863±0,096 | |
| PA sistólica (mmHg) | 115,86±11,30 | 116,01±17,99 | |
| PA diastólica (mmHg) | 77,36±11,92 | 76,03±13,03 | |
| Glucemia basal (mmol/l) | 5,37±2,33 | 4,01±0,74 | 0,049 |
| Insulina en ayunas (μU/ml) | 24,46±13,39 | 7,67±3,57 | <0,0001 |
| Colesterol (mmol/l) | 4,09±0,78 | 4,51±0,87 | |
| Triglicéridos (mmol/l) | 1,49±0,52 | 1,60±0,49 | |
| cHDL (mmol/l) | 1,78±0,76 | 1,65±0,06 | |
AGAD: autoanticuerpos antidescarboxilasa del ácido glutámico; AIA-2: autoanticuerpos antitirosina fosfatasa; cHDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; FPG1: familiares de primer grado de personas con diabetes tipo 1; ICC: índice cintura/cadera; IMC: índice de masa corporal; PA: presión arterial; PC: perímetro de cintura; RI: resistencia a la insulina.
En los adultos FPG1 la frecuencia de RI fue mayor entre los sujetos con SM, para el 100% (6/6), respecto a aquellos sin SM (8,9%) (8/90) (p<0,0001); asimismo, fue superior a la encontrada en los niños y adolescentes con SM (el 18,2%; p=0,023).
La frecuencia de RI en los sujetos sin SM fue superior en los niños y adolescentes (25,3%) que en los adultos (8,9%) (p=0,0012). La proporción de niños y adolescentes FPG1 con RI, independientemente de la presencia o no de SM, fue superior a la encontrada en los adultos FPG1 (el 24,9 vs. el 14,6%; p=0,0487, respectivamente).
Analizando las frecuencias de RI exclusiva (18,7%) y de SM (5,9%) en todos los FPG1 encontramos que predomina la presencia de RI sobre la de SM, pese a que la RI es más evidente en niños y adolescentes que en adultos.
DiscusiónLa mayoría de los estudios que abordan el SM en población pediátrica estiman su frecuencia entre un 2,0–9,4%, según se utilicen las diferentes definiciones modificadas para niños y adolescentes15,26. Al comparar la frecuencia del SM en los niños y adolescentes FPG1 para la definición del Consenso Cubano (5,7%) con la encontrada por otros autores que han utilizado definiciones semejantes, observamos correspondencia en los resultados, al estimar estos una prevalencia del SM en la infancia del 4,0–9,4%13,14,26.
Encontramos mayor frecuencia del SM en los niños y adolescentes FPG1 mestizos o negros respecto a los blancos, resultado que no concuerda con lo reportado por Cook et al12, quienes hallaron una frecuencia de SM más baja en los sujetos negros. Como parte del estudio NAHNES III, De Ferranti et al13 reportaron que la prevalencia de SM en los niños y adolescentes blancos triplicó la de los niños de raza negra. Algunos autores han encontrado prevalencias similares entre sujetos de diferente origen étnico16,27. Consideramos que nuestros resultados se deben principalmente a que encontramos una mayor frecuencia de sobrepeso y obesidad en los niños y adolescentes mestizos y negros respecto a los blancos, lo que explicaría la mayor frecuencia del SM en este grupo.
Algunos estudios han planteado la importancia que tiene la genética en la presentación del SM e incluyen la historia familiar de obesidad y DM2 entre los factores de riesgo de esta entidad28. En nuestro estudio no encontramos relación entre la presencia del SM en los FPG1 y los antecedentes patológicos familiares de enfermedad cardiovascular, DM2, obesidad, dislipidemia o hipertensión arterial. Otros autores reportan similares resultados29,30.
A pesar de que la prevalencia del SM es mucho mayor en los adultos respecto a los niños y adolescentes8,16, entre los adultos FPG1 la frecuencia del SM por la definición de la OMS fue del 6,2% (6/96), solo ligeramente superior a la frecuencia que encontramos en los niños y adolescentes por la definición del Consenso Cubano. Al comparar la frecuencia en los adultos FPG1 con lo reportado por la mayoría de los estudios revisados, se observa que es inferior, pues se estima que alrededor del 20–50% de los adultos padecen SM según los criterios de la OMS7,31. En un estudio publicado por Calderín et al en Cuba en SM en familiares de primer grado de diabéticos tipo 2 (FPG2), en el que se utilizó la definición de la OMS, se detectó una frecuencia del SM del 42,9% (146/340), muy superior a la encontrada por nosotros en los FPG132. El hecho de que en los FPG1 la frecuencia del SM sea inferior a la encontrada en los FPG2 podría deberse a la menor presencia de genes asociados al SM, así como a una menor historia familiar de DM233 en relación con los FPG2, quienes tienen una fuerte carga genética e historia familiar de DM2.
La prevalencia del SM en adultos obesos es mayor y aumenta a medida que la obesidad es más grave7. En nuestro trabajo, todos los FPG1 con SM tenían sobrepeso o eran obesos, lo que confirma la relación entre el exceso del peso corporal y el SM.
El hecho de que entre los FPG1 adultos con SM los valores de insulina en ayunas fueran superiores respecto a aquellos sin SM, se corresponde con lo encontrado en los FPG232 y, en general, en la mayoría de los estudios basados en la definición de la OMS10,11, teniendo en cuenta que la OMS considera como criterio principal la RI, y que este parámetro está relacionado fisiopatológicamente con el resto de las alteraciones que definen el SM.
En este estudio, el 23,6% (43/182) de los niños y adolescentes sin SM cumplía dos de los criterios diagnósticos del SM. Esta cifra es inferior a las halladas por otros autores como Cook, Cruz y Tapia-Ceballos, quienes reportan que entre el 38–56% de sus poblaciones (sobrepeso y obesidad) presentaban al menos dos componentes8,12. Con el paso del tiempo y sin intervenciones de prevención, estos sujetos posiblemente acaben padeciendo el SM8,26. La persistencia de los componentes del SM en el tiempo ha sido demostrada por varios estudios26,34,35. El Cardiovascular Risk in Young Finns Study35 mostró la persistencia de estos componentes seis años después de su primera evaluación y el Bogalusa Heart Study34 reportó que el 60% de los niños clasificados como de alto riesgo, lo seguían siendo ocho años después.
El 37,8% (34/90) de los adultos FPG1 sin SM mostraba dos de los criterios enunciados por la clasificación de la OMS para el diagnóstico de SM. Igualmente, algunos estudios han demostrado la persistencia de los componentes del SM y su repercusión en la morbimortalidad a largo plazo26,34,35. Estos hallazgos apoyan la hipótesis que afirma que el desarrollo del SM es un proceso de larga evolución8,26.
Aunque la RI ha sido invocada como uno de los elementos primarios en la patogénesis del SM, es conocido que puede aparecer aisladamente en algunos sujetos, con independencia del resto de las alteraciones que definen el SM y la enfermedad cardiovascular14. En nuestro estudio, el 24,9% de los niños y adolescentes FPG1 presentó RI; sin embargo, esta condición no se asoció solamente al SM. La frecuencia de RI en sujetos sin SM (25,3%) fue similar a la de los FPG1 con SM (18,2%). La RI constituye un fenómeno que se presenta debido a diversas condiciones: por un lado, podría estar condicionada genéticamente y ser parte del proceso de autoinmunidad en etapas tempranas del desarrollo de la DM16 y, por otro lado, asociada a la adiposidad visceral y la obesidad que podría formar parte de la antesala de la DM2, como señala la hipótesis aceleradora36. Esto podría ser la explicación de no encontrar diferencias entre las frecuencias de RI en los niños y adolescentes FPG1 con o sin SM.
Lamentablemente no existen reportes que expongan el comportamiento del SM en los FPG1 con los que comparar nuestros resultados. En este estudio, se encontró asociación entre la historia familiar de DM2 y la presencia de RI en un 16,7% de los niños y adolescentes FPG1, lo cual podría estar relacionado con los datos encontrados por Collado et al, quienes reportaron una mayor frecuencia de antecedentes de DM2 en personas con DM1 en comparación con la población control33. Sin embargo, la mayoría de los niños y adolescentes FPG1 con RI no presentó estos antecedentes familiares, lo que indica que la RI forma parte del período inicial a la progresión de la DM16 y no siempre está relacionada con la historia familiar de DM28,9. En los adultos FPG1, la RI también está presente (14,6%). Todos los adultos con SM tenían RI, lo que puede explicarse teniendo en cuenta que la OMS considera la RI como un criterio indispensable en su definición11. Sin embargo, en los adultos sin SM igualmente estaba presente la RI, lo que demuestra que esta puede presentarse de manera independiente y no únicamente relacionada con el SM en los FPG16.
En los FPG1 se ha demostrado la aparición de RI antes del comienzo de los síntomas de diabetes, fundamentalmente en aquellos familiares positivos para autoanticuerpos contra las células de los islotes pancreáticos, los cuales mostraron una progresión más rápida a la DM16. El estudio European Nicotinamide Diabetes Intervention Trial también demostró que la RI es un acelerador del proceso autoinmune de destrucción de las células β y, consecuentemente, participa en el desarrollo de la DM1 en individuos susceptibles6. Por tal motivo, no es difícil prever que algunos niños y adolescentes con RI desarrollan DM1 en el transcurso de sus vidas, lo cual implica una reducción de la frecuencia de individuos susceptibles sanos adultos con RI. Esto podría justificar por qué la RI fuera más frecuente en niños y adolescentes que en adultos.
Uno de los resultados más importantes de nuestro trabajo fue la asociación encontrada entre la RI y la presencia de AGAD tanto en niños y adolescentes como en adultos FPG1. Se ha señalado que la enzima GAD podría ser uno de los primeros antígenos de la célula β implicados en la respuesta autoinmune que conduce a la DM137. Björk et al37 encontraron que la GAD65 se incrementa en los islotes cultivados a mayores concentraciones de glucosa, y sugirieron que una mayor actividad de las células β aumenta la expresión de la GAD65 en las células de los islotes pancreáticos. Es importante destacar que en este estudio los FPG1 con RI presentaban mayores concentraciones de glucosa que aquellos con ausencia de RI, y, por ende, los sujetos con RI fueron más propensos a presentar los AGAD debido hipotéticamente a que presentaban una mayor actividad de las células β.
La hipótesis aceleradora36 plantea que la DM1 y la DM2 son parte de un mismo proceso y no entidades independientes. Desde el punto de vista fisiopatológico, argumenta que en la aparición de la diabetes coinciden tres elementos fundamentales denominados «aceleradores»: el primero, la predisposición constitucional de algunos individuos, genéticamente determinada, para desarrollar la apoptosis acelerada de las células β; el segundo, la RI asociada frecuentemente a la adiposidad visceral, que sería la causante de incrementar o acelerar la destrucción apoptótica, y el tercero, el desarrollo de una respuesta autoinmune dirigida contra las células β de los islotes pancreáticos en individuos genéticamente predispuestos. Esta hipótesis también señala que la RI es medular en el desarrollo de DM16,36.
Nuestros resultados y los elementos anteriormente expuestos confirman la asociación de la RI con la presencia de los autoanticuerpos asociados a la DM1 (en nuestro caso AGAD) y en la progresión a la DM1, de la misma manera que, asociada al SM, forma parte de la antesala de la DM2, lo que refuerza lo planteado por la hipótesis aceleradora6,9,36. Como los FPG1 comparten genes de susceptibilidad de DM12,6, es probable que la presencia de AGAD esté asociada con la RI como parte de la progresión a la enfermedad6 y no con el SM que se relaciona con un proceso etiopatogénico diferente mediado por la adiposidad, que precede el desarrollo de DM2.
Mientras se encontró asociación entre la presencia de AGAD y la RI en los niños y adolescentes FPG1, los AIA-2 se asociaron a la ausencia de esta. Este resultado podría explicarse teniendo en cuenta que los AIA-2 suelen aparecer tardíamente durante el proceso de destrucción de las células β, en momentos en que la RI ya no está establecida y predomina una importante deficiencia de la secreción de insulina por existir una reducción de la masa de células β, previo al comienzo de la DM11,25.
En conclusión, los resultados del presente estudio indican que la frecuencia de SM en niños y adolescentes FPG1 es similar a la encontrada en población general en estudios que han utilizado definiciones semejantes13,14,26. En cambio, en los adultos la frecuencia de SM es inferior a la reportada en Cuba para FPG232. La RI en los FPG1 no está únicamente asociada al SM. La asociación de la RI con la presencia de los AGAD quizás refleja el hecho de que la hiperactividad de las células β incrementa la expresión de los autoantígenos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores desean expresar su agradecimiento por la asistencia brindada en la ejecución de esta investigación a Gisela Molina, Marisol Hernández, Aydeé Valverde, Darwin Reyes y al Departamento de Bioquímica del Instituto Nacional de Endocrinología.