Las alteraciones en el metabolismo del agua y en la regulación de la vasopresina (AVP) u hormona antidiurética (ADH) son complicaciones frecuentes de la cirugía hipofisaria. La escasez de estudios que comparen diversas estrategias de tratamiento y monitorización de estos trastornos, así como la falta de guías clínicas previas, hace difícil hacer recomendaciones siguiendo la metodología basada en grados de evidencia. Este trabajo revisa la fisiopatología de la diabetes insípida y la secreción inadecuada de ADH en el postoperatorio de la cirugía hipofisaria, y pretende servir de guía en su diagnóstico, diagnóstico diferencial, tratamiento y monitorización.
Changes in water metabolism and regulation of vasopressin (AVP) or antidiuretic hormone (ADH) are common complications of pituitary surgery. The scarcity of studies comparing different treatment and monitoring strategies for these disorders and the lack of prior clinical guidelines makes it difficult to provide recommendations following a methodology based on grades of evidence. This study reviews the pathophysiology of diabetes insipidus and inappropriate ADH secretion after pituitary surgery, and is intended to serve as a guide for their diagnosis, differential diagnosis, treatment, and monitoring.
La hormona antidiurética (ADH) o vasopresina (AVP) es un nonapéptido sintetizado en los núcleos supraóptico y paraventricular. Después de su almacenamiento como una preprohormona en gránulos intracitoplasmáticos es transportada a lo largo de los axones en la eminencia media hasta la neurohipófisis, donde se transforma en la hormona nativa. Una vez liberada junto a la neurofisina ii se une a receptores específicos V2 localizados en la porción basal de las células del túbulo colector. La interacción da lugar al desplazamiento a la membrana apical de la acuaporina 2 preformada en el citoplasma y a la reabsorción pasiva de agua.
La AVP se halla regulada principalmente por la osmolalidad plasmática (Osmp) y el volumen circulante efectivo. El sodio es el catión predominante en el compartimento extracelular, y por tanto el principal determinante de la osmolalidad plasmática. Pequeños cambios en la concentración de sodio en el suero modifican la secreción de AVP.
Los osmorreceptores hipotalámicos mantienen la Osmp en un rango entre 280 y 290 mOsm/kg al modificar la secreción de AVP, que se halla máximamente inhibida por debajo de 280 mOs/kg; por encima de 290 mOsm/kg se estimula la secreción de AVP al máximo, así como los osmorreceptores de la sed1.
Esta guía revisa la fisiopatología y el manejo clínico de los trastornos del metabolismo del agua que aparecen en el postoperatorio de la cirugía hipofisaria. No existen guías clínicas previas sobre el manejo de los trastornos hidroelectrolíticos en el postoperatorio de la cirugía hipofisaria, ni tampoco se dispone de estudios que comparen diversas estrategias de tratamiento y monitorización. Por dicho motivo, en esta guía no se usa la metodología basada en grados de evidencia, sino que se hace una revisión actualizada del tema con sugerencias de actuación integrando las diversas fuentes consultadas.
Diabetes insipida en el postoperatorio de la cirugía hipofisariaLa diabetes insípida (DI) se produce como consecuencia de una disminución o ausencia de AVP. Se caracteriza por polidipsia y poliuria con emisión de orina diluida o hipotónica. Si la excreción de agua llega a superar el aporte se produce elevación de la natremia y de la Osmp, y en situaciones extremas puede originar hipovolemia e hipotensión.
Durante la cirugía hipofisaria se puede afectar alguno de los niveles de producción y/o liberación de la AVP (hipotálamo, tallo hipofisario o neurohipófisis) y producir DI.
EpidemiologíaLa DI transitoria es una complicación perioperatoria de la cirugía hipofisaria muy frecuente, aunque su incidencia depende del grado de sospecha clínica y de los criterios diagnósticos empleados. Hensen et al. observaron la presencia de poliuria en el postoperatorio inmediato en el 31% de 1.571 pacientes intervenidos de adenoma hipofisario2 y Nemergut et al. en el 18,3% de 881 pacientes operados de diversas lesiones selares3. En un estudio prospectivo controlado realizado en 57 pacientes intervenidos de adenoma hipofisario presentaron DI aislada el 38% y combinada (DI seguida de hiponatremia) el 15,7%4. La DI persistente, sin embargo, es poco frecuente (0,25 y 2%)2,3.
Factores que parecen incrementar el riesgo de su aparición son:
- -
Edad joven2.
- -
Sexo masculino2.
- -
Tamaño tumoral: más frecuente en masas intraselares de gran tamaño2 y en macroadenomas5.
- -
Fístula de líquido cefalorraquídeo intraoperatoria3,5.
- -
Tipo histológico: quistes de la bolsa de Rathke3 y craneofaringiomas3,5. También adenomas productores de ACTH2,3, aunque esto no se ha confirmado en otras series5.
Suele aparecer a las 24-48h de la cirugía y resolverse durante los 10 días siguientes4. Se produce por disfunción transitoria de las neuronas productoras de AVP como consecuencia del traumatismo ocasionado por la manipulación quirúrgica o por reducción del aporte sanguíneo al tallo y la hipófisis posterior. Se resuelve cuando dichas neuronas recuperan su función normal6,7.
Diabetes insípida permanenteSe produce únicamente cuando más del 80-90% de las neuronas hipotalámicas productoras de AVP degeneran7. Esta degeneración es más probable cuanto más alta es la lesión del tallo2,6,7.
Patrón trifásicoEs relativamente infrecuente (1,1% de los pacientes operados)2. Se caracteriza por 3 fases consecutivas: DI de 5-7 días de duración, seguida de una segunda fase de duración variable (2-14 días) de antidiuresis inapropiada (SIADH) debida a liberación incontrolada de AVP desde las terminaciones nerviosas degeneradas en la hipófisis posterior, con tendencia a la hiponatremia e hipoosmolalidad6. La tercera fase consiste en la reaparición de DI, que con frecuencia es permanente8,9, una vez que los depósitos de AVP se han agotado y el número de neuronas capaces de sintetizarla es insuficiente.
Patrón bifásicoLa aparición exclusiva de las 2 primeras fases es más frecuente que el patrón trifásico (3,4% en el estudio de Hensen et al. y 15,7% en el estudio prospectivo de Kristof et al.2,4.
Secreción inadecuada de la hormona antidiurética aisladaSin que se preceda o continúe de DI.
ClínicaEs típica la aparición brusca de poliuria y polidipsia. Clásicamente se describe un ansia por beber agua fría. Si no se reponen los líquidos adecuadamente por vía oral o parenteral puede aparecer depleción de volumen e hiperosmolalidad y ello conducir al desarrollo de sintomatología neurológica: irritabilidad, letargia, confusión y coma10.
DiagnósticoEl diagnóstico de DI en el postoperatorio de la cirugía hipofisaria debe considerarse ante una diuresis elevada, generalmente>40-50ml/kg de peso/día en adultos (normalmente 3-3,5 l/día) o >100ml/kg/día en niños, y típicamente >2,5ml/kg/h de una orina hipotónica. Un volumen de orina superior a 200-300ml por hora durante 2-3h consecutivas es un indicador razonable para sospechar el diagnóstico6. Dado que la mayoría de los pacientes en el postoperatorio se mantienen despiertos, conservan intactos los mecanismos de la sed y tienen acceso a la ingesta de líquidos, el desarrollo de depleción de volumen, hipernatremia e hiperosmolalidad manifiesta es relativamente infrecuente, aunque puede observarse en niños, ancianos, o en pacientes con alteración del nivel de conciencia o a los que se restringe la ingesta de líquidos.
Los datos de laboratorio deben demostrar la presencia de poliuria hipotónica: osmolalidad urinaria (Osmu)<100mOsm/kg (o una densidad específica<1.005) o inapropiadamente baja en relación con la plasmática. La hiperosmolalidad y la hipernatremia apoyan el diagnóstico.
Un cuadro clínico sugestivo con una relación Osmp/u compatible es suficiente para efectuar el diagnóstico. Solo ocasionalmente se precisa una restricción hídrica de unas pocas horas y mucho más raramente una prueba de restricción hídrica prolongada para confirmar el diagnóstico. La prueba de suero salino hipertónico no se realiza salvo en el contexto de estudios clínicos7 (tabla 1).
Diagnóstico de la DI en el postoperatorio de la cirugía hipofisaria
| Signos y síntomas |
| Poliuria, polidipsia, sed, típicamente de aparición en las primeras 24-48h después de la cirugía |
| Diuresis generalmente de 4-18 l/día de orina diluida (>40-50ml/kg/24h; >2,5ml/kg/h o>250ml/h×2h consecutivas) |
| Hipovolemia significativa (rara en situación de alerta y con mecanismo de sed conservado) |
| Datos analíticos |
| Natremia normal o aumentada |
| Osmolalidad sérica normal o aumentada |
| Osmolalidad urinaria<100 o inferior a la plasmática |
Considerar si existe diabetes mellitus, tratamiento con diuréticos, acromegalia y distinguir de poliuria por mayor aporte de líquidos en el perioperatorio.
Modificada de Dumont et al.6.
La falta de la hiperintensidad típica de la neurohipófisis en la RM no es relevante en el contexto del postoperatorio de la cirugía hipofisaria.
La elevada frecuencia de la DI durante el postoperatorio obliga a realizar balances hídricos diarios, monitorizando la diuresis y el aporte hídrico (líquidos ingeridos, sueroterapia y el agua que vehiculiza la medicación). Asimismo, es recomendable el control de peso diario y preguntar por la presencia de sed. Analíticamente es aconsejable la determinación del ionograma sérico a las pocas horas (6-8h) de la cirugía y, posteriormente, cada día hasta el alta10. Si se constata poliuria hay que determinar la Osmp y Osmu. Si se confirma DI idealmente dichas determinaciones se deberían realizar 2 veces al día9 (tabla 2).
Monitorización de la DI en el postoperatorio de la cirugía hipofisaria
| Detección DI |
| Monitorización diaria del balance hídrico: diuresis y entrada de líquidos |
| Monitorizar diariamente la presencia de sed |
| Control diario de peso |
| Ionograma sérico diario hasta el alta |
| Si se constata poliuria: determinación de la osmolalidad plasmática y urinaria |
| Ante la sospecha de hiperglucemia monitorizar glucemia y glucosuria |
| DI confirmada |
| Monitorización estricta |
| Ionograma sérico 2 veces al día |
| Osmolalidad urinaria 2 veces al día |
La presencia de poliuria en el postoperatorio de la cirugía hipofisaria puede deberse a otras causas, además de la DI:
- -
Poliuria osmótica: debida a la presencia de glucosuria en pacientes con hiperglucemia, la Osmu puede resultar falsamente incrementada por la glucosuria, y la natremia estar artefactualmente más baja en presencia de hiperglucemia6.
- -
Excreción durante el postoperatorio de una administración excesiva de líquidos endovenosos durante el periodo perioperatorio: es muy frecuente. Típicamente la natremia es normal o baja y no hay aumento de la sed6. Un cuidadoso repaso del balance hídrico nos dará el diagnóstico.
- -
Acromegalia: se puede producir incremento de la diuresis tras la resección del adenoma8.
El objetivo del tratamiento es asegurar la restauración y/o mantenimiento de la homeostasis osmótica. Debe individualizarse para cada paciente y dependerá de la gravedad y de la duración de la DI.
En la mayoría de casos, leves y transitorios, no se necesita ningún tratamiento específico. Si el paciente está consciente y tiene la sensación de sed conservada la propia sed es la mejor guía de las necesidades de ingesta de agua, y únicamente es recomendable una monitorización más estricta.
Si el paciente es incapaz de reponer por vía oral las pérdidas urinarias, por intolerancia a la ingesta oral o inadecuada percepción de la sed, el balance hídrico se puede mantener mediante sueroterapia endovenosa. La deficiencia de agua en litros puede ser estimada con la siguiente fórmula matemática: 0,6×peso corporal (kg)× ([Na sérico÷140]–1). Se sugiere hacer una determinación de electrolitos en suero cada 6-8h para comprobar que el aporte de líquido es apropiado7.
El tratamiento farmacológico se reserva para aquellos casos en que la poliuria es excesiva e incomoda al paciente, sobre todo por las noches, o si aparece hipernatremia9. La desmopresina (DDAVP), un análogo de AVP que interacciona exclusivamente con los receptores V2 y por tanto sin acción presora, es el fármaco de elección. Su administración consigue una rápida reducción de la diuresis, con una duración de su efecto de 6-12h. Puede administrarse por vía subcutánea (dosis de 1-2μg), muy usada en el postoperatorio inmediato, intranasal (10μg) u oral (0,1mg)5. Rara vez se administra en perfusión intravenosa continua, salvo en niños7.
Dado que la DI posquirúrgica suele tener un curso breve, lo más frecuente es que, de usarse, sea necesaria una única dosis8,10. Mediante la monitorización de la diuresis, la natremia y la osmolalidad urinaria, se irá comprobando la corrección de la DI y ello permitirá decidir si es necesario administrar más dosis, si persiste la poliuria, y teniendo en cuenta que un exceso de tratamiento puede conducir a retención hídrica e hiponatremia y que la DI puede ir seguida de hiponatremia por SIADH9.
Es aconsejable que los pacientes dados de alta con desmopresina se monitoricen semanalmente durante 3-4 semanas, ajustando la dosis a demanda, según la gravedad de la DI. La retirada periódica del fármaco permite valorar si continúa siendo necesario8 (tabla 3).
Tratamiento de la DI en el postoperatorio de la cirugía hipofisaria
| Tratamiento farmacológico |
| Desmopresina subcutánea o endovenosa. Dosis inicial de 1-2μg |
| Repetir la dosis cuando la diuresis sea entre 200-250ml/h durante≥2h con osmolalidad<200 mOsm/kg o densidad urinaria<1.005 |
| Indicaciones: paciente incapaz de mantener ingesta oral de líquidos, diuresis superiores a las entradas de líquidos, hipernatremia |
| Mantenimiento del balance hídrico |
| Recomendar al paciente que beba según la sed que tenga |
| Si el paciente es incapaz de mantener una osmolalidad plasmática y una concentración sérica de sodio normal, suplementar con soluciones hipotónicas endovenosas (suero glucosado al 5%, seguido por suero glucosalino 0,45%) |
| Tratamiento sustitutivo del eje hipotálamo-hipofiso-suprarrenal |
| Administrar dosis de estrés de glucocorticoides (hidrocortisona 50-100mg endovenosa cada 8h), pasando paulatinamente a dosis de mantenimiento por vía oral (15-30mg/d). Se mantendrá esta dosis hasta que la función de la hipófisis anterior pueda ser completamente evaluada |
| Monitorización de la resolución de la DI transitoria |
| Comprobar la desaparición de la poliuria y la normalización de la osmolalidad plasmática y del ionograma sérico |
| Un balance hídrico positivo>2l sugiere antidiuresis inapropiada |
| En este caso, además de suspender la desmopresina, se debe restringir la ingesta hídrica para mantener el sodio sérico en valores normales. |
La aparición concomitantemente de DI con alteración de la sed puede suceder cuando la cirugía daña los osmorreceptores hipotalámicos que regulan la sed y la secreción de AVP. Es muy poco frecuente pero entraña grandes dificultades de manejo y elevada morbimortalidad. La causa tumoral más frecuente es el craneofaringioma.
En ocasiones los centros productores de AVP están íntegros (responden con liberación de AVP ante estímulo hipotensor inducido por fármacos) y la AVP se libera de forma continua en pequeñas cantidades independientemente de la natremia y la osmolalidad plasmática. Cuando la lesión hipotalámica es más extensa se pierde la sed y no hay secreción de AVP en respuesta a ningún estímulo, incrementándose el riesgo de deshidratación y de hipernatremia grave11.
Ante la falta o sensación inadecuada de sed el paciente se halla en riesgo de presentar deshidratación e hipernatremia. Por el contrario, la ingesta excesiva de líquidos cuando la AVP no se suprime, o durante el tratamiento con análogos de AVP, puede favorecer la intoxicación acuosa y la hiponatremia. Los pacientes oscilan entre estas 2 situaciones que, por otra parte, son clínicamente difíciles de diferenciar, ya que ambas pueden causar somnolencia, debilidad, irritabilidad, náuseas, vómitos, convulsiones y coma12,13. Con frecuencia, los pacientes se mantienen en una hipernatremia crónica moderada, bien tolerada, durante largos periodos. Con cierta frecuencia se presentan trombosis venosas, favorecidas por dicha hipernatremia crónica11.
También pueden presentar otros síntomas por afectación hipotalámica: obesidad, apnea del sueño, convulsiones y disfunción termorreguladora11.
La DI suele ser permanente, pero la alteración de la sed puede mejorar o inclusive desaparecer, generalmente en los primeros 9 meses tras la cirugía, e indica que los osmorreceptores de la sed, a diferencia de los centros productores de AVP, mantienen capacidad de recuperación. Transcurrido un año de la intervención la recuperación es excepcional14.
DiagnósticoEl diagnóstico de adipsia/hipodipsia se puede hacer simplemente observando que el paciente, en situación de hipernatremia o hiperosmolalidad, niega tener sed y/o no bebe espontáneamente o inclusive muestra aversión a los líquidos13. La sed puede estimarse de manera más objetiva mediante escalas visuales analógicas validadas15.
Para asegurar el diagnóstico o para categorizar el tipo y grado de afectación pueden realizarse diferentes puebas:
- -
Prueba con suero salino hipertónico (0,05ml/kg/min durante 2h o hasta alcanzar una Osmp de 300 mOsmol/kg) para determinar la liberación de AVP y la sed en respuesta a un incremento de la Osmp. Se realiza control de natremia, Osmp y AVP cada 30min, y natriuria y Osmu cada hora. Se registran también la tensión arterial y la sensación de sed mediante una escala analógica visual11,14.
- -
Prueba con sobrecarga de agua (30ml/kg de agua por vía oral durante 15min) para evaluar la supresión de la liberación de AVP a un estímulo hipotónico en las 4h siguientes13.
- -
Prueba de liberación de AVP a estímulo no osmótico mediante hipotensión farmacológica11,13.
El manejo de estos pacientes suele ser complicado y exige el adiestramiento y colaboración del paciente y de sus personas allegadas. Si se intenta corregir las situaciones de hiper o hiponatremia variando las dosis de DDAVP es fácil caer en cambios bruscos entre estas 2 situaciones. La estrategia más aceptada es la de mantener dosis fijas de DDAVP y establecer una ingesta obligada de líquidos de alrededor de 1,5 l, aumentándola o disminuyéndola según las variaciones diarias de peso11,13 (tabla 4). Hay que estar especialmente alerta en situaciones en las que se pueden incrementar las pérdidas insensibles: calor, enfermedades intercurrentes, etc.
Tratamiento de la DI con adipsia (basado en 11,13)
| Establecer un peso objetivo en que el paciente está euvolémico y normonatrémico |
| Fijar una diuresis de 24h en 1,5-2l y establecer una dosis de desmopresina para esta finalidad |
| Aconsejar una ingesta obligada de líquidos de 1,5-2l |
| Peso diario |
| Ingesta diaria de líquidos=ingesta obligada (l)+(peso objetivo-peso día) (1l=1kg) |
| Determinación de sodio plasmático con cierta frecuencia dependiendo de la estabilidad (al inicio semanalmente) |
| Educar al paciente y a su familia |
| Aconsejar incremento de ingesta líquida en épocas de calor o si hay aumento de ejercicio físico |
Puede ser recomendable la profilaxis antitrombótica con heparina de bajo peso molecular, al menos durante los episodios de deshidratación hipernatrémica6,11.
Secreción inadecuada de hormona antidiurética en el postoperatorio de la cirugía hipofisariaEpidemiologíaLa secreción inadecuada de la hormona antidiurética (SIADH) es una complicación relativamente frecuente de la cirugía transesfenoidal. La hiponatremia de cualquier causa aparece en el 13-35% de los pacientes sometidos a cirugía transesfenoidal, siendo sintomática en el 2-7%2,4,16–22. La variabilidad referida probablemente se debe a que pasa a menudo desapercibida, pues los síntomas son habitualmente leves e inespecíficos y pueden estar presentes también en los pacientes con normo o hipernatremia16. Algunas de estas series quirúrgicas han intentado acotar mejor la incidencia de SIADH, distinguiéndola de otras entidades que cursan con hiponatremia, obteniendo porcentajes solo ligeramente menores18,23.
Algún trabajo ha identificado el sexo femenino22 o la enfermedad de Cushing2,16 como factores predisponentes, pero la mayor parte de los estudios publicados no encuentran que la edad, el sexo, el tipo o el tamaño tumoral marquen un exceso de riesgo estadísticamente significativo17,18,21,22 Por el contrario, la presencia de DI posquirúrgica sí incrementa el riesgo de padecer SIADH posterior en algunas series2,4,18,22.
Fisiopatología. Patrones de secreción inadecuada de la hormona antidiuréticaLa SIADH tras una cirugía hipofisaria se atribuye a una liberación no controlada de AVP por parte de las neuronas hipotalámicas secretoras de AVP en vías de degeneración, dañadas durante la intervención en su soma celular o en sus axones que integran el tallo hipotálamo-hipofisario. También puede ocurrir que la SIADH sea secundaria a otras complicaciones de la cirugía: meningitis, hemorragias intracraneales, etc. El exceso relativo de AVP da lugar a una orina concentrada, con disminución del volumen urinario y Osmu inapropiadamente elevada y, si el paciente continúa bebiendo o recibiendo líquidos intravenosos, a hiponatremia e hipoosmolalidad. El manejo renal de sodio permanece intacto, gracias al correcto funcionamiento del eje renina-angiotensina-aldosterona, el péptido natriurético auricular y otros factores natriuréticos: por ello, cualquier expansión del volumen plasmático provoca eliminación renal de sodio y agua, lo que mantiene un estado euvolémico10.
Raras veces la SIADH se encuadra en la clásica respuesta trifásica a la lesión del tallo hipotálamo-hipofisario, ya comentada previamente.
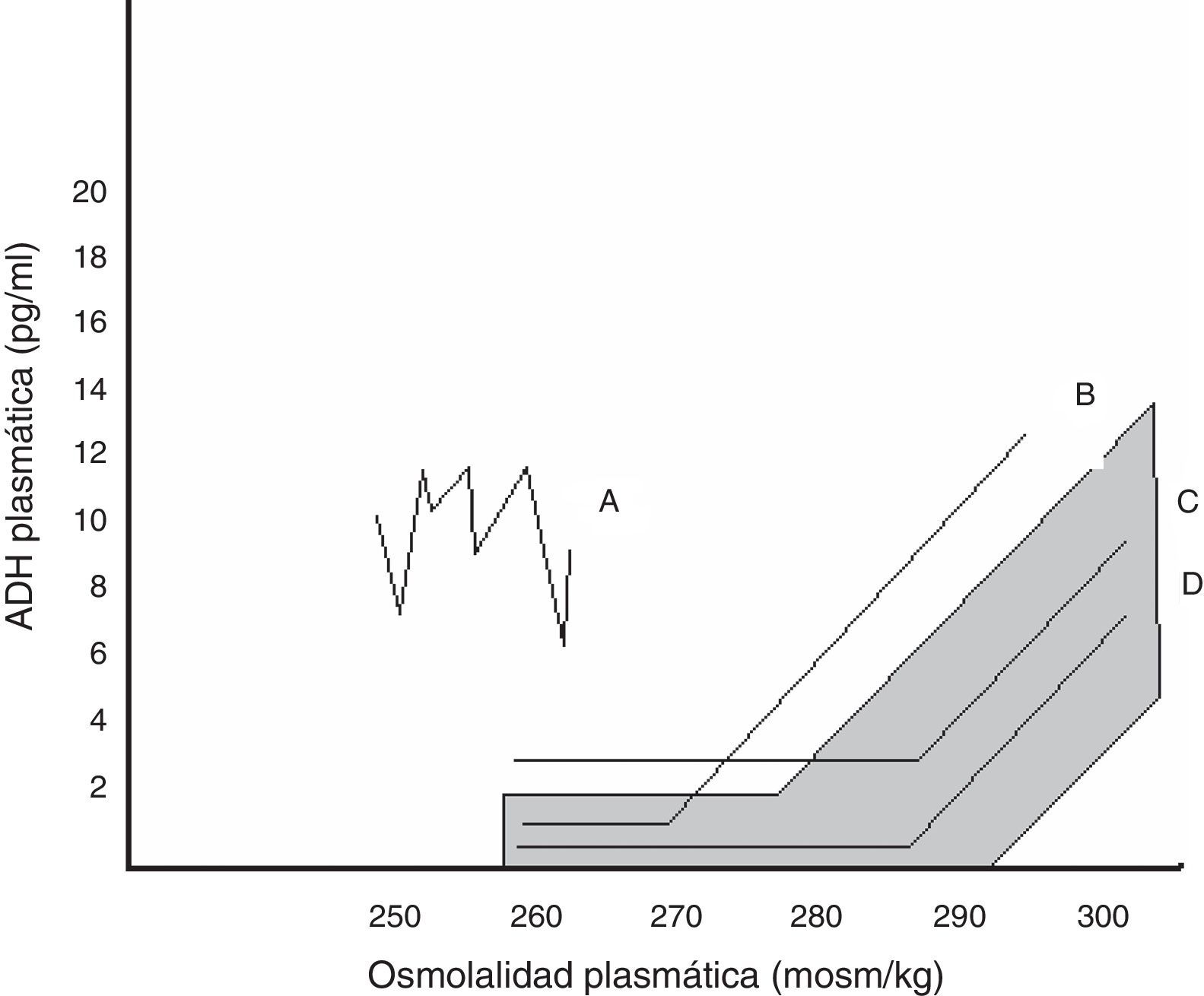
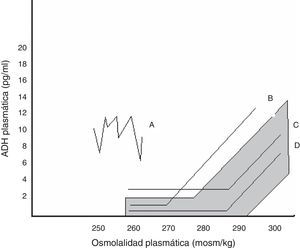
Dentro de la SIADH se han descrito varios patrones de respuesta de la AVP a los cambios de osmolalidad plasmática, representados en la figura 1. No se ha conseguido encontrar una correspondencia entre estos patrones y las diferentes causas que subyacen a la SIADH, ni se dispone de estudios que hayan evaluado qué patrón predomina tras la cirugía hipofisaria24.
Relación entre AVP plasmática y osmolalidad plasmática en los distintos patrones de SIADH. El área sombreada corresponde a la normalidad.
Patrón A. Secreción errrática de AVP, el más frecuente. Patrón B. Reset osmostat. La AVP responde perfectamente a los cambios de osmolalidad plasmática, aunque con una curva desplazada a la izquierda respecto a la normalidad. Patrón C. La AVP es adecuada a la osmolalidad plasmática en sus valores normales y altos, pero no se suprime a osmolalidades plasmáticas bajas, perpetuando la hipoosmolalidad. Patrón D. Secreción de AVP normal. Se especula que la hipoosmolalidad se deba a un aumento de la sensibilidad a los efectos de la AVP.
La SIADH ocurre habitualmente entre los días cuarto y décimo del postoperatorio. Cursa de manera asintomática o con síntomas leves en la mayoría de los casos y se suele diagnosticar por hiponatremia encontrada en los análisis de control postoperatorio. Los síntomas se deben a la hipoosmolalidad plasmática, y al consiguiente edema celular; su gravedad depende de la intensidad de la hiponatremia, así como de su velocidad de instauración. La hiponatremia, que en ocasiones se asocia a complicaciones graves o muerte por edema cerebral, puede ser bien tolerada si el organismo, y en concreto las células del sistema nervioso central, han tenido tiempo de adaptarse liberando otros osmoles y manteniendo así una Osmp similar a la extracelular para evitar el edema24,25. La presencia de otras alteraciones metabólicas (hipoxia, acidosis, hipercalcemia) pueden elevar el umbral de natremia asociado a la aparición de síntomas.
La forma de presentación es similar a la de otros trastornos hidroelectrolíticos y del equilibrio ácido-base. Los síntomas más frecuentes son cefalea, irritabilidad, dificultad de concentración, debilidad y náuseas, síntomas bastante inespecíficos, sobre todo en pacientes recién operados, por lo que a menudo pasan desapercibidos, de ahí la importancia de protocolizar el control electrolítico rutinario tras la cirugía hipofisaria, para diagnosticar la hiponatremia antes de que se agrave. Hiponatremias moderadas pueden provocar también vómitos, que a su vez pueden agravar la hiponatremia, desorientación, confusión, agitación, calambres musculares y anorexia. Y en los casos más graves se producirán disminución del nivel de conciencia hasta llegar al coma, crisis convulsivas, signos de afectación extrapiramidal, herniación del tronco del encéfalo y muerte. La ausencia de signos de focalidad neurológica nos permitirá distinguir la hiponatremia de otras complicaciones neuroquirúrgicas.
Se sabe que la hiponatremia de cualquier causa se asocia a mayor mortalidad, incidencia de caídas y estancia media hospitalaria, con riesgos mayores cuanto más baja es la concentración de sodio, y sobre todo cuando no se toman medidas para corregirla24,25. Aunque no hay estudios específicos en pacientes sometidos a cirugía hipofisaria, se supone que estos riesgos son similares a los de otros contextos clínicos.
Diagnóstico y diagnóstico diferencialSe debe sospechar SIADH en todos aquellos pacientes que en los días siguientes a la cirugía hipofisaria presentan síntomas sugestivos de hiponatremia. Sin embargo, el control analítico debe realizarse también en pacientes asintomáticos10. Dado que la mayor parte de las hiponatremias e hipernatremias son asintomáticas o presentan síntomas inespecíficos, y que el manejo es más sencillo si son leves, se puede sugerir determinar iones en sangre a las 6-8h de la intervención y después, si se mantienen en el rango normal, diariamente hasta el alta.
El diagnóstico de SIADH puede establecerse en un paciente con hiponatremia (concentración de sodio sérico<135mmol/l) e hipoosmolalidad plasmática (osmolalidad<275 mOsm/kg), orina inadecuadamente concentrada en relación con la osmolalidad plasmática (>100 mOsm/kg), habitualmente con concentración de sodio en orina elevado (>40mmol/l), con ingesta normal de sodio, en presencia de volumen extracelular normal y una vez descartadas la insuficiencia renal y las deficiencias de glucocorticoides y hormonas tiroideas26,27. Para determinar si el volumen extracelular es normal es fundamental la exploración física del paciente, que no debe mostrar edemas ni otros signos de sobrecarga hídrica, pero tampoco deshidratación cutáneo-mucosa, hipotensión ortostática, taquicardia, u otros signos de hipovolemia. La medición de la presión venosa central no es necesaria, pero contribuye a confirmar el estado de euvolemia cuando está disponible. Otros hallazgos bioquímicos que apoyan el diagnóstico de SIADH son concentraciones séricas disminuidas de urea, ácido úrico y hemoglobina, todos ellos relacionados con la hemodilución que se produce (tabla 5).
Diagnóstico de SIADH en el postoperatorio de la cirugía hipofisaria
| Signos y síntomas |
| Con frecuencia asintomático |
| Casos leves: cefalea, irritabilidad, dificultad de concentración, debilidad, náuseas |
| Casos moderados: desorientación, confusión, agitación, calambres musculares, anorexia |
| Casos graves: disminución del nivel de conciencia/coma, crisis convulsivas, afectación extrapiramidal |
| En la exploración, ausencia tanto de edemas como de signos de deshidratación |
| Datos analíticos |
| Natremia <135mmol/l |
| Osmolalidad sérica<275 mosm/kg |
| Osmolalidad urinaria>100 mosm/kg en presencia de hiposmolalidad sérica. Sodio en orina>40mmol/l |
Todo ello en presencia de un volumen circulante efectivo normal y una vez descartadas la insuficiencia renal, la insuficiencia suprarrenal y el hipotiroidismo. Considerar si existe diabetes mellitus, tratamiento con diuréticos, acromegalia y distinguir de poliuria por mayor aporte de líquidos en el perioperatorio.
El diagnóstico diferencial se debe plantear frente a otras causas de hiponatremia en el contexto de la cirugía hipofisaria (tabla 6). En las primeras horas tras la anestesia la causa más frecuente es la administración excesiva de líquidos intravenosos hipotónicos. Va acompañada de poliuria hipotónica, que no debe confundirse con una DI (que tendría natremia alta o normal-alta).
Causas de hiponatremia en el postoperatorio de la cirugía hipofisaria
| Sobrecarga de líquidos hipotónicos durante la intervención |
| SIADH |
| Síndrome cerebral pierde-sal |
| Insuficiencia suprarrenal secundaria |
| Hipotiroidismo central |
| Intoxicación por desmopresina |
| Otros fármacos: diuréticos, antipsicóticos, ISRS, antidepresivos tricíclicos, AINE, etc. |
| Hiperglucemia |
AINE: antiinflamatorios no esteroideos; ISSR: inhibidores selectivos de la recaptación de serotonina; SIADH: secrección inadecuada de la hormona antidiurética.
También suele aparecer en los primeros días la insuficiencia suprarrenal secundaria. Es una complicación conocida tanto de los tumores hipofisarios como de su tratamiento quirúrgico, y la hiponatremia es una de sus manifestaciones clínicas habituales, acompañada de hipotensión, disminución del volumen extracelular, malestar general, debilidad y náuseas. Además el cortisol es un inhibidor fisiológico de la secreción de AVP, por lo que su deficiencia favorece la aparición de SIADH5,10. Sin embargo, el uso profiláctico generalizado de glucocorticoides periquirúrgicos a dosis elevadas hace poco frecuente esta complicación. Una mejoría llamativa tras la administración de corticoides también apoya el diagnóstico, incluso en presencia de valores relativamente normales de cortisol sérico, que pueden reflejar una insuficiencia suprarrenal relativa en una situación de estrés.
El hipotiroidismo secundario o central es otra posible causa de hiponatremia. Habitualmente se tratará de una deficiencia prequirúrgica no diagnosticada o tratada de manera insuficiente. El volumen extracelular habitualmente es normal. También en estos casos se encuentran concentraciones plasmáticas inadecuadas de AVP, de causa no bien conocida: menor aclaramiento de AVP, reajuste del osmostato o estímulo de la secreción de AVP mediado por barorreceptores en respuesta a una disminución del gasto cardiaco5,10.
La hiperglucemia origina un reajuste a la baja de la concentración sérica de sodio para mantener una Osmp normal; se acompañará de poliuria, debido a la diuresis osmótica inducida por la glucosuria. A diferencia de la SIADH, por tanto, esta hiponatremia no se acompaña de hipoosmolalidad.
Otro capítulo a tener en cuenta es el de los fármacos. La responsable más frecuente de una hiponatremia es la DDAVP: si el paciente no reduce la ingesta de líquidos o, lo que es más frecuente, sigue recibiéndolos por vía intravenosa, desarrollará un cuadro clínico similar a una «intoxicación acuosa» prácticamente idéntica a la que ocurre en la SIADH. Además, como ya se ha mencionado previamente, los pacientes con DI posquirúrgica son más propensos a desarrollar SIADH. Esto hace que haya que ser cauto en la prescripción de DDAVP, y no olvidar que con frecuencia la DI es transitoria y puede ser manejada con una adecuada reposición de fluidos sin necesidad de tratamiento farmacológico. Otros fármacos que pueden favorecer la hiponatremia son los diuréticos, los antipsicóticos, los inhibidores selectivos de la recaptación de serotonina, los antidepresivos tricíclicos, los sedantes y los antiinflamatorios no esteroideos8,27.
El cuadro más parecido al de la SIADH y el que más dudas va a plantear es el síndrome perdedor de sal de origen cerebral. Su fisiopatología sigue sin estar suficientemente elucidada. Se presupone la existencia de algún factor natriurético liberado por el sistema nervioso central en respuesta a la agresión quirúrgica, que estimula la diuresis y la natriuresis y suprime la secreción de aldosterona, incluso en un contexto de hipovolemia e hiponatremia25,28. El péptido natriurético auricular (atrial natriuretic peptide [ANP]) y el factor natriurético cerebral (brain natriuretic peptide [BNP]), sintetizado en cantidades significativas en el hipotálamo, han sido propuestos como candidatos, pero los resultados de sus determinaciones en pacientes afectos son discordantes. Este cuadro comparte muchas características con la SIADH, pues también se caracteriza por hiponatremia e hipoosmolalidad y orina inadecuadamente concentrada, con natriuria inadecuada y función tiroidea y suprarrenal normales. El volumen de orina puede ser mayor que en la SIADH, pero hay demasiada superposición entre los 2 cuadros como para que pueda ayudar al diagnóstico diferencial. La concentración plasmática de AVP puede estar baja en respuesta a la hiposmolalidad pero también algo elevada, estimulada por la hipovolemia, por lo que tampoco resulta de utilidad diagnóstica. La principal diferencia es que la natriuresis excesiva conlleva una disminución del volumen extracelular, que se traducirá en disminución del peso corporal y de la presión venosa central y hemoconcentración (mayores concentraciones de urea, ácido úrico, hemoglobina, potasio, etc.). Además, la aldosterona plasmática está disminuida. Es importante hacer una correcta diferenciación entre este cuadro y la SIADH, pues aquí el tratamiento implica una correcta reposición de agua y sal, e incluso se propone el uso de fludrocortisona, mientras que el abordaje inicial para la SIADH es precisamente la restricción del aporte de agua12,25,26,29.
En resumen, ante una hiponatremia tras cirugía hipofisaria, varios factores nos pueden orientar al diagnóstico. Según el momento de aparición, en los primeros días son más frecuentes la sobrecarga iatrogénica de fluidos hipotónicos, la insuficiencia suprarrenal secundaria o la liberación de AVP debida a estímulos no osmóticos como el dolor o las náuseas, mientras que a la semana de la intervención o más tarde nos encontraremos con más frecuencia con la SIADH o síndrome perdedor de sal de origen cerebral5,8,10,28. Teniendo en cuenta el estado del volumen extracelular, cuando el paciente está euvolémico se debe pensar en SIADH o hipotiroidismo, mientras que la presencia de signos de hipovolemia debe orientar a insuficiencia suprarrenal, hiperglucemia o síndrome perdedor de sal.
TratamientoAunque no se dispone de estudios que comparen distintas estrategias de tratamiento y monitorización de la SIADH, el abordaje actual es relativamente similar en distintos centros, tal y como se desprende de trabajos publicados sobre el tema, y goza de amplia aceptación30,31.
Lógicamente, antes de iniciar un tratamiento específico para la SIADH se deben excluir otras causas contribuyentes a la hiponatremia o la SIADH y corregirlas en la medida de lo posible5,8,10. Ante la duda entre SIADH y síndrome perdedor de sal se sugiere infundir suero salino fisiológico (por ejemplo 1.000ml) y reevaluar al paciente: si se produce una clara mejoría en la natremia, muy probablemente el paciente presentaba depleción de volumen y de solutos, pero si se trataba de SIADH lo más probable es que el paciente elimine el exceso de agua y sodio recibido, pero no se modifique su osmolalidad o incluso empeore si la osmolalidad urinaria es muy elevada32.
En cualquier paciente con hiponatremia la primera decisión a tomar es a qué velocidad queremos corregirla, sopesando los riesgos de la hiponatremia, pero también los de su rápida corrección, principalmente el síndrome de desmielinización osmótica (SDO). Si la hiponatremia es aguda, lo que se define arbitrariamente como de menos de 48horas de duración, el riesgo de edema cerebral y herniación del tronco del encéfalo es grande, pues el cerebro no tiene tiempo de adaptarse y eliminar solutos intracelulares, y el riesgo de mielinolisis es pequeño, incluso con una corrección rápida de la hiponatremia; si por el contrario la hiponatremia es crónica (>48h), las manifestaciones neurológicas serán menores y el riesgo de una rápida corrección mucho mayor.
El SDO es la complicación más grave de una corrección rápida. Se trata de una degeneración de la mielina en el sistema nervioso central, que afecta sobre todo al tronco del encéfalo, los ganglios basales, el cuerpo calloso y el hipocampo, y que conlleva una alta morbimortalidad, ya que puede originar secuelas neurológicas permanentes. Clínicamente suele manifestarse como disartria, paraparesia o cuadriparesia espástica o parálisis pseudobulbar, que aparecen tras una mejoría neurológica inicial debida a la mejoría de la hiponatremia. El riesgo de padecerla depende sobre todo de la velocidad de corrección de la natremia, incluso aunque la natremia permanezca en concentraciones inferiores a lo normal, pero también de la gravedad de la hiponatremia preexistente y su duración. Los pacientes alcohólicos o malnutridos o con hipopotasemia tienen mayor propensión a padecerla. El diagnóstico puede confirmarse mediante RM, aunque las imágenes características pueden tardar en aparecer días o incluso pocas semanas.
Para determinar el ritmo previsto de corrección también hay que tener en cuenta si ha habido factores contribuyentes a la hiponatremia que sean reversibles (insuficiencia suprarrenal tras su tratamiento, interrupción del tratamiento con desmopresina o diuréticos, etc.), ya que una vez eliminados la natremia tenderá a mejorar espontáneamente y se producirá una diuresis acuosa.
En los pacientes asintomáticos con hiponatremias leves, por encima de 125mmol/l, suele ser suficiente con restringir la ingesta de líquidos a menos de 1.000ml y liberalizar la ingesta de sal, que suele ser escasa en las dietas hospitalarias. La principal dificultad en la aplicación de este tratamiento es que los pacientes continúan sintiendo sed pese a la hipoosmolalidad, y a veces se sienten incapaces de cumplir la restricción28,33. Ante un paciente asintomático o con síntomas mínimos con hiponatremia moderada (120-125mmol/l) se debe suponer que se trata de una hiponatremia crónica y corregirla lentamente. Se recomienda prescribir una restricción hídrica (RH) algo más agresiva (menos de 500ml diarios) o infundir inicialmente suero salino hipertónico (SSH) (al 3%) para aumentar la natremia a un ritmo de 0,5mmol/l/h. Igualmente se aconseja esta misma actitud en algunos casos con hiponatremias más profundas, en pacientes poco sintomáticos en los que se sospecha que la hiponatremia es de larga evolución, y en los que el ritmo de corrección debe ser aún más lento. Si el paciente está sintomático, por ejemplo con disminución progresiva del nivel de conciencia o convulsiones, o si se sabe que la hiponatremia se ha instaurado de forma aguda, recomendamos infundir SSH con intención de corregir a un ritmo inicial de 1mmol/l/h durante las primeras horas. Si la administración de suero origina una sobrecarga de volumen se recomienda asociar furosemida.
Desde el punto de vista práctico se puede emplear la siguiente fórmula para predecir el incremento de natremia que se producirá en respuesta a la infusión de una determinada cantidad de suero:
Aumento esperado en la natremia (mmol/l) (tras administrar 1000 ml de suero) = (Sodio infundido [mmol/l] – sodio sérico [mmol/l]) / Agua corporal total (l) + 1.
Para calcular el agua corporal total basta multiplicar el peso (kg) por 0,5 en mujeres y por 0,6 en varones.
Sea cual sea la rapidez de corrección elegida se sugiere interrumpir el tratamiento agudo cuando: 1) se resuelven los síntomas del paciente; 2) se alcanza una natremia segura (habitualmente 120mg/dl); o 3) se alcanza una magnitud total de corrección de 10-12mmol/l en 24h o 18mmol/l en 48h28,31,33,34. Se recomienda que el control analítico inicial se haga a las 2-4h. La fórmula de Furst (Na+o+K+o/Na+p) nos ayuda a tomar decisiones en los casos leves y moderados, ya que nos permite predecir la efectividad de la RH: si el resultado de la fórmula es >1 el paciente no está eliminando agua libre por vía renal, y no es de esperar que mejore con RH35.
En los casos leves sugerimos un nuevo control de la natremia a las 12-24h, mientras en los graves se aconseja realizarlo a las 2h de haber instaurado el tratamiento, y mantener controles cada 4h hasta que se alcancen los objetivos previamente comentados y pueda pasarse a tratamientos menos agresivos (RH+aporte de sal o un antagonista de vasopresina).
Aunque existen diversos fármacos (demeclociclina, litio), o la urea, utilizados para el tratamiento de la SIADH, ninguno de ellos ha sido evaluado en ensayos clínicos controlados en el postoperatorio de la cirugía transesfenoidal. Probablemente todos ellos van a ser desplazados por los antagonistas no peptídicos del receptor V2 de la AVP o vaptanes, que actúan como acuaréticos puros, promoviendo la liberación de agua libre, sin afectar a los solutos, a diferencia de los diuréticos que promueven la eliminación de ambos. En nuestro país está comercializado el tolvaptán, indicado en la hiponatremia asociada a la SIADH. Aunque no ha sido estudiado específicamente en el contexto de la cirugía hipofisaria los resultados de los ensayos clínicos indican que es eficaz y seguro en la corrección de la hiponatremia dilucional34,36. No hay datos que sostengan que reduzca la morbimortalidad asociada a la hiponatremia y tampoco hay experiencia en hiponatremias graves (ningún paciente con sodio<115mmol/l descrito). Su efecto es bastante más rápido que el de la RH, aumentando la natremia de manera significativa en 24-48h. Su administración debe iniciarse en el hospital para monitorizar la velocidad de corrección y ajustar la dosis, con controles iniciales cada 6h. La sensación de sed y de sequedad oral es su efecto adverso más frecuente. La dosis inicial es de 15mg/día en una sola toma, pero puede incrementarse hasta un máximo de 60mg/día. Se aconseja prescribirlo a pacientes leves tras el fracaso de la RH o en moderados como alternativa al suero hipertónico o tras este, una vez alcanzada una natremia segura26,33,37. También puede emplearse en la SIADH crónica, pero esta complicación es muy infrecuente tras la cirugía transesfenoidal.
Cada vez es más habitual el alta precoz de los pacientes sometidos a cirugía transesfenoidal a los 3 o 4 días de la intervención. El momento de mayor incidencia de SIADH es pasada la primera semana, por lo que en muchos casos se va a poner de manifiesto ya en el domicilio. Por ello se aconseja que se den recomendaciones al alta de restringir moderadamente la ingesta de líquidos pero no la de sal, salvo en los que padezcan DI, y que los pacientes sean informados de los posibles síntomas asociados a la hiponatremia, para que consulten en caso de padecerlos. Una buena praxis, poco extendida en nuestro medio, puede ser que el paciente realice un control analítico a los 7-10 días de la intervención en su centro de salud y que sea remitido al hospital si el resultado es anormal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.