La sobrenutrición puede ocasionar obesidad. La obesidad materna puede afectar la fertilidad no solo a través de la anovulación, sino también por medio de efectos directos en ovocitos y en embriones en la fase de preimplantación, indicando que el periodo de periconcepción es sensible a condiciones de sobrenutrición. El periodo de periconcepción abarca desde la foliculogénesis hasta el momento de la implantación. Estudios en modelos animales indican que ovocitos derivados de hembras obesas usualmente muestran una talla pequeña y anormalidades mitocondriales. Estas perturbaciones son probablemente inducidas a través de alteraciones en los componentes del fluido folicular ovárico. La evidencia experimental también indica que la obesidad puede afectar el microambiente en oviductos y útero, lo cual conlleva al desarrollo de embriones en la fase de preimplantación con un número reducido de células y con una regulación ascendente de genes proinflamatorios. Sin embargo, se necesita más investigación para una caracterización a fondo de los efectos de la obesidad materna durante el periodo de periconcepción.
Overnutrition may lead to obesity. Maternal obesity may affect fertility not only via anovulation, but also through direct effects on oocytes and preimplantation embryos, indicating that the periconceptional period is sensitive to conditions of overnutrition. The periconceptional period includes from folliculogenesis to implantation. Animal model studies suggest that oocytes derived from obese females usually have a small size and mitochondrial abnormalities. These disruptions are probably induced by changes in the components of the ovarian follicular fluid. Experimental evidence also suggests that obesity may affect the microenvironment in oviducts and uterus, resulting in development of preimplantation embryos with reduced cell numbers and up-regulation of proinflammatory genes. However, further research is needed for in-depth characterization of the effects of maternal obesity during the periconceptional period.
La sobrenutrición se origina cuando la biodisponibilidad de uno o más macro y/o micronutrientes exceden las cantidades necesarias para una actividad fisiológica y metabólica normal, que usualmente conlleva al sobrepeso u obesidad1. La obesidad es actualmente un problema global de salud pública2–5. La etiología de la obesidad es multifactorial6–9 y su fisiopatología aún no está totalmente entendida10,11. Además de causar problemas de salud asociados a enfermedades cardiovasculares y metabólicas5,12,13, la obesidad también puede ocasionar problemas de fertilidad14. Datos disponibles indican que la probabilidad de concepción espontánea disminuye en mujeres obesas, aun cuando los ciclos menstruales están presentes15–19. Asimismo, mujeres obesas sometidas a programas de reproducción asistida usualmente responden de manera desfavorable a tales biotecnologías. Así lo indican 3 recientes metaanálisis que examinaron más de 90 artículos de investigación relacionados con el efecto de un alto índice de masa corporal sobre los resultados de técnicas de reproducción asistida20. De hecho, en la mayoría de los casos se aconseja que mujeres obesas con problemas de fertilidad pierdan peso antes de ser sometidas a programas de reproducción asistida21. La infertilidad en mujeres obesas es usualmente atribuida a la ausencia de ovulación22,23. Sin embargo, recientemente, varias líneas de investigación han demostrado que el ovocito y el desarrollo embrionario durante el periodo de preimplantación también pueden ser afectados negativamente por la obesidad, indicando que el periodo de periconcepción es sensible a condiciones de sobrenutrición. En términos generales el periodo de periconcepción abarca desde la foliculogénesis hasta el momento de la implantación1. El presente artículo tiene como objetivo presentar una revisión actual de los efectos de la sobrealimentación materna sobre el periodo de periconcepción. La mayoría de la información discutida proviene de modelos de obesidad, ya que es el modelo experimental más utilizado en estudios de sobrenutrición.
Efecto de la obesidad en el desarrollo folicular ováricoLa infertilidad observada en mujeres obesas esta usualmente asociada a condiciones de anovulación, la cual a su vez está frecuentemente ligada al síndrome de ovario poliquístico24,25. En un modelo de obesidad inducida por dieta en ratones se observó una falta de desarrollo folicular ovárico y de ovulaciones, indicando la ausencia de ciclos estrales26. Ratones infértiles con obesidad inducida por dieta también presentaron un incremento en las concentraciones séricas de hormonas metabólicas (esto es, insulina, leptina y adiponectina) y metabolitos (glucosa)26. La fisiopatología de la anovulación en condiciones de obesidad no está totalmente entendida, pero se sabe que alteraciones metabólicas como la hiperinsulinemia e hiperleptinemia son características comunes en mujeres obesas con o sin síndrome de ovario poliquístico27,28. Experimentos en ratas indican que altos niveles de leptina pueden ocasionar ausencia de ovulación29,30. Sin embargo, la ovulación puede ocurrir en condiciones de sobrenutrición, ya que embarazos a término son comunes en mujeres obesas, incluso en casos de obesidad mórbida1. La foliculogénesis ovárica es un prerrequisito para el proceso de ovulación31 que puede estar presente en individuos obesos, aunque en la mayoría de los casos de manera deficiente. Por ejemplo, un bajo recuento de folículos antrales es una característica ovárica presente en mujeres obesas32 y en animales alimentados con dietas altas en lípidos y colesterol33. Asimismo, un bajo número de ovulaciones o un menor número de folículos ováricos ha sido documentado en genotipos obesos, como es el caso del ratón obeso de Nueva Zelanda34, ratas Zucker obesas35 y el cerdo ibérico mediterráneo36. Esta deficiente actividad folicular ovárica es muy probablemente la causa de la baja tasa de ovocitos obtenidos en mujeres obesas sometidas a programas de fecundación in vitro37, y pudiera estar relacionada con los bajos niveles de hormona antimülleriana usualmente detectados en mujeres obesas38–40. Otros autores consideran que los niveles séricos de hormona antimülleriana no están relacionados con la obesidad41. Sin embargo, se sabe que la leptina, que usualmente está incrementada en individuos obesos, puede suprimir la expresión génica de la hormona antimülleriana en células de la granulosa a través de la ruta Janus kinase 2/signal transducer and activator of transcription 342.
Otra característica en ratones con obesidad inducida por dieta es el aumento en el porcentaje de folículos ováricos apoptóticos43, especialmente en células de la granulosa y del cumulus44. En un modelo de sobrenutrición en conejos alimentados con dietas altas en lípidos y colesterol también se encontró un incremento en la atresia folicular ovárica33. De manera similar, ratas Zucker obesas (es decir, modelo genético de obesidad) también presentaron un aumento en el porcentaje de folículos atréticos unido a un aumento en los niveles de insulina35. En este modelo de obesidad genética la atresia folicular se asoció a una acumulación de Forkhead box protein O1 en el núcleo de células de la granulosa que mostraron signos de apoptosis35. Forkhead box protein O1 es un factor de transcripción que desempeña un papel primordial en el metabolismo energético y muerte celular, y está regulado en gran medida por insulina45,46. Este es un ejemplo en el que un mediador nutricional puede afectar directamente células ováricas. Sin embargo, algunos mediadores nutricionales pueden afectar indirectamente el desarrollo folicular ovárico. Tal es el caso de la leptina, debido a su asociación con el vascular endothelial growth factor, el cual ejerce un papel primordial en la regulación de la angiogénesis ovárica47. De hecho, la expresión proteica de vascular endothelial growth factor en los ovarios puede ser incrementada por medio de inyecciones intraperitoneales de leptina en ratones48. En humanos las concentraciones de leptina en el líquido folicular ovárico pueden estar correlacionadas negativamente con los niveles de oxígeno intrafolicular49 y con el flujo sanguíneo del estroma ovárico50. Dado que los niveles de oxigenación en fluido folicular ovárico dependen en gran parte del desarrollo vascular perifolicular51, se cree que altos niveles de leptina en condiciones de obesidad pueden interferir con el suministro de oxígeno y elementos regulatorios críticos para la foliculogénesis25. Sin embargo, dicha hipótesis tiene que ser comprobada con estudios experimentales.
Aunque la información disponible indica que el desarrollo folicular ovárico es afectado en condiciones de sobrenutrición, se necesitan estudios más detallados que aborden el efecto de la obesidad sobre la foliculogénesis ovárica. Importante es el análisis del microambiente ovárico (por ejemplo metabólico y proteómico), incluyendo el fluido intrafolicular y células de la granulosa, ya que estos proporcionarían marcadores de competencia ovocitaria que pudieran tener aplicación clínica en la medicina reproductiva.
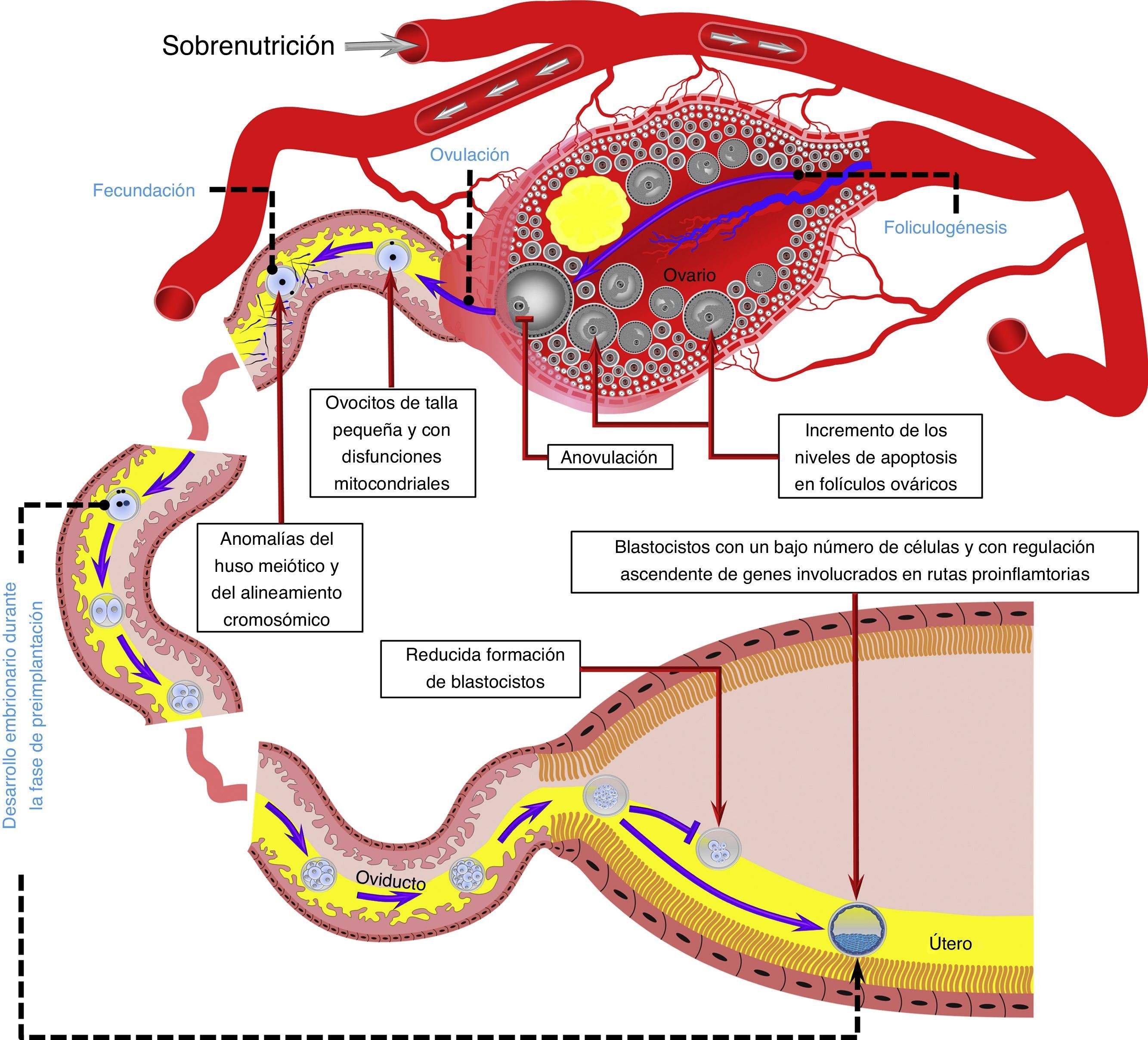
Efecto de la obesidad sobre la capacidad de desarrollo del ovocitoDesde el punto de vista de la periconcepción, la capacidad de desarrollo del ovocito se refiere a la habilidad del ovocito para madurar durante los últimos estadios de la foliculogénesis, lograr el proceso de fecundación y desarrollarse hasta el estadio de blastocisto1. Ratones con obesidad inducida por dieta mostraron una disminución de ovocitos con rotura de la vesícula germinal, lo cual sugiere un efecto negativo de la obesidad sobre la maduración ovocitaria43. De igual manera, ovocitos de talla pequeña están presentes en mujeres obesas52 y ratones con obesidad inducida por dieta43. Si el ovocito no alcanza un tamaño adecuado la maduración meiótica es afectada y la frecuencia de fecundaciones poliespérmicas puede ser aumentada53.
El proceso de fecundación también es afectado por la obesidad, ya que ratones superovulados alimentados con una dieta alta en grasa mostraron una baja tasa de fecundación44. En un modelo bovino el porcentaje de ovocitos no fecundados aumentó en vacas obesas superovuladas54. De manera similar, en pacientes sometidas a fecundación in vitro el fallo de la fecundación se incrementó en mujeres obesas55. En este último estudio el fallo de la fecundación se asoció a anomalías del huso meiótico y a un mal alineamiento cromosómico55. De hecho, en ratones con obesidad inducida por dieta la incidencia de ovocitos aneuploides se incrementa y está aunado con un aumento en la tasa de husos meióticos morfológicamente anormales y de cromosomas con un alineamiento inadecuado56.
La obesidad está parcialmente asociada a un alto consumo de lípidos, y la mayoría de los estudios animales que tratan de dilucidar la fisiopatología de la obesidad utilizan dietas con un alto contenido de grasa57. Dietas altas en grasas incrementan el contenido de lípidos en ovocitos, y un excesivo aumento de estos es considerado un biomarcador de lipotoxicidad44. Un alto contenido de lípidos en ovocitos es una característica usualmente encontrada en animales obesos con problemas reproductivos44,58. De hecho, la exposición in vitro de ovocitos de ratones a fluido folicular humano con altas concentraciones de lípidos resultó en un efecto negativo en la maduración nuclear ovocitaria59. Experimentos en ratones indican que dicha lipotoxicidad ovocitaria está asociada a una alteración de la expresión de genes indicadores de estrés del retículo endoplásmico como es activating transcription factor 4 (ATF4) y heat shock 70kDa protein 5 (glucose-regulated protein, 78kDa)44. En este último estudio la expresión de ambos genes fue incrementada en complejos cumulus-ovocito, mientras que en células de la granulosa solo ATF4 fue aumentado44. De forma similar células de la granulosa de mujeres obesas también mostraron una elevada expresión de ATF444.
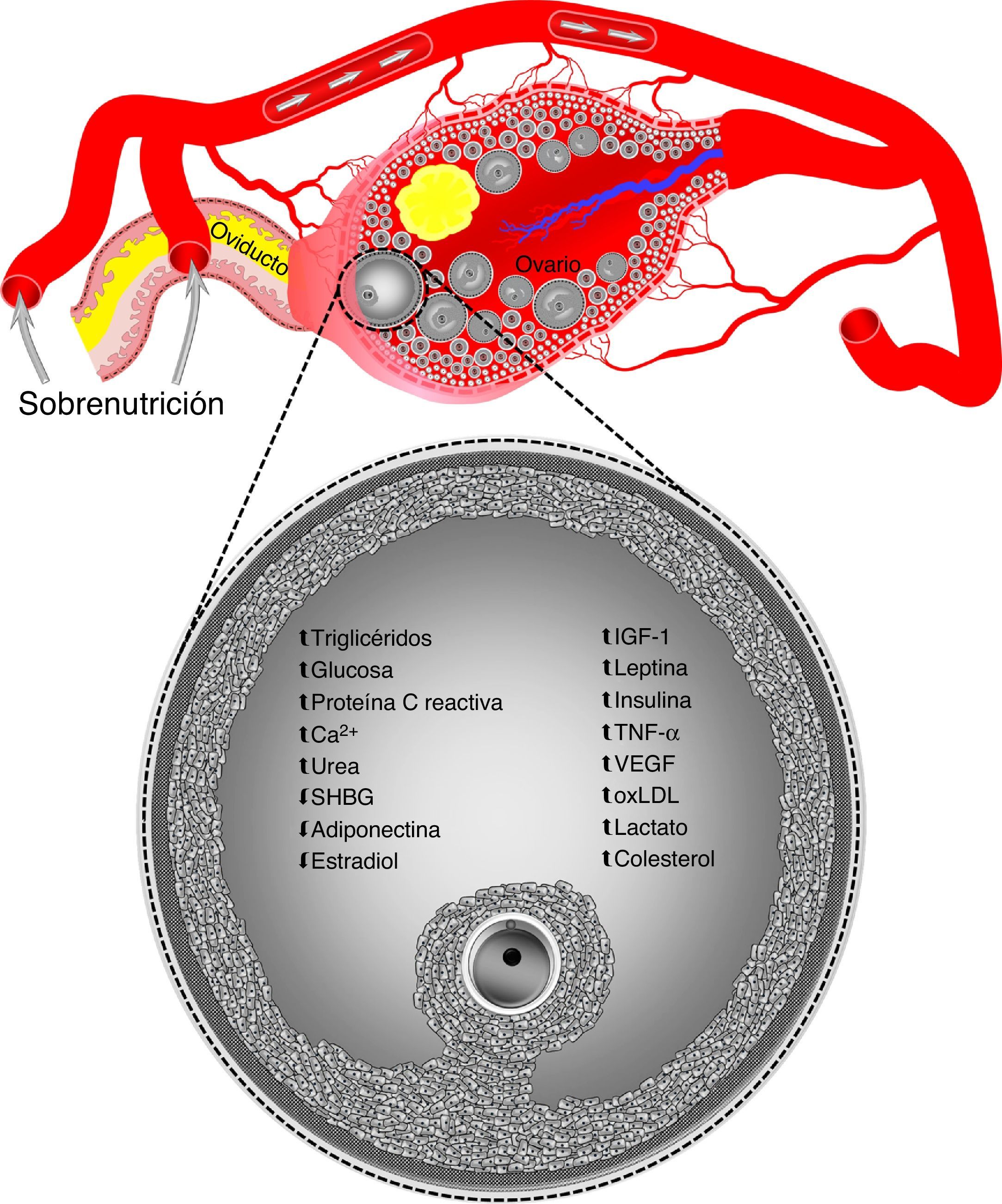
Por otro lado, ovocitos y cigotos de ratones con obesidad inducida por dieta presentan una mayor producción de especies reactivas de oxígeno y un estado redox más oxidado, así como una localización anormal de mitocondrias60. Otras disfunciones mitocondriales presentes en ovocitos, pero no en cigotos de ratones con obesidad inducida por dieta, son el incremento en el número de copias de ADN mitocondrial y una regulación ascendente de genes nucleares involucrados en la replicación y transcripción de ADN mitocondrial60. Ha sido sugerido que la degradación y replicación de ADN mitocondrial que ocurre inmediatamente después de la fecundación en cigotos y embriones de 2 células pudiera ser la razón por la cual los niveles alterados de ADN mitocondrial son normalizados en cigotos de ratones obesos60. Asimismo, debido a la degradación de transcriptos maternales que precede la activación del genoma embrionario, la normalización de los niveles alterados de genes nucleares asociados con la biogénesis mitocondrial en cigotos de animales obesos refleja la destrucción global del ARN mensajero materno durante la transición materna-embrionaria60. Sin embargo, esto no es suficiente para contrarrestar los efectos nocivos de la obesidad en la capacidad de desarrollo del ovocito. Por ejemplo, se sabe que el desarrollo in vitro de cigotos provenientes de ratones obesos es afectado, resultando en una menor formación de blastocistos61,62. De igual manera, ovocitos aspirados por ultrasonografía transvaginal en novillas sobrealimentadas mostraron un bajo desarrollo en programas de fecundación in vitro asociado a hiperinsulinemia observada en los animales donadores63,64. Tales elevados niveles de insulina pueden llegar a ser similares a los reportados en mujeres con síndrome de ovario poliquístico63. La formación in vivo de embriones también es reducida en ganado bovino obeso superovulado, y ha sido asociada a altas concentraciones sanguíneas de insulina65 e insulin-like growth factor 1 (IGF-1)54. Las alteraciones en ovocitos son inducidas a través de modificaciones en las concentraciones de componentes del fluido folicular ovárico durante episodios de sobrenutrición (fig. 1)1. Sin embargo, la sobrenutrición no solo afecta el microambiente intrafolicular, sino también el presente en el tracto reproductivo.
La sobrenutrición puede alterar las concentraciones de componentes del fluido folicular ovárico. Datos obtenidos en humanos, ganado ovino, bovino y porcino.
Ca2+: calcio; IGF-1: insulin-like growth factor 1; oxLDL: oxidized low-density lipoprotein; SHBG: sex hormone-binding globulin; TNF-α: tumor necrosis factor-alpha; VEGF: vascular endothelial growth factor;.
Vasos sanguíneos, ovario, folículos ováricos, y oviducto no están dibujados a escala.
Adaptado de Velazquez y Fleming1.
El microambiente oviductal puede ser afectado por la obesidad. Por ejemplo, se sabe que las concentraciones de leptina en el fluido luminal del oviducto aumentan en ratones obesos60. Estudios in vitro en ratones han demostrado que altas concentraciones de leptina en el medio de cultivo embrionario pueden reducir la formación de blastocistos66 e inducir fragmentación del ADN en los embriones resultantes67 (fig. 2).
La sobrenutrición puede afectar negativamente varios procesos reproductivos durante el periodo de periconcepción, incluyendo la foliculogénesis, la ovulación, la calidad del ovocito, el proceso de fecundación, así como el desarrollo del embrión en la fase de preimplantación.
Modelo basado en datos obtenidos en humanos32,52,55, rumiantes54,63,65 y roedores43,44,56,60,72. El tracto reproductivo es representativo de especies de rumiantes y roedores. Vasos sanguíneos, gametos, embriones y estructuras reproductivas no están dibujados a escala.
El colony stimulating factor 2 (CFS2 [granulocyte-macrophage]) es un importante regulador del desarrollo embrionario temprano, y su expresión en el oviducto, tanto génica como proteica, disminuye en vacas obesas68. Sin embargo no está clara la relevancia de estos resultados, ya que la reducida expresión de CFS2 fue observada predominantemente en la ámpula del oviducto68, y dicha estructura es más relevante para el proceso de fecundación que para las primeras divisiones celulares del embrión69. No hay literatura disponible que indique un efecto de CFS2 en el proceso de fecundación.
De igual manera el útero puede ser afectado por la sobrealimentación. La baja producción de embriones reportada en vacas obesas está asociada a un incremento en las concentraciones de IGF-1 en fluido luminal uterino54. Estudios in vitro indican que altas concentraciones de IGF-1 pueden incrementar los niveles de apoptosis y alterar la diferenciación celular en blastocistos bovinos70. Dichas alteraciones incluyen la formación de blastocistos con una excesiva proliferación de células en la masa celular interna, lo cual puede incrementar el riesgo de pérdida gestacional temprana71. Sin embargo, muy probablemente esto último ocurre durante condiciones de sobrenutrición de corto plazo, en las cuales no hay desarrollo de obesidad y los niveles de IGF-1 no son incrementados crónicamente, ya que durante condiciones de obesidad el número de células en blastocistos no aumenta, sino disminuye54. El bajo número de células en embriones bovinos está asociado a una reducida expresión proteica del receptor de IGF-154. Dicha disminución en la expresión proteica del receptor de IGF-1 también ha sido reportada en blastocistos de ratones con obesidad inducida por dieta43.
Experimentos en ratas han mostrado que la obesidad induce una extensa regulación ascendente de genes involucrados en rutas proinflamatorias en el útero72. Esta reacción proinflamatoria inducida por obesidad también está presente en el blastocisto y está asociada a una acumulación de lípidos en el útero y el blastocisto72. Como se mencionó anteriormente, la hiperlipidemia es considerada un indicador de lipotoxicidad, y un incremento en el contenido de lípidos en embriones bovinos resulta en una apariencia oscura del embrión, y embriones de apariencia oscura pueden reducir la tasa de preñez en programas de transferencia embrionaria en bovinos73.
Actualmente existe controversia en lo concerniente a la importancia de la receptividad endometrial en mujeres obesas, ya que en modelos de donación ovocitaria unos autores reportaron que los resultados de fecundación in vitro fueron afectados negativamente74, mientras que otros no encontraron efecto alguno75. Sin embargo, los modelos animales muestran que la obesidad perjudica el ambiente uterino. Algo que hay que tomar en consideración es que dichos estudios son análisis retrospectivos llevados a cabo con datos obtenidos usualmente en mujeres con problemas de infertilidad. Este tipo de análisis retrospectivo ha sido criticado, ya que hay evidencia de que resultados inverosímiles pueden producirse con este tipo de análisis76. Un ejemplo es el supuesto efecto positivo que puede ejercer la obesidad masculina en los porcentajes de implantación en programas de fecundación in vitro77. En dicho estudio datos de 700.000 ciclos de fecundación in vitro provenientes de 120 clínicas de reproducción asistida fueron utilizados77. Estos resultados contrastan directamente con el impacto negativo que ejerce la obesidad sobre la fertilidad masculina y los resultados de fecundación in vitro ampliamente reportados en estudios experimentales realizados en humanos y animales78–85.
La información discutida en el presente artículo señala que el microambiente del oviducto y del útero es afectado por la sobrenutrición, de tal manera que la idea de que los efectos nocivos de la sobrealimentación pueden ser ejercidos directamente en el tracto reproductivo es verosímil. Sin embargo, se necesitan más estudios (esto es, metabolómicos y proteómicos) para una caracterización a fondo de los efectos de la sobrenutrición sobre el tracto reproductivo.
ConclusionesLa sobrenutrición a largo plazo normalmente conlleva al desarrollo de la obesidad. La obesidad puede afectar la capacidad reproductiva no solo a través de la anovulación, sino también por medio de alteraciones en el ovario y el tracto reproductivo (fig. 2). Las alteraciones durante el crecimiento folicular ovárico, presentes en condiciones de obesidad, muy probablemente resultan en la ovulación de ovocitos con una deficiente capacidad de desarrollo. La información generada en modelos animales indica que el microambiente en el oviducto y el útero también es afectado por la sobrenutrición. Estas perturbaciones pueden afectar el embrión en la fase de preimplantación, afectando negativamente la posibilidad de una gestación exitosa. No obstante, se necesitan llevar a cabo más estudios experimentales para una caracterización a fondo (es decir, efectos metabólicos, moleculares y celulares) de los efectos de la sobrealimentación durante el periodo de periconcepción. Dichos estudios proporcionarían información relevante para el desarrollo de estrategias preventivas que incrementen la probabilidad de una gestación exitosa en individuos obesos. Este tipo de investigación es, sin embargo, difícil de llevar a cabo en humanos, ya que usualmente los trabajos al respecto son realizados en parejas con problemas de infertilidad, de tal manera que modelos animales son necesarios para llevar a cabo dicha investigación en detalle.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.