Las hipofisitis constituyen un conjunto heterogéneo de lesiones inflamatorias que afectan a la glándula pituitaria, con patogenia compleja e insuficientemente caracterizadas. Pertenecen al grupo de las masas sellares no secretoras de hormonas, con las que comparten la presentación clínica y, en ocasiones, también la radiológica. Estas similitudes hacen difícil el diagnóstico diferencial sin recurrir a la cirugía, no indicada en las hipofisitis, pero que permite el estudio anatomopatológico1,2. La presentación clínica es similar a la de otras masas sellares: cefalea, alteraciones visuales y grados variables de hipopituitarismo y diabetes insípida.
Las hipofisitis pueden clasificarse según diversos criterios. Se describen la adenohipofisitis, la infundibuloneurohipofisitis y la panhipofisitis según la localización anatómica del proceso; según las características histopatológicas pueden ser linfocíticas, granulomatosas, xantomatosas y formas mixtas; de acuerdo con la etiología, se describen las primarias, ya sean aisladas o como parte de una enfermedad sistémica, las secundarias a enfermedades sellares como germinoma, quiste de Rathke, craneofaringioma o adenoma pituitario, o las que integran afecciones sistémicas como granulomatosis de Wegener, tuberculosis, sarcoidosis y sífilis; por último, se han descrito las hipofisitis secundarias a fármacos inmunomoduladores como el interferón y los anticuerpos anti-antígeno 4 del linfocito T citotóxico (CTLA-4)1.
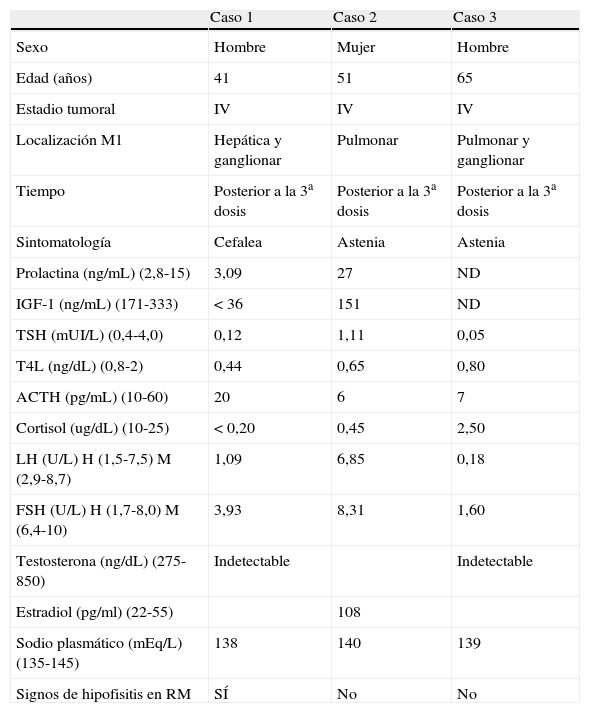
En el contexto del uso de terapias inmunomoduladoras describimos 3 casos de hipofisitis autoinmunitaria secundaria a ipilimumab, desarrollada en el curso del tratamiento del melanoma metastásico. Hasta la fecha, 13 casos con melanoma metastásico han sido tratados en nuestro centro con ipilimumab. Los datos clínicos y analíticos se resumen en la tabla 1.
Características clínicas y de laboratorio de la serie de casos
| Caso 1 | Caso 2 | Caso 3 | |
| Sexo | Hombre | Mujer | Hombre |
| Edad (años) | 41 | 51 | 65 |
| Estadio tumoral | IV | IV | IV |
| Localización M1 | Hepática y ganglionar | Pulmonar | Pulmonar y ganglionar |
| Tiempo | Posterior a la 3a dosis | Posterior a la 3a dosis | Posterior a la 3a dosis |
| Sintomatología | Cefalea | Astenia | Astenia |
| Prolactina (ng/mL) (2,8-15) | 3,09 | 27 | ND |
| IGF-1 (ng/mL) (171-333) | <36 | 151 | ND |
| TSH (mUI/L) (0,4-4,0) | 0,12 | 1,11 | 0,05 |
| T4L (ng/dL) (0,8-2) | 0,44 | 0,65 | 0,80 |
| ACTH (pg/mL) (10-60) | 20 | 6 | 7 |
| Cortisol (ug/dL) (10-25) | <0,20 | 0,45 | 2,50 |
| LH (U/L) H (1,5-7,5) M (2,9-8,7) | 1,09 | 6,85 | 0,18 |
| FSH (U/L) H (1,7-8,0) M (6,4-10) | 3,93 | 8,31 | 1,60 |
| Testosterona (ng/dL) (275-850) | Indetectable | Indetectable | |
| Estradiol (pg/ml) (22-55) | 108 | ||
| Sodio plasmático (mEq/L) (135-145) | 138 | 140 | 139 |
| Signos de hipofisitis en RM | SÍ | No | No |
ACTH: corticotropina; H: hombre; IFG-1: factor de crecimiento insulínico tipo 1; FSH: folitropina; LH: hormona luteinizante; M: mujer; M1: metástasis primaria;ND: datos no disponibles; RM: resonancia magnética; TSH: tirotropina; T4L: tiroxina libre.
Caso 1: hombre de 41 años, afecto de melanoma estadio iv, con metástasis hepáticas y ganglionares. Tras la tercera dosis de ipilimumab presentó cefalea holocraneana y disminución de la libido. La analítica mostró insuficiencia suprarrenal e hipotiroidismo e hipogonadismo secundarios. En la RM se constató el aumento global de la glándula hipofisaria con captación heterogénea del contraste intravenoso, con varios focos hipocaptantes, compatible con hipofisitis.
Caso 2: mujer de 51 años, afecta de melanoma estadio iv, con metástasis pulmonares. Tras la tercera dosis de ipilimumab desarrolló clínica de astenia marcada; la analítica hormonal demostró déficit de ACTH y TSH; la imagen hipofisaria en la RM fue normal.
Caso 3: hombre de 65 años, afecto de melanoma estadio iv, con metástasis ganglionares y pulmonares. Tras la tercera dosis de ipilimumab presentó astenia y desorientación temporo-espacial; en la analítica hormonal se evidenció déficit corticotropo y gonadotropo secundarios, si bien las concentraciones de T4L estaban dentro de los límites de la normalidad; la afectación de los demás ejes evidenciaba el origen central del déficit tirotropo; la imagen hipofisaria fue normal.
Los 3 casos fueron tratados con glucocorticoides a dosis altas (dexametasona 4mg/6h), que se redujeron de forma progresiva durante un mes hasta llegar a la dosis sustitutiva. Además, recibieron tratamiento hormonal sustitutivo con levotiroxina y testosterona, según los déficits encontrados. Hasta la fecha del envío de la publicación no presentaron recuperación de los ejes hormonales afectos. Todos recibieron la cuarta dosis de ipilimumab según lo previsto en su plan terapéutico.
La disrupción de la tolerancia del sistema inmunitario frente a los antígenos localizados en las células tumorales constituye uno de los nuevos abordajes del tratamiento del cáncer3.
En la activación de la respuesta inmune celular, los receptores de los linfocitos T (LT) interactúan con las moléculas del complejo mayor de histocompatibilidad de las células presentadoras de antígenos (APC). La coestimulación producida por la unión del ligando B7 de las APC con el CD28 de los LT permite la activación de estos últimos. Por otra parte, la activación y proliferación de los LT resulta inhibida si se produce una señal negativa mediada por la unión del mismo ligando B7 de las APC con el CTLA-44, con modulación de la formación de autoanticuerpos5.
Ipilimumab (Yervoy; Bristol-Myers Squibb, Princeton, NJ, EE. UU.), una inmunoglobulina (IgG1) monoclonal totalmente humana contra el CTLA-4, impide la unión de este último al receptor B7; en consecuencia, se produce activación y proliferación de los LT, con efecto antitumoral y aumento de la formación de autoanticuerpos. Fue aprobado en marzo de 2011 por la FDA y en julio de 2011 por la EMA para el tratamiento del melanoma metastásico. Además, hay actualmente en curso en el mundo 47 ensayos clínicos con este agente en diversas neoplasias6. El tratamiento de inducción consiste en un ciclo de 4 dosis de 3mg/kg por vía intravenosa, que se repite cada 3 semanas.
La disrupción de la tolerancia inmune a los antígenos de las células neoplásicas no está libre de consecuencias adversas en relación con la activación de fenómenos de autoinmunidad. La hipofisitis autoinmunitaria secundaria al tratamiento con ipilimumab ha sido reportada hasta en el 17% de los pacientes con melanoma y cáncer de células renales tratados con este fármaco3. Aparece como media en la semana 11 de tratamiento, generalmente antes de la cuarta dosis, lo que sugiere un efecto acumulativo. La presentación clínica no difiere de la hipofisitis por otras causas. En todas las hipofisitis por ipilimumab descritas hay afectación de ACTH y TSH; la mayoría de los varones presentan hipogonadismo hipogonadotrópico, y solo existe un caso descrito asociado con diabetes insípida3 y uno con secreción inapropiada de arginina vasopresina7.
En la RM hipofisaria se pueden encontrar los cambios típicos hallados en otras hipofisitis autoinmunitarias, como el aumento global, uniforme y homogéneo de la glándula, generalmente moderado; en ocasiones se observa disminución de la hiperintensidad de la señal característica de la neurohipófisis. Se han descrito casos de hipofisitis por ipilimumab con neuroimagen normal.
El tratamiento recomendado para los efectos adversos inmunomediados se basa en el empleo de altas dosis de glucocorticoides (dexametasona 4mg/6h o metilprednisolona 1-2mg/kg/día), con descenso progresivo en un mes hasta alcanzar dosis sustitutivas de glucocorticoides. Aún queda por establecer si estas dosis altas de glucocorticoides son necesarias, o si se podría iniciar el tratamiento con dosis cercanas a las fisiológicas. Por otra parte, se deben emplear levotiroxina y testosterona a dosis sustitutivas adecuadas según los hallazgos en cada caso4,8.
Hasta ahora, hay un solo caso publicado en el que la función corticotropa se ha recuperado3. La función tiroidea se recupera en el 37-50% de los casos3,9, y la gonadal masculina en un 57%10.
En conclusión, describimos 3 casos clínicos de hipofisitis inmunomediada en el contexto del tratamiento del melanoma maligno metastásico con ipilimumab.
Ante la introducción de nuevas terapias inmunomoduladoras que potencialmente pueden producir efectos adversos endocrinológicos es importante identificar y describir esta causa de hipofisitis y mantener una actitud de alerta ante su posible desarrollo. Se podrán así prevenir demoras en su tratamiento y evitar las consecuencias de un hipopituitarismo, especialmente la insuficiencia suprarrenal no sustituida.