INTRODUCCIÓN
La acromegalia sigue siendo una enfermedad objeto de profunda investigación ante la falta de acuerdo unánime con respecto a cuáles son los parámetros bioquímicos más adecuados para monitorizar su actividad.
Sobre la base de la pulsatilidad de la secreción de hormona del crecimiento (GH) en el individuo sano, se ha considerado la determinación basal aislada de GH como un parámetro poco adecuado para valorar el grado de hipersecreción hormonal en la acromegalia y se ha recomendado la realización de determinaciones seriadas de la hormona. Sin embargo, esto supone no sólo una mayor incomodidad para el paciente, sino también un considerable incremento en la utilización de recursos humanos y económicos. En el presente estudio se analiza la utilidad de la determinación aislada de GH sobre la base de la información proporcionada por el estudio de secreción espontánea de GH.
Fig. 1. Correlación entre concentración de GH basal y concentración integrada de GH.
PACIENTES Y MÉTODO
Se ha realizado un estudio retrospectivo de una población total de 24 pacientes acromegálicos diagnosticados en el Hospital General Universitario de Alicante entre los años 1987 y 2000 y a quienes se había realizado un estudio de secreción espontánea de GH durante la evaluación de la acromegalia.
El diagnóstico de acromegalia se estableció ante la presencia de signos y síntomas compatibles y falta de supresión de las concentraciones de GH por debajo de 2 ng/ml tras una sobrecarga oral de glucosa.
Una vez confirmado el diagnóstico se realizó un estudio de secreción espontánea de GH. Las muestras de sangre se obtuvieron mediante una bomba de extracción continua tipo CORMED (modelo ML 6-5, Cormed Inc., Medina, New York), unida a un catéter no trombogénico (Cormed) heparinizado y con separación de alícuotas cada 20 min. Tras la separación del plasma, las muestras fueron congeladas a 70 ºC hasta su ulterior procesamiento para las determinaciones hormonales. Con el total de muestras obtenidas durante el estudio (30-72) se obtuvo un pool para determinar la concentración integrada de GH. El estudio se prolongó entre 10 y 24 h. En 11 pacientes tuvo que ser interrumpido antes de completarse las 24 h debido a la obstrucción del catéter, pero en ningún caso duró menos de 10 h. En todos los casos el estudio se inició a las 21:00 h, de forma que todos los pacientes fueron al menos evaluados durante el período nocturno. Los pacientes fueron acomodados en una habitación tranquila, con condiciones óptimas para el sueño. No se restringió ni su actividad física ni su ingesta alimentaria y las luces se mantuvieron apagadas desde las 23:00 h hasta las 7:00 h.
Para el análisis de secreción de pulsos se utilizó el programa computarizado PULSAR. Se calculó la concentración integrada de GH, el área bajo la curva sobre la línea 0 (AUC0), el área bajo la curva sobre la línea de base (AUCB) y el cociente AUCB/AUC0. Como parámetros de pulsatilidad se evaluaron la frecuencia de los pulsos de secreción, su altura, su amplitud y su duración. Se comparó la GH basal obtenida en una determinación aislada con la concentración integrada de GH.
Las concentraciones de GH séricas fueron determinadas mediante un ensayo inmunorradiométrico (IRMA) utilizando un equipo comercial Tandem-R hGH (Hybritech Europe, S.A., Liège, Bélgica). El coeficiente de variación intraensayo fue del 6,6% y la sensibilidad del método fue menor de 0,2 ng/ml.
Dado el extenso período de tiempo evaluado en el presente estudio, las técnicas de determinación hormonal utilizadas por nuestro laboratorio para cuantificar el insulin-like growth factor 1 (IGF-1) han variado. Por este motivo se ha utilizado la desviación estándar de IGF-1 con respecto a los valores normales para cada método empleado, y no las concentraciones absolutas.
Para el análisis estadístico de los resultados se ha utilizado el programa SPSS 8.0 y se han empleado pruebas estadísticas no paramétricas. Las variables se expresan como la mediana de la población y los percentiles 25 y 75. Para la correlación entre variables se ha utilizado el test Rho de Spearman. Se ha considerado la existencia de asociación estadística con niveles de significación superiores al 95% (p < 0,05).
RESULTADOS
Para el grupo completo de pacientes estudiados, la concentración integrada de GH fue de 6,4 ng/ml (p25 = 5; p75 = 17,5), la concentración basal de GH de 6,7 ng/ml (p25 = 4,6; p75 = 22,2) y las desviaciones estándar de IGF-1 de 2,9 (p25 = 2,3; p75 = 4,9). El área bajo la curva sobre la línea 0 (AUC0) fue de 365,1 ng/ml (p25 = 161,5; p75 = 1095,5) y el área bajo la curva sobre la línea de base (AUCB) fue de 3,1 ng/ml (p25 = 0,1; p75 = 26,3). Se obtuvo un cociente AUCB/AUC0 de 5,6 * 103 (p25 = 0,00; p75 = 5,5 * 102), lo que evidencia que la secreción de GH fue predominantemente tónica (fig. 4).
Fig. 4. Estudio de secreción espontánea de GH en 2 pacientes.
Se registró una mediana de 0 pulsos de secreción (p25 = 0; p75 = 1) en 15,5 h (p25 = 10; p75 = 22,5), con un rango que osciló entre 0 y 12. Sólo 8 de los 24 pacientes estudiados (33,3%) tuvieron al menos un pulso de secreción. El intervalo entre los pulsos de secreción fue de 7,6 h (p25 = 2,5; p75 = 10,5). La altura (desde la línea 0) de los pulsos de secreción fue de 21 ng/ml (p25 = 10,4; p75 = 93,6) y su amplitud (desde la línea de base) de 10,2 ng/ml (p25 = 4,6; p75 = 20,1). La duración mediana de los pulsos fue de 1,2 h (p25 = 0,4; p75 = 1,9).
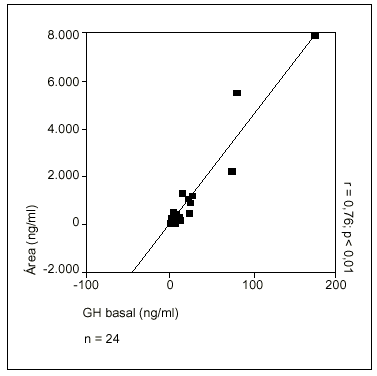
Se objetivó una fuerte correlación entre la concentración basal de GH y la CIGH (r = 0,83; p = 0,000) (fig. 1), así como entre la GH basal y el AUC0 (r = 0,76; p = 0,000) (fig. 2), pero no entre GH basal o CIGH y AUCB, datos también en concordancia con un patrón tónico de secreción de GH. Además, se demostró una marcada correlación entre la altura de los pulsos de secreción con la GH basal (r = 0,97; p = 0,000) y con la CIGH (r = 0,97; p = 0,000), así como entre la amplitud de los pulsos de secreción y la GH basal (r = 0,92; p = 0,001) y la CIGH (r = 0,85; p = 0,007). Por el contrario, no hubo correlación significativa entre GH basal o CIGH y la duración de los pulsos de secreción.
Fig. 2. Correlación entre concentración de GH basal y área bajo la curva sobre línea 0.
Fig. 3. Correlación entre concentración integrada de GH y desviaciones estándar de IGF-1.
Se objetivó una correlación estadísticamente significativa entre la CIGH y las desviaciones estándar de IGF-1 (r = 0,42; p = 0,03) (fig. 3), así como entre el área bajo la curva sobre la línea 0 y las desviaciones estándar de IGF-1 (r = 0,48; p = 0,01).
Por el contrario, no se encontró una correlación significativa entre la concentración de GH basal y las desviaciones estándar de IGF-1 (r = 0,36; p = 0,06), aunque sí se evidenció una tendencia hacia concentraciones más elevadas de GH basal con mayores desviaciones estándar de IGF-1.
DISCUSIÓN
En sujetos sanos se estima que aproximadamente el 75% de la secreción de GH se produce en forma de pulsos y el 25% de forma tónica. En los pacientes del presente estudio, sólo el 5,6% de la secreción total de GH ha sido pulsátil. Pese a que no se ha evaluado un grupo control, es evidente que en nuestra población de pacientes acromegálicos la secreción de GH ha sido predominantemente tónica. Esta disminución del cociente secreción pulsátil/secreción no pulsátil en la acromegalia ha sido descrita por otros autores con anterioridad1-4.
Esta secreción tónica preferente de GH durante la acromegalia justifica la excelente correlación encontrada en el presente estudio entre la concentración de GH basal y la concentración integrada de GH (r = 0,83) y el área bajo la curva sobre la línea 0 (r = 0,89).
Esta misma correlación ha sido encontrada por otros autores1,5,6 y permite utilizar la determinación aislada de GH basal como indicadora del estado secretor de GH en la acromegalia. Aun así, determinados autores recomiendan la medición de GH en un pool de al menos 9 muestras obtenidas durante 3 h por la mañana para estimar el estado secretor de GH durante la evaluación de la acromegalia. En nuestra opinión, basada en los resultados descritos, la determinación puntual de GH permite valorar adecuadamente el estado de hipersecreción hormonal en la acromegalia, pudiendo obviarse la realización de determinaciones seriadas de la hormona, que no sólo no aporta información relevante, sino que, por el contrario, dificulta y encarece el estudio bioquímico de la acromegalia. Aunque los resultados del presente estudio se han obtenido durante la evaluación diagnóstica inicial de la acromegalia, consideramos que las conclusiones son aplicables también para el seguimiento de la enfermedad activa, lo que supone una considerable simplificación del mismo.
La determinación aislada de IGF-1 también podría ser un buen parámetro de evaluación en el diagnóstico y seguimiento de la acromegalia. El IGF-1 circulante es una proteína cuya síntesis, preferentemente hepática, depende de la GH. Circula en sangre formando parte de un complejo ternario bastante estable y no presenta las fluctuaciones secretoras de la GH, por lo que durante los últimos años se ha aceptado la medición puntual de la concentración sérica de esta proteína como un fiel reflejo del estado secretor de GH. En este sentido, se ha demostrado la existencia de una correlación positiva entre IGF-1 y la concentración integrada de GH5,7, y algunos autores han publicado que la concentración de IGF-1 se correlaciona con la gravedad clínica de la enfermedad8,9.
En el presente estudio se ha evidenciado una correlación positiva entre las concentraciones de IGF-1 y el valor integrado de GH y el área bajo la curva sobre la línea 0, lo cual de alguna forma valida la utilización de este parámetro en el diagnóstico y seguimiento de la acromegalia, máxime cuando coincide con la opinión de otros autores y forma parte en este momento de los criterios de control de la enfermedad establecidos en el consenso Criteria for cure of acromegaly: A consensus Statement10.
Sin embargo, pese a la indudable utilidad del IGF-1 en la monitorización de los pacientes acromegálicos, continúa siendo una estimación indirecta de la actividad de la enfermedad y su idoneidad se encuentra limitada por varias razones.
Se ha demostrado que la correlación entre GH e IGF-1 es lineal hasta concentraciones de GH de aproximadamente 15-20 ng/ml. Incrementos de GH por encima de estas cifras no modifican las concentraciones de IGF-1, que ya están máximamente estimuladas1,5,6. Pero, además, se ha evidenciado que la concentración de IGF-1 depende no sólo de la cantidad de GH secretada, sino también de su patrón de secreción. Así, para una misma concentración de GH secretada, las concentraciones de IGF-1 serán más altas si el patrón de secreción es predominantemente tónico que si es pulsátil1. Además, las concentraciones de IGF1 están influidas por otra serie de factores independientes de la GH, como la edad, los esteroides sexuales, el estado nutricional y las concentraciones plasmáticas de sus proteínas transportadoras (IGFBP)11-14. Probablemente, estos factores adicionales sean los responsables de las discrepancias que se observan en ocasiones en los pacientes acromegálicos entre concentraciones de GH e IGF115-17.
De hecho, en el presente estudio, la correlación de IGF-1 con la capacidad secretora tumoral estudiada mediante la concentración integrada de GH (r = 0,42) ha sido sustancialmente menor a la de la GH basal. Si además se tiene en cuenta que concentraciones de GH inferiores a 2 ng/ml no asocian un aumento de morbimortalidad respecto a la población normal, independientemente de las concentraciones de IGF-118,19, es prudente no sobrevalorar al IGF-1 como parámetro de seguimiento en la acromegalia.
Por tanto, teniendo en cuenta que la concentración de GH plasmática es el único parámetro con valor pronóstico establecido en la acromegalia, y al menos hasta que aparezcan resultados sobre la utilidad pronóstica de las concentraciones de IGF-1, consideramos necesaria la medición tanto de IGF-1 como de GH en la monitorización de la enfermedad. A la vista de los presentes resultados sería suficiente una determinación aislada de GH, puesto que la medición seriada no reporta mayor información y sí un mayor consumo de recursos humanos y materiales.