Evaluar el efecto de la lipemia pos-prandial sobre la función endotelial, la resistencia a la insulina y el perfil de lípidos en sujetos sanos.
Materiales y métodosEstudio de intervención prospectivo en 14 hombres jóvenes sanos entre los 18 y 25 años de edad a los que se administró una comida rica en grasas. La función endotelial se midió a través de vasodilatación mediada por flujo (VMF) en arteria braquial, la velocidad de flujo y los niveles séricos de nitritos/nitratos (NO2/NO3). Se evaluaron los niveles de glucosa, insulina, colesterol total y triglicéridos. La resistencia a la insulina se determinó mediante el cálculo del índice homeostatic model assessment–insulin resistance (HOMA-IR).
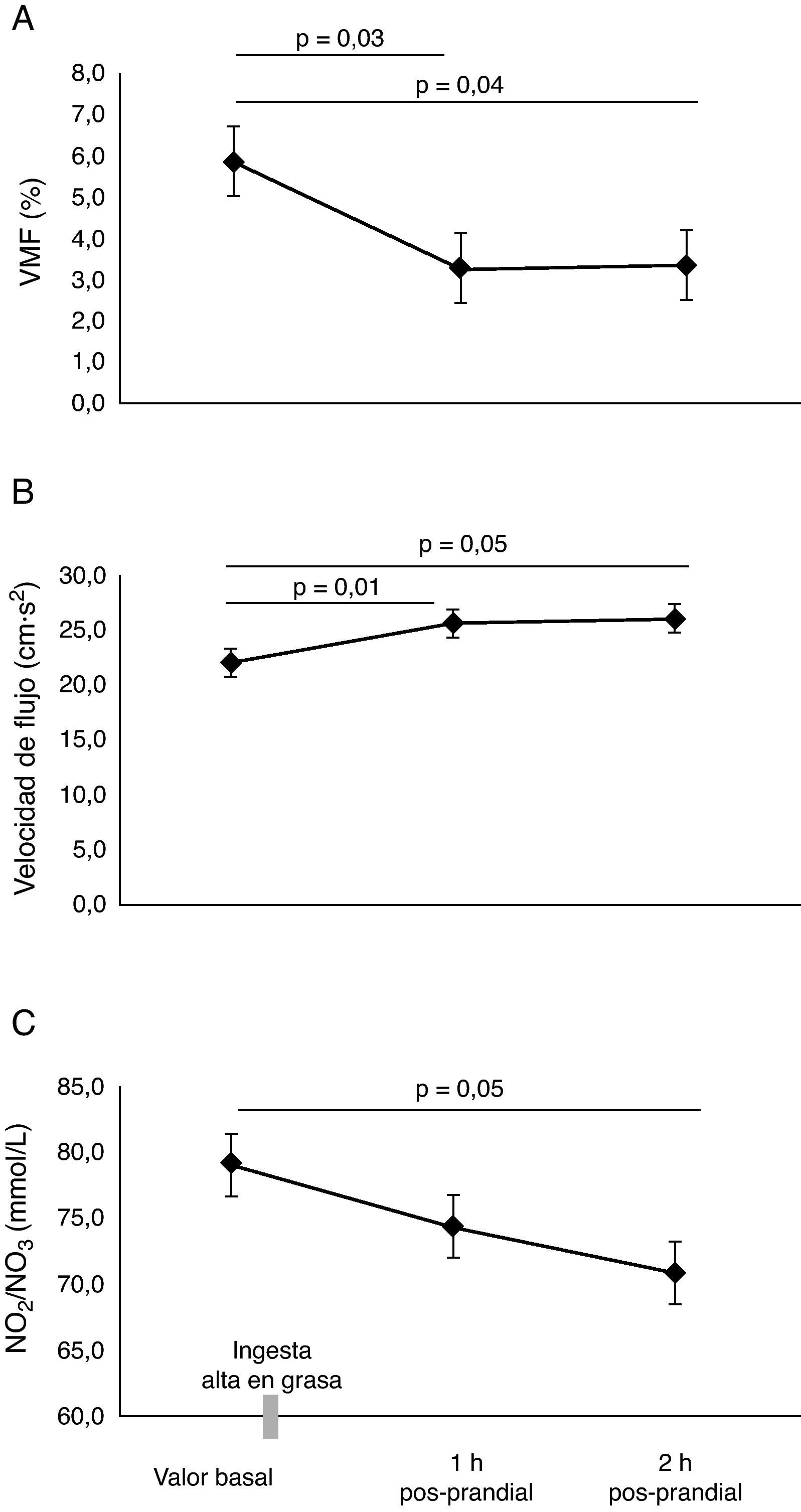
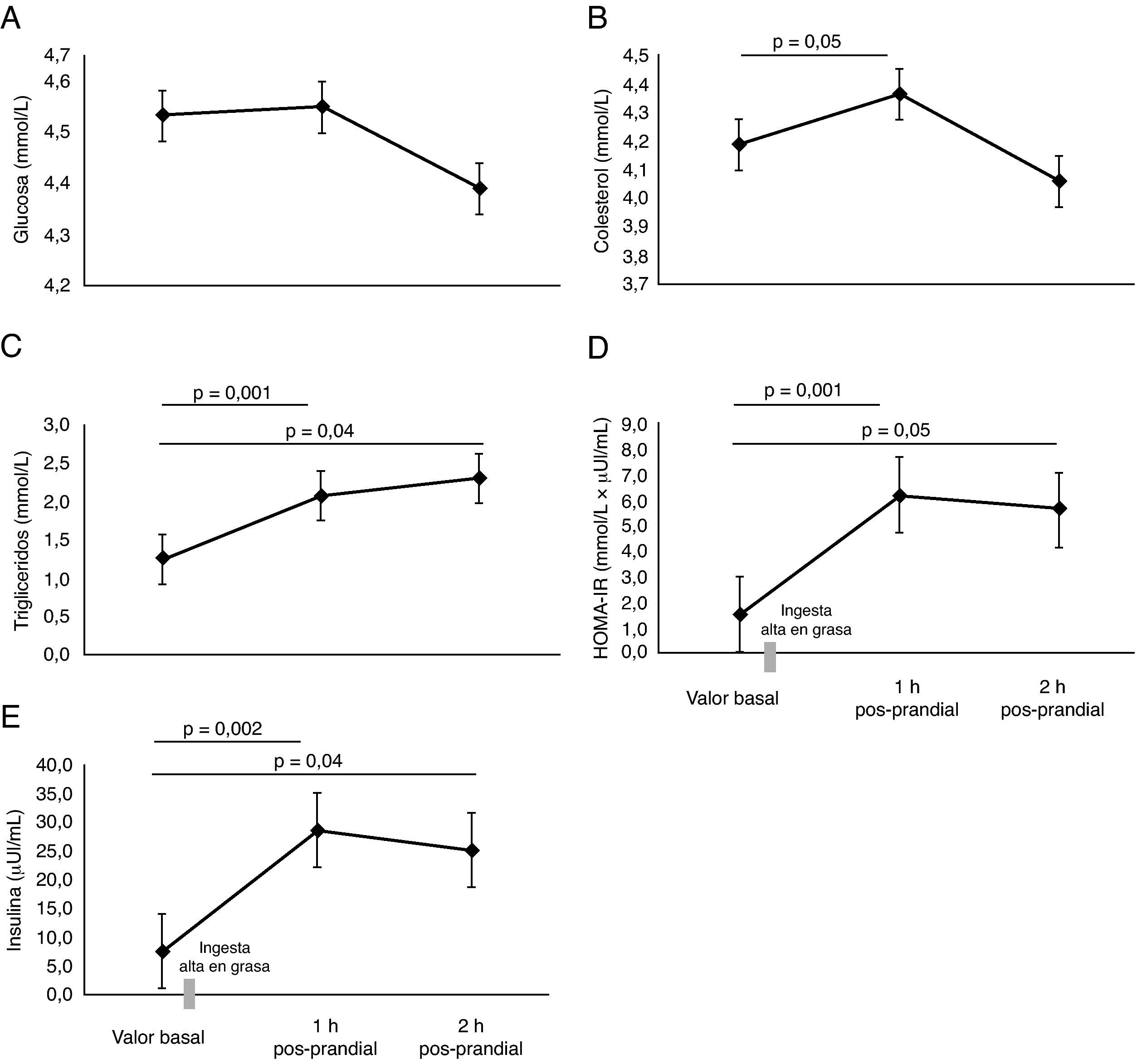
ResultadosEl valor basal de la VMF fue de 5,9±1,1%. Se identificó que la lipemia pos-prandial reducía la función endotelial aproximadamente en 50%, en la primera (3,3±0,5%, p=0,03) y segunda hora (3,3±0,4%, p=0,04), respectivamente. Este hallazgo se acompañó de un incremento en la velocidad del flujo braquial, la presión arterial media y menores niveles de NO2/NO3 (p<0,05). Se encontraron mayores niveles de colesterol total y triglicéridos a la 1h y 2h pos-prandial (p<0,05). El HOMA-IR, se encontró significativamente elevado comparado a la 1h y 2h pos-prandial, (p<0,05).
ConclusionesLa lipemia pos-prandial induce cambios en el perfil de lípidos circulantes e induce disfunción endotelial y mayor grado de resistencia a la insulina.
To assess the effect of postprandial lipemia on endothelial function, insulin resistance, and lipid profile in healthy subjects.
Patients and methodsA prospective‘, interventional study in 14 healthy young men aged 18-25 years who were given a high-fat meal. Endothelial function was measured using flow-mediated dilation (FMD) in the brachial artery, flow velocity, mean arterial pressure and serum nitrite/nitrate levels (NO2/NO3). Glucose, insulin, total cholesterol, and triglyceride levels were also tested. Insulin resistance was determined by calculating the HOMA-IR index (Homeostatic Model Assessment-Insulin Resistance).
ResultsBaseline FMD was 5.9 ± 1.1%. Postprandial lipemia reduced endothelial function by approximately 50% in the first (3.3 ± 0.5%, p=0.03) and second (3.3 ± 0.4%, p=0.04) moment respectively. This finding was associated to an increased flow rate in the brachial artery and lower NO2/NO3 levels (p<0.05). Higher cholesterol and triglyceride levels were found 1h and 2h postprandial (p<0.05). HOMA-IR was significantly increased 1h and 2h postprandial (p<0.05).
ConclusionsPostprandial lipemia causes changes in circulating lipid profile and induces endothelial dysfunction and higher insulin resistance.
Estudios epidemiológicos1,2, clínicos3,4 y experimentales5,6 han señalado la asociación entre el metabolismo pos-prandial de las lipoproteínas ricas en triglicéridos y la presencia de enfermedades cardiovasculares y metabólicas. La lipemia pos-prandial es un estado metabólico caracterizado por un incremento exagerado en plasma de las concentraciones de triglicéridos, consecuencia del aumento en su aclaramiento, luego de una ingesta alta en grasa7. Durante este período se ha observado también un incremento de remanentes de quilomicrones (QM) y very low density lipoprotein (VLDL ), promoviendo la formación de low density lipoprotein (LDL) pequeñas y densas, así como la disminución en las concentraciones de high density lipoprotein (HDL)8.
A largo plazo, este estado metabólico induce un deterioro de la función vascular y un aumento en el estrés oxidativo9,10. El estrés oxidativo y la disfunción endotelial son considerados factores de riesgo importantes en el desarrollo y la progresión de la aterosclerosis11, y ambas condiciones se han asociado con un mayor riesgo de morbi-mortalidad por todas las causas12. No obstante, otros autores han añadido que factores genéticos13 y medioambientales14, entre los que se destacan la disminución de la sensibilidad a la insulina secundaria a la obesidad y dietas ricas en carbohidratos, pueden generar niveles basales aumentados de triglicéridos, favoreciendo también la aparición de enfermedades cardiometabólicas15.
Otro aspecto relevante en el estado pos-prandial es el efecto de la insulina y la sensibilidad a la misma, considerados importantes biomarcadores del riesgo cardiovascular16,17. La insulina facilita la entrada de los ácidos grasos libres, su esterificación y el almacenamiento en forma de triglicéridos en el tejido adiposo. En situaciones de resistencia a la insulina (RI) esto no ocurre, de modo que en situación pos-prandial circula una cantidad inadecuada de ácidos grasos libres que reduce la sensibilidad a la misma y acentúa la lipemia pos-prandial, reduciendo también la vasodilatación dependiente del endotelio y la consecuente disfunción endotelial18. Si tenemos en cuenta que gran parte del ciclo vital humano se encuentra en estado pos-prandial, este puede considerarse como un importante factor metabólico en el estudio del riesgo cardiovascular. El objetivo de este estudio fue evaluar el efecto de la lipemia pos-prandial sobre la función endotelial, la resistencia a la insulina y el perfil de lípidos en sujetos sanos.
MétodosEstudio de intervención prospectivo en 14 hombres jóvenes aparentemente sanos entre los 18 y 25 años de edad. Los sujetos incluidos en el estudio pertenecían a una institución de educación superior de la ciudad de Cali (Colombia) y fueron seleccionados a través de muestreo consecutivo durante el primer trimestre del 2011. Se excluyeron sujetos con antecedentes personales de tabaquismo, cirugía o trauma mayor reciente, enfermedad endocrina, autoinmune, respiratoria o cardiaca (<1 mes al estudio) e índice de masa corporal (IMC) mayor a 28kg/m2. Adicionalmente, una encuesta de hábitos alimentarios, datos sociodemográficos y consentimiento informado, previa aprobación de comité de ética (UV 10-09) fueron obtenidos. Las variables antropométricas (peso, talla, IMC, % de grasa) se determinaron según el protocolo de Estrada19 y Ramírez-Vélez et al.20 en población colombiana.
Tras ayuno aproximado a 12 h, se extrajo por punción en vena antecubital 10mL de sangre en tubos sin aditivo para la determinación de glucosa, y la de colesterol total y triglicéridos (TAG) por método colorimétrico directo en espectrofotómetro automatizado (Biosystems, España)21. Los niveles de insulina se determinaron por ensayo de quimioluminiscencia (Immulite 1000, San José, EE.UU.)22. Con estos resultados se calculó el índice de resistencia a insulina (HOMA-IR: Homeostatic Model Assessment-Insulin Resistance) a partir de la fórmula: HOMA-IR = glucosa en ayunas (mmol/L) × insulina en ayunas (μU/mL)/22,523. La medición en suero de los metabolitos del óxido nítrico (NO), nitritos/nitratos (NO2/NO3) se realizó por ensayo colorimétrico (Cayman Chemical, EE.UU.)24, como un indicador de la producción y biodisponiblidad in vivo del NO.
La función endotelial se evaluó mediante la prueba vasodilatación mediada por flujo (VMF), técnica que comprende la visualización de la arteria braquial, la medición de su diámetro y la velocidad del flujo sanguíneo, a través de imágenes por pletismografía vascular25,26. Tras cinco minutos de reposo, se colocó al paciente en decúbito supino; en esta posición, se realizó la medición del calibre de la arteria braquial, un minuto antes y uno después de ocluirla con el brazalete del esfigmomanómetro durante cinco minutos (presión de 60mmHg por encima de la presión arterial sistólica basal). Se colocó el transductor de 7,5mH a 60° en relación con el eje longitudinal del vaso y se midió la velocidad del flujo arterial (cm·s2). Se congeló la imagen cuando coincidió con el período QRS del electrocardiograma y se identificó la interfase luz-íntima. Se midió el diámetro y área de la arteria (mm), y se marcó la piel del brazo para la colocación posterior del transductor (en la misma posición) para posteriores mediciones. La VMF se expresó como el porcentaje de cambio del diámetro arterial calculado con la formula VMF = (pico del diámetro hiperémico–diámetro arterial basal)/diámetro arterial basal × 100. Se calculó el estrés de fricción endotelial (EFE) de la arteria braquial (dinas·cm-2) utilizando la fórmula: EFE= (Vm·D-1), donde Vm = velocidad media o pico de la sangre (cm·s-1) y D-1 = diámetro basal braquial arterial medio (cm)27. Durante esta medición, se registraron las cifras tensionales siguiendo las recomendaciones del American Heart Association28, con esfingomanómetro automático Omron®. La presión arterial media se calculó mediante la fórmula: (2 × presión arterial diastólica + presión arterial sistólica)/3. El efecto de la ingesta alta en grasa sobre los marcadores vasculares y cardiovasculares se realizó tras un ayuno de 8-12h (valor basal), y a 1h y 2h post-ingesta, y todos los sujetos recibieron una dieta estándar baja en nitratos 24 h antes de las pruebas.
Para inducir el estado de lipemia pos-prandial se elaboró un menú que contenía 1.049 calorías, de los cuales 31g provenían de proteínas, 79g de grasas (31g de grasa saturada), 666mg de colesterol y 69g de carbohidratos (software Ceres Versión 1.02, 1997, FAO). Un estudio piloto confirmó que esta ingesta producía alteración transitoria de la función endotelial.
Los datos se presentaron como media ± error estándar de la media (EEM) para las variables metabólicas y vasculares, y media ± desviación estándar (DE) para las características de los sujetos. Se usó el test de Shapiro-Wilk para valorar la normalidad de los datos continuos. Se usó un análisis de varianza de medidas repetidas (ANOVA one way) con prueba pos-hoc T3 de Dunnett, un análisis factorial de varianza o la prueba de Kruskall-Wallis según la distribución de las variables, para examinar las diferencias entre los distintos tiempos. Se atribuyó significación estadística a un valor p≤0,05, y los datos se procesaron en el programa SPSS 15.0 (SPSS Inc., Chicago, EE.UU.).
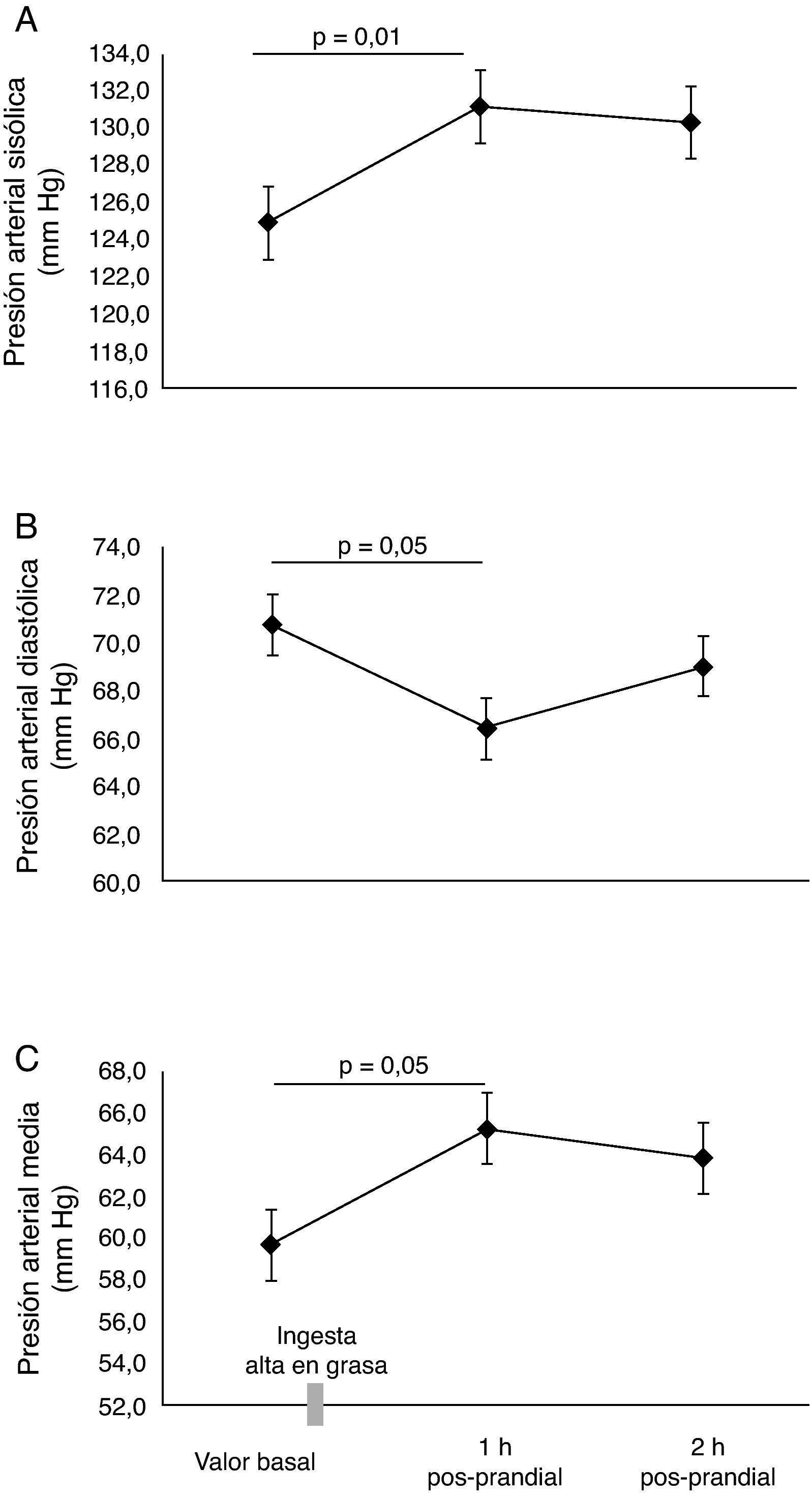
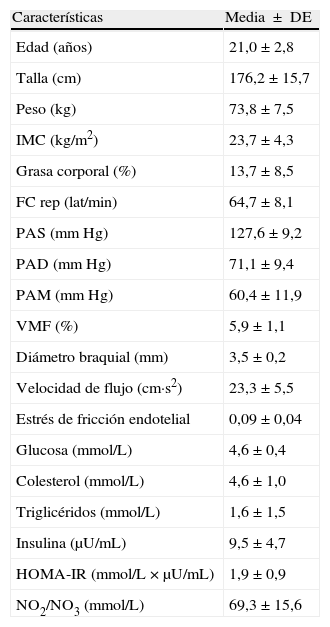
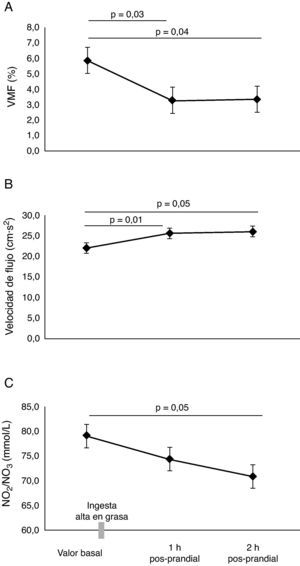
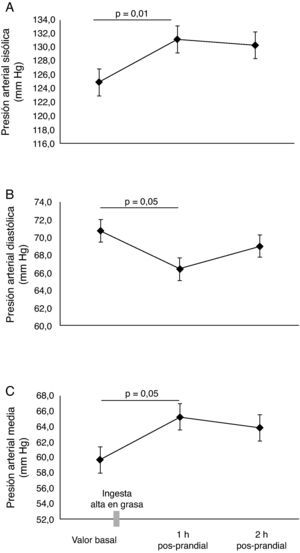
ResultadosEn la tabla 1, se resumen las características basales de los participantes. Todos los parámetros evaluados estaban en el rango considerado como saludables para esta edad. En los sujetos evaluados, el valor de la VMF fue de 5,9±1,1% en la determinación basal. Se identificó que la lipemia pos-prandial reducía la función endotelial aproximadamente en 50% en la primera (3,3±0,5%, p=0,03), y segunda hora (3,3±0,4%, p=0,04), respectivamente (fig. 1A). Este hallazgo se acompañó de un incremento significativo en la velocidad del flujo de la arteria braquial (fig. 1B), pasando de 22±1,2cm·s2 en estado basal, a 25,6±1,5cm·s2 al cabo de 1h y 26,0±1,7cm·s2 a las 2h pos-prandial, respectivamente (p < 0,05). Al comprobar el metabolismo del NO, se observaron menores niveles de NO2/NO3 al cabo1h (74,4±4,4mmol/L) y 2h (70,9±3,8mmol/L, p=0,05) pos-prandial vs. el valor basal (79,1±6,0mmol/L) (fig. 1C). Se observó también un incremento de la presión arterial sistólica, diastólica y media de manera significativa a 1h pos-prandial (p<0,05) (fig. 2A, B y C).
Características basales de los sujetos de estudio
| Características | Media ± DE |
| Edad (años) | 21,0±2,8 |
| Talla (cm) | 176,2±15,7 |
| Peso (kg) | 73,8±7,5 |
| IMC (kg/m2) | 23,7±4,3 |
| Grasa corporal (%) | 13,7±8,5 |
| FC rep (lat/min) | 64,7±8,1 |
| PAS (mm Hg) | 127,6±9,2 |
| PAD (mm Hg) | 71,1±9,4 |
| PAM (mm Hg) | 60,4±11,9 |
| VMF (%) | 5,9±1,1 |
| Diámetro braquial (mm) | 3,5±0,2 |
| Velocidad de flujo (cm·s2) | 23,3±5,5 |
| Estrés de fricción endotelial | 0,09±0,04 |
| Glucosa (mmol/L) | 4,6±0,4 |
| Colesterol (mmol/L) | 4,6±1,0 |
| Triglicéridos (mmol/L) | 1,6±1,5 |
| Insulina (μU/mL) | 9,5±4,7 |
| HOMA-IR (mmol/L × μU/mL) | 1,9±0,9 |
| NO2/NO3 (mmol/L) | 69,3±15,6 |
FC: frecuencia cardiaca; HOMA-IR: Homeostatic model assessment-insulin resistance; IMC: índice de masa corporal; NO2/NO3: nitritos/nitratos; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PAM: presión arterial media; VMF: vasodilatación mediada por flujo.
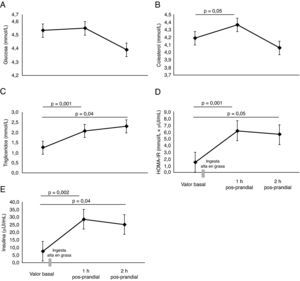
No se encontraron diferencias significativas en las concentraciones de glucosa (fig. 3A). Como era esperable, se encontraron mayores niveles de colesterol y triglicéridos a 1h y 2h pos-prandial (p=0,05) (fig. 3B y C). El HOMA-IR se encontró significativamente elevado al cabo de 1h y 2h pos-prandial (p=0,05) (fig. 3D). Las concentraciones plasmáticas de insulina fueron altas a la 1h pos-prandial frente al estado basal (7,6±1,2μU/mL vs. 28,5±5,7μU/mL, p=0,002) (fig. 3E).
DiscusiónEl hallazgo principal de este estudio es que la lipemia pos-prandial provoca cambios en el perfil de lípidos circulantes e induce disfunción endotelial y mayor grado de resistencia a la insulina (RI), determinado por el índice HOMA. Estos resultados coinciden con estudios previos que sugieren una asociación entre grados mayores de RI y el riesgo incrementado de eventos cardiovasculares en sujetos con características similares a las de este estudio29,30. Aunque se desconoce exactamente el mecanismo responsable de la disminución de la función vascular y de la RI ocasionada por la lipemia pos-prandial, se considera que la elevación de las lipoproteínas ricas en triglicéridos como quilomicrones y VLDL, sus remanentes, junto a un estado de estrés oxidativo son los principales mecanismos que podrían explicar este estado metabólico31.
La marcada reducción (descenso de 50%) de la VMF a la primera pos-prandial (p=0,03) en este estudio es consistente con los resultados de De Koning y Rabelink29, Tsai et al.32, y Kovacs et al.33. No obstante, las diferencias con otros estudios que no han encontrado estos mismos cambios pueden ser explicadas por la edad de los participantes, la composición de lípidos de la dieta administrada, el momento de las mediciones vasculares y/o el sexo de los sujetos estudiados10,13. Del mismo modo, un hallazgo similar fue comunicado en sujetos diabéticos y no diabéticos tras una ingesta alta en grasa. Por ejemplo, Tsai et al.32 observaron que tras una ingesta alta en lípidos –similar a la del presente estudio– se incrementa la concentración de triglicéridos de 8-PFG-2α (un marcador de estrés oxidativo), y se produce un descenso de la actividad GSH-Px (glutatión peroxidasa); estos hallazgos son consistentes con la reducción significativa de la VMF en este trabajo. Asimismo, se ha demostrado que la función vascular mejora tras el tratamiento con ciprofibrato33 o con la ingesta de suplementos con vitamina C y vitamina E6.
Existe evidencia que un incremento en el aclaramiento de los triglicéridos en el plasma puede ocasionar disfunción endotelial y RI, hallazgo que fue corroborado en este estudio34. Los ácidos grasos libres pueden conducir a disfunción endotelial por el incremento en la producción del anión súperoxido (O2-), y una subsiguiente disminución de la biodisponibilidad del NO35, como el apreciado en la primera y segunda hora pos-prandiales, con los niveles plasmáticos de NO2/NO3. Los radicales libres de oxígeno, como el O2-, pueden reaccionar directamente con el NO formando peroxinitritos (ONOO–) y neutralizando la función biológica del mismo, ocasionando pérdida en la vasodilatación dependiente del endotelio36. La acumulación de ONOO– lleva a la inhibición de eNOS (sintasa de óxido nítrico; enzima encargada de la producción de NO), generando modificaciones del sistema vascular que se reflejan incluso en las cifras de presión arterial, como lo que se observa en este trabajo.
Múltiples marcadores de RI han sido estudiados como predictores de riesgo de eventos cardiovasculares, y sus resultados son heterogéneos y conflictivos23,37. El clamp hiperinsulinémico euglucémico se considera como la prueba de referencia para determinar la sensibilidad a la insulina38. Sin embargo, por su dificultad técnica, invasividad y coste no se ha considerado como una herramienta aplicable a grandes poblaciones, lo cual lleva a la utilización de alternativas de evaluación de aplicación más prácticas. El HOMA-IR ha sido utilizado como una herramienta clínica y epidemiológica, que puede sustituir al clamp37. Por ello, este modelo es una buena herramienta para el establecimiento de RI. En este estudio encontramos elevaciones significativas en este parámetro de evaluación de la RI. Aunque el HOMA-IR, por definición, es utilizado en situación de ayuno, su uso en situación pos-prandial ha demostrado explicar algunos de los mecanismos a través de los cuales la RI atenúa la hipertrigliceridemia pos-prandial. Por ejemplo, una menor actividad de la lipoproteinlipasa (LPL) inhibe el aclaramiento de los triglicéridos pos-prandiales en individuos con RI39. Por otro lado, la RI produce una menor supresión pos-prandial en la liberación hepática de partículas ricas en triglicéridos, como VLDL, e interfieren con las rutas de señalización de la insulina40.
Como se mencionó anteriormente, la etiología de las enfermedades cardiometabólicas no ha sido establecida por completo y se ha sugerido que el estado pos-prandial explicaría en parte el proceso que conlleva a su desarrollo1–7. Recientemente, se demostró que sujetos que ingieren dietas altas en grasas presentan menor función endotelial y mayores concentraciones de insulina, factor de necrosis tumoral-α y proteína C reactiva4, marcadores que también se han descrito en pacientes con enfermedades cardiovasculares relacionadas con la resistencia a la insulina41. Todos estos mecanismos fundamentan la asociación de lipemia pos-prandial y RI.
De manera general, nuestros resultados deben interpretarse con precaución debido a las limitaciones propias del estudio. En primer lugar, el pequeño número de sujetos y el rango limitado de edad deben ser considerados. Tampoco fueron tenidos en cuenta los patrones de alimentación y de actividad física de los sujetos que pueden modular la respuesta metabólica y vascular. En conclusión, nuestros resultados sugieren que una comida rica en grasas provoca cambios en el perfil de lípidos circulantes e induce disfunción endotelial y mayor grado de RI en sujetos sanos. Aunque no todos los estudios han mostrado atenuación de la VMF y mayor grado de RI en el estado pos-prandial, nuestros hallazgos pueden servir como insumo para la elaboración de estudios que investiguen y comprueben este fenómeno metabólico.
FinanciaciónEste estudio recibió soporte financiero y administrativo por parte del Programa de Medicina de la Universidad ICESI, Cali (Colombia) y el Laboratorio de Proteínas y Enzimas de la Universidad del Valle, Cali-Colombia.
Conflicto de interesesDurante la realización de este artículo, ninguno de los autores tuvo vinculación con alguna actividad que pudiera generar conflictos de interés.