1) Valorar nutricionalmente la dieta seguida por los pacientes con síndrome metabólico, y 2) analizar bioquímicamente el nivel de oxidación-reducción en los pacientes con síndrome metabólico.
Material y métodoSe trata de un estudio transversal realizado a pacientes con síndrome metabólico de la Región de Murcia. Se seleccionaron 53 individuos, 33 con síndrome metabólico y 20 sin él (grupo control). La intervención realizada consistió en la cumplimentación de una encuesta recordatorio y un test para valorar nutricionalmente la ingesta dietética, además de la determinación de variables antropométricas y analíticas que incluyen variables relacionas con la actividad antioxidante.
ResultadosLa actividad antioxidante en ambos grupos analizados está dentro de los límites normales (1,7±0,2mmol/l en el grupo control y 1,8±0,1mmol/l en el grupo con síndrome metabólico; ns). La enzima superóxido dismutasa no presenta diferencias significativas entre ambos grupos. Los valores medios de glutatión reductasa (U/l) son superiores en el grupo control que en los pacientes con SM (p<0,05). Respecto a los biomarcadores de estrés oxidativo, los valores medios de isoprostanos son superiores en el grupo control (4,9±6,2ng/ml) que en los pacientes con SM (3,5±3,9ng/ml; p<0,05). Los valores de LDL oxidadas tienden a ser superiores en los enfermos con SM (96±23,2U/l) que en el grupo control (86,2±17,3U/l), no observándose diferencias significativas.
ConclusionesExiste una tendencia a un peor perfil nutricional y bioquímico de los pacientes que presentan síndrome metabólico. También tienden a presentar un mayor grado de estrés oxidativo.
1) Nutritional assessment of the diet followed by patients with metabolic syndrome, and 2) biochemical analysis of the oxidation-reduction level in patients with metabolic syndrome.
Material and methodsA cross-sectional study was conducted in patients with metabolic syndrome in Murcia. Fifty-three patients, 33 with and 20 without (control group) metabolic syndrome, were selected. The intervention consisted of completion of a recall survey and a test to nutritionally assess dietary intake. Anthropometric and laboratory variables, including those related to antioxidant activity, were also tested.
ResultsAntioxidant activity was within normal limits in both groups (1.7±0.2mmol/L in the control group and 1.8±0.1mmol/L in the metabolic syndrome group) (NS). Superoxide dismutase levels were not significantly different between the groups. Mean glutathione reductase levels (U/L) were higher in the control group as compared to patients with metabolic syndrome (P<.05). As regards oxidative stress biomarkers, mean isoprostane levels were higher in the control group (4.9±6.2ng/mL) than in metabolic syndrome patients (3.5±3.9ng/mL) (P<.05). Oxidized LDL values tended to be higher in metabolic syndrome patients (96±23.2U/L) as compared to the control group (86.2±17.3 U/L), but differences were not significant.
ConclusionsThere is a trend to a poorer nutritional and biochemical profile in patients with metabolic syndrome, who also tend to have a greater degree of oxidative stress.
El síndrome metabólico (SM) ha incluido un conjunto de factores de riesgo representados por obesidad central, dislipidemias, anomalías en el metabolismo de la glucosa e hipertensión arterial, asociados a resistencia a la insulina, que incrementa el riesgo de diabetes mellitus, enfermedad cardiaca (infarto de miocardio e insuficiencia cardiaca), arteriopatía periférica y enfermedad cerebrovascular y renal1,2. La resistencia a la acción periférica de la insulina es el nexo patogénico común y desempeña un papel central en el desarrollo, la progresión y la inestabilización de la placa de ateroma por diferentes vías patogénicas. Así, en un mismo individuo suelen coexistir las alteraciones del metabolismo glucémico con factores de riesgo clásicos (hipertensión arterial, dislipidemia, obesidad-sobrepeso) y marcadores de riesgo vascular (inflamación, alteración en la fibrinólisis)3,4. Este conjunto de alteraciones es lo que se denominó SM, y su relación con el riesgo cardiovascular es lo que determina su importancia5–7.
La prevalencia del SM ha variado según factores como el género y la edad, y oscila entre el 15 y el 40%1,6. Existen varios criterios para el diagnóstico de SM. El más conocido es el del Third Report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III)8, donde se debían cumplir 3 o más de los siguientes criterios: perímetro abdominal elevado (>102cm en hombres y>88cm en mujeres), triglicéridos>150mg/dl, HDL bajo (<40mg/dl en hombres y<50mg/dl en mujeres), presión arterial>130/85mmHg, glucemia>110mg/dl, incluyendo diabetes mellitus. Se consideraron otros factores, como inflamación, hiperuricemia, tabaco, sedentarismo, edad, síndrome de ovario poliquístico y microalbuminuria.
Los criterios emitidos por el Adult Treatment Panel III definieron un tipo de paciente con riesgo cardiovascular alto y son los que se siguen mayoritariamente, aunque no existe uniformidad en este aspecto. Dada la evidente asociación del SM con la enfermedad cardiovascular, debe prevenirse favoreciendo la implantación de hábitos saludables desde la infancia, valorando la importancia de seguir una alimentación sana y practicar ejercicio regularmente8–13.
Se ha considerado interesante plantear un estudio que analice las características bioquímicas y nutricionales de los pacientes con SM. Por tanto, los objetivos del presente estudio han sido: 1) valorar nutricionalmente la dieta seguida por los pacientes con SM, y 2) analizar bioquímicamente el nivel de oxidación-reducción en los pacientes con SM.
Material y métodoSe ha tratado de un estudio transversal realizado a pacientes con SM de la Región de Murcia.
La muestra se obtuvo aleatoriamente mediante muestreo representativo. Se aplicó un sistema de búsqueda oportunista de pacientes que acudieron a consulta a demanda o programada de un centro de salud, cumplieran los criterios de inclusión y aceptasen participar. Está constituida por 53 individuos de ambos sexos (29 mujeres y 24 hombres), con una edad comprendida entre los 50 y 65 años. Los pacientes con SM (n=33) cumplían 3 de los requisitos establecidos por el Adult Treatment Panel III8, y el grupo control (n=20) estuvo formado por personas sanas del mismo rango de edades. La información sobre el estudio se realizó de forma individual y todos los participantes otorgaron su consentimiento informado por escrito. Fueron excluidos los sujetos que presentaban enfermedades infecciosas de cualquier índole en el momento del estudio, consumo de suplementos multivitamínicos, enfermedad renal, hepática o sistémica grave, hábitos dietéticos anormales (por ejemplo, ausencia de frutas y verduras en la dieta) e índice de masa corporal (IMC)>30Kg/m2.
La intervención realizada consistió en la cumplimentación de una encuesta recordatorio y un test para valorar nutricionalmente la ingesta dietética, además de la determinación del peso, la talla, el IMC y el perímetro de la cintura. También se les extrajo sangre de la vena antecubital para las determinaciones analíticas. La encuesta recordatorio de 24h es un método de valoración del consumo alimentario mediante entrevista, retrospectivo y cuantitativo. Este método valora la ingesta real del individuo en las 24h anteriores. Para ello, el encuestador hace recordar al individuo todos los alimentos e ingredientes consumidos el día anterior a la entrevista. En el estudio se realizaron 3 encuestas recordatorio de 24h a cada individuo durante 3 días no consecutivos, incluyendo en ellos un día festivo o un fin de semana. La valoración nutricional de los recordatorios dietéticos de 24h se llevó a cabo mediante el programa informático Valoración y soporte nutricional del paciente hospitalizado y ambulatorio, DietSOURCE® versión 2.01, elaborado por Novartis Health S. A. Se consideró que con 3 encuestas recordatorio de 24h en 3 días no consecutivos (considerando un día festivo) se podía valorar a un individuo nutricionalmente. Las encuestas se realizaron por la misma persona y directamente a cada paciente o integrante del grupo control.
Las determinaciones analíticas consistieron en la evaluación del estado antioxidante total, enzimas antioxidantes (glutatión peroxidasa, glutatión reductasa, superóxido dismutasa), marcadores de oxidación del material genético (8-hidroxi-2’-desoxiguanosina, marcadores de oxidación proteica (grupos carbonilo), marcadores de oxidación lipídica (isoprostanos, LDL oxidadas, cociente glutatión reducido/glutatión oxidado y bioquímica general (glucosa, colesterol total, colesterol HDL, colesterol LDL, triglicéridos, proteínas totales, albúmina, ácido úrico, homocisteína, urea, proteína C reactiva).
El análisis estadístico se realizó mediante el paquete estadístico SPSS® v 13.0, calculándose la media y la desviación típica de las determinaciones numéricas obtenidas. Las medias de los criterios evaluados se compararon mediante la t de Student. Se consideró significación estadística cuando p<0,05.
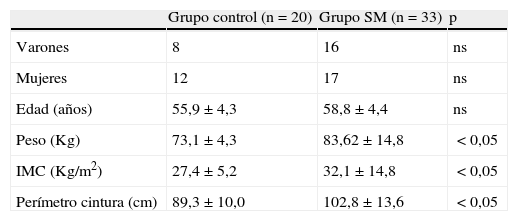
ResultadosLa edad, expresada como media (desviación típica), de los pacientes con SM fue de 58,1 (4,3)años, el peso, de 83,62 (14,8)Kg, el IMC, de 32,1 (14,8)Kg/cm2, y el perímetro de cintura, de 102,8 (13,6)cm. El grupo control presentó una edad de 55,9 (4,32)años, un peso de 73,1 (4,3)Kg, un IMC de 27,4 (5,2)Kg/cm2 y un perímetro de cintura de 102,8 (13,6)cm. Al aplicar la t de Student para muestras independientes se observan diferencias significativas (p<0,05) en el IMC, el peso y el perímetro de la cintura (tabla 1), siendo los valores mayores en los sujetos con SM.
Descripción de la muestra poblacional
| Grupo control (n=20) | Grupo SM (n=33) | p | |
| Varones | 8 | 16 | ns |
| Mujeres | 12 | 17 | ns |
| Edad (años) | 55,9±4,3 | 58,8±4,4 | ns |
| Peso (Kg) | 73,1±4,3 | 83,62±14,8 | <0,05 |
| IMC (Kg/m2) | 27,4±5,2 | 32,1±14,8 | <0,05 |
| Perímetro cintura (cm) | 89,3±10,0 | 102,8±13,6 | <0,05 |
IMC: índice de masa corporal; ns: no significativo; SM: síndrome metabólico.
Valores expresados como media±desviación típica.
El consumo medio (desviación típica) de energía en pacientes con SM fue de 1.432,5 (372,9)Kcal/día, tendiendo a ser inferior al de la población control, que fue de 1.556,5 (425,2)Kcal/día (ns). No se observaron diferencias significativas en el consumo de proteínas, siendo de 72,2 (20)g (18,3%) el consumo medio de proteínas en el grupo control, y de 63 (14)g (18%) en pacientes con SM. El consumo de proteínas medio en la población control se correspondió con 1g/Kg/día aproximadamente, y en los pacientes con SM fue de aproximadamente 1,3g/Kg/día. El consumo medio de lípidos en la población control y en los pacientes con SM fue de 38,6 (9) y 39,8 (8)%, respectivamente (ns). El consumo de ácidos grasos en la población control se correspondió con un 9,9 (3)% de ácidos grasos saturados –18,6 (9,4)g–, un 16,3% de ácidos grasos monoinsaturados –29,5 (12,5)g–, y un 5,6 (4)% de ácidos grasos poliinsaturados –11,5 (12)g–, siendo el consumo de ácido eicosapentaenoico y de ácido docosahexaenoico de 0,24 (0,26)g y 0,38 (0,35)g respectivamente, valores muy por debajo de las recomendaciones, que son de 1,6g para hombres y 1,1g para mujeres. El consumo de ácidos grasos en la población con SM se correspondió con un 11,4 (4)% de ácidos grasos saturados –19 (13)g–, un 16,1 (3)% de ácidos grasos monoinsaturados –26 (10)g–, y un 5,7 (2)% de ácidos grasos poliinsaturados –9 (3,5)g–, siendo el consumo de ácido eicosapentaenoico y de ácido docosahexaenoico de 0,15 (0,16) y 0,30 (0,3)g, respectivamente, valores también muy por debajo de las recomendaciones. Al comparar el consumo de ácidos grasos en la población control y en la población con SM, solo se observaron diferencias significativas en el consumo medio de ácidos grasos saturados, siendo superior en la población con SM (p<0,05). El consumo de hidratos de carbono fue inferior a las recomendaciones (55%), siendo de un 41,5 (6,6)% en la población con SM y de un 43 (8,6)% en el grupo control. La ingesta de fibra fue de 15 y 13g en el grupo control y en la población con SM, respectivamente, no observándose diferencias significativas.
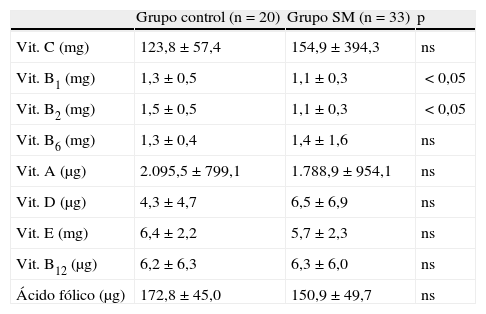
Respecto a las vitaminas, en la tabla 2 se muestra la ingesta de estas en pacientes con SM y en el grupo control. Los enfermos con SM tienden a consumir mayores cantidades de vitamina C, piridoxina y cianocobalamina, no observándose diferencias significativas. En el grupo control fue superior el consumo de tiamina y riboflavina (p<0,05). No se observaron diferencias significativas en los resultados obtenidos en los valores de homocisteína del grupo control y de los pacientes con SM, 11,6 (2,9) y 11,5 (2,5)μmoles/l, respectivamente.
Ingesta de vitaminas del grupo control y de los pacientes con síndrome metabólico
| Grupo control (n=20) | Grupo SM (n=33) | p | |
| Vit. C (mg) | 123,8±57,4 | 154,9±394,3 | ns |
| Vit. B1 (mg) | 1,3±0,5 | 1,1±0,3 | <0,05 |
| Vit. B2 (mg) | 1,5±0,5 | 1,1±0,3 | <0,05 |
| Vit. B6 (mg) | 1,3±0,4 | 1,4±1,6 | ns |
| Vit. A (μg) | 2.095,5±799,1 | 1.788,9±954,1 | ns |
| Vit. D (μg) | 4,3±4,7 | 6,5±6,9 | ns |
| Vit. E (mg) | 6,4±2,2 | 5,7±2,3 | ns |
| Vit. B12 (μg) | 6,2±6,3 | 6,3±6,0 | ns |
| Ácido fólico (μg) | 172,8±45,0 | 150,9±49,7 | ns |
ns: no significativo; SM: síndrome metabólico; Vit.: vitamina.
Valores expresados como media±desviación típica.
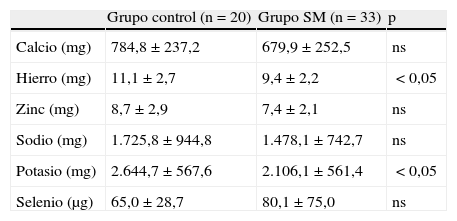
En cuanto a los minerales (tabla 3), solo se observan diferencias significativas en la ingesta de hierro y potasio, que fue mayor en el grupo control (p<0,05).
Ingesta de minerales del grupo control y de los pacientes con síndrome metabólico
| Grupo control (n=20) | Grupo SM (n=33) | p | |
| Calcio (mg) | 784,8±237,2 | 679,9±252,5 | ns |
| Hierro (mg) | 11,1±2,7 | 9,4±2,2 | <0,05 |
| Zinc (mg) | 8,7±2,9 | 7,4±2,1 | ns |
| Sodio (mg) | 1.725,8±944,8 | 1.478,1±742,7 | ns |
| Potasio (mg) | 2.644,7±567,6 | 2.106,1±561,4 | <0,05 |
| Selenio (μg) | 65,0±28,7 | 80,1±75,0 | ns |
ns: no significativo; SM: síndrome metabólico.
Valores expresados como media±desviación típica.
Los pacientes con SM presentaron unos niveles de glucosa y triglicéridos superiores a los niveles normales y a los presentados por el grupo control (p<0,05) (tabla 4).
Parámetros bioquímicos analizados en el grupo control y en los enfermos con síndrome metabólico
| Grupo control (n=20) | Grupo SM (n=33) | p | |
| Glucosa (mg/dl) | 96,2±13,4 | 129,0±26,9 | <0,05 |
| Urea (mg/dl) | 35,73±8,0 | 36,7±11,4 | ns |
| Ácido úrico (mg/dl) | 4,8±1,3 | 4,7±0,92 | ns |
| Proteínas totals (mg/dl) | 7,3±0,4 | 7,4±0,4 | ns |
| Bilirrubina (mg/dl) | 0,6±0,2 | 0,5±0,2 | ns |
| Colesterol sérico (mg/dl) | 219,9±40,4 | 220,0±39,0 | ns |
| Triglicéridos (mg/dl) | 108,7±44,3 | 153,8±65,4 | <0,05 |
| Colesterol HDL (mg/dl) | 62,8±22,2 | 57,8±32,3 | ns |
| Colesterol LDL (mg/dl) | 129,5±33,8 | 131,9±33,1 | ns |
| Proteína C reactiva (mg/dl) | 0,3±0,6 | 0,4±0,4 | ns |
| Homocisteína (micromoles/l) | 11,6±2,6 | 11,6±2,6 | ns |
ns: no significativo; SM: síndrome metabólico.
Valores expresados como media±desviación típica.
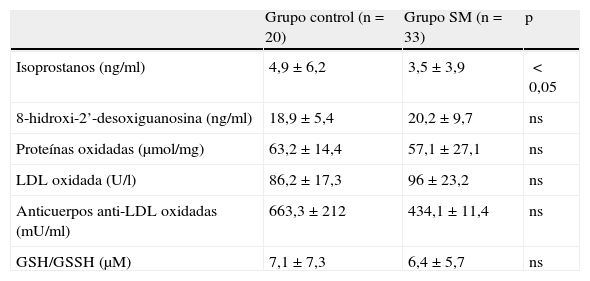
La actividad antioxidante (tabla 5) en ambos grupos analizados estuvo dentro de los límites normales (1,16-1,94mmol/l), no observándose diferencias significativas entre ambos grupos. La enzima superóxido dismutasa no presentó diferencias significativas entre ambos grupos. Los valores medios de glutatión reductasa (U/l) fueron superiores en el grupo control que en los pacientes con SM (p<0,05). Respecto a los biomarcadores de estrés oxidativo (tabla 6), los valores medios de isoprostanos fueron superiores en el grupo control –4,9 (6,2)ng/ml– que en los pacientes con SM –3,5 (3,9)ng/ml– (p<0,05). El cociente glutatión reducido/glutatión oxidado mostró una tendencia a ser inferior en los pacientes con SM que en el grupo control, si bien no se observan diferencias significativas. Los valores de LDL oxidadas tienden a ser superiores en los enfermos con SM –96 (23,2)U/l– que en el grupo control –86,2 (17,3)U/l–, no observándose diferencias significativas.
Actividad antioxidante y enzimas antioxidantes en el grupo control y en los enfermos con síndrome metabólico
| Grupo control (n=20) | Grupo SM (n=33) | p | |
| Actividad antioxidante (mmol/l) | 1,7±0,2 | 1,8±0,1 | ns |
| SOD (U/gHg) | 947,8±272,0 | 853,8±326,2 | ns |
| Glutatión-peroxidasa (U/l) | 7.913,6±2.091,1 | 7.257,5±1.448,1 | ns |
| Glutatión reductasa (U/l) | 59,8±10,1 | 50,0±0,4 | <0,05 |
ns: no significativo; SM: síndrome metabólico; SOD: superóxido dismutasa.
Valores expresados como media±desviación típica.
Biomarcadores de estrés oxidativo en el grupo control y en los enfermos con síndrome metabólico
| Grupo control (n=20) | Grupo SM (n=33) | p | |
| Isoprostanos (ng/ml) | 4,9±6,2 | 3,5±3,9 | <0,05 |
| 8-hidroxi-2’-desoxiguanosina (ng/ml) | 18,9±5,4 | 20,2±9,7 | ns |
| Proteínas oxidadas (μmol/mg) | 63,2±14,4 | 57,1±27,1 | ns |
| LDL oxidada (U/l) | 86,2±17,3 | 96±23,2 | ns |
| Anticuerpos anti-LDL oxidadas (mU/ml) | 663,3±212 | 434,1±11,4 | ns |
| GSH/GSSH (μM) | 7,1±7,3 | 6,4±5,7 | ns |
GSH/GSSH: glutatión reducido/glutatión oxidado; ns: no significativo; SM: síndrome metabólico.
Valores expresados como media±desviación típica.
La importancia clínica del SM se ha relacionado con su potencial impacto en la morbimortalidad cardiovascular de pacientes con y sin diabetes. Como ejemplo, en el trabajo realizado por Lakka et al.14, con exclusión de pacientes diabéticos, la presencia de SM triplicó el riesgo de mortalidad cardiovascular. Del mismo modo, la asociación de IMC elevado, hipertrigliceridemia, descenso de HDL e hiperinsulinemia puede predecir la mortalidad cardiovascular en pacientes con diabetes tipo 2, como queda reflejado en el estudio de Lehto et al.15. No es sorprendente la predicción del riesgo vascular por la presencia de SM, ya que todos sus componentes por separado se han asociado a morbimortalidad cardiovascular en numerosos estudios y han sido objeto de atención por parte de las sociedades científicas16,17.
En el presente trabajo se aportan evidencias sobre un peor perfil nutricional y bioquímico de los pacientes que presentaron SM. También han presentado un mayor estrés oxidativo, lo que puede justificar la mayor morbimortalidad cardiovascular existente en dichos pacientes. El mayor consumo medio de ácidos grasos saturados en los pacientes con SM puede ser un factor importante en la justificación de las diferencias analíticas que se han obtenido entre ambos grupos.
Entre los aspectos a resaltar, hay que destacar que el consumo de energía en toda la muestra poblacional fue inferior a las recomendaciones para la población española (2.400Kcal en varones y 1.875Kcal en mujeres), lo que puede suponer una carencia energética significativa o un sesgo en la realización de la encuesta nutricional. También la ingesta de ácido fólico en la población analizada fue inferior a las recomendaciones (400μg), observándose diferencias significativas cuando se comparan los resultados con los valores de referencia para la población mayor. La deficiencia de ácido fólico es bastante frecuente en la población mayor, y las principales causas son una ingesta insuficiente y una menor absorción. Además, la carencia de esta vitamina es más elevada de lo que podría deducirse, utilizando como referencia solo los niveles plasmáticos de la misma, ya que se han observado alteraciones metabólicas en presencia de concentraciones normales. Millen et al.18 observaron que una mala calidad de la dieta (rica en lípidos, y con una ingesta deficitaria de hidratos de carbono, fibra y micronutrientes) es predictiva de SM en general y de obesidad abdominal en particular.
En referencia al estrés oxidativo, el aumento descontrolado de radicales libres en nuestro organismo se produce por un disbalance entre la producción de sustancias prooxidantes y sustancias antioxidantes. El estrés oxidativo se ha asociado al envejecimiento y a varias afecciones, como la diabetes, el SM y enfermedades cardiovasculares, entre otros. La obesidad y el sedentarismo causan un aumento de la glucosa intracelular y de los ácidos grasos libres, lo que produce un aumento de radicales libres y un mayor estrés oxidativo. Esposito et at.19,20 observaron que los pacientes con SM tenían niveles superiores de estrés oxidativo y lo asociaron con un aumento de la resistencia a la insulina y una disfunción endotelial. Estas alteraciones pueden interactuar entre sí y amplificar el conjunto de alteraciones metabólicas y vasculares. De hecho, en cada uno de los trastornos que caracterizan al SM (diabetes, obesidad, hipertensión e hiperlipidemia) hay alteración de la función endotelial, que responde mal a los estímulos de relajación, como la acetilcolina o el aumento del flujo. El cociente glutatión reducido/glutatión oxidado fue inferior en los pacientes con SM que en el grupo control, si bien no se observaron diferencias significativas. La aterosclerosis se ha asociado a un aumento de la peroxidación lipídica y del estrés oxidativo. Las LDL, al ponerse en contacto con las paredes de las arterias, sufren una oxidación progresiva por parte de las células endoteliales y los macrófagos. La hipercolesterolemia aumenta tanto la cantidad de LDL que penetra en las paredes arteriales como su oxidación. La LDL oxidada es captada por los macrófagos, a través de receptores específicos de eliminación, e induce la formación de células espumosas características de la aterosclerosis.
Dado que el SM es heterogéneo, con una proporción variable de resistencia insulínica y de defecto de secreción, y que el riesgo vascular es más elevado en los pacientes en que predomina la resistencia a la insulina21–29, es importante detectarlos clínicamente para aplicar las medidas terapéuticas preventivas adecuadas, ya que, además, el pronóstico de los pacientes con diabetes tras la aparición de un evento coronario es peor que en los no diabéticos.
Una limitación o sesgo a tener en cuenta en este estudio es el hecho de ser de ámbito reducido a la Región de Murcia, por tanto, los resultados no pueden generalizarse, ya que existen características intrínsecas de las diferentes regiones que pueden modular los resultados obtenidos. También puede ser un sesgo para la encuesta nutricional que los pacientes no recuerden correctamente lo que han ingerido los días anteriores. También hubiese sido interesante haber incluido una muestra más numerosa.
Por tanto, es preciso emprender medidas correctoras para mejorar el control dietético y metabólico de nuestros pacientes con SM, actuando sobre los médicos concienciándolos sobre la importancia que adquiere el control adecuado de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.