En los últimos años son muy numerosos los trabajos que han relacionado la microbiota intestinal con el desarrollo de enfermedades de alta prevalencia como son la diabetes tipo 2 y la obesidad. La obesidad por sí misma se asocia con cambios en la composición de la microbiota intestinal con tendencia al sobrecrecimiento de microorganismos con una mayor eficiencia en la obtención de la energía de la dieta. Son varios los mecanismos que relacionan la microbiota con la aparición de insulinorresistencia y diabetes, entre ellos destacan los cambios en la permeabilidad intestinal, endotoxemia, interrelación con ácidos biliares, cambios en la proporción de tejido adiposo marrón y efectos asociados al uso de fármacos como la metformina.
Actualmente, a través de la dieta, el uso de pro y prebióticos y otras nuevas técnicas como el trasplante de microbiota intestinal, o incluso la terapia con antibióticos, se postulan como herramientas útiles para modular la aparición de obesidad e insulinorresistencia.
In recent years, many studies have related gut microbiome to development of highly prevalent diseases such as type 2 diabetes and obesity. Obesity itself is associated to changes in the composition of gut microbiome, with a trend to an overgrowth of microorganisms more efficiently obtaining energy from diet. There are several mechanisms that relate microbiota to the onset of insulin resistance and diabetes, including changes in bowel permeability, endotoxemia, interaction with bile acids, changes in the proportion of brown adipose tissue, and effects associated to use of drugs like metformin.
Currently, use of pro and prebiotics and other new techniques such as gut microbiota transplant, or even antibiotic therapy, has been postulated to be useful tools to modulate the development of obesity and insulin resistance through the diet.
Los microorganismos que residen dentro y sobre el cuerpo humano constituyen nuestra microbiota y sus genes son conocidos como microbioma.
Alrededor de 10 a 100 trillones de microorganismos pueblan el intestino del adulto. Tienen un peso de 1,5 kilos y son cerca de 1.000 especies que superan por 100 el genoma humano. La gran mayoría reside en el colon.
Los componentes de la microbiota son mayoritariamente bacterias con una minoría de virus, hongos y células eucariotas. Los filos más abundantes, tanto en humanos como en ratones, son los Firmicutes, que representan el 60-80% e incluyen más de 200 géneros (los más importantes son Ruminiococcus, Clostridium y Lactobacillus); los Bacteroidetes, que representan entre un 20-30% (donde destacan los Bacteroides, Prevotella y Xylanibacter), y las Actinobacterias, representan una minoría de en torno al 10% (con predominio del género Bifidobacterium). En menor medida, se localizan las Proteobacterias como Escherichia y Enterobacteriaceae (tabla 1). Existe una importante interacción entre ellos y con el huésped1.
La microbiota del intestino está implicada en una variedad de funciones metabólicas como la fermentación y absorción de hidratos de carbono sin digerir, la absorción de electrolitos y minerales, la modulación de la motilidad intestinal y la síntesis de algunos micronutrientes2. Por su papel en el desarrollo de estas funciones, los cambios microbianos en el intestino humano se han propuesto como una causa posible de obesidad3.
Además de sus funciones metabólicas, la microbiota participa en la interacción con el sistema inmunitario, proporcionando señales para promover la maduración de las células inmunitarias y el desarrollo normal de sus funciones, así como la destrucción de toxinas y carcinógenos, evitando la colonización por bacterias patógenas2.
La composición de la microbiota intestinal depende de la edad, el sexo, la geografía, etnicidad, familia y dieta, y esta puede ser modulada por los prebióticos, probióticos y antibióticos4.
Los bebés adquieren su microbiota inicial ya desde el parto, en especial por vía vaginal maternal o procedente de la microflora fecal. De manera diferente, los niños nacidos por cesárea poseen una microbiota característica de la piel. Estas diferencias según el tipo de parto parecen influir en la inmunidad desarrollada en el primer año de vida dando lugar a diferente microbiota intestinal5.
En los primeros días tras el nacimiento predominan las Proteobacterias y las Actinobacterias. La composición bacteriana comienza a converger hacia un perfil de microbiota adulta al final del primer año de vida, conforme el niño crece y empieza la ingesta de alimentos. La diversidad de la microbiota aumenta y se asemeja por completo a la microbiota adulta en torno a los 2 años y medio de edad. A partir de esta etapa, predominan Firmicutes y Bacteroidetes.
Durante este tiempo, el sistema inmunitario «aprende» a diferenciar entre las bacterias comensales y las patógenas. Una vez que la microbiota ha alcanzado la madurez, esta permanece en su mayor parte estable hasta la vejez. El consorcio ELDERMET ha estudiado la microbiota de los ancianos, encontrando una composición característica diferente de la de los adultos jóvenes, particularmente en las proporciones de los grupos Bacteroides y Clostridium6,7.
En los últimos años está aumentando el interés en el conocimiento de la microbiota, con un incremento exponencial en el número de publicaciones en la materia. Se intenta esclarecer su relación con el desarrollo de enfermedades de alta prevalencia como son la diabetes y la obesidad8.
Es importante comprender que la microbiota no es una entidad congelada, sino que, con el paso de los años, los cambios en el ambiente y diferentes influencias pueden ir modulándola. Cambios en la ecología humana han ido afectando a la composición de la microbiota a lo largo de la evolución del ser humano, pero este cambio ha sido más radical en las últimas décadas.
Uno de los hallazgos más significativos es que en los países desarrollados se ha producido una pérdida de determinadas especies que colonizaban hace unas décadas nuestros intestinos, provocando una pérdida de la biodiversidad de nuestra microbiota.
Entre los factores que han influido en este cambio de la microbiota se encuentran el saneamiento del agua, el incremento de las cesáreas, el mayor de uso de antibióticos en recién nacidos pretérmino, una reducción de la lactancia materna, el nuevo modelo de familias pequeñas, el incremento del aseo o la difusión de jabones antibacterianos9.
Cuando comparamos la microbiota de niños europeos con los africanos encontramos una composición radicalmente diferente. Los niños africanos presentan una mayor proporción de Bacteroidetes y de grampositivos en su intestino, mientras que parece que el estilo de vida occidental favorece el incremento de Firmicutes y de gramnegativos10.
Uno de los factores más importantes que pueden perturbar la composición de la microbiota es el uso de antibióticos. Aunque el particular taxón afectado varía entre individuos, algunos taxones no se recuperaran incluso después de meses de tratamiento, y en general, hay una disminución a largo plazo en la biodiversidad de las bacterias tras su uso.
En relación con estas suposiciones, investigaciones en poblaciones aisladas han demostrado tener una más amplia variedad de microorganismos, superior que los sujetos industrializados11.
Otros trabajos en humanos en etapas específicas como es el embarazo han identificado alteraciones en la microbiota materna, como mecanismo adaptativo al feto y a la diferente composición corporal12,13.
Métodos para la determinación de la microbiotaCon objeto de conocer los mecanismos que podrían estar implicados en el desarrollo de la obesidad y otras enfermedades de alta prevalencia se han desarrollado proyectos a gran escala, como el Proyecto del Microbioma Humano y el MetaHIT14,15.
La investigación en este campo se realiza principalmente con ARN ribosómico 16S (ARNr) y con la secuenciación de genomas completos (whole-genome shotgun); nos han proporcionado una visión general de las comunidades microbianas comensales y de su capacidad funcional14-16.
Estos trabajos han demostrado una gran variabilidad en la composición de la microbiota en individuos sanos, encontrándose cómo incluso los gemelos comparten menos del 50% de sus taxones bacterianos a nivel de especie. Sin embargo, este hecho no quiere decir que la genética no desempeñe un papel en el establecimiento y la conformación de la microbiota intestinal, ya que se ha demostrado que la composición de la comunidad bacteriana está influenciada por locus genómicos específicos del huésped17,18.
Tradicionalmente, el estudio de la microbiota intestinal se ha abordado fundamentalmente a través del cultivo de los microorganismos y en su identificación mediante pruebas fenotípicas clásicas: morfológicas, fisiológicas y bioquímicas.
El cultivo de la microbiota fecal en medios selectivos y diferenciales es en apariencia el método más simple y directo; sin embargo, no posee una alta fiabilidad debido a la existencia de bacterias no cultivables. El 99% de las bacterias del contenido fecal son anaerobias estrictas y muchas de ellas extremadamente sensibles al oxígeno, lo que obliga a procurar estrictas condiciones reductoras durante el procesado y el cultivo.
Los métodos indirectos consisten básicamente en el estudio del metabolismo bacteriano. El principio se basa en la estimación de la microbiota intestinal mediante el análisis y la cuantificación de sus metabolitos o ciertas actividades enzimáticas. Se pueden estudiar metabolitos como los ácidos grasos volátiles o productos del metabolismo de los ácidos biliares mediante técnicas cromatográficas, o actividades enzimáticas de origen microbiano. Estos métodos de estudio presentan el inconveniente de que muchas actividades enzimáticas no son específicas de un microorganismo o de un grupo bacteriano concreto; a lo que hay que añadir la existencia, en ocasiones, de una gran variabilidad o plasticidad metabólica en las especies.
Los inconvenientes que los métodos tradicionales de estudio presentan han llevado al desarrollo de estrategias alternativas. La aplicación de herramientas de genética molecular independientes de cultivo ofrece un gran potencial en la identificación, la cuantificación y la tipificación de los microorganismos del tracto gastrointestinal. La reacción en cadena de la polimerasa (polymerase chain reaction) con todas sus variantes es una de las metodologías más extendidas y utilizadas para estimar los microorganismos no cultivables. Muchas estrategias se basan, además, en las diferencias de secuencia en el gen que codifica el ARNr 16S, que debido a la alternancia de regiones conservadas y variables, con claras implicaciones filogenéticas, es especialmente útil para el estudio de la diversidad microbiana.
El ARNr 16S es la macromolécula más ampliamente utilizada en estudios de filogenia y taxonomía bacteriana19.
Entre las técnicas más utilizadas están:
- –
Fluorescence in situ hibridization. Esta técnica cuantitativa consiste en la utilización de sondas para el ARNr marcadas con fluorescencia que se hibridan directamente con preparaciones bacterianas fijadas sobre un portaobjetos. La detección o visualización se realiza por microscopia de fluorescencia20.
- –
Construcción de bibliotecas genómicas de secuencias del ADNr 16S obtenidas por amplificación directa del ADN bacteriano de las muestras. Si la amplificación no está sesgada, el número y la diversidad de los clones de la genoteca serán un reflejo de las especies presentes en la muestra original. La diversidad microbiana se determina tras la secuenciación y la comparación de las secuencias con las depositadas en las bases de datos21.
- –
Denaturing gradient gel electrophoresis y temperature gradient gel electrophoresis. Ambas metodologías se basan en la separación de fragmentos de amplificación con distinta secuencia mediante electroforesis en un gradiente desnaturalizante químico o de temperatura22.
- –
La gnotobiótica es un método de estudio in vivo de la microbiota intestinal que utiliza animales de experimentación libres de microorganismos. Tras el parto, realizado generalmente por cesárea, los animales se disponen directamente en cabinas estériles, donde además de la atmósfera, todos los materiales y nutrientes que se les proporciona son estériles. En otros casos, el estado de esterilidad se consigue con un primer biberón de antibióticos que imposibilita la implantación de bacterias en el tracto gastrointestinal. En estos animales se pueden introducir con posterioridad microorganismos de forma controlada para su estudio. Gran parte de las funciones que se le atribuyen a la microbiota intestinal se han determinado mediante la comparación de animales axénicos (estériles) y animales holoxénicos (animal convencional con microbiota normal)23.
La obesidad es una enfermedad pandémica asociada con muchas alteraciones metabólicas e implica varios órganos y sistemas.
Durante el curso de la década pasada, varios estudios han unido causalmente la microbiota intestinal con el desarrollo de las enfermedades metabólicas como la diabetes y la obesidad. Emerge un nuevo paradigma que plantea como la microbiota puede contribuir en la regulación de la homeostasis energética.
Se postula como la interrelación de las circunstancias ambientales con la microbiota intestinal podría provocar un disbalance energético causando cambios metabólicos, neurocognitivos y del comportamiento que favorecerían el desarrollo de obesidad24-26.
La contribución independiente de la microbiota a una acumulación de grasa se ha demostrado en una serie de estudios in vivo en ratones. Los ratones libres de gérmenes, con falta de microbiota, tienen significantemente menos grasa corporal que los ratones normales, a pesar de comer más27.
Probablemente, el experimento que más solidez le ha dado a la causalidad entre microbiota y obesidad, fue el realizado por Turnbaugh et al. en 2006 donde demostraron que el trasplante de la microbiota de ratones genéticamente obesos a ratones libres de gérmenes le provocaba un incremento de peso muy significativo comparado con los ratones libres de gérmenes que se le trasplantaba la microbiota de ratones delgados28.
Estudios en ratones han encontrado una abundancia mayor de Firmicutes en ratones obesos y en aquellos alimentados con dietas occidentales, simultáneo a un descenso de la abundancia de Bacteroidetes3,29. Dentro de los filos Firmicutes, la clase Mollicutes fue la más común en los ratones obesos29.
El incremento de Firmicutes observado en animales y también en sujetos obesos se podría asociar con un aumento en la capacidad para digerir algunos polisacáridos indigeribles, dando lugar a monosacáridos y ácidos grasos de cadena corta capaces de ser absorbidos por el huesped, obteniendo así más energía de sustancias que en el sujeto delgado se eliminarían por las heces sin ser absorbidas3,30,31.
Los Bacteroidetes poseen menos genes para las enzimas implicadas en el metabolismo de lípidos e hidratos de carbono que los Firmicutes32. Sin embargo, dentro de los filos Bacteroidetes, el Bacteroides thetaiotaomicron ha demostrado que mejora la absorción y el procesamiento de nutrientes del huésped33.
Estudios en humanos encontraron resultados dispares. Algunos apoyaron el hallazgo de un índice alto de Firmicutes/Bacteroidetes8,34-36, algunos no encontraron una correlación entre el índice de masa corporal y el índice de Firmicutes/Bacteroidetes37,38 y aún otros encontraron un índice opuesto39,40.
Los pacientes obesos incluidos en un programa de dieta hipocalórica o aquellos sometidos a bypass gástrico en Y de Roux tenían proporciones reducidas de Firmicutes y/o aumento de los Bacteriodetes41-43.
Otro hallazgo importante en humanos, fue observar que cambiar una dieta rica en grasas y baja en fibra por una baja en grasas y rica en fibra, provocó notables cambios en la microbiota intestinal en tan sólo 24 h. Además, numerosas evidencias indican que en humanos un incremento en la cantidad de grasas de la dieta disminuye la cantidad del género Lactobacillus y produce un incremento en las bacterias gramnegativas44,45.
De manera específica, un nivel más alto de Lactobacillus reuteri y niveles más bajos de Lactobacillus casei/paracasei y Lactobacillus plantarum estaban asociados a la obesidad46.
Zhang et al. sugieren que un mayor almacenamiento de energía en individuos obesos está relacionado con la transferencia de hidrógeno entre taxones ya que observaron un incremento simultáneo en Prevotella que produce hidrógeno y en Archaea metanogénica que utiliza hidrógeno41,46,47. Las Arqueas metanogénicas son capaces de transformar el hidrógeno en metano y son capaces de obtener más energía de la misma ingesta calórica diaria48,49.
Por otro lado, la microbiota intestinal puede disminuir la producción del factor adipocitario inducido por el ayuno (fat-induced adipocyte factor), llevada a cabo por las células intestinales e inhibiendo así la actividad de la lipoproteína lipasa. Estas enzimas favorecen la liberación de ácidos grasos no esterificados hacia los tejidos como el hígado y las células adiposas50.
En el nivel de especies, varios estudios han investigado su asociación con la obesidad en humanos. En niños y mujeres embarazadas se demostró una asociación entre Staphylococcus aureus y el estado de sobrepeso40,51. Un número menor de Bacteroides y un número mayor de Staphylococcus, Enterobacteriaceae y Escherichia coli (E. coli) se han descrito en sujetos con sobrepeso comparado con mujeres embarazadas de peso normal36. Niveles de Faecalibacterium prausnitzii (F. prausnitzii) (del filo Firmicutes) fueron significantemente mayores en niños obesos que en no obesos52. Se mostró que las proporciones del grupo de Bacteroides-Prevotella aumentan después de la pérdida de peso en adolescentes obesos53.
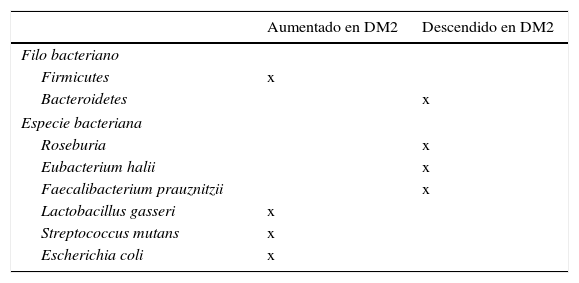
Papel de la microbiota en el desarrollo de diabetesLas técnicas de pirosecuenciación masiva han permitido avanzar de forma considerable en la caracterización de nuestra microbiota. Los resultados en pacientes con diabetes comparados con sujetos sin diabetes describen los siguientes hallazgos: un descenso de las bacterias productoras de butirato como Roseburia intestinalis y F. prausnitzii; un aumento de Lactobacillus gasseri (L. gasseri), Streptococcus mutans (S. mutans) y ciertos Clostridium (tabla 2). Una mayor proporción de Proteobacterias y un incremento de la expresión de genes de la microbiota envueltos en el estrés oxidativo y la inflamación54,55.
Especies bacterianas relacionadas con la aparición de insulinorresistencia y diabetes mellitus tipo 2 (DM2)
| Aumentado en DM2 | Descendido en DM2 | |
|---|---|---|
| Filo bacteriano | ||
| Firmicutes | x | |
| Bacteroidetes | x | |
| Especie bacteriana | ||
| Roseburia | x | |
| Eubacterium halii | x | |
| Faecalibacterium prauznitzii | x | |
| Lactobacillus gasseri | x | |
| Streptococcus mutans | x | |
| Escherichia coli | x | |
En estudios realizados por nuestro grupo comparando obesos metabólicamente sanos con obesos con resistencia a la insulina se siguen observando cambios importantes asociados a la resistencia a la insulina56.
Son varios los mecanismos que se proponen para explicar cuál es la influencia de la microbiota sobre la resistencia a la insulina. A continuación, se detallan los que se postulan con mayor solidez en la literatura.
Incremento en la endotoxemiaLa diabetes tipo 2 se asocia a un estado proinflamatorio con un exceso moderado en la producción de citocinas como IL-6, IL-1 o factor de necrosis tumoral-α, que dificultan la interacción de la insulina con su receptor y contribuyen a la resistencia a la insulina y a la diabetes. El incremento en el peso parece ser uno de los factores iniciadores de esta inflamación de bajo grado.
Experimentos animales han demostrado que cambios en la microbiota son capaces de cambiar el grado de inflamación del tejido adiposo. Los lipopolisacáridos (LPS) son un componente de la pared celular de las bacterias gramnegativas. Se ha observado que se produce un incremento en los niveles de LPS circulantes en sujetos que tienen una ingesta de grasa aumentada57,58. Los LPS se absorben por el enterocito y son transportados en plasma fundamentalmente unidos a los quilomicrones59.
El papel causal de los LPS ha sido demostrado, ya que al infundir LPS en ratones alimentados con una dieta normal se inducía resistencia a la insulina a nivel hepático, intolerancia a la glucosa y un incremento en el peso del tejido adiposo. El LPS se une al receptor CD14/TLR4 presente en los macrófagos y se produce un incremento en la producción de moléculas proinflamatorias. Cuando las inyecciones de LPS se administraron a ratones con ausencia genética del receptor CD14/TLR4 no provocaron estas características metabólicas y no presentaron diabetes tipo 2 ni obesidad, mostrando el importante papel del mecanismo del receptor CD14/TLR4 para LPS. Además, los ratones knock out CD14/TLR4 eran incluso más sensibles a la insulina que los controles de tipo salvaje60.
Esto sugiere que ante determinadas situaciones se produce un cambio en la proporción de bacterias gramnegativas en el intestino, o bien un cambio en la permeabilidad intestinal para que los LPS se incrementen en suero y este incremento en suero se relaciona de forma directa con el grado de resistencia a la insulina.
Modificaciones de la secreción de incretinas relacionadas con la resistencia a la insulina y la funcionalidad de la célula betaSe ha mostrado que un aumento de Bifidobacterium spp. modula la inflamación en ratones obesos por un incremento en la producción de péptido similar al glucagón (GLP1), reduciendo también la permeabilidad intestinal. Existe evidencia de que el incremento de Bifidobacterium spp. que producen algunos prebióticos se acompaña de un incremento en la secreción de GLP1 y de péptido YY por parte del intestino; estas 2 moléculas tienen efectos favorables en el descenso de la resistencia a la insulina e incremento de la funcionalidad de la célula beta61.
Modificaciones en la producción de butiratoEl butirato es un ácido graso de cadena corta (AGCC) que, junto con el propionato y el acetato, son producidos por las bacterias intestinales al digerir la fibra62.
Estos AGCC son absorbidos en el intestino, donde sobre todo el butirato proporciona energía a las células epiteliales del colon, mientras que el resto pasan al sistema venoso portal y el butirato contribuye de forma muy importante a disminuir la permeabilidad intestinal.
Los datos de los estudios con animales sugieren que el propionato afecta a la lipogénesis hepática y la gluconeogénesis, mientras que las funciones del acetato a nivel periférico se reducen a ser el sustrato para la síntesis de colesterol63.
Curiosamente, en modelos animales, la producción de butirato ha demostrado afectar a los niveles de serotonina. Y afecta directamente al tono simpático, al tiempo de tránsito intestinal y a la actividad física64.
Actualmente, se reconoce que la serotonina puede regular la permeabilidad intestinal además de ser un importante neurotransmisor en el intestino y el cerebro involucrado en la regulación del peso corporal y la ingesta de alimentos al controlar la saciedad. Una reducción en la producción cerebral de SERT, reguladores esenciales de la transmisión serotoninérgica, está asociada con obesidad65.
Cambios en las características del tejido adiposo marrónLa obesidad se caracteriza por una reducción de la actividad termogénica del tejido adiposo marrón (BAT). El BAT promueve un fenotipo delgado y saludable y mejora la sensibilidad a la insulina. En respuesta al frío o ejercicio, células de grasa marrón también surgen en el tejido adiposo blanco (WAT), también conocidas como células de color beige, un proceso conocido como pardeamiento.
El desarrollo de la grasa de color beige en el tejido adiposo subcutáneo o visceral se logra en modelos animales tras tratamiento antibiótico de amplio espectro que erradica la microbiota o en ratones libres de gérmenes. Esto conduce a una mejor tolerancia a la glucosa y la sensibilidad a la insulina, y la disminución de la grasa blanca y el tamaño de los adipocitos en ratones.
Estos efectos se revierten por la recolonización de los ratones tratados con antibióticos o libres de gérmenes con microbios66.
Un reciente estudio revela que la microbiota intestinal dificulta la aparición de adipocitos marrones, conocidos como adipocitos beige, incluidos dentro del WAT habitual a través de un mecanismo que implica el control de los macrófagos y la infiltración de eosinófilos67.
Influencia de los ácidos biliares secundariosLa mayoría de los ácidos biliares primarios conjugados se reabsorben por medio de la circulación enterohepática y solo un 5% escapa de este mecanismo alcanzando el intestino grueso y transformándose en ácidos biliares secundarios por acción principal de los Firmicutes.
En sujetos con sobrepeso y diabetes tipo 2 se observó menor número de ácidos biliares secundarios en comparación con los sujetos sanos. Esto parecía estar más relacionado con una alteración del metabolismo hidrocarbonado que con la obesidad.
Los ácidos biliares secundarios parecen tener un papel insulinosensibilizador. Actúan como moléculas mediadoras a través de receptores nucleares como el receptor FXR y el receptor de membrana TGR5 expresado en diversos tejidos como la vesícula, el íleon, colon y el BAT y el WAT68.
En BAT y en músculo, aumenta la actividad mitocondrial y la fosforilación y conduce a una insulinosensibilización en modelos de ratones diabéticos y obesos. Sobre las células intestinales L parece mejorar el metabolismo glucémico estimulando la producción de péptidos como GLP1 y promoviendo la secreción de insulina.
Papel de colina y niacina como vitaminasLas bacterias Firmicutes, Actinobacteria y Proteobacteria son capaces de degradar la colina. Sus productos finales se han asociado con el desarrollo de enfermedad cardiovascular y diabetes al ser productos que favorecen el desarrollo de estrés oxidativo. Para la niacina y sus productos de metabolización finales se han encontrado resultados similares con F. prausnitzii68.
Influencia del tratamiento farmacológicoAunque está claro que la salud pública se ha beneficiado sustancialmente del descubrimiento de los antibióticos, su amplia utilización está empezando a plantear problemas de salud. Además de la aparición de resistencia a los antibióticos, podría estar potencialmente asociado con la epidemia de obesidad69.
El tratamiento con metformina, común en el paciente con diabetes tipo 2, también aparece como potencial modificador de la microbiota intestinal en algunos trabajos, en probable relación con sus efectos gastrointestinales70.
Modificaciones de la microbiota intestinalHay lugar para la esperanza en cuanto a la utilidad de la microbiota y su adaptación para obtener beneficios para la salud. A través de la dieta, con prebióticos y probióticos, los antibióticos y técnicas más novedosas como el trasplante de microbiota intestinal parecen tener resultados alentadores.
Ya hemos comentado como la dieta modifica la composición de la microbiota y también la expresión del metagenoma independientemente del genoma del huésped23,24. Trabajos recientes utilizando la dieta mediterránea también nos aportan información relevante sobre sus beneficios al modificar la microbiota intestinal en sujetos obesos para la prevención del desarrollo de diabetes tipo 271.
Cuando sujetos obesos se sometieron a una dieta hipocalórica, baja en grasa o hidratos de carbono, se produjo un aumento en la abundancia de Bacteroidetes y una disminución en Firmicutes72,73.
El consumo de probióticos y prebióticos han demostrado modificar la microbiota intestinal y mejorar el metabolismo hidrocarbonado74. Bacterias fermentadoras de hidratos de carbono como las bifidobacterias y Lactobacillus se han administrado como parte del tratamiento prebiótico en trabajos con población de diferentes grupos de edad72.
En esta misma línea, cuando se dieron prebióticos que contenían oligofructosa a ratones con una dieta alta en grasas, este restauraba los niveles de bifidobacterias y reducía la endotoxemia a la vez que mejoraba su tolerancia a la glucosa75.
Otro trabajo de nuestro grupo demostró que el consumo de vino tinto puede modular significativamente el crecimiento de la flora intestinal en humanos, aumentando el número de Enterococcus, Prevotella, Bacteroides, Bifidobacterium, Bacteroides uniformis, Eggerthella lenta y Blautia coccoides-Eubacterium rectale y conduciendo a una menor cantidad de LPS. Esto indica posibles beneficios prebióticos en la dieta a través de los polifenoles del vino tinto76,77.
Otra línea de intervención aparece con los probióticos, como suplementos nutricionales enriquecidos con cepas de bacterias vivas. Incluyendo especies de bifidobacterias y lactobacilos, que son capaces de alterar la flora intestinal de forma que resulte beneficiosa para el receptor. En ratones, se ha demostrado un efecto antidiabético tras la administración de probióticos que contienen ciertas cepas de Lactobacillus con una reducción concomitante de la endotoxemia78-80.
El tratamiento con antibióticos (ampicilina más neomicina) a ratones genéticamente obesos sometidos a una dieta rica en grasas modificó su microbiota y se redujo la resistencia a la insulina y el peso de los animales, además los animales sometidos a tratamiento antibiótico sorprendentemente redujeron el grado inflamación de su tejido adiposo así como el estrés oxidativo y la infiltración de macrófagos del mismo81,82.
Otros trabajos, como el recientemente publicado por nuestro grupo, relaciona la mejora del metabolismo hidrocarbonado con la erradicación de Helicobacter pylori83.
Los primeros trabajos en los que se utilizó la microbiota intestinal en trasplante fueron en pacientes que desarrollaban una colitis seudomembranosa tras la infección por Clostridium difficile tratada con antibióticos y en los que el trasplante de materia fecal de donantes sanos parecía restaurar el equilibrio microbiano intestinal al sustituir las cepas bacterianas intestinales más patógenas, por otras más beneficiosas84. Desde entonces su utilización se ha extendido a otras enfermedades intestinales y a partir de ahí se ha abierto un nuevo camino para su empleo en enfermedades como la obesidad, la diabetes y las enfermedades cardiovasculares85-87.
Algunos trabajos recientemente publicados en este sentido utilizaron varones con resistencia a la insulina y síndrome metabólico, que recibieron un trasplante de microbiota fecal autógeno o alogénico de donantes delgados86. Aquellos sujetos que recibieron el trasplante de donantes delgados mejoraron significativamente su sensibilidad periférica a la insulina. Además, se produjo un aumento de la diversidad microbiana intestinal y un aumento de las bacterias productoras de butirato.
Otro trabajo de la cohorte sueca mostró los cambios en la microbiota intestinal con mayores concentraciones de L. gasseri y S. mutans (ambos habitantes del intestino proximal), así como E. coli podían ayudar a predecir la posibilidad de desarrollar insulinorresistencia en mujeres posmenopáusicas87.
Estos trabajos son a pequeña escala y no se han podido reproducir sus resultados en otros grupos pero han servido como estímulo para el desarrollo de mejores técnicas para la identificación de la microbiota intestinal y sus posibles propiedades.
ConclusionesLa identificación de una microbiota intestinal relacionada con la obesidad y diabetes tipo 2ha servido como estímulo para el avance en la producción científica en los últimos años de forma exponencial. Son múltiples los factores implicados en las modificaciones de la microbiota intestinal y su relación con la diabetes tipo 2. Las posibilidades actuales para modificar esta microbiota en nuestro propio beneficio son numerosas y ofrecen resultados esperanzadores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.