Bajo el epígrafe de osteoporosis secundaria se agrupa un amplio grupo de desórdenes heterogéneos. La osteoporosis secundaria puede plantear problemas diagnósticos que deben ser abordados para establecer un tratamiento y pronóstico apropiados. Entre las causas de osteoporosis secundaria encontramos trastornos endocrinológicos, hematológicos, del tejido conjuntivo, tratamientos farmacológicos, enfermedades renales, trastornos nutricionales y gastrointestinales, entre otros1. Aproximadamente entre el 40-60% de los casos de osteoporosis en el varón son secundarios, siendo las causas más frecuentes el tratamiento con glucocorticoides, el hipogonadismo y el alcoholismo2.
En individuos de edad avanzada, el mieloma múltiple (MM) y otras neoplasias hematológicas producen un cuadro clínico similar a la osteoporosis primaria. Por lo tanto, es necesario excluir esta entidad en pacientes con fracturas por fragilidad y una rápida evolución clínica3. En el MM la actividad osteoclástica está aumentada porque las células mielomatosas producen o inducen la producción de factores osteoclastogénicos en el microambiente óseo y disminuyen la producción de osteoprotegerina (OPG), un receptor señuelo del ligando de RANK (RANKL), por células de estirpe osteoblástica4. El aumento de RANKL incrementa la formación y supervivencia de los osteoclastos y la proteína inflamatoria de los macrófagos 1 (MIP-1 α) actúa como un factor quimiotáctico para los precursores de osteoclastos además de favorecer el crecimiento y supervivencia de las células MM. Por otra parte, el proceso de destrucción ósea libera factores de crecimiento que incrementan la proliferación de células MM, exacerbándose así el proceso osteolítico5. Además del papel del RANKL en el aumento de la resorción ósea, en el mieloma existe una inhibición de la formación ósea. Recientemente se han implicado el TGF-beta, así como inhibidores de la importante vía wnt, como DKK-1, sFRP-2, sFRP-3 producidos por las células mielomatosas6.
En la mayoría de los pacientes con MM, las manifestaciones esqueléticas (osteopenia, fracturas y osteolisis) son frecuentes y conducen al deterioro de la calidad de vida. Las lesiones óseas en el mieloma se diferencian de otras lesiones metastásicas líticas en la supresión o ausencia de la actividad osteoblástica en una zona con gran carga tumoral. Estas lesiones son mejor visualizadas mediante RN o radiología convencional7. Otras técnicas como la gammagrafía con 99mTc no son más útiles que la radiografía convencional ya que infraestiman las lesiones óseas en pacientes con mieloma múltiple.
Caso clínicoPresentamos el caso de un paciente varón de 82 años, remitido a consulta de Metabolismo Óseo para estudio de osteoporosis por presentar fracturas vertebrales en D12 y L1, L2 y L4. Como antecedentes personales destacaba hiperuricemia, hipertensión e hiperplasia benigna de próstata en seguimiento por Urología. Entre sus antecedentes familiares destacaba madre fallecida a edad joven de neoplasia que no sabía especificar y tres hermanos fallecidos de hepatocarcinoma.
El paciente refería dolor lumbar importante desde hacía unos 6 meses que había aumentado de intensidad hasta llegar a ser incapacitante. No refería traumatismo previo, era exfumador, exbebedor y no había estado en tratamiento con corticoides previamente salvo en el último mes a raíz de lumbalgia. Destacaba pérdida de peso de 8kg en un año, asociada a hiporexia. En la encuesta alimentaria se detectó baja ingesta de lácteos, aproximadamente 1 ración al día y escasa exposición solar. La exploración física mostraba dolor a la palpación, en columna lumbar y a nivel costal, así como con los movimientos. En relación a las medidas antropométricas el peso era de 52,5kg y la talla de 1,54m (con cifosis moderada), con un índice de masa corporal de 22,13kg/m2. La bioquímica básica mostraba una insuficiencia renal con creatinina 1,7mg/dl y urea 72,8mg/dl (no conocida previamente), hipercalcemia de 10,8mg/dl, fósforo de 3,9mg/dl y fosfatasa alcalina de 46 U/l.
Sospechando una causa secundaria de osteoporosis dada la hipercalcemia y la semiología del paciente, se solicitó electroforesis de proteínas, que mostró hipoproteinemia de 6g/dl, albúmina dentro de rango de normalidad 4,4g/dl (VN. 3,5-5g/dl) y un aumento de la alfa-1 y alfa 2 globulina del 5% (VN: 2,9-4.5) y 15,4% (VN 7,1-11,8%) respectivamente. La beta-globulina era normal: 10,8% (VN: 7,9-13,7%) y el pico gamma debajo de rango de normalidad. 7% (VN: 11,1-18,8). La determinación de cadenas ligeras en suero era de 48.200mg/dl (VN 0,33-1,94), con hipogammaglobulinemia de inmunoglobulinas IgA, M y G, lo que apoyaba el diagnóstico de proteinuria de Bence Jones en el contexto de mieloma de cadenas ligeras.
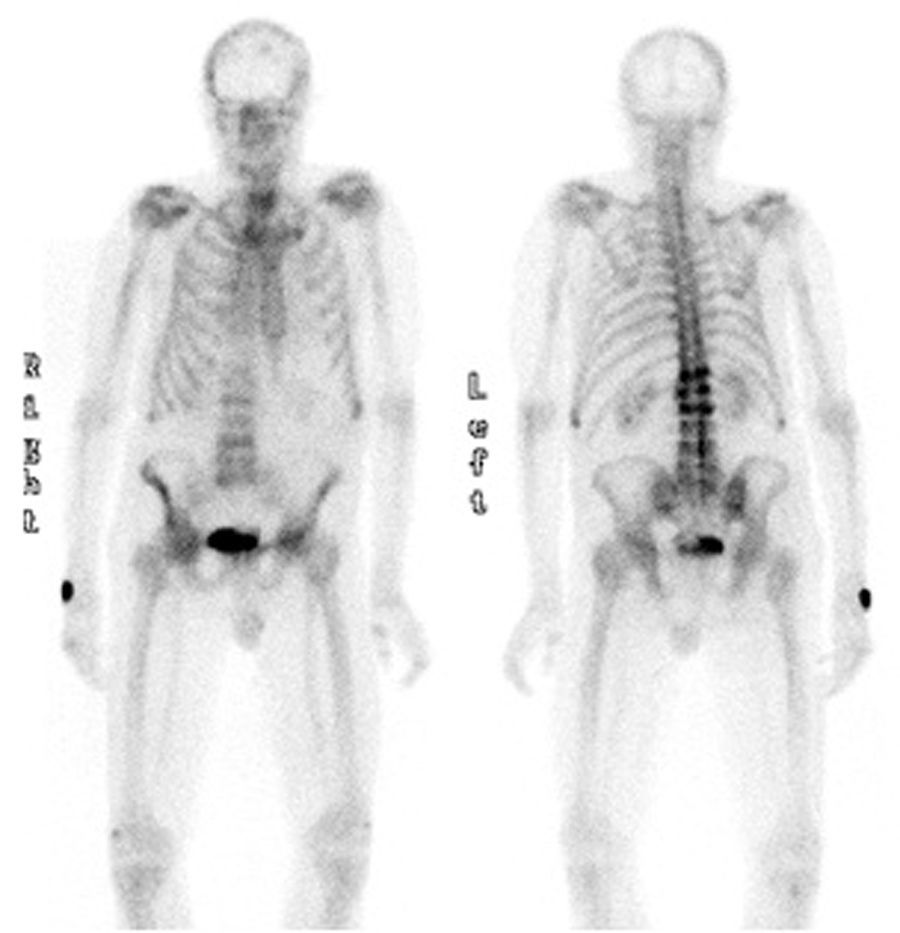
El PSA era de 4ng/ml, la TSH de 1,56 mUI/ml. En el estudio de metabolismo óseo destacaba una hipovitaminosis D (25OHD D: 8,2ng/ml) con PTHi de 21pg/ml (VN 15-65pg/ml). En el hemograma se encontró una anemia normocítica normocrómica, además de leucopenia de 3.870 leucocitos. La velocidad de sedimentación glomerular era de 27mm. La radiografía de columna dorsal y lumbar mostraba múltiples fracturas vertebrales en D12 (grado 3), L1, L2 y L4 (grado 2). La densitometría ósea mostraba un T score lumbar de -1,9 DE, -2,7 DE en cadera total y -0,6 DE en cuello femoral y la gammagrafía ósea visualizaba hipercaptación en las vértebras D12, L1, L2 y L4. (fig. 1)
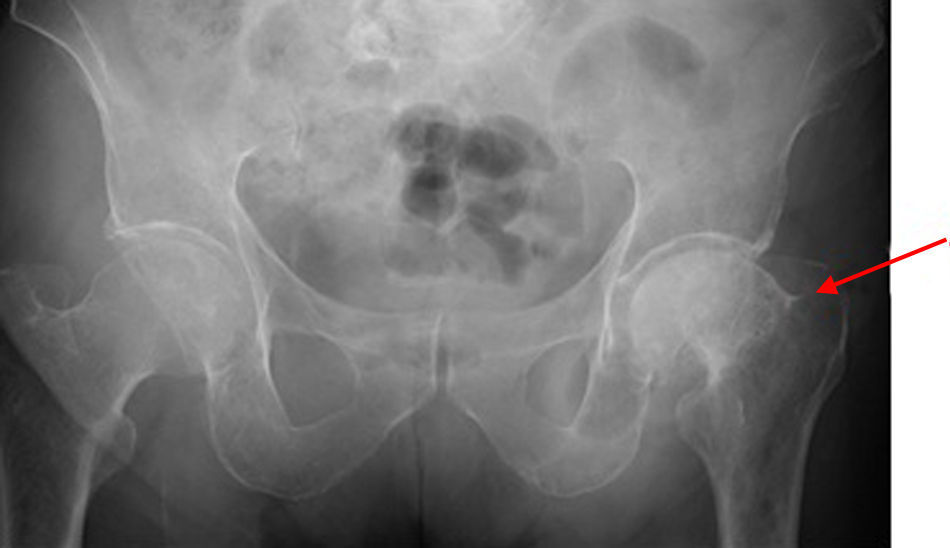
En el transcurso del estudio el paciente presentó dolor e impotencia funcional del miembro inferior izquierdo, de forma espontánea, por lo que se completó estudio radiológico que mostraba fractura de cadera no conocida previamente y múltiples lesiones líticas en ambas diáfisis femorales. (fig. 2). La evolución del paciente fue desfavorable complicándose con una infección respiratoria e insuficiencia respiratoria grave que no respondió a tratamiento y finalmente motivó su fallecimiento. No fue posible realizar punción de médula ósea.
DiscusiónEl 25-30% de las fracturas osteoporóticas se producen en varones y se estima que entre el 13 y el 25% de los varones mayores de 50 años tendrán una fractura osteoporótica a lo largo de su vida8. En el varón, la necesidad de descartar la existencia de una osteoporosis secundaria es aún más importante puesto que aproximadamente el 50% de los casos son secundarios a otras patologías, destacando entre ellas el alcoholismo, las enfermedades reumáticas, la inmovilización, el tratamiento con glucocorticoides, enfermedades endocrinas y las neoplasia hematológicas como el MM. El MM se caracteriza por una proliferación neoplásica monoclonal de células plasmáticas que da lugar a una destrucción ósea con lesiones osteolíticas, osteopenia y fracturas patológicas. El diagnóstico se sospecha por dolor óseo con lesiones líticas descubiertas radiológicamente, aumento de las proteínas séricas o la presencia de proteína monoclonal en orina o plasma, signos o síntomas sistémicos de malignidad como anemia no explicada y fracaso renal. La mayoría de los pacientes presenta síntomas o signos relacionados con la infiltración de células plasmáticas en el hueso y otros órganos y daño renal por exceso de cadenas ligeras. Nuestro paciente presentaba todas estas manifestaciones.
La destrucción ósea excesiva es la causa más frecuente de morbilidad en el paciente con MM. Estudios recientes han mostrado nuevos mecanismos biológicos que explican la afectación ósea en estos pacientes. Así, la expresión de heparinasa por las células tumorales del mieloma aumenta la destrucción ósea local y además, aumenta la osteoclastogénesis y osteolisis sistémica imitando la osteoporosis sistémica9. Se ha demostrado una relación positiva entre el nivel de expresión de la heparinasa y los niveles de RANKL. Por otra parte, otros estudios han mostrado la presencia de «células híbridas» en pacientes con mieloma, al detectarse en biopsias fragmentos del núcleo de las células tumorales en los osteoclastos10. Estas células híbridas pueden dar lugar a una «reprogramación» de los osteoclastos y contribuir a una mayor resorción ósea en comparación con los osteoclastos normales.
En relación con la supervivencia algunos estudios muestran una relación con la densidad mineral ósea medida mediante técnicas cuantitativas de tomografía computarizada de columna lumbar11. Así, los pacientes con T-score≤3,5 DE mueren en torno a 18 meses antes que los que presentan un T-score≥3,5 DE.
Los pacientes con mieloma tienen un aumento del riesgo de infección debido a la disfunción del sistema inmune por el deterioro de la función linfocitaria, hipogammaglobulinemia y supresión de la función normal celular plasmática. De hecho, la infección respiratoria fue la causa del fallecimiento de nuestro paciente que presentaba una variante poco frecuente, de cadenas ligeras kappa, con proteinuria de Bence Jones. Desde el punto de vista terapeútico, la radioterapia se reserva para el control del dolor local pero no con fines curativos. La vertebroplastia percutánea se utiliza para estabilizar las lesiones y mejorar el dolor. La cifoplastia reduce la deformidad y estabiliza la fractura vertebral. Los bifosfonatos constituyen el tratamiento médico más empleado. En la actualidad, las pautas de zoledronato intravenoso han mostrado una mayor eficacia en el control de la enfermedad ósea de estos pacientes12. En el futuro nuevos agentes antiosteoporóticos como los anticuerpos monoclonales frente a RANKL constituyen una opción prometedora.
En conclusión, en los varones con osteoporosis establecida debe realizarse un cribado meticuloso de osteoporosis secundaria para establecer un diagnóstico, tratamiento y pronóstico apropiados. La evolución clínica rápidamente progresiva es muy sugerente de neoplasia hematológica como el mieloma múltiple donde las intervenciones farmacológicas específicas no deben retrasarse.