Determinar la relación del hipotiroidismo primario con la aterosclerosis carotídea subclínica y sus posibles modificaciones con la terapia sustitutiva.
MétodosSe realizó un estudio de cohorte prospectivo que incluyó 101 pacientes con diagnóstico de hipotiroidismo primario y 101 pacientes eutiroideos como controles, desde julio del año 2011 hasta diciembre del 2013. Se incluyeron variables clínicas, antropométricas, bioquímicas y ultrasonográficas, evaluadas al inicio del estudio y al año de tratamiento sustitutivo con levotiroxina sódica.
ResultadosLos sujetos afectos de hipotiroidismo al inicio mostraron valores significativamente mayores de tensión arterial, colesterol total, colesterol VLDL, masa del ventrículo izquierdo, grasa epicárdica y grosor íntima-media carotídeo, respecto a los controles. El colesterol total, el colesterol VLDL, la función diastólica ventricular, la grasa epicárdica, el grosor íntima media, la velocidad de propagación del pulso carotídeo, la elastancia y el índice de rigidez arterial β mostraron una correlación positiva y significativa con las concentraciones de TSH. Al año de tratamiento, los pacientes afectos de hipotiroidismo tuvieron modificaciones para el colesterol total, el colesterol VLDL, la TSH, el grosor íntima-media y los parámetros de rigidez arterial.
ConclusionesLos pacientes afectos de hipotiroidismo primario se caracterizan por mayor riesgo cardiometabólico. La sustitución con levotiroxina sódica en estos pacientes se relaciona con una mejoría de la dislipidemia, y mejoría de los indicadores de aterosclerosis carotídea subclínica al año de iniciado el tratamiento.
To assess the relationship between primary hypothyroidism and subclinical atherosclerosis and its potential changes with L-thyroxine replacement therapy.
MethodsA prospective cohort study including 101 patients with primary hypothyroidism and 101 euthyroid patients as controls was conducted from July 2011 to December 2013. Clinical, anthropometrical, biochemical, and ultrasonographic parameters were assessed at baseline and after one year of L-thyroxine replacement therapy.
ResultsAt baseline, hypothyroid patients had significantly greater values of blood pressure, total cholesterol, VLDL cholesterol, left ventricular mass, epicardial fat, and carotid intima-media thickness as compared to controls. Total cholesterol, VLDL cholesterol, ventricular diastolic function, epicardial fat, carotid intima-media thickness, carotid local pulse wave velocity, pressure strain elastic modulus, and β arterial stiffness index showed a significant and positive correlation with TSH levels. After one year of replacement therapy, patients with hypothyroidism showed changes in total cholesterol, VLDL cholesterol, TSH, carotid intima-media thickness, and arterial stiffness parameters.
ConclusionsPrimary hypothyroidism is characterized by an increased cardiovascular risk. In these patients, L-thyroxine replacement therapy for one year is related to decreased dyslipidemia and improvement in markers of subclinical carotid atherosclerosis.
El hipotiroidismo es ocasionado por la secreción deficiente de hormonas tiroideas y se asocia a comorbilidades como la hipertensión arterial, la dislipidemia y la cardiopatía isquémica. Su incidencia es mayor entre la tercera y la sexta décadas de la vida, con predominio en el sexo femenino. Tiene una incidencia en la población general del 1 al 2%, y alcanza el 6-7% de la población femenina mayor de 60 años. En Cuba, ocupa el segundo lugar en la prevalencia de las enfermedades endocrinas, después de la diabetes mellitus1.
En afectos de hipotiroidismo, se han demostrado elevaciones del colesterol total, el colesterol LDL, así como disminución del colesterol HDL. Por tanto, queda claro que el hipotiroidismo conlleva un perfil aterogénico, que puede incrementar el riesgo vascular en los pacientes que lo padecen2.
El riesgo cardiovascular parece asociarse de forma independiente al hipotiroidismo subclínico en pacientes mayores de 65 años. Las mujeres afectas de hipotiroidismo tienen un riesgo 2 veces mayor de desarrollar aterosclerosis y mayor historia previa de infarto de miocardio respecto a controles. Se ha descrito también un incremento de enfermedad arterial periférica, disfunción ventricular izquierda diastólica y sistólica, así como eventos isquémicos coronarios en pacientes afectos de hipotiroidismo subclínico3.
Hoy se conoce que las alteraciones cardiovasculares en la disfunción tiroidea no quedan restringidas a las formas de disfunción clínicamente evidentes. Numerosas evidencias indican que el sistema cardiovascular responde a los mínimos pero persistentes cambios en las concentraciones de hormonas tiroideas circulantes, que son típicos de la disfunción tiroidea subclínica4.
El hipotiroidismo clínico y subclínico se relacionan con un estado reversible de disfunción endotelial, que puede ser responsable de la hipertensión arterial y del riesgo incrementado de aterosclerosis. A medida que la TSH se incrementa, los valores de vasodilatación mediada por flujo disminuyen, señalando la presencia de disfunción endotelial. Por otro lado, la alteración cardiovascular encontrada con mayor frecuencia en el hipotiroidismo es la disfunción diastólica del ventrículo izquierdo (VI), caracterizada por una relajación miocárdica lenta y un retraso en el llenado ventricular5.
El incremento del riesgo de aterosclerosis en el hipotiroidismo se sustenta esencialmente en la resistencia a la insulina, y se vincula con un estado de inflamación crónica de bajo grado favorecido por la gran cantidad de adipocinas secretadas por el tejido adiposo, como el factor de necrosis tumoral alfa y la interleucina-6, que aceleran la aterosclerosis4.
El no reajuste de la dosis adecuada de levotiroxina trae consigo alteraciones, ya sea por exceso ya sea por defecto del fármaco. No obstante, está probada la mejoría progresiva del cuadro clínico después del tratamiento sustitutivo con la mejoría de la calidad de vida y remisión de la sintomatología de los pacientes4.
Si bien diferentes estudios observacionales han demostrado la relación entre dislipidemia, enfermedad cardiovascular aterosclerótica y disfunción tiroidea, los resultados aún son contradictorios6–8, sobre todo para la enfermedad subclínica. Además, los estudios que indican que la aterosclerosis temprana detectada en pacientes con hipofunción tiroidea subclínica es reversible con el tratamiento con levotiroxina y el mantenimiento de la estabilidad de la función tiroidea son aún escasos9–11, sobre todo respecto a las posibles modificaciones de la rigidez arterial carotídea12,13.
Por ello, el presente estudio se propuso identificar la relación entre la aterosclerosis carotídea subclínica y el hipotiroidismo primario, así como sus posibles modificaciones con la terapia sustitutiva.
MétodosSe realizó un estudio observacional de cohorte prospectivo que incluyó de manera consecutiva 2 grupos de comparación: 1) 101 pacientes con diagnóstico confirmado de hipotiroidismo primario al inicio: idiopático (n=47; 46,5%), por tiroiditis crónica (n=33; 32,7%), posquirúrgico (n=12; 11,9%), y posterior a la administración de I131 (n=9; 8,9%), todos ellos tratados con levotiroxina sódica en dosis sustitutiva (dosis de 1,5 a 1,9μg por kg de peso, comenzando por la mitad de la dosis y subiendo progresivamente hasta lograr la dosis necesaria para mantener al paciente clínicamente eutiroideo y con TSH entre 0,27 y 3,75 mUI/l), y 2) 101 eutiroideos como controles, ambos grupos con sujetos entre 25 y 40 años. Los pacientes se atendieron en las consultas de Endocrinología del Hospital Universitario Dr. Miguel Enríquez y el Instituto Nacional de Endocrinología, durante el período comprendido entre julio del 2011 y diciembre del 2013. No se presentaron pacientes afectos de hipotiroidismo por exceso o deficiencia de yodo porque en Cuba no existen regiones con deficiencia de yodo, y los fármacos que lo contienen, como la amiodarona, no son de uso frecuente a estas edades; tampoco se incluyó a pacientes con las anomalías del desarrollo del tiroides: hipoplasia, aplasia y localizaciones anómalas con hipofunción, ya que estas frecuentemente se descubren en la infancia y se sustituyen con levotiroxina, por lo que arriban ya sustituidos a estas edades. Se excluyó a pacientes con antecedentes de diabetes, cardiopatía isquémica, enfermedad cerebrovascular, insuficiencia renal u otra enfermedad crónica que favoreciera la aparición o el desarrollo de la ateroesclerosis. El estudio se realizó de acuerdo con las recomendaciones de la Declaración de Helsinki, y fue aprobado por el Comité de Ética de nuestra institución.
Los criterios de exclusión durante el seguimiento fueron: inasistencia a las consultas de seguimiento, interrupción del tratamiento por más de 2 semanas, aparición de efectos adversos importantes atribuidos al tratamiento y abandono voluntario del tratamiento.
Se incluyeron variables clínicas (edad, sexo, tabaquismo), antropométricas (circunferencia de la cintura [CCin] e índice de masa corporal [IMC]), bioquímicas (glucemia, colesterol total, colesterol VLDL, colesterol HDL, triglicéridos, creatinina, ácido úrico, aspartato-aminotransferasa [ASAT], alanino-aminotransferasa [ALAT], insulinemia en ayunas y TSH), y ultrasonográficas (grosor íntima-media carotídeo [GIMC], parámetros de rigidez arterial [velocidad local de propagación del pulso carotídeo {VLPP}, elastancia {Ep}, complianza arterial {CA} e índice β], volumen de aurícula izquierda [AI], índice de masa del ventrículo izquierdo [VI], relación E/e’ y grasa epicárdica).
Al asistir por primera vez a consulta, se le realizó a cada paciente el programa de estudio completo. Las concentraciones de TSH se determinaron mensualmente ajustando dosis hasta lograr el estado eutiroideo. Posteriormente se realizaron determinaciones de TSH con frecuencia trimestral y, al año de logrado el control, se realizó nuevamente el programa de estudio completo.
Adquisición de los parámetros antropométricos- -
Circunferencia de la cintura: con el paciente previamente desvestido, se midió el perímetro abdominal a nivel del punto medio entre el último arco costal y la cresta ilíaca anterosuperior.
- -
Índice de masa corporal: se calculó según fórmula de Quetelet: peso en kg/(talla en m)2.
En todos los participantes, la extracción (10ml) se realizó por punción en la vena cubital y se depositó la sangre en un tubo con EDTA, un tubo con heparina y un tubo con gel seco para suero. Para la determinación de la glucemia, colesterol total y triglicéridos se emplearon los reactivos RapiGluco-Test, Colestest y Monotriglitest respectivamente, producidos en la empresa Carlos J. Finlay (La Habana, Cuba). La glucemia fue procesada en un equipo Eppendorf mediante método enzimático colorimétrico y el colesterol, triglicéridos, ASAT, ALAT y ácido úrico en un equipo Hitachi 7170 A (Tokyo, Japón). Para las variables colesterol HDL y colesterol VLDL, se emplearon los reactivos C HDL InmunoFS, VLDL-C Select FS, respectivamente, mediante determinación cuantitativa in vitro en suero o plasma en equipos fotométricos (test inmunoturbidimétrico), fabricados por DiaSys Diagnostic Systems GmbH (Holzheim, Alemania).
La insulina se determinó por método de radioinmunoanálisis (insulina por radioinmunoanálisis (Coat-A-CountInsulin [DPC)] en fase sólida por competencia) con una sensibilidad de 5 μIU/ml y un rango de normalidad de 5-35μIU/ml, con un coeficiente de variación inter- e intraensayo de 6,2 y 7,1% respectivamente.
La TSH ultrasensible fue medida por inmunoanálisis competitivo de electroquimioluminiscencia (Modular Analitics E 170, Roche). La detección mínima fue 0,005 μUI/mL y el coeficiente de variación fue 7,2% para una concentración de 0,035μUI/mL y 3,3% para una concentración de 3,66μUI/mL durante el período del estudio. En el caso del radioinmunoanálisis, el coeficiente de variación del control de calidad oscila habitualmente entre un 6 y un 9%, rango característico de este tipo de método inmunorradiológico.
Adquisición de los parámetros ultrasonográficosEl examen ecocardiográfico se realizó en un equipo de ultrasonidos Aloka, Alfa-10 (MitakaShi, Tokio, Japón), con transductor S5-1 provisto de imagen armónica, con frecuencia de 1,3-3,6MHz. El estudio fue realizado por un observador con nivel III de experiencia de la Sociedad Americana de Ecocardiografía, quien en ningún momento conoció los datos del paciente.
- Grasa epicárdica: La grasa epicárdica fue determinada mediante medición en modo bidimensional en las vistas eje largo paraesternal, tomando como referencia de corte el plano valvular aórtico y el eje corto paraesternal a nivel de los músculos papilares. Para la determinación de la grasa epicárdica anterior al VD se promediaron los valores obtenidos de las vistas del eje largo y corto paraesternal. La grasa epicárdica fue medida en el período telesistólico del ciclo cardiaco. La grasa epicárdica se definió como el espacio ecolúcido (con elementos ecorrefringentes en su interior indicativos de grasa) entre la línea ecodensa del pericardio visceral y el epicardio de la pared ventricular derecha.
- -
Índice de masa del VI: se calculó a partir de medir las áreas epicárdica y endocárdica del VI en la vista eje corto paraesternal a nivel medio ventricular. Posteriormente, se procedió a medir el área del VI por el método del elipsoide truncado, descrito por Schiller14. El equipo informó automáticamente la masa del VI en gramos.
- -
Relación E/e’: cociente entre la velocidad de llenado diastólico del VI mediante flujograma mitral y la velocidad de desplazamiento del anillo lateral mitral por doppler tisular. Evalúa la función diastólica del VI, y se emplea para el cálculo de las presiones de llenado.
- -
Parámetros de rigidez arterial: se utilizó el software e-Tracking con el que está dotado el equipo de ultrasonidos Aloka, Alfa-10 (MitakaShi, Tokio, Japón). Siguiendo el mismo procedimiento para la determinación del GIMC, se examinó cada arteria carótida separadamente, seleccionando el nombre del vaso en el menú del equipo, habilitando la función echo-tracking del panel de control y deshabilitando la función de armónicos, dada la cercanía de las estructuras vasculares al transductor. Para el análisis se midió la tensión arterial sistólica (TAS) y diastólica (TAD) con esfigmomanómetro de mercurio, a la llegada del paciente, introduciéndose estos valores en el menú del programa.
El cursor de echo-tracking fue colocado en el centro de la imagen longitudinal de la arteria. Este sistema detecta el movimiento de la pared del vaso que produce el desplazamiento de la onda a través de 2 cursores, uno colocado en la pared anterior y otro en la pared posterior de la arteria, obteniéndose el diámetro máximo y mínimo del vaso para un total de 10 ciclos cardiacos. Después de almacenada la información primaria en el equipo, el programa automáticamente determinó los valores de la velocidad de la onda del pulso que transita por la arteria carótida (VLPP), de la presión que ejerce la sangre para deformar el vaso (Ep), del cambio de volumen por la presión sanguínea (CA) y del índice de rigidez arterial β (cambio del diámetro en sístole de una arteria con respecto a la diástole durante el ciclo cardíaco). Se realizaron 3 mediciones y se tomó el valor promedio.
- Grosor íntima-media carotídeo: se colocó el paciente en decúbito supino con ligera laterización del cuello, ubicándose un transductor lineal con frecuencia de 7,5 MHz en posición longitudinal con respecto a la arteria carótida común (posición laterosuperior del cuello por dentro del músculo esternocleidomastoideo), con la señal del electrocardiograma activada para obtener imágenes vasculares al final de la diástole, visualizándose con una profundidad de 4cm. Para la determinación del GIMC se examinaron ambas arterias carótidas comunes en un segmento de 10mm distal a la emergencia del bulbo carotídeo. Se realizaron las mediciones a nivel de la pared posterior, con un programa semiautomático de detección de bordes.
Análisis estadísticoLas variables cualitativas se expresaron en números absolutos y porcentaje y las cuantitativas en media y desviación estándar. Para establecer diferencias entre las variables cualitativas se empleó la prueba chi2 y para las variables cuantitativas, la t de Student. Se determinó la correlación entre las variables bioquímicas, ecocardiográficas y ultrasonográficas con el TSH, mediante el coeficiente de correlación de Pearson. Para establecer diferencias en los parámetros evaluados en pacientes afectos de hipotiroidismo antes y después del tratamiento sustitutivo, se aplicó una prueba de ANOVA multifactorial. Se consideró asociación significativa entre las variables si p<0,05. Para el análisis estadístico se aplicó el programa SPSS versión 20.0 (SPSS Inc., Chicago, EE. UU.).
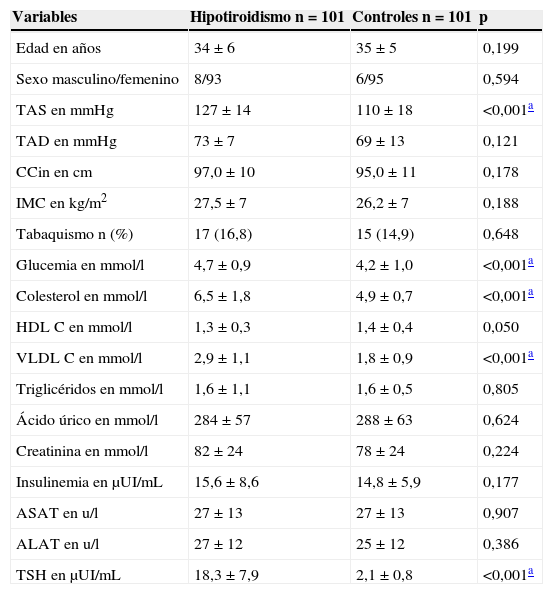
ResultadosSe incluyó a 202 pacientes divididos en 2 grupos de comparación (casos [n=101] frente a controles [n=101]), con una edad media similar (32±5 frente a 33±5 años, respectivamente), sin diferencias de género (sexo femenino 91,2% frente a 94,1%, respectivamente). Los pacientes con diagnóstico de hipotiroidismo mostraron cifras significativamente mayores de TAS (127±14 frente a 110±18mmHg), glucemia en ayunas (4,7±0,9 frente a 4,2±1,0mmol/l), colesterol total (7,5±1,8 frente a 4,9±0,7mmol/l) y colesterol VLDL (2,9±1,1 frente a 1,8±0,9mmol/l) (tabla 1). Por otro lado, con excepción del área de AI, el índice de masa del VI, la relación E/e’, el grosor de la grasa epicárdica, el GIMC y los parámetros de rigidez arterial carotídea fueron significativamente mayores en los sujetos afectos de hipotiroidismo respecto al grupo control (tabla 2).
Variables clínicas, antropométricas y bioquímicas en pacientes afectos de hipotiroidismo vs. controles
| Variables | Hipotiroidismo n=101 | Controles n=101 | p |
|---|---|---|---|
| Edad en años | 34±6 | 35±5 | 0,199 |
| Sexo masculino/femenino | 8/93 | 6/95 | 0,594 |
| TAS en mmHg | 127±14 | 110±18 | <0,001a |
| TAD en mmHg | 73±7 | 69±13 | 0,121 |
| CCin en cm | 97,0±10 | 95,0±11 | 0,178 |
| IMC en kg/m2 | 27,5±7 | 26,2±7 | 0,188 |
| Tabaquismo n (%) | 17 (16,8) | 15 (14,9) | 0,648 |
| Glucemia en mmol/l | 4,7±0,9 | 4,2±1,0 | <0,001a |
| Colesterol en mmol/l | 6,5±1,8 | 4,9±0,7 | <0,001a |
| HDL C en mmol/l | 1,3±0,3 | 1,4±0,4 | 0,050 |
| VLDL C en mmol/l | 2,9±1,1 | 1,8±0,9 | <0,001a |
| Triglicéridos en mmol/l | 1,6±1,1 | 1,6±0,5 | 0,805 |
| Ácido úrico en mmol/l | 284±57 | 288±63 | 0,624 |
| Creatinina en mmol/l | 82±24 | 78±24 | 0,224 |
| Insulinemia en μUI/mL | 15,6±8,6 | 14,8±5,9 | 0,177 |
| ASAT en u/l | 27±13 | 27±13 | 0,907 |
| ALAT en u/l | 27±12 | 25±12 | 0,386 |
| TSH en μUI/mL | 18,3±7,9 | 2,1±0,8 | <0,001a |
ALAT: alanino-aminotransferasa; ASAT: aspartato-aminotransferasa; CCin: circunferencia de la cintura; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica.
Parámetros ultrasonográficos y ecocardiográficos en pacientes con hipotiroidismo y en controles
| Parámetros | Hipotiroidismon=101 | Controlesn=101 | p |
|---|---|---|---|
| Índice de masa del VI (g/m2) | 115±17 | 103±7 | <0,001a |
| Área de AI (cm2) | 22,5±0,4 | 21,9±0,4 | 0,454 |
| Relación E/e’ | 7,4±0,7 | 6,3±0,3 | <0,001a |
| Grasa epicárdica (mm) | 5,0±1,3 | 4,3±0,7 | <0,001a |
| GIMC (mm) | 0,69±0,1 | 0,59±0,1 | <0,001a |
| VLPP (m/seg) | 4,7±0,2 | 4,3±0,3 | <0,001a |
| Ep (kPa) | 82,2±11 | 63,9±7 | <0,001a |
| CA (mm2/kPa) | 0,89±0,2 | 0,97±0,1 | <0,001a |
| Índice de rigidez arterial β | 5,59±1,3 | 4,28±0,9 | <0,001a |
AI: aurícula izquierda; CA: complianza arterial; Ep: elastancia; GIMC: grosor íntima-media carotídeo; VI: ventrículo izquierdo; VLPP: velocidad local de propagación del pulso carotídeo.
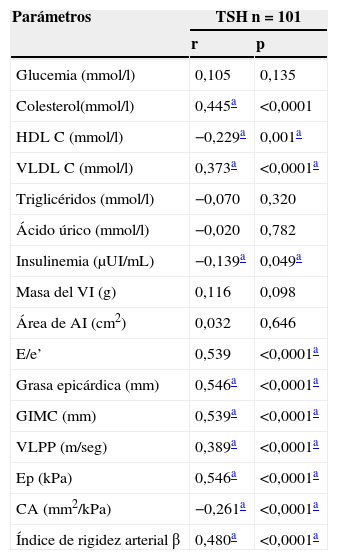
La tabla 3 muestra la correlación entre la TSH y las variables incluidas en el estudio. El colesterol total, el colesterol VLDL, la relación E/e’, la grasa epicárdica, el GIMC, la VLPP, la elastancia y el índice de rigidez arterial β mostraron una correlación positiva y significativa con las concentraciones de TSH, mientras que el colesterol HDL y la complianza arterial mostraron una correlación negativa y significativa.
Correlación entre la TSH y los parámetros bioquímicos y ultrasonográficos en pacientes afectos de hipotiroidismo
| Parámetros | TSH n=101 | |
|---|---|---|
| r | p | |
| Glucemia (mmol/l) | 0,105 | 0,135 |
| Colesterol(mmol/l) | 0,445a | <0,0001 |
| HDL C (mmol/l) | −0,229a | 0,001a |
| VLDL C (mmol/l) | 0,373a | <0,0001a |
| Triglicéridos (mmol/l) | −0,070 | 0,320 |
| Ácido úrico (mmol/l) | −0,020 | 0,782 |
| Insulinemia (μUI/mL) | −0,139a | 0,049a |
| Masa del VI (g) | 0,116 | 0,098 |
| Área de AI (cm2) | 0,032 | 0,646 |
| E/e’ | 0,539 | <0,0001a |
| Grasa epicárdica (mm) | 0,546a | <0,0001a |
| GIMC (mm) | 0,539a | <0,0001a |
| VLPP (m/seg) | 0,389a | <0,0001a |
| Ep (kPa) | 0,546a | <0,0001a |
| CA (mm2/kPa) | −0,261a | <0,0001a |
| Índice de rigidez arterial β | 0,480a | <0,0001a |
AI: aurícula izquierda; CA: complianza arterial; Ep: elastancia; GIMC: grosor íntima-media carotídeo; VI: ventrículo izquierdo; VLPP: velocidad local de propagación del pulso carotídeo.
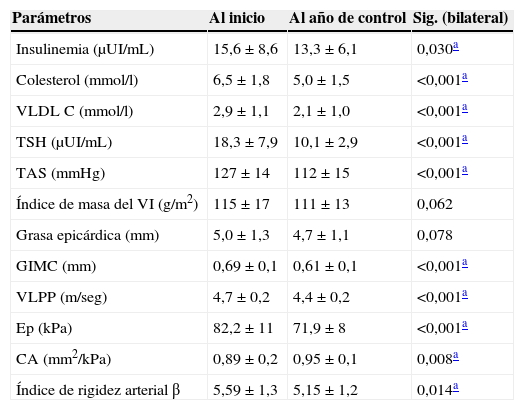
La tabla 4 muestra las diferencias de los parámetros bioquímicos, ultrasonográficos y ecocardiográficos en los pacientes afectos de hipotiroidismo al inicio y al año de tratamiento. Se encontró una disminución significativa de la TAS, el colesterol total, el colesterol VLDL, la TSH, el GIMC, la VLPP, la CA, la Ep y el índice β al año de tratamiento respecto a los valores basales.
Parámetros clínicos, bioquímicos y ultrasonográficos de interés en pacientes afectos de hipotiroidismo al inicio y después de un año de control
| Parámetros | Al inicio | Al año de control | Sig. (bilateral) |
|---|---|---|---|
| Insulinemia (μUI/mL) | 15,6±8,6 | 13,3±6,1 | 0,030a |
| Colesterol (mmol/l) | 6,5±1,8 | 5,0±1,5 | <0,001a |
| VLDL C (mmol/l) | 2,9±1,1 | 2,1±1,0 | <0,001a |
| TSH (μUI/mL) | 18,3±7,9 | 10,1±2,9 | <0,001a |
| TAS (mmHg) | 127±14 | 112±15 | <0,001a |
| Índice de masa del VI (g/m2) | 115±17 | 111±13 | 0,062 |
| Grasa epicárdica (mm) | 5,0±1,3 | 4,7±1,1 | 0,078 |
| GIMC (mm) | 0,69±0,1 | 0,61±0,1 | <0,001a |
| VLPP (m/seg) | 4,7±0,2 | 4,4±0,2 | <0,001a |
| Ep (kPa) | 82,2±11 | 71,9±8 | <0,001a |
| CA (mm2/kPa) | 0,89±0,2 | 0,95±0,1 | 0,008a |
| Índice de rigidez arterial β | 5,59±1,3 | 5,15±1,2 | 0,014a |
CA: complianza arterial; Ep: elastancia; GIMC: grosor íntima-media carotídeo; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica; VLPP: velocidad local de propagación del pulso carotídeo.
Los resultados más importantes y novedosos de nuestro estudio son: los pacientes afectos de hipotiroidismo muestran un mayor riesgo cardiometabólico respecto a controles, y el tratamiento sustitutivo durante un año en hipotiroideos jóvenes reduce las alteraciones lipídicas y la aterosclerosis carotídea subclínica.
El metabolismo lipídico está alterado en el hipotiroidismo, y aproximadamente un 90% de los pacientes con hipotiroidismo manifiesto presentan unas concentraciones elevadas de colesterol total y colesterol VLDL3. Resultados similares fueron encontrados en este estudio en cuanto a concentraciones significativamente mayores de colesterol total y colesterol VLDL en sujetos afectos de hipotiroidismo respecto al grupo control. El hipotiroidismo subclínico se ha asociado también a aumento de colesterol VLDL y de colesterol total en varios estudios transversales4,11,15, mientras que Nakova et al. describieron un aumento significativo en las concentraciones medias de triglicéridos y en la razón colesterol total/colesterol HDL en 69 pacientes con hipotiroidismo subclínico16.
Igualmente, se encontró una relación proporcional y significativa del valor del TSH con la insulinemia, el colesterol total, el colesterol VLDL, e inversa con el colesterol HDL, resultados que muestran una posible relación entre el hipotiroidismo y el síndrome metabólico. Por otro lado, de manera similar a nuestro estudio, Adrees et al. han demostrado una reducción significativa del colesterol total, el colesterol LDL y VLDL con el tratamiento sustitutivo en pacientes afectos de hipotiroidismo subclínico10.
Respecto a los parámetros ecocardiográficos y ultrasonográficos, en el estudio se encontró una relación significativa entre el hipotiroidismo primario y la relación E/e’, la grasa epicárdica, el GIMC, la Ep, el índice β, e inversamente proporcional a la CA. Estos hallazgos relacionan el hipotiroidismo primario subclínico y las concentraciones de TSH con la disfunción diastólica del VI, la rigidez arterial carotídea y la grasa epicárdica, un marcador emergente de riesgo cardiometabólico17, que ha sido relacionado en estudios previos en población hispana con el síndrome metabólico18,19, y la aterosclerosis a nivel carotídeo20 y coronario21. Al respecto, en el único estudio que se halló publicado sobre el tema, Korkmaz et al.22 encontraron un grosor de la grasa epicárdica significativamente mayor en pacientes hipotiroideos respecto a controles (3,6±0,9 frente a 2,8±1,4mm; p=0,005). Hasta donde conocemos, nuestra investigación es el primer estudio que evalúa la posible modificación de la grasa epicárdica con el tratamiento sustitutivo en individuos afectos de hipotiroidismo, aunque solo se observó una reducción no significativa de la grasa epicárdica al año de iniciado el tratamiento.
Diversos autores han encontrado también relación entre el hipotiroidismo subclínico y el GIMC. Recientemente, en un metaanálisis que incluyó 8 estudios y un total de 3.602 pacientes23, se demostraron cifras significativamente mayores de GIMC en pacientes con hipotiroidismo subclínico respecto al grupo eutiroideo. Hallazgos similares a nuestro estudio respecto a la reducción del GIMC con tratamiento sustitutivo han sido descritos por Adrees et al. en 56 mujeres en las que se redujo el GIMC en un 13% respecto a los valores basales con terapia de reemplazo durante 18 meses10. Igualmente, Kim et al. reportaron una disminución significativa del GIMC (0,67±0,11 a 0,60±0,10mm) con tratamiento hormonal sustitutivo durante 18 meses en 28 pacientes con hipotiroidismo11. Por el contrario, Dias et al. no encontraron cambios significativos en el GIMC en 32 mujeres con hipotiroidismo subclínico durante un año de tratamiento24.
En el hipotiroidismo, hay además disfunción diastólica ventricular izquierda en reposo y disfunción tanto sistólica como diastólica con el ejercicio. Se ha demostrado un deterioro de la función diastólica ventricular izquierda por la relajación miocárdica más lenta y el deterioro del llenado ventricular temprano. La terapia sustitutiva de T4 resuelve estas anomalías funcionales y mejora la función tanto sistólica como diastólica. También se han demostrado modificaciones de la disfunción diastólica del VI en reposo en los pacientes afectos de hipotiroidismo subclínico, con mejoría en respuesta a la terapia sustitutiva de T44.
Esta afectación de la función diastólica también puede estar relacionada con el aumento característico de la rigidez arterial en estos pacientes. La relación estrecha entre el hipotiroidismo y la rigidez arterial evaluada con diferentes métodos de medición (tonometría de la arteria radial12, método oscilométrico de la arteria braquial13 y ultrasonido carotídeo25) ha sido demostrada en varios estudios. Al respecto, Tian et al. demostraron en 93 pacientes valores significativamente mayores del índice de rigidez arterial carotídea β en sujetos afectos de hipotiroidismo respecto a controles25, y una correlación positiva entre este parámetro de rigidez arterial y las concentraciones de TSH.
Koren et al.12 demostraron en 30 pacientes con hipotiroidismo subclínico una reducción significativa del índice de aumentación, otro parámetro indicativo de rigidez arterial, en un 3,0% respecto a valores basales tras 7 meses de tratamiento sustitutivo.
Otro hallazgo interesante de nuestro estudio fueron las cifras más elevadas de TAS en los pacientes portadores de hipotiroidismo, lo que mostró modificaciones significativas con el tratamiento sustitutivo. En el metaanálisis de Gao et al.23 también se encontró una relación entre el hipotiroidismo subclínico y el incremento de la TAS. No obstante, se ha señalado que hasta un 20% de pacientes afectos de hipotiroidismo manifiesto muestran hipertensión diastólica significativa relacionada con una mayor rigidez arterial, y se ha señalado que mejora con terapia sustitutiva de T43,4.
No existieron factores externos que influyeron en los cambios observados al año de tratamiento, es decir, los pacientes afectos de hipotiroidismo solo llevaron tratamiento con levotiroxina a dosis sustitutivas.
Como conclusión, los pacientes con hipotiroidismo primario se caracterizan por mayor riesgo cardiometabólico, aumento de la grasa epicárdica y aterosclerosis carotídea subclínica respecto a pacientes eutiroideos. La sustitución con levotiroxina sódica en estos pacientes se relaciona con una mejoría de la dislipidemia y de los indicadores de aterosclerosis carotídea, al año de iniciado el tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.