INTRODUCCIÓN
Las fístulas digestivas y el intestino corto son 2 procesos muy diferentes entre sí y de gran complejidad clínica, en los que el soporte nutricional adquiere una importancia crucial dentro del abordaje terapéutico. Se han publicado trabajos científicos acerca del tratamiento nutricional en estas patologías: nutrición enteral (NE), nutrición parenteral (NP), la distribución de los nutrientes, así como el efecto de determinados nutrientes y/o fármacos en la evolución de la enfermedad.
Las Guías de la American Society for Parenteral and Enteral Nutrition (ASPEN) aportan recomendaciones basadas en la evidencia que resultan ser muy genéricas en ambos casos debido a la gran variabilidad clínica que presentan tanto las fístulas como el intestino corto. Así, el tipo de soporte nutricional quedará condicionado a las múltiples variables clínicas que presentan estos pacientes, entre las que destacan la localización en el caso de las fístulas y el intestino remanente en el síndrome del intestino corto.
El objetivo de esta revisión es analizar los trabajos publicados acerca del tratamiento nutricional en las fístulas digestivas y en el intestino corto, establecer los niveles de evidencia y los grados de recomendación, para así poder aplicar los criterios de la medicina basada en la evidencia (MBE)1 en la práctica clínica.
Dado que el tipo de soporte nutricional en estos procesos ya está establecido y demostrado en trabajos de mucho tiempo atrás, en esta revisión se ha intentado aportar algún dato novedoso buscando trabajos con nuevos fármacos o nutrientes, que pudieran mejorar la evolución y pronóstico de estas enfermedades.
MÉTODOS2
Se llevó a cabo la búsqueda bibliográfica en 2 bases de datos médicas: PubMed y la Cochrane Library. Como límites de la búsqueda se establecieron la fecha y el tipo de publicación. Se han seleccionado los metaanálisis y estudios prospectivos aleatorizados (EPA) publicados entre 1990 y 2004 acerca del soporte nutricional en las fístulas digestivas y en el intestino corto. En caso de no encontrar metaanálisis ni EPA para una determinada cuestión, se analizaron otros estudios de casos y controles no aleatorizados, así como opiniones de expertos y/o conferencias de consenso. Las palabras clave para la realización de la búsqueda fueron: gastrointestinal fistulae, enterocutaneous fistulas, parenteral nutrition, enteral nutrition, somatostatin, octreotide, short bowel syndrome, glutamine, growth hormone (GH), glucagon-like peptide-2 (GLP-2). Se ha utilizado la clasificación de la Canadian Task Force3 para establecer los niveles de evidencia y los grados de recomendación.
FÍSTULAS DIGESTIVAS
Introducción
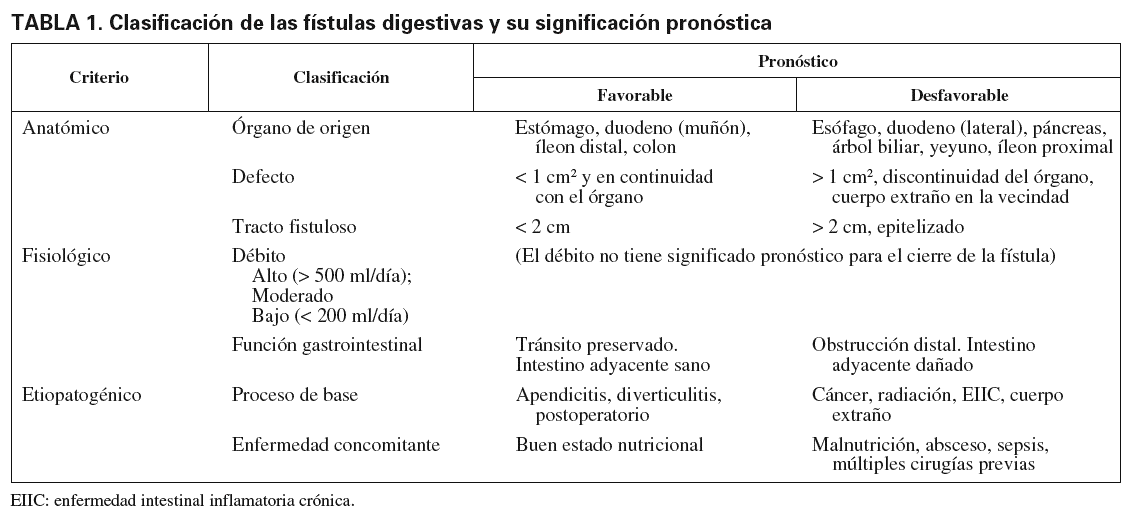
Las fístulas son comunicaciones anormales entre 2 superficies epitelizadas. Las fístulas del tracto gastrointestinal (GI) se subdividen en intensas, con la comunicación entre el tracto digestivo y las cavidades anatómicas preexistentes (pleura, mediastino, peritoneo, retroperitoneo), y externas o enterocutáneas (EC), entre una víscera hueca y la piel. La mayoría ocurren tras una intervención o instrumentación, aunque también pueden aparecer de forma espontánea. El 90% de las fístulas digestivas son EC, y su incidencia según el tipo de cirugía es del 1 al 2% tras cirugía gástrica o duodenal y del 1% tras cirugía yeyunal o ileal. Tras la cirugía pancreática su incidencia es mayor: en cirugía programada es del 20% y en cirugía por pancreatitis aguda, del 20 al 41%. Entre el 75 y el 85% de las fístulas ocurren en el período postoperatorio, durante los 7 a 10 días después de la intervención, aunque algunas se pueden presentar más tarde. Entre el 15 y el 25% restante son espontáneas, y las causas más comunes son radiación, enfermedad intestinal inflamatoria crónica (EIIC), diverticulosis, apendicitis, isquemia intestinal, erosión de tubos permanentes, perforación de úlceras duodenales y neoplasias pancreáticas o ginecológicas. Las fístulas por radiación o neoplasia intestinal tienen posibilidades escasas de cerrarse, mientras que las que aparecen en una EIIC se pueden cerrar para reabrirse más tarde. En la tabla 1 se representa la clasificación y significación pronóstica de las fístulas digestivas4.
En cuanto a la clínica, cuando la fístula es EC5 es evidente, por la salida de un fluido a través de una incisión o drenaje. El análisis bioquímico del contenido de la fístula orienta acerca del origen. Son síntomas comunes el dolor, inicialmente localizado y posteriormente difuso; puede haber íleo, fiebre y, en ocasiones, clínica de sepsis.
Para realizar el diagnóstico se debe medir el débito de 24 h, calcular el balance hidroelectrolítico y buscar infección si se sospecha. La localización en la cabecera del enfermo se puede realizar mediante la administración de azul de metileno o carbón vegetal por vía oral, y su salida posterior por el drenaje o incisión. La prueba diagnóstica de elección es el fistulograma o la fistulografía con contraste. Esta prueba confirma la existencia de la fístula, define su tracto y la anatomía del intestino distal; su rentabilidad es superior a la del tránsito gastrointestinal (TGI). En el paciente con signos clínicos de sepsis es obligatoria la realización de una ecografía y, mejor aún, una tomografía computarizada (TC). Ambas técnicas permiten localizar un absceso y realizar un drenaje percutáneo, si es posible.
Las principales complicaciones de las fístulas incluyen la pérdida de fluidos y electrolitos, que varía en cualidad (según el lugar de origen) y en cantidad (según el débito). En una fístula de alto débito próxima al ligamento de Treitz se pueden llegar a perder hasta 4 l de fluidos ricos en electrólitos y proteínas, que hay que reponer para mantener la estabilidad hemodinámica del paciente. La malnutrición está presente entre el 55 y el 90% de los pacientes y es responsable de la alta morbimortalidad. La pérdida potencial de proteínas por fístulas de alto débito incluye 75 g de células descamadas y 75 g de enzimas digestivas. Tres factores contribuyen a la malnutrición: la ausencia de una ingesta adecuada, el hipercatabolismo asociado a la sepsis y la pérdida de secreciones ricas en proteínas6. La sepsis es la complicación más frecuente de las fístulas y la principal causa de muerte; además, el estado hipercatabólico de la sepsis incrementa aún más el riesgo de malnutrición. Si se sospecha, es necesario un diagnóstico temprano con TC o ecagrafía y se requiere un tratamiento agresivo, ya que la mortalidad es muy elevada si no se drenan los abscesos (por vía percutánea o mediante cirugía).
El tratamiento consta de una serie de medidas generales, como la protección de la piel adyacente y el drenaje percutáneo de las colecciones o abscesos si los hubiera, el soporte nutricional (NE o NP), el tratamiento farmacológico, que incluye la corrección de desequilibrios hidroelectrolíticos, los antisecretores gástricos, los antibióticos de amplio espectro y la somatostatina o sus análogos, como la octreótida. En cuanto al tratamiento quirúrgico, a veces se requiere el drenaje quirúrgico de un absceso o colección que no ha podido ser drenado por TC o ecografía, y también como tratamiento definitivo en una fístula que no ha cerrado en 4 o 6 semanas, siempre que las condiciones del paciente lo permitan y el riesgo quirúrgico no sea alto. Para investigar factores adversos ante una fístula que no cierra, existe la regla FRIEND7 (foreing body [cuerpo extraño], radiación, inflamación, infección, inflammatory bowel disease [enfermedad inflamatoria intestinal], epitelización, neoplasia y distal obstruction [obstrucción distal]).
Recomendaciones ASPEN8
1. Los pacientes con fístulas EC están en riesgo nutricional y deben seguir una evaluación y un plan de tratamiento nutricional (grado de recomendación B).
2. La NE, proximal o distal a la fístula, debe administrarse cuando los pacientes no puedan cubrir sus necesidades nutricionales mediante la ingesta oral, estén malnutridos o vayan a tener una ingesta oral inadecuada durante 7 a 14 días o más (grado de recomendación B).
3. En los pacientes que precisen soporte nutricional, la NP se debe reservar a los casos en los que la NE deba ser restringida (grado de recomendación C).
Evidencia
Nutrición artificial frente a la ausencia de soporte nutricional
La mejoría de la morbimortalidad en los últimos 40 años, especialmente en las fístulas de alto débito, debe atribuirse, en gran parte, al tratamiento nutricional. Ryan et al9 seleccionaron series de estudios retrospectivos10,11 donde se analizaba la evolución de las fístulas en la era pre-NP y tras la introducción de la NP, de un mismo centro hospitalario, y demostraron un incremento significativo de la tasa de cierre espontáneo (el 30 frente al 68%) y una espectacular reducción de la mortalidad (el 36 frente al 8%). Parece lógico, pues, que en la actualidad no existan EPA ni metaanálisis que comparen los resultados del soporte nutricional (NE y NP) con controles que no reciban tratamiento nutricional, para ningún tipo de fístula digestiva.
El soporte nutricional ha de iniciarse lo más pronto posible para prevenir el deterioro del estado nutricional o mejorarlo en caso de que ya exista un déficit12. Las necesidades energéticas dependen del débito de la fístula, del estado nutricional previo y de la existencia o no de sepsis. Se calcula el gasto energético basal (GEB) mediante la fórmula de Harris-Benedict y se aplica un factor de estrés que es de 1,3-1,5 en las fístulas de débito bajo y medio; en las de débito alto las necesidades pueden aumentar hasta 1,5-2, especialmente si hay sepsis asociada. Las necesidades proteicas suelen están aumentadas y oscilan entre 1,25 g/kg/día en las fístulas de débito bajo y 1,5-2 g/kg/día en las de débito medio y alto, en ausencia de fallo hepático o renal. El aporte vitamínico y mineral se realiza según las RDA, aunque algunos pacientes pueden perder cantidades considerables de potasio, magnesio, cinc, sodio y bicarbonato, y requerir suplementación.
Tipo de nutrición
No hay estudios que comparen el tipo de nutrición (NP frente a NE), sino recomendaciones6,12-14 según la localización de la fístula. En las fístulas de localización media (yeyuno e íleon proximal) la única alternativa nutricional es la nutrición parenteral total (NPT). En la fístulas altas (por encima del ligamento de Treitz) y bajas (íleon distal y colon) se puede intentar NE. Para ello, se requiere un mínimo de 60-90 cm de intestino delgado funcionante, preferentemente íleon, para permitir la absorción suficiente de nutrientes y fluidos. Si este intestino es accesible y el paciente no tiene obstrucción distal o íleo paralítico, se debe intentar NE. En el caso de fístulas altas el acceso se hará mediante una sonda u ostomía de localización distal a la fístula. En cuanto al tipo de NE, en las fístulas esofágicas, gástricas y colónicas se tolera bien una dieta polimérica; en las fístulas de intestino delgado y pancreáticas podría ser necesario utilizar dietas oligoméricas o peptídicas, aunque también se pueden añadir enzimas pancreáticas a la dieta polimérica. En cualquier caso, si con la NE aumenta el débito de la fístula, y si este débito no puede ser reducido con modificaciones en la dieta o añadiendo enzimas pancreáticas, hay que considerar la NP como principal fuente de soporte nutricional.
Somatostatina o sus análogos (octreótida) asociados a nutrición parenteral
La somatostatina y sus análogos, como la octreótida, se utilizan por sus acciones en el aparato digestivo15 (inhibición de la secreción exocrina y endocrina, enlentecimiento de la motilidad gastrointestinal y de la contractilidad de la vesícula biliar, reducción del flujo sanguíneo esplácnico y estimulación de la absorción de agua y electrólitos). La somatostatina requiere su administración intravenosa continua debido a su vida media corta, a dosis de 125 a 250 µg/h (de 3 a 6 mg/día). La mayor vida media de la octreótida permite su administración cada 8 h por vía subcutánea. Las dosis habituales suelen ser de 100 µg/8 h por vía subcutánea, aunque se han llegado a administrar dosis de 500 µg/8 h.
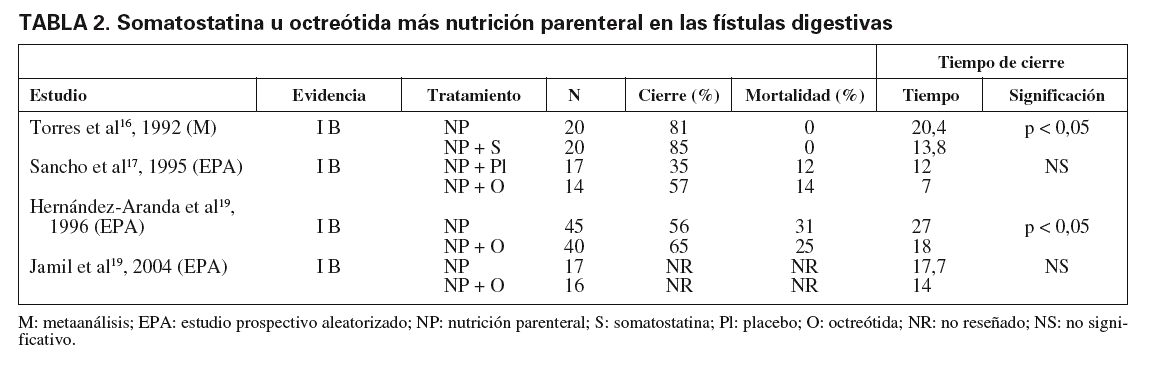
Somatostatina. En las fuentes consultadas sólo se ha encontrado un estudio prospectivo, multicéntrico, aleatorizado y simple ciego, realizado por Torres et al16, en 1992, que compara el efecto de NP sola frente a NP más somatostatina a dosis de 250 µg/h. No se encontraron diferencias significativas entre los 2 grupos en mortalidad ni en el porcentaje de cierre espontáneo. Sin embargo, sí fue significativa la reducción del tiempo de cierre espontáneo en el grupo de somatostatina (13,8 ± 2 días frente a 20,4 ± 3 días), así como la reducción de la morbilidad por complicaciones (sepsis por catéter, abdominal, urinaria, neumonía, neumotórax e infección de la herida quirúrgica).
Octreótida. Se han encontrado 3 estudios. En el primero de ellos, publicado por Sancho et al, en 199517, prospectivo, aleatorizado y doble ciego, se estudia a pacientes con fístulas postoperatorias de aparición en los 8 días siguientes a la cirugía, y se les trata con NP más octreótida (100 µg/8 h) frente a NP más placebo. No encuentran diferencias significativas en la mortalidad, la morbilidad, la tasa de cierre espontáneo y el tiempo de cierre de la fístula. Concluyen que el efecto inhibitorio del débito de la fístula se debe más a la NP que a la octreótida, y no encuentran justificación para el uso de octreótida en este tipo de fístulas. Posteriormente, Hernández-Aranda et al18, en 1996, en un ensayo prospectivo, aleatorizado, controlado y simple ciego, comparan NP sola frente a NP más octreótida (100 µg/8 h). No observan diferencias significativas en cuanto a la mortalidad, la morbilidad, la tasa de cierre espontáneo y el tiempo de estancia hospitalaria, y sí en cuanto al tiempo de cierre (27 frente a 18 días) y tiempo de apoyo nutricional (29 frente a 22 días), por lo que sí recomiendan el uso de octreótida junto con NP en el tratamiento de las fístulas. Un trabajo reciente de Jamil et al, de 200419, prospectivo, aleatorizado y simple ciego que comparaba NP frente a NP más octreótida (100 µg/8 h), encuentra que la octreótida asociada a NP tiene un cierto efecto en el tiempo de cierre y en la estancia hospitalaria, pero que no es estadísticamente significativo. Sin embargo, se produjo un incremento significativo en el coste del tratamiento con octreótida, por lo que concluyen que no está del todo establecido el papel de este fármaco en el tratamiento de las fístulas enterocutáneas. En la tabla 2 se muestran los resultados de estos estudios.
INTESTINO CORTO
Introducción
El intestino corto es el síndrome malabsortivo de macronutrientes, fluidos, electrólitos, minerales y/o vitaminas que resulta de resecciones intestinales extensas junto con la disfunción del intestino remanente (menos de 200 cm)20,21. La insuficiencia intestinal se refiere a la disminución de la absorción intestinal, que puede compensarse por la hiperfagia o por la adaptación física o metabólica intestinal. El fracaso intestinal se define cuando se precisa NP o fluidoterapia para mantener el equilibrio nutricional y la composición corporal22.
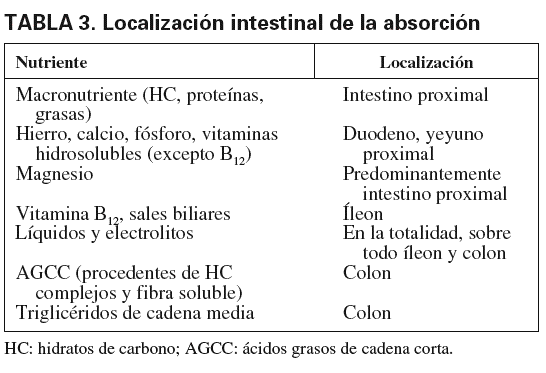
La absorción de los nutrientes/no nutrientes es diferente a lo largo del intestino (tabla 3). Según el grado y la localización de la resección, aparece una clínica u otra. La válvula ileocecal es de gran importancia para enlentecer el vaciamiento gástrico y el tránsito intestinal e impedir el sobrecrecimiento bacteriano por paso de bacterias colónicas al intestino delgado20,23,24. En el intestino también se producen hormonas como la colecistocinina, la secretina, el péptido intestinal vasoactivo o el péptido YY, que tienen diferentes funciones, pero que comparten la acción de retraso en el vaciamiento gástrico25.
Tras la resección intestinal amplia disminuye la superficie absortiva. Esto conlleva una maldigestión y una malabsorción de nutrientes que, asociada al aumento de la secreción gástrica que se produce a consecuencia de la hipergastrinemia26,27 y al aumento del tránsito intestinal, puede originar una diarrea de etiología multifactorial (osmótica, esteatorrea, colerética y secretora). Náuseas, vómitos, intolerancia oral, depleción hidroelectrolítica, alteraciones del equilibrio ácido-base, depleción de vitaminas y minerales, desnutrición calórico-proteica, dolor y prurito anal, y hemorroides son algunos de los síntomas que suceden en el síndrome del intestino corto, al menos en la fase previa de la adaptación que experimentará el intestino.
La fase de adaptación intestinal puede comenzar desde el inicio y durar más de 2 años20. Tras la activación genética de los enterocitos se producirá hiperplasia e hipertrofia celular con el crecimiento de la longitud de los villi y en profundidad de las criptas, un aumento de las enzimas y los transportadores intestinales, un enlentecimeinto del tránsito intestinal y una cierta especialización en la absorción de otras regiones intestinales24. La consecuencia de esto es que se van a disminuir las pérdidas por las ostomías, los requerimientos en la NP y se aumentará la tolerancia a la nutrición oral y/o enteral, con lo que mejorará la sintomatología. Los factores que contribuirán al buen pronóstico en la adaptación son la independencia de NPT, la presencia de válvula ileocecal, de hemicolon o de colon completo, así como la relación entre la longitud intestinal y el peso corporal (B), del intestino residual sano y de la longitud del intestino remanente (más de 100 cm sin colon o más de 50 cm con colon)28.
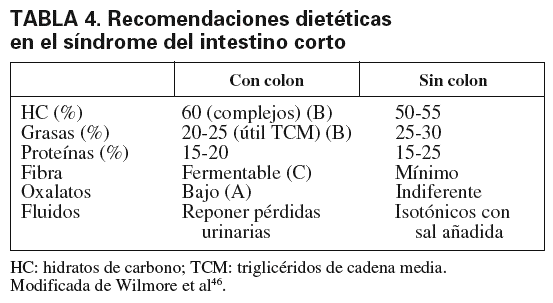
Los nutrientes intraluminales son, probablemente, los mayores factores tróficos intestinales, ya que ejercen efectos directos beneficiosos y estimulan la secreción pancreática29. La nutrición oral debe comenzar tan pronto como el paciente acepte, siempre que no exista contraindicación. Se recomienda iniciar con 600 kcal/día en 6-8 tomas diarias, y se debe evitar beber líquidos 1 h antes y después de cada comida. Las recomendaciones dietéticas se resumen en la tabla 4, según la presencia o no de colon30. Otras recomendaciones establecidas hacen referencia a evitar la cafeína, el alcohol y los medicamentos con el manitol o el sorbitol, puesto que aumentarán la diarrea. Por otra parte, es muy rara la necesidad de colocar una sonda nasogástrica. Las dietas oligoméricas no muestran ventajas respecto a las poliméricas, por lo que estas últimas se usarían en un primer momento22,31. Inicialmente, además, siempre requerirán NP asociada para hidratar, reponer iones y complementar la dieta. El tiempo necesario de la NP se establecerá fundamentalmente por la longitud del intestino remanente30.
Las complicaciones que pueden aparecer en la evolución, así como su tratamiento, se muestran en la tabla 5.
Recomendaciones ASPEN
1. Los pacientes con síndrome del intestino corto presentan riesgo nutricional y requieren de un cribado para identificar a aquellos que precisen una valoración y un tratamiento nutricional (grado de evidencia B).
2. Si tienen colon intacto deberían recibir dietas ricas en hidratos de carbono complejos (fermentados a ácidos grasos de cadena corta y utilizados por el colonocito) y bajas en grasa (menos esteatorrea y menos pérdidas calóricas) (grado de evidencia A).
3. Se debe dar una dieta baja en oxalatos a los pacientes con colon intacto (grado de evidencia A).
4. Los pacientes con resección de más de 100 cm de íleon terminal deberían recibir inyecciones mensuales de vitamina B12 (grado de evidencia A).
5. Si no es posible cubrir los requerimientos nutricionales mediante nutrición oral o enteral, se necesitaría administrar NP (grado de evidencia A)20.
Evidencia
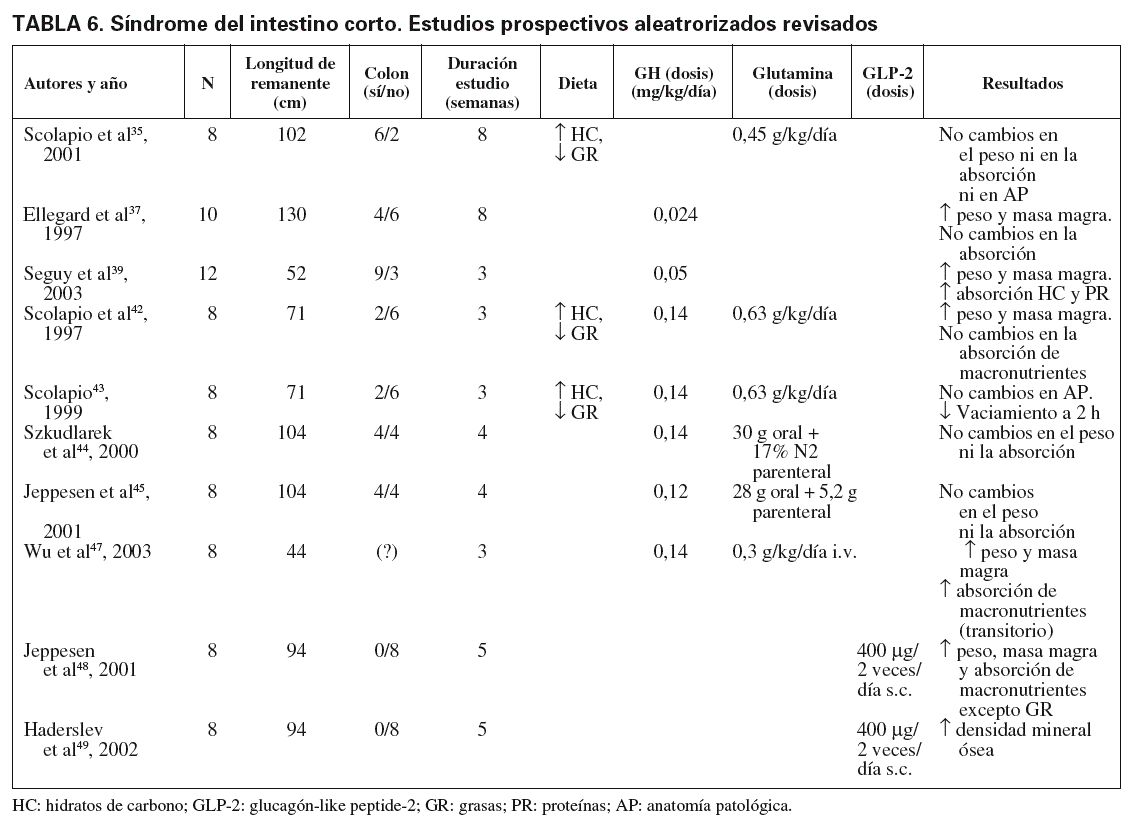
Ahora bien, ¿se puede acelerar la fase de adaptación intestinal? ¿Existen fármacos o nutrientes capaces de modificar la evolución natural del síndrome del intestino corto en beneficio del paciente, que consigan una independencia de la NP? Seguidamente se exponen y se discuten los trabajos publicados (tabla 6). No se encontraron metaanálisis para ninguna de las preguntas formuladas.
¿Qué aporta la glutamina en el síndrome del intestino corto?
La glutamina es un aminoácido que se encuentra fundamentalmente en el compartimiento tisular. El músculo es el principal productor de glutamina. Su metabolismo depende únicamente de las enzimas glutaminosintetasa y de la glutaminasa. Se encuentra implicada en la síntesis proteica, así como en funciones relacionadas con el transporte del nitrógeno entre los tejidos. En lo que respecta al síndrome del intestino corto, convendría recordar que la glutamina es un sustrato preferencial del enterocito. Su deficiencia, que puede ocurrir en situaciones de hipercatabolismo por un consumo elevado, mediado principalmente por el cortisol, podría ocasionar una translocación bacteriana si añadimos que la deficiencia de este aminoácido también compromete la función inmunitaria y el equilibrio ácido-base32. En modelos animales, su uso favorece la adaptación intestinal33. Por este motivo, se trabaja en busca de estos resultados en humanos. Se encontraron 2 EPA que hacen referencia al uso de glutamina en el síndrome del intestino corto.
En 6 pacientes con yeyunostomía se comparó la administración por sonda nasogástrica de 2 soluciones isotónicas con y sin glutamina, y no se encontraron diferencias en la absorción de fluidos ni de glucosa. Sin embargo, la absorción de sodio fue más alta en los pacientes que no tomaron la solución con glutamina34.
Posteriormente, en 8 pacientes (3 de ellos dependientes de NP) que seguían una dieta rica en hidratos de carbono complejos y pobre en grasas, se realizó un estudio aleatorizado, doble ciego, cruzado y controlado con placebo, en que se añadían 0,45 g/kg/día de glutamina por vía oral administrada cada 4 h durante 8 semanas. No se encontró ninguna diferencia respecto a placebo en ninguno de los parámetros medidos (peso, vaciamiento gástrico a las 2 y 4 h, volumen de heces, porcentaje de absorción de grasas y de hidratos de carbono, altura de villi y profundidad de criptas)35.
¿Qué aporta la hormona de crecimiento en el síndrome del intestino corto?
En estudios animales la hormona de crecimiento (GH) aumenta la longitud y funcionalidad intestinal por unidad de longitud36.
El primer estudio aleatorizado, doble ciego y controlado con placebo, realizado con GH, fue en una serie de 10 pacientes con síndrome del intestino corto secundario a enfermedad de Crohn, en los que solamente uno precisaba NP37. Se trataron con 0,024 mg/kg/día de GH subcutánea frente a placebo durante 8 semanas y tras un período de lavado de 12 semanas se cruzaron los tratamientos. Como resultado se obtuvo aumento de peso en 2 kg, junto con un aumento de masa magra y de masa libre de grasa, medida por DEXA; esto último en relación directa con el aumento de los valores de factor de crecimiento similar a la insulina tipo 1 (IGF-1) de manera significativa. Sin embargo, no se objetivaron aumentos en absorción de energía, proteínas, agua o diferentes oligoelementos medidos. No se encontraron parámetros analíticos indicativos de mejora del perfil nutricional ni variaciones en la densitometría ósea, aunque sí un aumento de osteocalcina como medidor de formación ósea. Se encontraron efectos secundarios leves, aunque un paciente tuvo que reducir la dosis por presentar pesadillas, exantema y obstrucción nasal38.
En 12 pacientes con síndrome del intestino corto, dependientes todos de NP, al menos desde 1 año antes de entrar en el estudio y con remanente intestinal de 48 ± 11 cm, se administraron 0,05 mg/kg/día de GH frente a placebo durante 3 semanas. Se encontró un aumento de peso significativo añadido a un aumento de absorción de energía (15 ± 15%), proteínas e hidratos de carbono. En la impedianciometría se encontró aumento de masa magra, sin cambios en la masa grasa. Los valores de glutamina plasmática, sin haberse suplido previamente, aumentaron significativamente tras el tratamiento con GH. Estos beneficios se obtuvieron sin efectos secundarios graves39.
¿Y la combinación de hormona de crecimiento con glutamina?
En esta línea, los trabajos iniciales que encontramos son los de Byrne et al, que muestran ensayos clínicos no aleatorizados ni ciegos. Primero, con 10 pacientes a los que se les siguió durante 21 días tras la administración de GH (0,14 mg/kg/día) y glutamina parenteral (0,42 g/kg/día) u oral (0,63 g/kg/día) junto con una dieta rica en hidratos de carbono, pobre en grasas y con fibra soluble. Los resultados fueron un aumento en un 39% en la absorción de hidratos de carbono, junto con un aumento de peso de 5,4 kg40. Posteriormente, ampliaron su trabajo a una serie de 47 pa cientes con una media de remanente intestinal de 50 cm, la mayor parte sin colon, disminuyendo la dosis de GH administrada (0,03-0,14 mg/kg/día). Estos autores observaron que el 57% de los pacientes pudo retirar la NP y el 30% disminuyó sus requerimientos calóricos en ésta41.
En un ensayo aleatorizado, doble ciego, controlado con placebo y cruzado de 8 pacientes con una media de 71 cm (intervalo entre 55 y 120 cm) de remanente intestinal (2 con colon) y con dependencia de NP durante una media de 13 años, se ha administrado una dieta rica en hidratos de carbono y pobre en grasas con tratamiento con GH a dosis bajas (0,14 mg/kg/día) y glutamina oral (0,63 g/kg/día) durante un período de 21 días. Se obtuvo una ganancia de peso en todos los pacientes, pero con aumento del edema. Aumentó la masa magra en 4 kg y disminuyó significativamente la masa grasa. Sin embargo, no se produjo un aumento en la absorción de ningún macronutriente, variación en el volumen de las heces ni una disminución en las pérdidas de sodio y potasio fecal. En la biopsia realizada no hubo diferencias en villi ni criptas a pesar del aumento de proliferación del ADN. El edema producido despareció a las 2 semanas de suspender el tratamiento. Otros efectos secundarios fueron: síndrome del túnel carpiano, alteraciones del sueño, artralgias, cefalea y náuseas42,43.
Posteriormente se publicó una serie de 8 pacientes con una media de remanente intestinal de 100 cm (intervalo entre 30 y 150 cm), 4 de enea (0,14 mg/kg/día), glutamina oral (30 g/día) y parenteral (el 17% nitrógeno como glutamina) durante 28 días. No hubo diferencias en peso, masa magra, masa grasa, masa ósea, en absorción de macronutrientes ni en los iones. Significativamente, hubo un aumento en la absorción de hidratos de carbono y de sodio en los pacientes que tenían colon. Todos presentaron efectos adversos que identificaban claramente el período de placebo frente al de tratamiento44,45.
Reseñamos la serie de casos de Wilmore et al, a pesar de no ser un estudio aleatorizado, por presentar un número elevado de pacientes y por plantearse la presencia de factores predictivos en la adaptación intestinal46. Se seleccionó a 45 pacientes con remanente intestinal menor de 50 cm, con dieta rica en hidratos de carbono y pobre en grasas, y se les administró GH subcutánea (0,03-0,14 mg/kg/día) complementada con glutamina oral o parenteral. La administración de GH duró 4 semanas. Tras este período, el 58% de los pacientes no precisaba NP. El factor predictivo más claro que discriminaba una buena adaptación intestinal tras el tratamiento fue el índice longitud intestinal/peso corporal; así, en el 80% de los que presentaban buena respuesta tenía un índice igual o superior a 0,5 cm/kg. Tras una media de seguimiento de 22 meses (intervalo 1-84), los pacientes libres de nutrición parenteral eran el 40%.
Recientemente, como parte de un ensayo clínico, se administró a 8 pacientes una combinación de GH subcutánea (0,14 mg/kg/día) junto con glutamina intravenosa (0,3 g/kg/día) durante 3 semanas. Tenían una media de 44 cm de intestino remanente (intervalo, 0-80 ). Al final presentaban una ganancia de peso significativa, un aumento de la absorción de hidratos de carbono, proteínas y grasas. Sin embargo, a la semana de suspender el tratamiento, todos los parámetros medidos perdían significación estadística respecto a los parámetros basales47.
¿Y el glucagón-like peptide-2 (GLP-2)?
El GLP-2 es un péptido derivado del proglucagón que interviene en el trofismo intestinal, con propiedades antisecretoras y que sirve para modular el tránsito intestinal. En condiciones normales se secreta por la mucosa del íleon terminal y colon tras la ingesta.
Se estudió a 8 pacientes (el 50% con NP) con una media de remanente intestinal de 94 cm (intervalo, 30 170 ) y con yeyunostomía terminal. Se les administró GLP-2, 400 µg, 2 veces al día por vía subcutánea, durante 35 días. Se demostró que estos pacientes no tenían capacidad para aumentar los valores de GLP-2 tras una comida, como los sujetos sanos, pero sí aumentaban tras la administración farmacológica de este péptido. Tras finalizar el estudio aumentó la absorción de energía sin aumentar la absorción de grasas. También aumentó significativamente la absorción de agua en un 11%. Hubo mejoría de los parámetros histológicos, como la altura de los villi y la profundidad de las criptas, pero sin significación estadística. Cuanto más corto era el remanente intestinal, mayor la absorción de agua. Pero, sin duda, la mayor mejoría estadísticamente significativa resultó en los parámetros clínicos: aumento de peso como media de 1,2 kg, aumento de masa magra, disminución de masa grasa y aumento de masa ósea. Dos de 8 pacientes presentaron eritema en el lugar de punción, y en 1 de 8 se observó disminución del apetito. No se objetivaron otros efectos adversos48. Tras finalizar el estudio mejoró la densidad mineral ósea de manera significativa en los que tenían nutrición parenteral49.
CONCLUSIONES
En las fuentes consultadas, según los criterios de búsqueda descritos anteriormente, no se han encontrado metaanálisis ni EPA que comparasen el soporte nutricional frente a su ausencia, ni otros trabajos que comparasen el tipo de nutrición (oral frente a enteral frente a parenteral) en las fístulas digestivas ni en el intestino corto.
En las fístulas digestivas se da por sentado que el soporte nutricional es esencial para el tratamiento (grado de recomendación B): NE cuando sea posible, y de no ser así, NP (grado de recomendación C). El uso de somatostatina o de sus análogos, como octreótida, asociados a la nutrición artificial es controvertido, aunque parece que sí tienen un cierto efecto de acortamiento del tiempo de cierre de las fístulas (grado de recomendación B) y, por tanto, del tiempo de soporte nutricional.
En el síndrome del intestino corto existen pocos trabajos y, en muchos casos, duplicación de los pacientes en dife-rentes publicaciones, como indican Matarese et al en una revisión reciente50. En cuanto a las recomendaciones dietéticas, aunque no ha sido marcado como objetivo de nuestro trabajo, las publicaciones que existen van en la línea de la ASPEN. El paciente con síndrome del intestino corto tiene riesgo nutricional (grado de recomendación B), debe recibir nutrición oral o enteral cuando sea posible (grado de recomendación B) y, cuando tienen colon deben llevar una dieta rica en hidratos de carbono complejos, pobre en grasas (grado de recomendación B) y oxalatos (grado de recomendación A), y se administra vitamina B12 mensual cuando hay resección íleon mayor de 100 cm (grado de recomendación B).
La intervención farmacológica para mejorar la adaptación intestinal no apunta favorablemente. La glutamina no presenta recomendación (grado de recomendación B), al menos fuera del estado de hipercatabolismo. El uso de GH aislada consigue aumentar peso y masa magra en un breve período de tiempo, pero conviene ser cautos a la hora de recomendar su uso, hasta que no se disponga de más datos en cuanto a dosis de GH óptimas y resultados a medio-largo plazo que puedan evaluar efectos secundarios potencialmente graves. Cuando se ha combinado una dieta rica en hidratos de carbono y pobre en grasas, junto con GH y glutamina, se consigue aumentar el peso pero los beneficios que se obtienen se limitan exclusivamente al período de administración, con lo que no podemos establecer el grado de recomendación B para su uso en el momento actual. Los resultados con GLP-2 en pacientes con síndrome del intestino corto y sin colon son prometedores: los pacientes aumentaron de peso con mejoría de los parámetros clínicos, pero al sustentarse únicamente por un EPA preferimos ser prudentes en su recomendación, pendientes de otras valoraciones y estudios que avalen estos resultados.
Los tratamientos en este tipo de pacientes van encaminados a mejorar su calidad de vida, intentando la independencia de la NP. Quizá habría que identificar a los candidatos óptimos, en cuanto a enfermedad subyacente y a remanente intestinal, para emplear las medidas farmacológicas expuestas.