"La mitad de lo que les enseñamos se demostrará que es falso en los próximos 10 años. El problema es que ninguno de sus profesores sabe cuál es esa mitad."*
Dr. Sydney Burwell, Decano de la Facultad de Medicina de Harvard
MEDICINA BASADA EN LA EVIDENCIA
Definición
La medicina basada en la evidencia (MBE) es una nueva forma de entender la práctica médica. Comienza a desarrollarse a partir de 1989 por un grupo de epidemiólogos e internistas de la Universidad de MacMaster, en Canadá, aunque no es hasta 1992, con la constitución del Evidence Based Medicine Working Group (EBMWG) y su primera publicación en la revista JAMA1, cuando se extiende al resto de profesionales de la medicina. Según palabras de sus propios autores, la MBE es un "nuevo paradigma para la práctica de la medicina [...] que resta importancia a la intuición, la experiencia clínica no sistemática y a la base fisiopatológica, y resalta la importancia de las pruebas (evidences) procedentes de la investigación para la toma de decisiones clínicas"1.
Tradicionalmente, y hasta la introducción de la MBE, existía la creencia de que las opiniones de los expertos y la práctica clínica habitual (lo normal en nuestro medio) eran suficientes para solucionar las cuestiones clínicas de cada día. Ante un determinado problema de diagnóstico o tratamiento, nuestra conducta habitual consistía en seguir las recomendaciones de los expertos en el tema que encontrábamos en los libros de texto o en las revisiones clásicas (a las que denominaremos narrativas), o plantear el problema a colegas que, suponíamos, tenían más experiencia y conocimientos que nosotros en ese tema concreto. Las recomendaciones así obtenidas, y moduladas también en parte por nuestra propia experiencia, conformaban la base en la que sentar nuestra decisión terapéutica o diagnóstica. Sin embargo, ninguna de estas soluciones es un mecanismo adecuado para la toma de decisiones clínicas1,2. Las opiniones y las recomendaciones de los expertos suelen modificarse lentamente y, en general, las novedades científicas se reflejan en los libros de texto con demasiado retraso. Al igual que en las revisiones narrativas, los libros incluyen referencias bibliográficas seleccionadas que apoyan o confirman las opiniones de los expertos a los que se les ha encargado su redacción, y con frecuencia obvian los estudios clínicos que no demuestran efectos positivos o cuyos resultados son contrarios a las opiniones de los autores.
Por el contrario, lo que la MBE propone es que el médico, cuando se enfrenta a un problema de decisión clínica, busque la mejor información disponible, la que le aporte suficientes pruebas, para respaldar su decisión. Así planteado, no parece que haya duda alguna sobre su racionalidad y fiabilidad. Sin embargo, han aparecido muchas publicaciones en contra de la MBE y bibliografía que analiza sus problemas y sus limitaciones2-4. Se la ha criticado por reduccionista, por no tener en cuenta la experiencia de los profesores, por basarse en premisas falsas, etc. De lo que no hay duda es que supone un cambio sustancial en la práctica médica y requiere que el médico posea una serie de habilidades que tradicionalmente no han sido parte de su formación académica.
Estrategia de la MBE
Ante una cuestión clínica el camino que el médico debe seguir desde la perspectiva de la MBE es, de una forma esquemática, la siguiente2,5:
1. Plantear con precisión el problema clínico y la información que se requiere para solucionarlo. Hay que definir claramente el paciente-problema, la intervención y los resultados que se quieren evaluar y que deben ser clínicamente importantes.
2. Realizar una búsqueda eficiente de la bibliografía disponible hasta la fecha, que se refiera específicamente al problema clínico planteado.
3. Seleccionar los estudios relevantes.
4. Determinar su validez y su utilidad, que, en última instancia, condicionarán su aplicabilidad clínica.
5. Extraer una conclusión para aplicar a nuestro paciente-problema concreto.
Analizando de forma global la estrategia de 5 pasos que propone la MBE, podemos deducir los principales problemas que encuentra el médico tradicional para llevarla a cabo. Por una parte, debe poseer suficientes conocimientos informáticos para poder realizar las búsquedas bibliográficas en las bases de datos biomédicas, revistas online y/o centros de MBE. No sólo hay que saber qué se quiere buscar sino dónde y cómo ha de buscarse, y las limitaciones de cada una de las fuentes consultadas. La ayuda de un bibliotecario o un documentalista es, al menos inicialmente, inestimable. Además, entre la gran cantidad de artículos científicos publicados (se calcula que cada día se publican más de 3.000 y unas 1.000 nuevas referencias en Medline5) el médico debe ser capaz de seleccionar sólo los que sean relevantes (según el BMJ, menos del 10% de los estudios publicados) para, posteriormente, una vez determinada su validez, analizarlos y extraer las conclusiones adecuadas para la resolución del problema clínico planteado. Se requiere, por tanto, que el médico maneje conceptos epidemiológicos y de estadística básica, conozca al menos una escala de calidad y una clasificación de los niveles de evidencia, según el tipo de intervención, diagnóstica, preventiva o terapéutica.
Sería difícil (además de pretencioso) resumir aquí las normas de lectura crítica y profundizar en la estrategia de la MBE. Hay otros recursos de extraordinaria utilidad, como las guías del EBMWG2 o los cursos online de introducción a la MBE5,6, que el lector interesado puede con sultar.
Niveles de evidencia y grados de recomendación
Los niveles de evidencia permiten clasificar jerárquicamente los estudios de investigación en función del rigor científico en su diseño y, por tanto, según su fiabilidad y posibilidad de error. Históricamente, la Canadian Task Force fue la primera institución que publicó una clasificación de niveles de evidencia y sus correspondientes grados de recomendación7, en respuesta a la necesidad de jerarquizar los estudios realizados sobre determinados tratamientos farmacológicos8. Resulta, por tanto, lógico que los estudios prospectivos aleatorizados (EPA) sean considerados el gold standard y que en las primeras clasificaciones les correspondieran el mayor nivel de evidencia, seguidos por los noEPA, los estudios de cohortes y de casos y controles, los controles históricos y las opiniones de los expertos. Más tarde se han ido introduciendo novedades, entre las que destaca la incorporación de los metaanálisis y las revisiones sistemáticas de la bibliografía (RSB), por encima de los EPA9.
La generalización del método de la MBE y su aplicación a otras especialidades se ha acompañado de problemas y críticas que, al menos en parte, se relacionan con la dificultad de aplicar las escalas de intervención a otras facetas de la práctica médica. Esto ha favorecido la aparición de nuevas clasificaciones de la evidencia que pueden utilizarse en otro tipo de estudios, no sólo de intervención terapéu tica sino de diagnóstico, prevención, pronóstico y prevalencia, así como en estudios económicos y en análisis de decisión8,9.
En la actualidad existen varias clasificaciones de la evidencia que, en algunos casos, incluyen también escalas de calidad y de consistencia de resultados10,11. En la tabla 1 se presenta la clasificación de la evidencia utilizada en los originales de este monográfico y tomada de la inicial de la Canadian Task Force, con las modificaciones introducidas por los mismos autores en los años noventa.
Revisiones sistemáticas de la bibliografía y guías de práctica clínica
Las RSB y las guías de práctica clínica facilitan al clínico la toma de decisiones basadas en la evidencia. De una forma coloquial puede decirse que los autores de ambas han hecho nuestro trabajo en MBE. Mientras que en las revisiones narrativas un experto analiza los estudios que ha considerado interesantes para demostrar o criticar determinada práctica médica, es decir, combina evidencias seleccionadas con opiniones propias, las RSB se basan en "toda" la bibliografía disponible sobre el tema. El método para realizar una RSB es similar a la estrategia de 5 pasos comentada antes salvo en la búsqueda bibliográfica, que debe ser más sensible y menos específica, ya que se pretenden encontrar todos los estudios (también los no publicados) que cumplan los criterios de inclusión de dicha revisión2,12.
No hay que confundir las RSB con los metaanálisis. Los autores de las RSB pueden incluir la realización de un metaanálisis, pero no es imprescindible (de hecho, en ocasiones es imposible hacerlo con la investigación realizada hasta ese momento). El metaanálisis se define como un método estadístico que combina los resultados de distintos EPA sobre una misma cuestión, y así conseguir aumentar el poder estadístico y disminuir la posibilidad de error. Por supuesto, los resultados de los metaanálisis dependen de la calidad de los EPA que los conforman2,13.
Las guías de práctica clínica se basan en las RSB pero van un poco más lejos, ya que pretenden abarcar todos los aspectos de una decisión clínica12. Se han definido como "declaraciones institucionales desarrolladas de forma sistemática para ayudar a los médicos y a los pacientes en la toma de decisiones en unas circunstancias clínicas concretas"2.
Tanto en las RSB como en las guías se debe especificar siempre el tipo de clasificación de la evidencia que se ha utilizado. Por ejemplo, las Guías de la American Society of Parenteral and Enteral Nutrition (ASPEN)14 utilizan la clasificación de la Agency for Healthcare Research and Quality (AHRQ), en la que un grado de recomendación A se obtienen a partir de cualquier EPA (con independencia de su tamaño muestral); un grado B, a partir de estudios no EPA con "buen diseño", y un grado C, de opiniones de expertos y conferencias de consenso (tabla 2). Aunque después se analizará con más detalle, conviene resaltar aquí la diferencia que existe entre la clasificación propuesta por la Canadian Task Force y la de la AHRQ.
NUTRICIÓN BASADA EN LA EVIDENCIA
Definición
Una vez desarrollado el concepto de MBE resulta sencillo comprender la definición de nutrición basada en la evidencia (NuBE), ya que deriva directamente de la aplicación del método de la MBE al campo de la nutrición. Es decir, lo que la NuBE pretende es que tanto la práctica clínica diaria de la nutrición, como las recomendaciones a escala comunitaria, se basen en todas las pruebas científicas disponibles12,15,16.
Estudiar la relación entre la dieta y el estado de salud pública es un proceso complejo8,15-17. Algunas recomendaciones de expertos basadas en estudios de insuficiente calidad y que posteriormente han demostrado ser erróneas, como la utilidad de la vitamina C para prevenir los catarros, o la de la vitamina E en la disminución del riesgo de enfermedad coronaria, han hecho dudar a la opinión pública sobre aspectos nutricionales de gran importancia para la salud. Éste es uno de los motivos fundamentales por el que los organismos internacionales, y las sociedades científicas de nutrición y dietética justifican la necesidad de implantar la NuBE14-17.
Respecto a la nutrición clínica, y para entender la necesidad de la NuBE, es necesario diferenciar 2 grandes vertientes. Por un lado, el tratamiento nutricional puede entenderse como una terapia de soporte adyuvante que pretende mantener la vida. Pero en determinadas situaciones la nutrición puede utilizarse como un tratamiento farmacológico para curar, cambiar el curso evolutivo o mejorar el pronóstico de determinadas enfermedades.
Sin embargo, al igual que la MBE, también la NuBE ha recibido críticas y opiniones en contra de algunos autores que piensan que existen demasiados problemas y limitaciones en la aplicación de los conceptos de la MBE en nutrición, tanto clínica como comunitaria18,19.
Dificultades, problemas y limitaciones de la NuBE
La mayoría de la comunidad científica está de acuerdo en la necesidad de aplicar el método de la MBE en las recomendaciones que tratan sobre la eficacia de una intervención farmacológica. Pero, como se ha apuntado antes, también en nutrición comunitaria sería interesante incorporar la MBE con el fin de establecer unas recomendaciones objetivas y reales. La creencia generalizada de que solamente los EPA son válidos para basar las recomendaciones de grado A explica (en parte) por qué se ha retrasado esta incorporación8. Realmente, los EPA no son los estudios más adecuados para evaluar el efecto de las modificaciones dietéticas en la salud8,18. Un nutriente puede ser esencial para el desarrollo o la prevención de determinadas enfermedades en fases demasiado tempranas para ser detectadas en un EPA, o requerir tiempos de estudio excesivos, o la consideración de factores no dietéticos relativos a estilo de vida, etc. Los estudios epidemiológicos observacionales (preferiblemente estudios de cohortes bien diseñados) pueden, según en qué momento de la investigación, considerarse suficientes para fundamentar las recomendaciones nutricionales a escala comunitaria17,18. Por este motivo, según algunos autores, convendría utilizar clasificaciones de la evidencia distintas a las que se utilizan en la intervención terapéutica8,18. Otras intervenciones nutricionales, como la fortificación o la suplementación de las dietas, requieren, probablemente, la realización de EPA (y la aplicación de escalas de evidencia "convencionales"), ya que, en estos casos, se está equiparando la nutrición con un tratamiento farmacológico8.
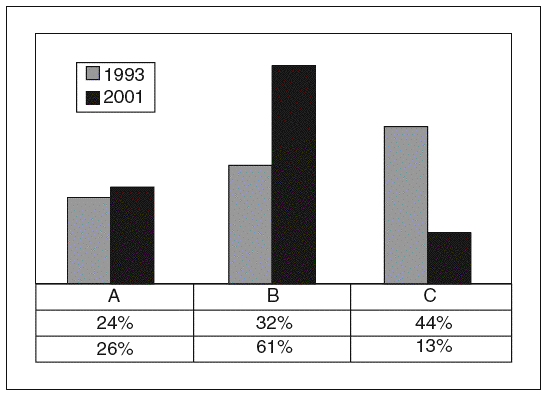
Respecto a la nutrición clínica y sus 2 vertientes comentadas antes (adyuvante o farmacológica) también se han detectado problemas conceptuales en la aplicación de la NuBE. Las guías de práctica clínica publicadas por la ASPEN14,20 son un magnífico ejemplo de las dificultades que, por el momento, tiene la NuBE. En la figura 1 puede verse el porcentaje de recomendaciones de acuerdo con la clasificación de la evidencia de la AHRQ en las 2 ediciones de las guías ASPEN. Llama la atención que solamente el 26% de las recomendaciones nutricionales en situaciones fisiopatológicas, excluyendo la pediatría, estén basadas en estudios con niveles de evidencia I. La gran mayoría de los trabajos realizados sobre la nutrición, en los que basamos nuestras decisiones clínicas, son de niveles II y III. Entre las 2 ediciones hay una tendencia a disminuir el número de las recomendaciones de grado C y a aumentar el número de recomendaciones de grado B, pero es el momento de recordar que en la clasificación AHRQ se consideran de grado B estudios no aleatorizados que, en la clasificación de la Canadian Task Force, se considerarían de grado C, y que la mayoría de las recomendaciones de grado A de la AHRQ se basan en EPA de muestra pequeña, de nivel II (grado de recomendación B) en la clasificación canadiense (tablas 1 y 2). Esto significa que si se utilizaran otras clasificaciones de la evidencia, las guías clínicas de la ASPEN, probablemente las más consultadas en nutrición clínica, reflejarían en su mayor parte recomendaciones de grado C y D.
Fig. 1. Evolución de las recomendaciones de la American Society of Parenteral and Enteral Nutrition (ASPEN), 1993-2001, según grados de recomendación de la Agency for Healthcare Research and Quality (AHRQ).
Son 2 los motivos fundamentales de esta escasez de evidencia científica en nutrición: por un lado, la escasez de EPA y los problemas en su diseño y, por otro, las limitaciones desde un punto de vista ético.
Problemas éticos
La afirmación de que la desnutrición conduce necesariamente a la muerte no necesita ser demostrada con metaanálisis ni EPA21. A través de las referencias históricas del sitio de Varsovia y, más recientemente, por las observaciones realizadas en las huelgas de hambre de presos del IRA en cárceles inglesas y de presos kurdos en cárceles turcas, se sabe que las personas, por otro lado sanas, sometidas a ayuno mueren tras aproximadamente 45-61 días de inanición.
Este período es considerablemente más corto en personas enfermas que presentan un aumento de los requerimientos metabólicos1. Aparecen problemas graves en la mayoría de órganos y sistemas cuando la pérdida de peso es superior al 18% del habitual, aunque ello depende del peso previo y de la velocidad con que éste se ha perdido. Pérdidas inferiores producen alteraciones metabólicas, inmunológicas y hemodinámicas que pueden favorecer el desarrollo de determinadas enfermedades o empeorar el pronóstico de las ya existentes14,22. Por otra parte, la misma enfermedad influye negativamente en el estado nutricional22. En las situaciones patológicas es difícil medir el grado de desnutrición, ya que los parámetros de malnutrición energético-proteínica se ven alterados por la gravedad de la enfermedad. Así, por ejemplo, la albúmina, la prealbúmina y la proteína ligada al retinol pueden considerarse reactantes de fase aguda negativos22, con un descenso de éstos como respuesta al estrés. Su recuperación al cesar la agresión es, en muchas ocasiones, independiente del aporte de nutrientes. Por tanto, se podría interpretar que los pacientes desnutridos presentan peores pronósticos simplemente porque están más graves, y no a la inversa.
Así, los estudios en nutrición se encuentran ante 2 grandes limitaciones: la imposibilidad ética de realizar grupos control que no reciban soporte nutricional y la dificultad de atribuir exclusivamente a ésta determinados resultados clínicos que podrían explicarse por la evolución de la propia enfermedad o por otras intervenciones terapéuticas distintas del soporte nutricional.
Escasez de EPA
Como comentábamos, el segundo gran problema de la NuBE es la falta de EPA de buena calidad, si bien algunos autores sostienen que en nutrición las guías de práctica clínica no deberían basarse en estos ensayos21. Se han implicado los siguientes factores para explicar esta escasez de trabajos19,21,23:
1. Objetivos secundarios. La mayoría de los trabajos publicados durante las últimas décadas están dirigidos a evaluar objetivos secundarios como, por ejemplo, cambios en la concentración plasmática de determinados aminoácidos, balance nitrogenado, valores de citocinas, etc., olvidando el objetivo principal de cualquier ensayo médico: el beneficio clínico para el paciente. El problema es que la consecución de estos objetivos secundarios no tiene por qué asociarse con la obtención de resultados clínicamente importantes, como la mejoría de la calidad de vida, y la disminución de la mortalidad, de las complicaciones (infecciosas, por ejemplo) o de la estancia hospitalaria. Los trabajos que evalúan dichos objetivos secundarios, junto con los estudios fisiológicos y de experimentación animal, permiten generar hipótesis que deben ser comprobadas evaluando objetivos clínicos primarios. Hasta hace relativamente poco tiempo, estos estudios de confirmación eran poco habituales, con lo que modificábamos nuestra práctica clínica basándose en los resultados secundarios.
2. Muestras pequeñas. El tamaño muestral de la mayoría de los EPA publicados es muy pequeño y, por tanto, los estudios no tienen suficiente poder estadístico para demostrar cambios significativos en las variables clínicamente importantes. Un criterio de calidad de diseño para considerar un EPA de nivel de evidencia I o II es el número de sujetos incluidos en el estudio. Esta falta de pacientes puede paliarse, en parte, gracias a los estudios multicéntricos y los metaanálisis, que permiten estimar el resultado con mucha mayor precisión y significación13,23.
3. Generalización de resultados. Los resultados de los trabajos realizados en un hospital no deben generalizarse al resto. Los hospitales tienen diferentes casuísticas y actividades. Por ejemplo, los pacientes posquirúrgicos que en la mayoría de los hospitales españoles pasan de las salas de reanimación a las plantas de cirugía, en Estados Unidos son considerados pacientes críticos y son atendidos en las unidades de cuidados intensivos. Los estudios multicéntricos consiguen aumentar el tamaño muestral y, al englobar a pacientes, prácticas y actitudes terapéuticas heterogéneas, pueden generalizarse con más fiabilidad.
4. Calidad de los EPA. Existe una clara correlación entre la calidad metodológica de un ensayo y la estimación de su efecto. Los estudios no aleatorizados tienden a mostrar mayores diferencias en los resultados (con frecuencia falsos positivos) comparados con los EPA. La aleatorización persigue la distribución por igual de las variables pronósticas (conocidas o no) entre los grupos control y tratado, de modo que los resultados dependan de la intervención y no de posibles diferencias entre ellos. Sin embargo, no todos los EPA son metodológicamente iguales. Suele ser difícil y complicado evaluar su calidad y, en ocasiones, distinguir si un ensayo tiene nivel de evidencia I o II con independencia de su tamaño muestral. Aunque existen varias escalas de calidad10,23, en general todas puntúan algunos de los siguientes factores: especificación del método de aleatorización, diseño ciego-doble ciego, elección de pacientes consecutivos, homogeneidad de los grupos, descripción de las cointervenciones, definición de objetivos y variables de resultado, así como análisis de los pacientes en los grupos en los que fueron asignados ("intención de tratar"). En un reciente metaanálisis24 sobre el efecto de la inmunonutrición en pacientes críticos, los trabajos con peores puntuaciones en la escala de calidad son los que mayor beneficio encuentran con la utilización de fórmulas específicas frente a fórmulas isonitrogenadas estándar (riesgo relativo [RR] de mortalidad = 0,74; intervalo de confianza [IC] del 95%, 0,49-1,14). Por el contrario, los EPA de mayor calidad parecen mostrar una tendencia a aumentar la mortalidad (RR = 1,19; IC del 95%, 0,99-1,43)24.
5. Financiación. La investigación clínica actual está financiada, en su mayor parte, por la industria farmacéutica. Muchos médicos no confían en los resultados de los estudios financiados por las casas comerciales, pero el hecho es que, hoy por hoy, y si los gobiernos no invierten más en investigación, son las multinacionales farmacéuticas las únicas capaces de realizar un EPA de muestra grande, multicéntrico y con un alto nivel de evidencia. Los resultados de estos trabajos, aun siendo realmente positivos, pueden ser rechazados por los clínicos y, al contrario, los resultados no favorables o perjudiciales pueden permanecer escondidos y sin publicar. Un ejemplo de esto último lo tenemos en un estudio patrocinado por Ross Products Division of Abbott, en 1996, sobre una fórmula experimental no comercializada con inmunonutrientes (omega-3 y arginina) en el que la mortalidad era claramente superior a la de las fórmulas estándares24. Además de buscar nuevas fuentes de financiación independientes, los autores de las RSB deben procurar incluir todos los estudios realizados, aunque sus resultados no se hayan publicado; para ello, deben ponerse en contacto con los investigadores y los laboratorios farmacéuticos.
CONCLUSIONES
La MBE supone un cambio sustancial y necesario en la práctica médica. A partir de su implementación, las decisiones diagnósticas, preventivas y terapéuticas deben tomarse según pruebas científicas objetivas pero teniendo siempre en consideración la experiencia del médico y los deseos o las necesidades del paciente1. Con la MBE, las verdades no son verdades absolutas sino que deben descubrirse y pueden modificarse según los resultados de las investigaciones que surjan12. La MBE exige al médico nuevas habilidades (informáticas, estadísticas...) que le ayudarán a solucionar los problemas clínicos habituales desde una nueva perspectiva. Por otro lado, la MBE, además de tener una utilidad demostrada en nuestra actividad diaria, nos permite enfrentarnos a la gran cantidad de bibliografía científica, soportar la presión de la industria farmacéutica, comprender la utilidad de las nuevas tecnologías y buscar la calidad sin aumentar excesivamente el gasto sanitario2.
Respecto a la NuBE, y a pesar del desarrollo de la nutrición de los últimos 20 años, todavía no existen suficientes pruebas relativas a la eficacia y el beneficio del soporte nutricional en la mayoría de las situaciones clínicas. La aplicación de la MBE al campo de la nutrición permitirá reducir la variabilidad de nuestra práctica clínica, fundamentar nuestros conocimientos en nutrición comunitaria y clínica, y mejorar la calidad de nuestra atención12,15. Sin embargo, debemos tener presentes las limitaciones y los problemas que encuentra la NuBE, fundamentalmente éticos y de dificultad de diseño y calidad metodológica de los EPA. Estos problemas, más que retrasar la incorporación de la NuBE en la práctica diaria, en las recomendaciones de nutrición comunitaria y en nuestra formación como especialistas, deben animarnos a unir nuestros esfuerzos para llevar a cabo trabajos de buena calidad (multicéntricos, prospectivos, aleatorizados y de muestra grande) y RSB sobre cuestiones nutricionales interesantes y enfocados a variables clínicas relevantes.
AGRADECIMIENTO
Queremos expresar nuestro agradecimiento a Isabel Martínez Hervás, bibliotecaria y documentalista de la Biblioteca del Hospital Severo Ochoa, por su inestimable ayuda en la realización de la búsqueda bibliográfica.