Conocer la opinión de un grupo endocrinólogos sobre los potenciales efectos perjudiciales del tratamiento supresor (TS) en el carcinoma diferenciado de tiroides (CDT).
Material y métodosEncuesta a un grupo de endocrinólogos con experiencia en el tratamiento del CDT. El cuestionario constaba de 3 preguntas: la primera respecto a los posibles efectos adversos sobre diferentes órganos y sistemas, la segunda sobre la trascendencia clínica de los mismos y la tercera sobre la utilidad de las guías de tratamiento del CDT.
ResultadosRespondieron 91 endocrinólogos con una gran discrepancia de opiniones. Ninguna pregunta tuvo más del 80% de respuestas en un determinado sentido. De los posibles efectos indeseables del TS, en 3 de ellos (aumento de la masa ventricular izquierda, la taquicardia de reentrada y la disfunción diastólica) se reconoció un elevado grado de desconocimiento, en 7 (demencia, disminución de la calidad de vida, enfermedad tromboembólica, disminución de la densidad mineral ósea en mujeres premenopáusicas y varones, signos y síntomas de hipertiroidismo y aumento del riesgo de fracturas), la mayoría de los encuestados consideraron que no se afectaban por el TS, mientras que en 2 (aumento de la frecuencia cardiaca y disminución de la densidad mineral ósea en mujeres postmenopáusicas), la mayoría respondieron afirmativamente. El 80% de los encuestados consideró que estos efectos no tenían trascendencia clínica. Respecto a las guías de tratamiento, un 33% opinó que deberían ser revisadas.
ConclusionesLa percepción de los endocrinólogos sobre los potenciales efectos perjudiciales del tratamiento supresor en el CDT es muy heterogénea.
To explore the opinion of clinical endocrinologists as to the deleterious effects of thyrotropin (TSH) suppressive therapy in patients with differentiated thyroid carcinoma (DTC).
Materials and methodsA self-administered survey was sent by e-mail to a group of endocrinologists with expertise in the treatment of patients with differentiated thyroid carcinoma. The questionnaire consisted of three questions related to: 1) the possible adverse effects of this therapy on different organ systems, 2) the clinical significance of these effects and 3) the usefulness of treatment guidelines for DTC.
ResultsA total of 91 endocrinologists responded with a wide divergence of opinions. No question had more than 80% of answers in a particular option. Of the possible side effects of suppressive therapy, a high degree of ignorance to three of them (increased left ventricular mass, reentrant tachycardia and diastolic dysfunction). Most respondents felt that the seven items, dementia and Alzheimer, decreased quality of life, decreased bone mineral density (BMD) in premenopausal women and men, thromboembolic disease, signs and symptoms of hyperthyroidism and increased risk of fractures were not affected by suppressive therapy, while most responded positively to two items (increased heart rate and decreased BMD in postmenopausal women). Eighty percent of the respondents felt that in any case these effects were not clinically significant and 33% considered that treatment guidelines should be reviewed.
ConclusionsClinical endocrinologists seem to have a very heterogeneous opinion regarding the potential harmful effects of TSH-suppressive therapy for DTC
El tratamiento supresor (TS) de la tirotropina (TSH) con levotiroxina ha sido y es uno de los pilares del abordaje terapéutico en pacientes afectos de carcinoma diferenciado de tiroides (CDT)1. Aunque la tendencia es limitar el tiempo de supresión de la TSH, en el momento actual las principales guías de manejo del CDT2,3 aconsejan el TS continuado en casos de enfermedad persistente o recurrente y durante períodos de 3–5 años2 o de 5–10 años3, según la guía, en pacientes de alto riesgo sin evidencias de enfermedad. Esto, junto a la extensa utilización del TS en el pasado, conlleva que un considerable número de pacientes hayan permanecido y permanezcan en una situación de tirotoxicosis subclínica durante periodos de tiempo muy prolongados4. Por lo que respecta a la concentración de TSH a conseguir, se recomienda una supresión inicial inferior a 0,1mUI/l en pacientes de riesgo elevado o intermedio y entre 0,1–0,5mUI/l en pacientes de bajo riesgo2.
La posibilidad de que el TS produzca efectos indeseables sobre diversos órganos o sistemas es motivo de debate científico no concluido5–7. Se han publicado gran número de estudios y metanálisis sobre el efecto del TS en el sistema cardiovascular8,9, la densidad mineral ósea (DMO)10–12 o el sistema nervioso central13–15, con resultados contradictorios. Estas discrepancias dependen en gran medida del tamaño y de la heterogeneidad de la muestra seleccionada, de la duración e intensidad de la inhibición de la TSH, de las concentraciones de triiodotironina (T3) o de tiroxina (T4) libre sanguíneas, de la edad de los pacientes o de los métodos de medición de los efectos analizados. Además, van apareciendo nuevos datos a favor y en contra del potencial perjuicio del TS sobre otros sistemas orgánicos como la inmunidad16, el sistema nervioso autónomo17 o la hemostasia18 y, con cierta periodicidad, se publican análisis y artículos de revisión que en la mayoría de las veces dejan abiertos interrogantes5–7,19.
Ante esta situación, consideramos que sería de interés recabar la opinión, mediante una encuesta, de una muestra de endocrinólogos con responsabilidad en el seguimiento de pacientes con CDT, en base a su propia experiencia y contrastarla con los datos obtenidos de las evidencias científicas de que se dispone. El objetivo de este trabajo es aportar los resultados de dicha encuesta.
Material y métodosEstudio transversal realizado entre octubre y diciembre de 2009, basado en el análisis y evaluación de una encuesta autoadministrada remitida por correo electrónico a un grupo de endocrinólogos en ejercicio en el territorio nacional con conocida dedicación al diagnóstico y tratamiento de pacientes afectos de CDT.
Selección de los participantesEn primer lugar, se seleccionaron los endocrinólogos de los hospitales docentes y no docentes de las diferentes comunidades autónomas españolas con conocida experiencia en el tratamiento de pacientes con CDT. En segundo lugar, se revisaron los resúmenes de las presentaciones como ponencia, póster o comunicación oral al congreso de la Sociedad Española de Endocrinología y Nutrición publicadas en la revista Endocrinología y Nutrición desde el año 2006–2009, seleccionando los endocrinólogos clínicos autores de los trabajos sobre diferentes aspectos del CDT.
De los endocrinólogos incluidos se seleccionaron de los que se disponía de una dirección de correo electrónico. La encuesta se remitió en formato MS Office Word® (.doc) para su cumplimentación recibiéndola por la misma vía una vez completada.
A los endocrinólogos a los que se les remitió la encuesta se les requirió para que a su vez la hicieran llegar a algún colaborador en caso que, a su criterio, tuviera a su cargo el tratamiento de los pacientes con cáncer diferenciado de tiroides.
Contenido de la encuestaEl cuestionario se componía de 3 preguntas sobre posibles efectos secundarios del TS, sobre su trascendencia clínica y sobre las guías internacionales de manejo del CDT:
- 1.
Primera pregunta: en su experiencia y según su opinión, ¿el tratamiento supresor de la TSH con levotiroxina en pacientes afectos de carcinoma diferenciado de tiroides puede producir efectos perjudiciales sobre estos órganos o sistemas?
A continuación se incluía un listado de los eventuales efectos indeseables del TS con levotiroxina descritos en la literatura5,20 sobre: signos y síntomas de hipertiroidismo, signos y síntomas similares a crisis de ansiedad (palpitaciones, temblores, nerviosismo, ansiedad), el sistema nervioso central (disminución de la calidad de vida, demencia y enfermedad de Alzheimer), el sistema cardiovascular (aumento de la frecuencia cardiaca, aumento de la masa ventricular izquierda, arritmias supraventriculares, taquicardia de reentrada, enfermedad tromboembólica y disfunción diastólica) y el esqueleto (disminución de la densidad mineral ósea en mujeres premenopáusicas, en mujeres menopáusicas y en varones y aumento del riesgo de fracturas). En cada caso se debía escoger la respuesta afirmativa (sí), negativa (no) o indeterminada (no sé).
- 2.
Segunda pregunta: en su experiencia y según su opinión, ¿estos eventuales efectos perjudiciales son clínicamente significativos?
- 3.
Tercera pregunta: en su experiencia y según su opinión, ¿cree que son correctas las guías actuales de tratamiento y seguimiento de los pacientes con carcinoma diferenciado de tiroides?
En estas 2 últimas preguntas se permitía una respuesta abierta en la que el entrevistado podía incluir su opinión con más detalle.
Análisis y valoración de resultadosLas respuestas categóricas se expresaron como porcentaje del total de las encuestas recibidas. Las respuestas abiertas recibidas se valoraron de forma individualizada para su discusión.
La valoración de los resultados se realizó en base a los datos de la medicina basada en la evidencia utilizando como comparación la guía de diagnóstico y manejo de la disfunción tiroidea subclínica de Surks et al publicada en 200420, que incluye un apartado específico sobre el hipertiroidismo subclínico exógeno.
ResultadosSe recibieron 96 respuestas a la solicitud de participación (un 90% de los remitidos satisfactoriamente). Cinco encuestados declinaron responder el cuestionario: 3 al no tener responsabilidad directa en el manejo del CDT y 2 por que se consideraba que los datos que se solicitaban no habían sido tabulados por el entrevistado en su hospital. En total se completaron correctamente 91 encuestas sobre las que se contabilizaron los resultados. En ningún caso quedó alguna pregunta sin responder.
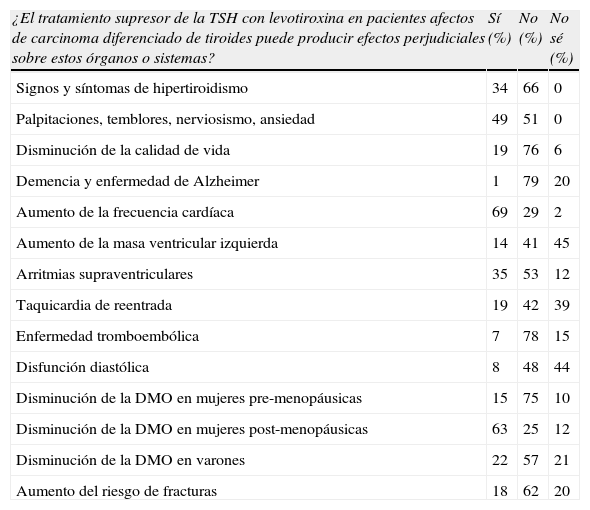
Primera pregunta. Prevalencia de la percepción de efectos perjudiciales del TSEl porcentaje de respuestas positivas, negativas o indeterminadas se refleja en la tabla 1. Destaca la gran diversidad de opiniones en la mayoría de los ítems investigados, de forma que en solo 6 de los 14 ítems (signos y síntomas de hipertiroidismo, disminución de la calidad de vida, demencia y enfermedad de Alzheimer, aumento de la frecuencia cardíaca, enfermedad tromboembólica y disminución de la DMO en mujeres pre-menopáusicas), se alcanzó más del 65% de repuestas en un sentido u otro y en ningún caso más del 80%.
- a.
Signos y síntomas de hipertiroidismo, palpitaciones, temblores, nerviosismo, ansiedad y disminución de la calidad de vida:
En este ítem combinado la totalidad de los encuestados tenían opinión formada (en ningún cuestionario respondido se reconoció desconocimiento). En el caso de los síntomas de hipertiroidismo, una mayoría (66%) se decantó por no considerar que el TS los produzca, mientras que en el caso específico de los síntomas similares a un cuadro de ansiedad las opiniones se repartieron prácticamente a la mitad.
Según los datos publicados por el panel de expertos20, en este apartado se considera que la calidad de la evidencia de la asociación entre el hipertiroidismo subclínico exógeno y los síntomas clínicos de hipertiroidismo es insuficiente tanto con concentraciones de TSH<0,1 como entre 0,1–0,45mUI/l.
- b.
Sistema nervioso central:
Este apartado fue el más homogéneo en las respuestas negativas. Una mayoría de los endocrinólogos encuestados manifestaron que el TS no está relacionado con una disminución de la calidad de vida (76%) ni con la demencia senil o enfermedad de Alzheimer (79%).
Los datos derivados de la evidencia científica20 se consideran insuficientes para demostrar la potencia de la asociación entre el TS y los síntomas neuropsiquiátricos.
- c.
Aparato cardiovascular:
En este apartado es donde se observaron las mayores discrepancias. Resulta interesante la observación de que en 3 de los ítems se produjo un elevado porcentaje de respuestas indeterminadas o de desconocimiento sobre el tema [aumento de la masa ventricular izquierda (45%), taquicardia de reentrada (39%) y disfunción diastólica (44%)], que en el caso del aumento de la masa ventricular izquierda representó la mayor proporción de las respuestas frente a las positivas (14%) y las negativas (41%).
La relación entre el TS y el aumento de la frecuencia cardiaca se consideró positiva por el 69% de los endocrinólogos encuestados, mientras que la mayoría (78%) consideró que no existía relación entre la tirotoxicosis subclínica y la enfermedad tromboembólica.
Solo la mitad de los endocrinólogos que respondieron a la encuesta consideraban que el TS podía inducir arritmias supraventriculares.
Según los expertos20, en el caso de la fibrilación auricular, se considera que existe suficiente evidencia de la asociación con el hipertiroidismo subclínico para concentraciones de TSH<0,1 mUI/l, mientras que no está demostrada para TSH entre 0,1–0,45 mUI/l. Tampoco hay evidencia de asociación con la insuficiencia cardiaca y se considera escasa respecto a los restantes parámetros de disfunción cardiaca.
- d.
Hueso y metabolismo óseo:
Prevalencia de la percepción de los potenciales efectos perjudiciales del tratamiento supresor de la TSH en determinados órganos o sistemas de los endocrinólogos que respondieron a la encuesta
| ¿El tratamiento supresor de la TSH con levotiroxina en pacientes afectos de carcinoma diferenciado de tiroides puede producir efectos perjudiciales sobre estos órganos o sistemas? | Sí (%) | No (%) | No sé (%) |
| Signos y síntomas de hipertiroidismo | 34 | 66 | 0 |
| Palpitaciones, temblores, nerviosismo, ansiedad | 49 | 51 | 0 |
| Disminución de la calidad de vida | 19 | 76 | 6 |
| Demencia y enfermedad de Alzheimer | 1 | 79 | 20 |
| Aumento de la frecuencia cardíaca | 69 | 29 | 2 |
| Aumento de la masa ventricular izquierda | 14 | 41 | 45 |
| Arritmias supraventriculares | 35 | 53 | 12 |
| Taquicardia de reentrada | 19 | 42 | 39 |
| Enfermedad tromboembólica | 7 | 78 | 15 |
| Disfunción diastólica | 8 | 48 | 44 |
| Disminución de la DMO en mujeres pre-menopáusicas | 15 | 75 | 10 |
| Disminución de la DMO en mujeres post-menopáusicas | 63 | 25 | 12 |
| Disminución de la DMO en varones | 22 | 57 | 21 |
| Aumento del riesgo de fracturas | 18 | 62 | 20 |
Se presentan los porcentajes de respuestas positivas (Sí), negativas (No) o indeterminadas (No sé), referentes a la primera pregunta del cuestionario. DMO: densidad mineral ósea; TSH: tirotropina.
Una amplia mayoría de los endocrinólogos encuestados consideraron que en mujeres premenopáusicas la masa ósea no se afecta por el TS (75%). En el caso de las mujeres menopáusicas, una escasa mayoría consideró que existía un efecto perjudicial (63% de respuestas positivas frente a un 25% de negativas y un 12% de indeterminadas). Por lo que respecta a los varones, un 57% de los encuestados consideró que la tirotoxicosis subclínica no se asociaba con la pérdida de DMO. La percepción del riesgo de fracturas fue similar, con un 62% de respuestas negativas. Hay que señalar que en este ítem, al igual que en el caso de los varones, la quinta parte de respuestas fueron indeterminadas.
En este apartado, la evidencia científica es negativa para TSH entre 0,1–0,45mUI/l; se ha señalado una débil asociación entre hipertiroidismo subclínico con TSH inferior a 0,1mUI/l y disminución de DMO en mujeres menopáusicas con historia de hipertiroidismo previo, aunque sin evidencias de incremento del riesgo de fracturas óseas20.
Segunda pregunta. Relevancia clínica percibidaEl 80% de los endocrinólogos encuestados respondieron que los efectos del TS sobre los diversos órganos o sistemas no eran clínicamente significativos. Un 9% respondieron con observaciones puntuales sobre la posible relevancia clínica, como la aparición en pacientes individuales, la puntualización sobre alguno de los efectos como en el caso de la disminución de la DMO, las fracturas o la taquicardia en pacientes con alguna condición de riesgo, la importancia de determinados grupos de pacientes (ancianos, síndrome ansioso u osteoporosis previos) y destacando la importancia de un control estricto de la concentración de hormonas periféricas.
Tercera pregunta. Opinión sobre la utilidad de las guías de práctica clínicaEn opinión del 67% de los encuestados, las guías actuales de tratamiento del CDT son correctas. El 26% de los endocrinólogos las consideraron poco útiles y un 7% indicó que deberían modificarse por su complejidad y actualizarse con más frecuencia en base a las evidencias de estudios prospectivos. En relación al TS, se cuestionan las recomendaciones relacionadas con la intensidad y la duración de la supresión de la TSH.
DiscusiónLos resultados de esta encuesta realizada a una muestra seleccionada de profesionales con responsabilidad en el manejo de pacientes afectos de CDT no reflejan la opinión de todos los endocrinólogos del país, sino únicamente la de aquéllos que respondieron al cuestionario. La selección de profesionales es siempre un proceso complejo con riesgo de omisiones injustificables y no deseadas. En nuestro caso se intentó abarcar al máximo de ellos con el único criterio de exclusión de no disponer de un correo electrónico correcto de contacto. Creemos que la selección de los encuestados en base a su conocida experiencia y sus trabajos en el campo del cáncer de tiroides, así como el número de participantes, hace que los resultados obtenidos puedan considerarse una buena aproximación a la percepción que tienen los endocrinólogos clínicos en nuestro país sobre este tema.
De las respuestas obtenidas destaca la gran disparidad en la percepción que tienen los endocrinólogos clínicos encuestados sobre la posibilidad de que el TS con levotiroxina en el CDT pueda afectar de forma perjudicial a algún órgano o sistema. Sin embargo, una gran mayoría opina que en todo caso estos efectos indeseables no tienen una trascendencia clínica relevante para el paciente y, por tanto, no deberían ser motivo de preocupación.
Lo primero a destacar de las respuestas obtenidas a la pregunta sobre los efectos del TS es que solo en los 2 ítems relacionados con signos y signos y síntomas de hipertiroidismo, no hubo ninguna respuesta de desconocimiento. En todos los demás, los endocrinólogos encuestados reconocían un grado de duda que era especialmente significativo en 3 parámetros cardiovasculares: el aumento de la masa ventricular izquierda, la taquicardia de reentrada y la disfunción diastólica. Este resultado puede tener una doble explicación. Por un lado la propia disparidad en los resultados de los efectos del hipertiroidismo subclínico exógeno sobre el corazón5,9, que es muy manifiesta en los 3 parámetros mencionados. Por otro lado, la necesidad de técnicas específicas para la detección de estas eventuales alteraciones subclínicas (electrocardiografía Holter, ventriculografía isotópica o ecocardiografía Doppler), que no se utilizan de forma habitual en el seguimiento clínico de estos pacientes2,3.
Los datos basados en evidencias científicas son concluyentes solo en el caso de la asociación entre la tirotoxicosis subclínica y el riesgo de desarrollar arritmias supraventriculares (fundamentalmente fibrilación auricular), en caso de TSH inferior a 0,1mUI/l. Es destacable que las respuestas en este punto fueron muy equilibradas, con aproximadamente la mitad de negativas y un 35% de positivas. En nuestra opinión este resultado no se debe a que no se investigue la posibilidad de arritmias en estos pacientes. La edad media de las personas afectas de CDT en nuestro ámbito (en el caso de las serie conjunta del Hospital Germans Trias i Pujol y del Hospital Clínic la media de edad fue de 56 años, después de 16 años de seguimiento)21, que es muy inferior a la de los estudios sobre los que se basa la asociación de hipertiroidismo subclínico y fibrilación auricular (con una media de edad de 70 años el momento de inclusión)22,23 puede ser determinante. En el momento actual no existen evidencias de que el TS y no el hipertiroidismo subclínico endógeno, sea una causa de fibrilación auricular. En este sentido es destacable que el panel de expertos20 considere que los cambios ecocardiográficos descritos de función cardiaca en personas con hipertiroidismo subclínico en comparación con grupos de control son pequeños y de repercusión clínica incierta.
Otro dato interesante es el elevado porcentaje de los endocrinólogos encuestados que respondieron que el TS podría inducir aumento de la frecuencia cardiaca. Sin embargo, los estudios en este aspecto concreto son altamente contradictorios. Así, la frecuencia cardiaca se encontró aumentada respecto al grupo control en 2 de los trabajos, y sin diferencias en otros 25, por lo que la evidencia de la asociación se considera insuficiente o solo muy débil en el caso de que la TSH sea inferior a 0,1mUI/l20.
De los ítems considerados, en 8 de ellos: demencia y enfermedad de Alzheimer (79%), disminución de la calidad de vida (76%), disminución de la DMO en mujeres premenopáusicas (75%), enfermedad tromboembólica (78%), signos y síntomas de hipertiroidismo (66%), aumento del riesgo de fracturas (62%) y disminución de la DMO en varones (57%), la mayoría de los encuestados consideraron que no se afectaban por el TS, en coincidencia con las evidencias científicas20. Por el contrario, en el caso del aumento de la frecuencia cardiaca (69%) y la disminución de la DMO en mujeres postmenopáusicas (63%), la mayoría respondieron afirmativamente; aunque en estos 2 ítems específicos solo existe evidencia científica de una débil asociación del segundo, siempre que exista un hipertiroidismo previo20.
Es interesante destacar el elevado porcentaje (80%), de endocrinólogos que respondieron que los eventuales efectos perjudiciales descritos no tenían trascendencia clínica. Además, en los comentarios al respecto se destacaba la importancia de las concentraciones en sangre periférica de T3 y/o T4 libre en valores de normalidad, probablemente un punto crucial para evitar su aparición.
Por último, la tercera cuestión relacionada con las principales guías de tratamiento del CDT2,3,24, demuestra que en un elevado porcentaje se mantiene una postura crítica, considerándolas poco útiles o modificables en alguna de sus características. Sin embargo, debemos señalar que dado que la pregunta referente a las guías clínicas era general y no pormenorizada según diferentes aspectos del diagnóstico y tratamiento, no se pueden extraer conclusiones mas detalladas referentes al acuerdo o desacuerdo de los encuestados con diferentes aspectos contemplados en las guías.
En conclusión, la opinión de una muestra de los endocrinólogos españoles con experiencia en el manejo de pacientes con CDT respecto a los potenciales efectos perjudiciales del TS está muy dividida aunque su riesgo para los pacientes no parece ser un motivo de preocupación. En todo caso la prescripción de la menor dosis posible para conseguir la concentración deseada de TSH debería ser una práctica habitual. Por otra parte, es una opinión generalizada que las guías de manejo de estos pacientes deben ser revisadas y actualizadas en base a las evidencias que se vayan aportando.
Los autores quieren agradecer a Pilar Muñoz por su ayuda en la elaboración del trabajo y por su participación desinteresada a: J. Acha (Hospital Miguel Servet, Zaragoza); R. Albero (Hospital Miguel Servet, Zaragoza); V. Alcázar (Hospital Severo Ochoa, Madrid); M. Aguilar (Hospital Puerta del Mar, Cádiz); N. Alonso (Hospital Universitari Germans Trias i Pujol, Badalona); C. Alvarez (Hospital La Paz, Madrid); J. Aranda (Hospital Virgen de la Luz, Cuenca); C. Asensio (Hospital General de Hospitalet); M.O. Bandres (Hospital Royo Vilanova, Zaragoza); E. Ballestar (Hospital de Mataró); P. Benito (Hospital Universitario Reina Sofía, Córdoba); M. Bergua (Hospital Universitari Arnau de Vilanova, Lleida); I. Bernabeu (Hospital de Santiago de Compostela, A Coruña); C. Blanco (Hospital Príncipe de Asturias, Madrid); Y. Blasco (Hospital Universitari Arnau de Vilanova, Lleida); F. Botella (Complejo Hospitalario de Albacete); M. Botella (Hospital Príncipe de Asturias, Madrid); M.A. Caixás (Hospital de Sabadell); I. Cano (Hospital de León); F. C-Soriguer (Hospital Universitario Carlos Haya, Málaga); C. Castell (Direcció General de Salut Pública. Generalitat de Catalunya); I. Castells (Hospital de Granollers), A. Chico (Hospital Santa Creu i San Pau, Barcelona); J.J. Diez (Hospital Ramón y Cajal, Madrid); S. Donnay (Hospital Universitario Fundación Alcorcón, Madrid); F.J. Enciso (Complejo Hospitalario de Cáceres); F. Escobar (Hospital Clínico, Granada); C. Fajardo (Hospital Universitario de La Ribera, Alzira), C. Familiar (Hospital de Móstoles, Madrid); Ll. Forga (Hospital de Navarra, Pamplona); J.C. Galofré (Clínica Universitaria de Navarra, Pamplona); M.A. Gálvez (Hospital Universitario Reina Sofía, Córdoba); R. García-Mayor (Hospital Xeral-Cíes, Vigo); M.S. Gaztambide (Hospital de Cruces, Bilbao); G. Giménez (Hospital de Granollers); G. Giménez (Hospital de Granollers); A. Goday (Hospital del Mar, Barcelona); J.M. Gómez (Hospital Universitari Bellvitge, Barcelona); T. Gónzalez (Hospital Severo Ochoa, Madrid); F. Hawkins (Hospital Universitario 12 de Octubre, Madrid); A. Hernández (Hospital Dr Peset, Valencia); M. Lahera (Hospital Infanta Sofía, Madrid); A. Lecube (Hospital Universitari Vall d′Hebron, Barcelona); A. Lisbona (Hospital Central de la Defensa, Madrid); J. López (Hospital Universitario de Canarias, Sta Cruz de Tenerife); J López (Complejo Hospitalario de Toledo); M. López de la Torre (Hospital Universitario Virgen de las Nieves, Granada); A. Lucas (Hospital Universitari Germans Trias i Pujol, Badalona); T. Lucas (Hospital Universitario Puerta de Hierro, Madrid); M. Luque (Hospital de La Princesa, Madrid); F. Maravall (Hospital Universitari Arnau de Vilanova, Lleida); Ll. Masmiquel (Hospital Son Llàtzer, Palma de Mallorca); A. Megia (Hospital Universitari Joan XXIII, Tarragona); E. Menéndez (Hospital Universitario Central de Asturias, Oviedo); J. Mesa (Hospital Universitari Vall d′Hebron, Barcelona); P. de Miguel Novoa (Hospital Clínico San Carlos, Madrid), J.M. Miralles (Universidad de Salamanca); I. Moraga (Hospital de Móstoles, Madrid); M. Muñoz (Hospital Universitario San Cecilio, Granada); A. Nubiola (Hospital de l’Esperit Sant, Santa Coloma Gramanet); J Parra (Hospital de Mérida); V. Pereg (Hospital Son Dureta, Palma de Mallorca); C Pesquera (Hospital Universitario Marques de Valdecilla. Santander); A. Picó (Hospital General Universitario de Alicante); F. Piñón (Hospital Universitario La Fe, Valencia), E. Pizarro (Hospital de Mataró); J.M. Pou (Hospital de la Santa Creu i Sant Pau, Barcelona); L. Ramírez (Hospital Santa Mª del Rosell, Cartagena); F. Rius (Hospital Universitari Arnau de Vilanova, Lleida); I. Salinas (Hospital Universitari Germans Trias i Pujol, Badalona); J Salvador (Clínica Universitaria, Navarra); F. Sánchez-Franco (Hospital Carlos III, Madrid); J. Santamaría (Hospital de Cruces, Bilbao); J. Sastre (Complejo Hospitalario de Toledo); G. Sesmilo (Institut Dexeus, Barcelona); R. Simó (Hospital Universitari Vall d′Hebron, Barcelona); B. Soldevila (Hospital Universitari Germans Trias i Pujol, Badalona); J. Soler (Hospital Universitari Bellvitge, Barcelona); E. Torres (Hospital Universitario San Cecilio, Granada); C. Varela (Hospital Infanta Sofía, Madrid); L. Vila (Hospital Dos de Maig, Barcelona); M. Villa (Hospital de Móstoles); C. Villabona (Hospital Universitari Bellvitge, Barcelona); S. Webb (Hospital Santa Creu i Sant Pau, Barcelona); S. Wengrowicz (Hospital Santa Creu i Sant Pau, Barcelona) y C. Zafon (Hospital Universitari Vall d′Hebron, Barcelona).