La diabetes se ha convertido en una comorbilidad prevalente que tiene un impacto negativo sobre el estado nutricional, la función pulmonar y la supervivencia en la fibrosis quística.
ObjetivoIdentificar alteraciones en los puntos intermedios del test de tolerancia oral a la glucosa de 2h (OGTT), la disfunción de la célula β pancreática y la resistencia insulínica en la diabetes relacionada con la fibrosis quística.
MétodosAnalizamos de forma retrospectiva una serie de 64 pacientes mayores de 14 años, mediante los datos del primer OGTT patológico durante su seguimiento. Se determinaron la resistencia insulínica, usando el modelo HOMA-IR, la función de la célula β pancreática según Wareham, el tiempo en alcanzar la concentración máxima plasmática de insulina y glucosa y el área bajo la curva (AUC0-120).
ResultadosSe incluyeron 28 mujeres y 36 varones. La media de edad de la serie fue de 26,8 años. El 26,7% tenía una tolerancia normal (TGN), un 18,3% diabetes sin alteración de la glucosa en ayunas (CFRD sin FPG), el 10% una alteración indeterminada (INDET) y el 45% intolerancia hidrocarbonada (IGT). En los valores del HOMA-IR no se encontraron diferencias entre ningún grupo. Los casos con alguna alteración diagnóstica tenían una peor función de la célula β, con un retraso significativo en la secreción de insulina, aunque no hubo diferencias en su producción total (AUC0-120). El tiempo en alcanzar el pico máximo de glucosa era significativamente menor en los TGN frente al resto de categorías, siendo el AUC0-120 de glucosa mayor en las distintas categorías diagnósticas frente a TGN.
ConclusionesEn más de la mitad de los casos el pico máximo de glucemia en la OGTT se alcanza en puntos intermedios y no en el tiempo clásico de 120min. La secreción precoz de insulina está retrasada en los pacientes con fibrosis quística y alteraciones en el metabolismo de la glucosa, sin llegar a observarse diferencias en la producción total de la misma. La ausencia de alteraciones significativas en el HOMA-IR sugiere que la disfunción de la célula β es el principal mecanismo patogénico.
diabetes has become a co-morbidity with a negative impact on nutritional status, lung function and survival in cystic fibrosis.
ObjectiveTo identify any changes in intermediate points after a 2-hour oral glucose tolerance test (OGTT), pancreatic β-cell dysfunction, and insulin resistance in cystic fibrosis-related diabetes.
MethodsIt was carried out a retrospective analysis in a cohort of 64 patients affected of cystic fibrosis, older than 14 years, using the first pathological OGTT. Peripheral insulin resistance was measured using the homeostasis model assessment for insulin resistance (HOMA- IR), and pancreatic β-cell function was calculated according to Wareham. Time to maximum plasma insulin and glucose levels and area under the curve (AUC0-120) were also measured.
ResultsTwenty-eight women and 36 men with a mean age of 26.8 years were enrolled, of whom 26.7% had normal glucose tolerance (NGT), 18.3% cystic fibrosis-related diabetes without fasting hyperglycemia (CFRD w/o FPG), 10% indeterminate (INDET), and 45% impaired glucose tolerance (IGT). HOMA-IR values were not significantly different between the diagnostic categories. Patients with any pathological change had worse β cell function, with a significant delay in insulin secretion, although there were no differences in total insulin production (AUC0-120). Time to maximum glucose levels was significantly shorter in NGT patients as compared to other categories, with glucose AUC0-120 being higher in the different diagnostic categories as compared to NGT.
ConclusionsIn over half the cases, peak blood glucose levels during a standard OGTT are reached in the intermediate time points, rather than at the usual time of 120minutes. Patients with cystic fibrosis and impaired glucose metabolism have a delayed insulin secretion during the standard OGTT due to loss of first-phase insulin secretion, with no differences in total insulin production. Absence of significant changes in HOMA-IR suggests that β-cell dysfunction is the main pathogenetic mechanism.
La fibrosis quística (CF) es la enfermedad genética letal con herencia autosómica recesiva más frecuente en la raza caucásica. Se produce por una mutación en el gen codificador de la proteína transmembrana reguladora de la conductabilidad de la fibrosis quística (CFTR) ubicado en el brazo largo del cromosoma 7 (7q31.2). Se han identificado más de 1.500 mutaciones, pero la más frecuente es la deleción de una fenilalanina en la posición 508 (ΔF508), afectando aproximadamente al 94% de los individuos; ninguna de las demás mutaciones supera el 5%1,2. En España su incidencia oscila entre uno por cada 2.810-8.028 nacidos vivos, dependiendo de la diferente prevalencia de la mutación ΔF5083,4. En las últimas décadas la supervivencia de los pacientes con CF ha mejorado significativamente gracias a los avances en los cuidados médicos respiratorios y nutricionales, llegando a alcanzar una esperanza de vida entre 30 y 40 años de edad5. La diabetes relacionada con la fibrosis quística (CFRD), y otras alteraciones del metabolismo hidrocarbonado, constituyen una de las comorbilidades más frecuentes en la actualidad, si bien los primeros casos descritos de CFRD e intolerancia a la glucosa (IGT) en CF datan de 19555. La prevalencia de CFRD aumenta con la edad: 9% de 5-9 años, 26% de 10-20 años y aproximadamente hasta un 50% a los 30 años. Entre los 15 y 30 años el porcentaje de pacientes con tolerancia normal a la glucosa (TGN) desciende casi linealmente, a pesar de que su estimación es difícil de precisar, ya que el estado de tolerancia a la glucosa varía de año a año en los pacientes con CF6–10. Se estima que el riesgo de muerte atribuible a la diabetes en la CF está comprendido entre el 31% y el 55%, independientemente de otras complicaciones de la CF11; aunque la tasa de mortalidad global ha disminuido en los últimos años desde 6,7 (1992-1997) a 3,5 (2003-2008) por 100 personas-año12. Por lo tanto, un diagnóstico precoz de CFRD y un adecuado manejo terapéutico son claves en el seguimiento de estos pacientes, no solo en la infancia, sino como un factor clínico determinante en el pronóstico en la adolescencia y la edad adulta.
El test de tolerancia oral de glucosa (OGTT) es la prueba diagnóstica de elección, puesto que los niveles de glucemia basal en ayunas (FPG) usados como único test de screening dejarían sin diagnosticar a más de 2/3 de los pacientes con CFRD13. Sin embargo, el pico de glucemia máximo a los 120min puede estar ausente en un gran número de pacientes con CF, por lo que se cree necesario extraer muestras cada 30min durante dicha prueba. Se ha observado que los sujetos con CF sin CFRD presentan niveles máximos de glucemia a los 30, 60 y 90min, pero niveles de glucemia similares a los controles sanos, tanto basales como a los 120min14, y que puede que estas alteraciones más sutiles tengan relevancia clínica15,16. De este modo, en los últimos años diversos autores han señalado que la glucemia a los 60 y 90min puede ser más sensible para detectar intolerancia a la glucosa en estos pacientes14. La U.S. Cystic Fibrosis Foundation17 y la International Society of Pediatric & Adolescent Diabetes18 no diferencian entre CFRD con o sin FPG, puesto que recientemente se ha sugerido que el tratamiento de ambas conllevaría beneficios en relación con el estado nutricional y la función pulmonar19,20.
Los objetivos de este estudio son evaluar las diferencias de la curva del OGTT (sobre todo la existencia de alteraciones en los puntos intermedios), la resistencia insulínica y la función de la célula β pancreática entre los casos con TGN y las distintas categorías diagnósticas de alteraciones en el metabolismo hidrocarbonado en una cohorte de pacientes adolescentes y adultos con CF.
Material y métodosSujetosSe recogieron una serie de variables en pacientes con CF en seguimiento por la unidad multidisciplinar de fibrosis quística del Hospital Universitario Ramón y Cajal durante los años 2011-2012. Los pacientes fueron diagnosticados de CF según los criterios de Rosenstein y Cutting (1998) y la European Cystic Fibrosis Society.
En el estudio se incluyeron aquellos pacientes que cumplieron los siguientes criterios: diagnóstico de CF, edad mayor de 14 años y screening anual de diabetes mediante la realización de un OGTT. Los criterios de exclusión fueron: edad menor de 14 años y datos incompletos en el OGTT, ausencia de registros de función pulmonar y parámetros nutricionales coincidentes en el tiempo, embarazo, las infecciones virales por VIH, VHC y/o VHB, y el trasplante de órgano en el momento o previo a la realización del OGTT.
MétodosPara la recogida de datos se utilizaron las historias clínicas, tanto electrónicas como las depositadas en el archivo del centro. Se analizaron aquellos datos correspondientes al año diagnóstico del primer OGTT de screening patológico, es decir, con alguna de las categorías diagnósticas definidas por la American Diabetes Association (ADA)17. En los pacientes sin OGTT patológico se recogieron los datos correspondientes al último OGTT realizado.
El estudio fue aprobado por el comité de ética local (número de registro 063/12).
Test de tolerancia a la glucosaEl OGTT consiste en la administración de una solución oral que contiene 1,75g/kg de glucosa (máxima dosis 75g), disuelta en agua. Posteriormente se recogen muestras sanguíneas para determinar los niveles basales de insulina y glucosa y a los 30, 60, 90 y 120min.
Se definieron los grupos de estudio siguiendo los criterios para CFRD y otras alteraciones del metabolismo de la glucosa —IGT y alteración indeterminada de la glucosa (INDET)— por la North American CF Consensus Conference (2010) y American Diabetes Association (ADA)12,17. El OGTT se realizó durante un periodo de estabilidad de la enfermedad de al menos 6 semanas —definido como la ausencia de procesos infecciosos intercurrentes, corticoterapia y/o antibioterapia sistémica u hospitalizaciones— y como método de screening anual desde los 10 años de edad, según las recomendaciones de la U.S. Cystic Fibrosis Foundation17 y de la International Society of Pediatric & Adolescent Diabetes18.
La glucosa plasmática se determinó mediante el método de la glucosa oxidasa (Beckman Glucose Analyser; Beckman Instruments, Fullerton, California, EE. UU.). Las determinaciones séricas de insulina se realizaron mediante un ensayo inmunométrico quimioluminiscente en fase sólida (IMMULITE 2000, Siemens Medical Solutions Diagnostics. Los Ángeles, CA,EE. UU.). Los máximos coeficientes intraensayo e interensayo eran 5,5% y 7,3% para la insulina. La sensibilidad analítica del ensayo para la insulina fue de 2mU/l. Los valores de glucemia están expresados en mg/dl y de insulina en mU/l.
La resistencia a la insulina se estudió mediante el modelo de homeostasis HOMA-IR, que requiere solo de los valores basales de glucosa e insulina (G0 [mmol/l)×I0/22,5)21. La función de la célula β pancreática (mU/mmol) se evaluó mediante la ratio del incremento de insulina a los 30min (I30-I0mU/l) entre la glucosa a los 30min durante el OGTT (enmmol/l), basándonos en el modelo de Wareham et al.22 y la metodología de Yung et al.23
Las pruebas funcionales respiratorias se realizaron mediante un sistema de espirometría siguiendo los procedimientos modificados en 1987 por el National Institute for Ocupational Safety and Health y la American Thoracic Society. Los resultados del volumen respiratorio forzado en el primer segundo (FEV1) se expresan como el porcentaje del valor predicho para la edad, sexo, etnia, peso y altura, según las recomendaciones de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR).
Análisis estadísticoLas variables cualitativas están expresadas en sus respectivas frecuencias y las continuas con distribución normal fueron expresadas con medias (y su desviación estándar); las que no cumplieran con dicha distribución normal fueron mostradas con sus medianas y rango intercuartil (IQR, Ip25-p75). La distribución normal de las variables fue comprobada mediante el test de Kolmogorov-Smirnov.
Se utilizó la prueba de la «t» de Student bimodal para datos independientes como test paramétrico en las variables continuas con distribución normal. Para aquellas con ausencia de distribución normal se utilizó la U de Mann-Whitney, excepto en aquellos casos en los que una transformación logarítmica de los datos presentara un mejor ajuste del modelo en la comparación de las diferentes categorías diagnósticas en el área bajo la curva (AUC0-120) y en el tiempo para alcanzar la concentración máxima plasmática de insulina y glucosa (Tmáx en minutos). Dichos tiempos para alcanzar la concentración máxima de insulina y glucosa se calcularon asumiendo una distribución gaussiana de los datos en el OGTT.
Para todos los análisis se consideró una p significativa<0,05 (bilateral). Los análisis estadísticos fueron realizados mediante los programas SPSS, versión 18.0 (Chicago, IL, EE. UU.) y MedCalc Statistical Software, versión 13.1.2 (MedCalc Software bvba, Ostend, Bélgica; http://www.medcalc.org; 2014).
ResultadosLa media de edad a la entrada en el estudio fue de 26,8 años (DE 9,5). La muestra estaba formada por un total de 64 sujetos, de los cuales 60 casos fueron finalmente incluidos en el análisis. Las características generales de la serie están recogidas en la tabla 1.
Características clínicas, genéticas y de función pulmonar de los pacientes sometidos a test de sobrecarga oral de glucosa y con los trastornos de la glucemia relacionados con fibrosis quística
| N | Pacientes (%) | Media (DE) | |
|---|---|---|---|
| Edad de entrada en estudio (años) | 63 | 26,8 (9,5) | |
| Edad de diagnóstico de fibrosis quística (años) | 61 | 1 (IP25-75 5,5)* | |
| Género | 64 | ||
| Varón | 36 (56,25) | ||
| Mujer | 28 (43,75) | ||
| Estatus mutacional ΔF508 | 64 | ||
| Heterocigótico | 48 (75) | ||
| Homocigótico | 15 (23,4) | ||
| Desconocido | 1 (1,6) | ||
| Tolerancia normal a la glucosa (TGN) | 60 | 16 (26,7) | |
| Diabetes relacionada con la fibrosis quística sin alteración de la glucemia basal (CFRD sin FPG) | 60 | 11 (18,3) | |
| Tolerancia indeterminada (INDET) | 60 | 6 (10) | |
| Intolerancia hidrocarbonada (IGT) | 60 | 27 (45) | |
| Enfermedad pulmonar | 62 | 61 (98,4) | |
| Enfermedad pancreática exocrina | 62 | 46 (74,2) | |
| IMC | 61 | 20,3 (3,3) | |
| FEV1 total (%) | 61 | 69,5 (20,4) | |
| CVF % | 61 | 75,1 (19) | |
El 26,7% (n=16) tenían una TGN tras el OGTT. La CFRD sin FPG se detectó en el 18,3% (n=11) de los pacientes. No hubo ningún caso de CFRD con FPG. La categoría INDET fue encontrada en el 10% (n=6) y la IGT en el 45% (n=27) de los casos. En ningún paciente se detectó una glucemia basal alterada en ayunas (FPG).
Estado glucémico y respuesta de glucosa e insulina en el test de tolerancia a la glucosaEl pico máximo de glucemia se alcanzó a los 30min en el 10,9% de los pacientes, a los 60min en el 50%, a los 90min en el 15,6% y a los 120min en el 6,3% de los casos. En el caso del pico máximo de insulina, este se objetivó a los 120min en el 40,6% de los pacientes, mientras que el 25% lo alcanzó a los 90min, el 10,9% a los 60min y, finalmente, el 3,1% a los 30min del OGTT.
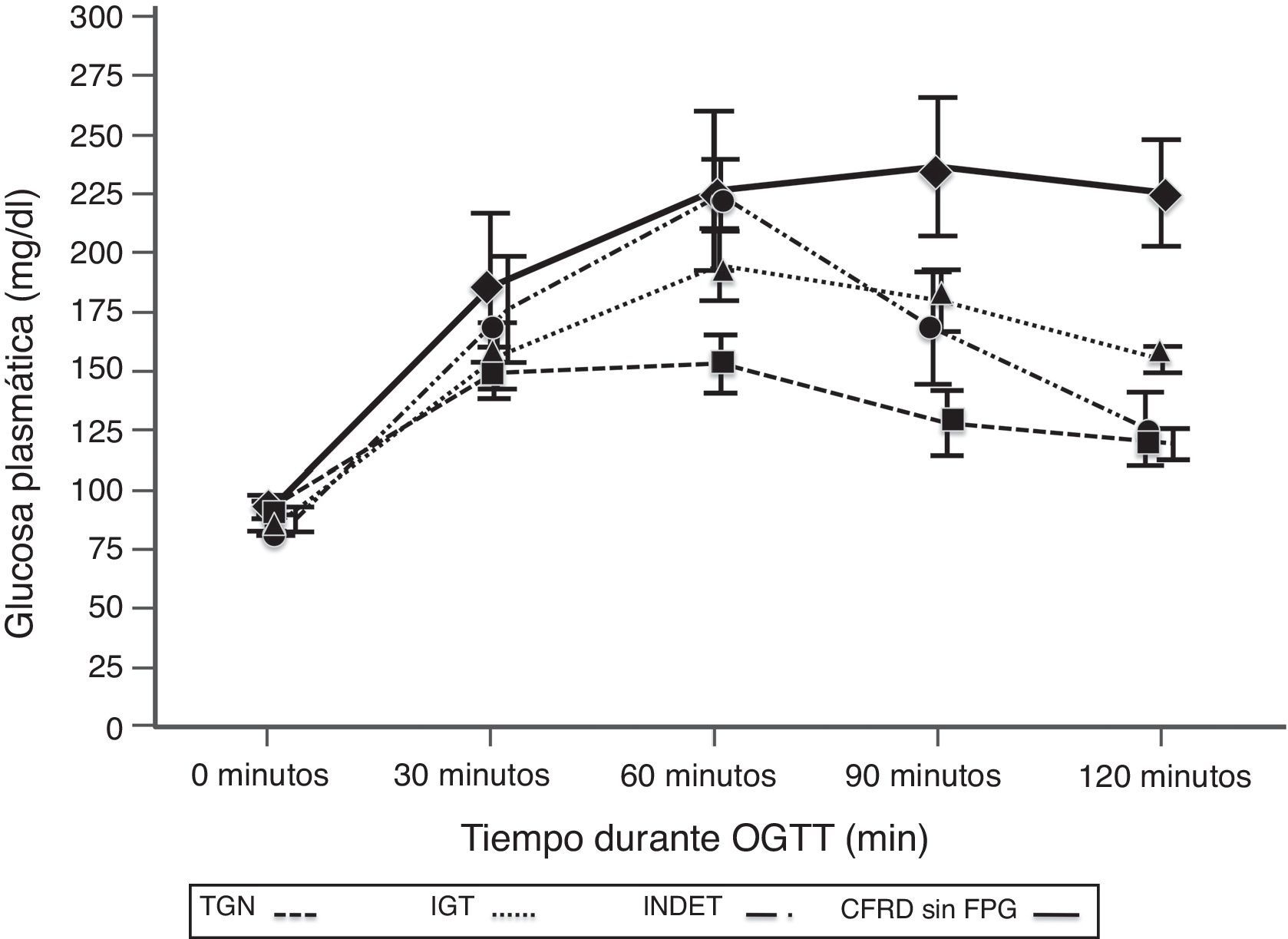
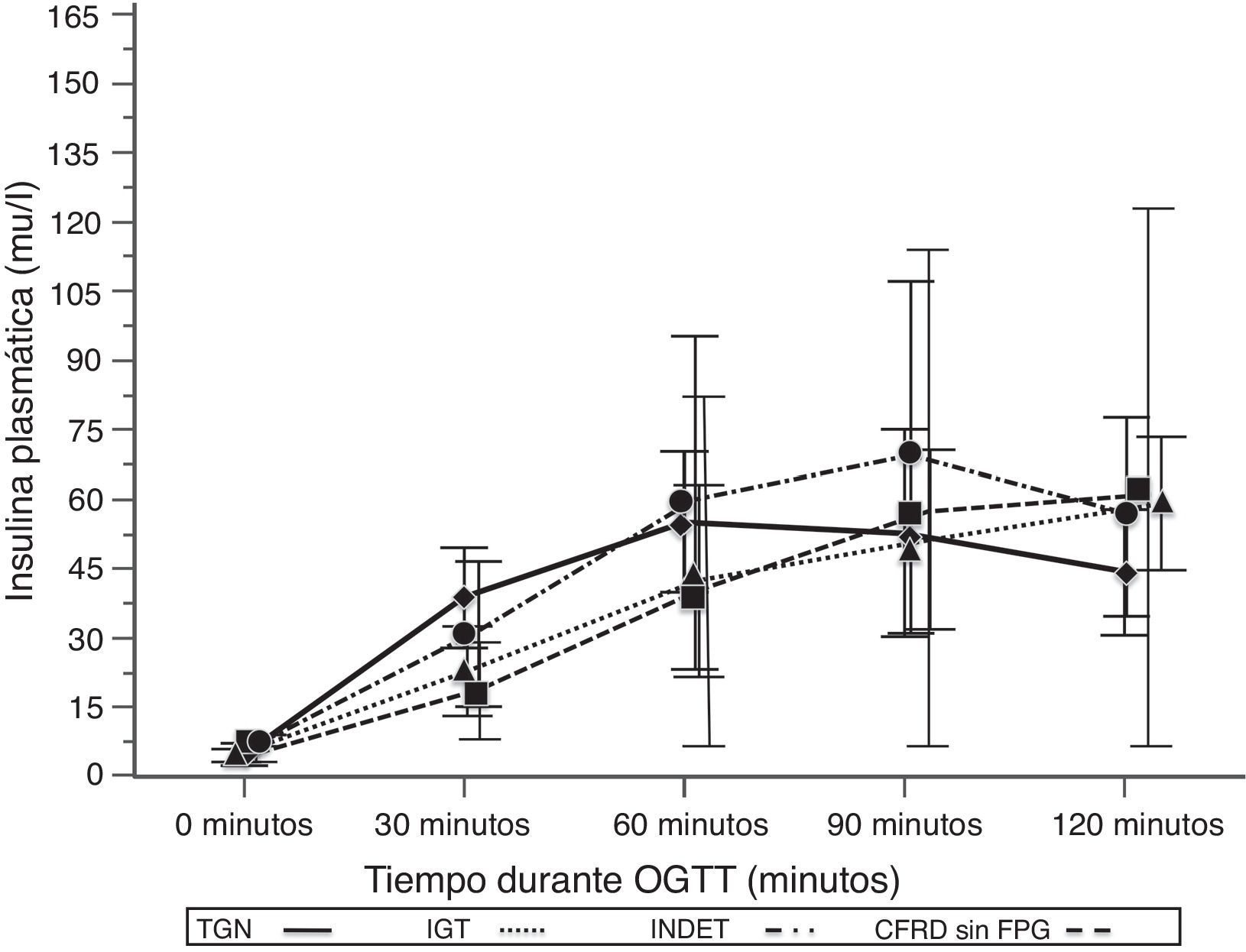
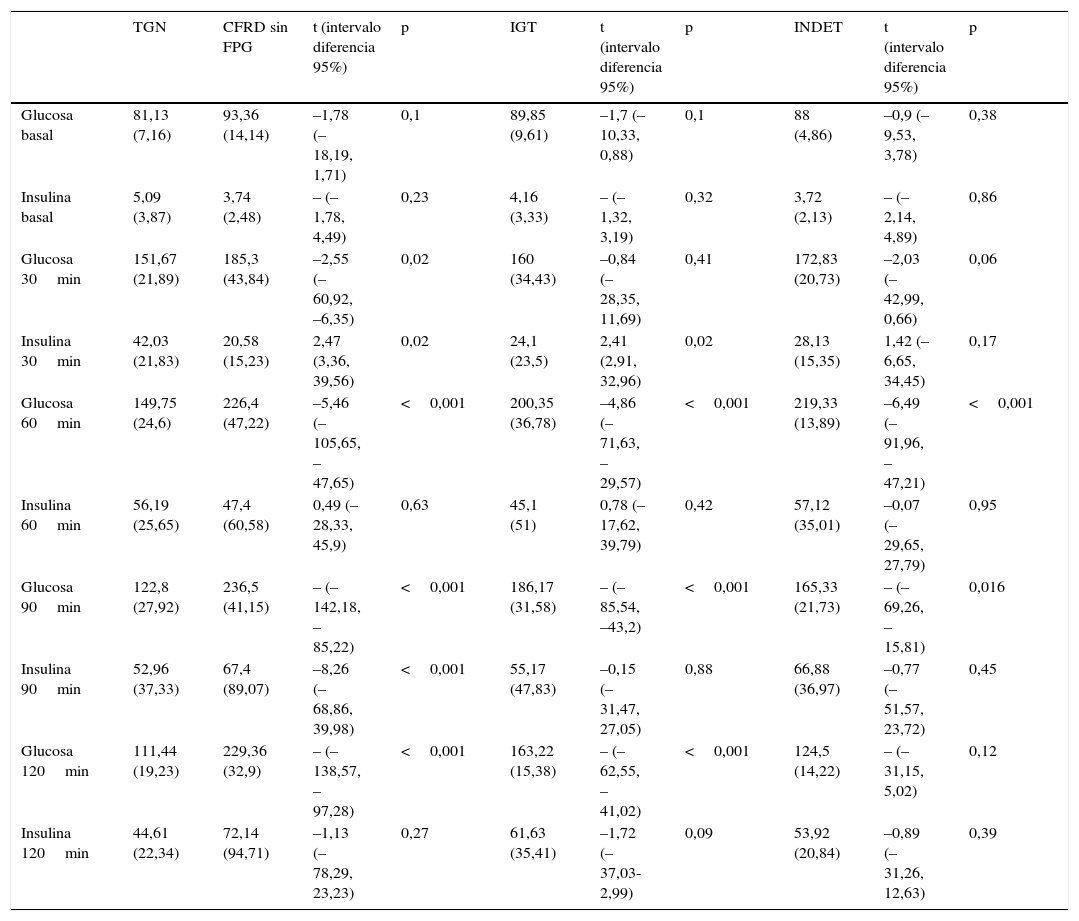
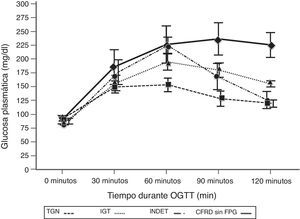
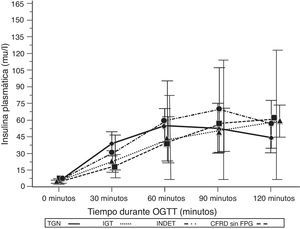
Al comparar los casos con TGN frente a los que presentaban criterios de CFRD sin FPG (tabla 2; fig. 1), se encontró una diferencia estadísticamente significativa en los valores medios de la glucosa plasmática ya desde el minuto 30 de la prueba (p=0,018), manteniéndose esta diferencia en la siguientes mediciones a los 60, 90 y 120min (p<0,001, en cada uno de estos puntos). En el caso de los valores plasmáticos de insulina las diferencias las encontramos en niveles más disminuidos a los 30minutos en los casos con CFRD sin FPG (p=0,022), y más elevados a los 90min (p<0,001) (tabla 2; fig. 2).
Diferencias en la curva de sobrecarga oral de glucosa entre TGN y las distintas categorías de alteraciones hidrocarbonadas
| TGN | CFRD sin FPG | t (intervalo diferencia 95%) | p | IGT | t (intervalo diferencia 95%) | p | INDET | t (intervalo diferencia 95%) | p | |
|---|---|---|---|---|---|---|---|---|---|---|
| Glucosa basal | 81,13 (7,16) | 93,36 (14,14) | –1,78 (–18,19, 1,71) | 0,1 | 89,85 (9,61) | –1,7 (–10,33, 0,88) | 0,1 | 88 (4,86) | –0,9 (–9,53, 3,78) | 0,38 |
| Insulina basal | 5,09 (3,87) | 3,74 (2,48) | – (–1,78, 4,49) | 0,23 | 4,16 (3,33) | – (–1,32, 3,19) | 0,32 | 3,72 (2,13) | – (–2,14, 4,89) | 0,86 |
| Glucosa 30min | 151,67 (21,89) | 185,3 (43,84) | –2,55 (–60,92, –6,35) | 0,02 | 160 (34,43) | –0,84 (–28,35, 11,69) | 0,41 | 172,83 (20,73) | –2,03 (–42,99, 0,66) | 0,06 |
| Insulina 30min | 42,03 (21,83) | 20,58 (15,23) | 2,47 (3,36, 39,56) | 0,02 | 24,1 (23,5) | 2,41 (2,91, 32,96) | 0,02 | 28,13 (15,35) | 1,42 (–6,65, 34,45) | 0,17 |
| Glucosa 60min | 149,75 (24,6) | 226,4 (47,22) | –5,46 (–105,65, –47,65) | <0,001 | 200,35 (36,78) | –4,86 (–71,63, –29,57) | <0,001 | 219,33 (13,89) | –6,49 (–91,96, –47,21) | <0,001 |
| Insulina 60min | 56,19 (25,65) | 47,4 (60,58) | 0,49 (–28,33, 45,9) | 0,63 | 45,1 (51) | 0,78 (–17,62, 39,79) | 0,42 | 57,12 (35,01) | –0,07 (–29,65, 27,79) | 0,95 |
| Glucosa 90min | 122,8 (27,92) | 236,5 (41,15) | – (–142,18, –85,22) | <0,001 | 186,17 (31,58) | – (–85,54, –43,2) | <0,001 | 165,33 (21,73) | – (–69,26, –15,81) | 0,016 |
| Insulina 90min | 52,96 (37,33) | 67,4 (89,07) | –8,26 (–68,86, 39,98) | <0,001 | 55,17 (47,83) | –0,15 (–31,47, 27,05) | 0,88 | 66,88 (36,97) | –0,77 (–51,57, 23,72) | 0,45 |
| Glucosa 120min | 111,44 (19,23) | 229,36 (32,9) | – (–138,57, –97,28) | <0,001 | 163,22 (15,38) | – (–62,55, –41,02) | <0,001 | 124,5 (14,22) | – (–31,15, 5,02) | 0,12 |
| Insulina 120min | 44,61 (22,34) | 72,14 (94,71) | –1,13 (–78,29, 23,23) | 0,27 | 61,63 (35,41) | –1,72 (–37,03-2,99) | 0,09 | 53,92 (20,84) | –0,89 (–31,26, 12,63) | 0,39 |
Concentración media de glucosa en mg/dl después del test de sobrecarga oral de glucosa en pacientes con fibrosis quística y diferentes categorías diagnósticas de alteraciones en el metabolismo hidrocarbonado.
TGN frente CFRD sin FPG: p=0,018 a los 30min; p<0,001 a los 60, 90 y 120min. TGN frente IGT: p<0,001, a los 60, 90 y 120min; p=NS a los 30min. TGN frente INDET: p=NS a los 30 y 120min; p<0,001 a los 60min y p=0,016 a los 90min.
CFRD sin FPG: diabetes relacionada con la fibrosis quística sin glucemia basal en ayunas alterada; IGT: intolerancia a la glucosa; INDET: alteración de la glucosa indeterminada; TGN: tolerancia normal a la glucosa.
Concentración media de insulina en mU/l después del test de sobrecarga oral de glucosa en pacientes con fibrosis quística y diferentes categorías diagnósticas de alteraciones en el metabolismo hidrocarbonado.
TGN frente CFRD sin FPG: p=0,022 a los 30min; p<0,001 a 90min; p=NS a 60 y 120min. TGN frente IGT: p=0,021 a los 30min; p<0,001, a los 60, 90 y 120min. TGN frente INDET: p=NS a los 30, 60, 90 y 120min.
CFRD sin FPG: diabetes relacionada con la fibrosis quística sin glucemia basal en ayunas alterada; IGT: intolerancia a la glucosa; INDET: alteración de la glucosa indeterminada; TGN: tolerancia normal a la glucosa.
En la comparación de los valores de glucosa e insulina para los grupos de TGN e IGT (tabla 2), las diferencias se mantuvieron para los valores de glucosa a los 60, 90 y 120min (p<0,001 en cada uno de estos puntos), y también en los niveles de insulina más bajos a los 30min en el caso de IGT (p=0,021). En el caso de TGN e INDET, las diferencias únicamente se observaron en los valores de glucemia plasmática a los 60 y 90min (p<0,001 y p=0,016, respectivamente).
El tiempo en alcanzar el pico máximo (Tmáx minutos) de glucosa fue significativamente menor en los TGN frente al resto de categorías de forma global (TGN 52,5min[17,32] vs 71,59min [24,39], t=–2,87, –19,09 [IC 95%: –32,4, –5,78], p=0,005). Tmáx de glucosa de CFRD sin FPG e IGT estaba también significativamente retrasado respecto a los TGN (tabla 3), pero no en el caso de INDET. Al realizar las AUC0-120 de glucosa también se encontraron diferencias entre TGN y el resto de las categorías (5.344,7 [2.037,4] vs 10.178,9 [3.050,3], t=–5,87; –4.834,2 [IC 95%: –6.484,1, –3.184,3], p<0,001), alcanzando, además, mayores valores en cada una de ellas respecto a la TGN (tabla 3).
Categorías de alteraciones hidrocarbonadas y parámetros de glucosa plasmática en función del área bajo la curva y el tiempo en alcanzar la concentración máxima
| TGN (n=16) | CFRD sin FPG (n=11) | IGT (n=27) | INDET (n=6) | ||
|---|---|---|---|---|---|
| Glucosa plasmática (mg/dl) | |||||
| Tmáx (min)* | 52,5 (17,32) IC 95%: 43,27-61,73 | 76,36 (28,03)** IC 95%: 54,54-95,19 | 73,84 (24,34)*** IC 95%: 64,01-83,68 | 60**** | |
| AUC0-120***** | 5.344,7 (2.037,4) IC 95%: 4.259,0-6.430,4 | 12.923,2 (3.115,1)****** IC 95%: 10.830,41-15.016,0 | 9.058,9 (2.538,0)****** IC 95%: 8.033,7-10.084,0 | 9.352,5 (1.209,5)****** IC 95%: 8.083,2-10.621,8 | |
En el caso de la insulina plasmática, Tmáx (minutos) estaba aún más retrasado si los pacientes presentaban alguna alteración del metabolismo hidrocarbonado (TGN 73,13 [28,92] vs 109,50 [17,39], Z=4,37, p<0,001); en el caso de IGT y el resto de categorías estaba especialmente retrasado (IGT 111,92 [18,12] vs 88,00 [28,33]; Z=3,58, p<0,001). Además estas diferencias en Tmáx para la insulina se mantuvieron al comparar entre sí TGN frente a CFRD sin FPG o IGT, pero no en el caso de INDET.
En el AUC0-120 de insulina no se hallaron diferencias significativas al comparar los grupos frente a TGN (tabla 4).
Categorías de alteraciones hidrocarbonadas y parámetros de insulina plasmática en función del área bajo la curva y el tiempo en alcanzar la concentración máxima, resistencia insulínica (HOMA-IR) y función de la célula β pancreática
| TGN (n=16) | CFRD sin FPG (n=8) | IGT (n=27) | INDET (n=6) | |
|---|---|---|---|---|
| Insulina plasmática (mU/l) | ||||
| Tmax (min)* | 73,13 (28,92) IC 95%: 57,72-88,53 | 112,5 (13,89)** IC 95%: 100,89-124,11 | 111,92 (18,12)*** IC 95%: 104,61-119,24 | 95 (12,25)**** IC 95%: 82,14-107,85 |
| AUC0-120***** | 4.268,5 (4.733,9) IC 95%: 3.289,9-5.538,2 | 3.017,2 (2.342,9)****** IC 95%: 1.408,2-6.464,7 | 4.055,7 (3.799,2)****** IC 95%: 2.521,2-5.590,3 | 4.982,1 (4.478,3)****** IC 95%: 2.150,6-7.814,4 |
En los valores del HOMA-IR (tabla 5) no se encontraron diferencias significativas (TGN 1,04 [0,88] vs CFRD sin FPG 0,85 [0,58]; Z=–0,45, p=0,68; vs IGT 0,96 [0,79], Z=–0,1, p=0,93; vs INDET 0,79 [0,42]; Z=–0,04 p=0,97).
Categorías de alteraciones hidrocarbonadas y parámetros de resistencia insulínica (HOMA-IR) y función de la célula β pancreática
Sin embargo, sí se obtuvieron diferencias estadísticas en la determinación de la función de la célula β (tabla 5) al comparar aquellos pacientes con TGN frente a CFRD sin FPG y frente a IGT (TNG 4,34 [2,2]mU/mmol vs CFRD sin FPG 1,6 [1,23]mU/mmol, t=3,24; 2,74 [IC 95%: 0,98-4,5], p=0,004; vs IGT 2,2 [2,46]mU/mmol, t=2,78; 2,14 [IC 95%: 0,58-3,69], p=0,008), pero no en el caso del grupo INDET, que mantuvo una secreción de insulina más preservada (vs INDET 2,65 [1,79]mU/mmol, t=1,66; 1,68 [IC 95%: –0,44, –3,81], p=0,11).
DiscusiónUno de los principales factores fisiopatogénicos en el desarrollo de CFRD es la disfunción de la célula β pancreática8,24. La primera fase de la secreción de insulina en respuesta a una sobrecarga de glucosa intravenosa, y a otros estímulos secretores de insulina, está alterada en adultos con CF. Dicha alteración también se ha descrito tras la sobrecarga oral de glucosa8,25,26. El tiempo requerido para alcanzar el pico de insulina está retrasado desde los 30-60min en los sujetos sanos hasta los 90-120min en los sujetos con CFRD8. Esta pérdida de la primera fase de la secreción de insulina puede aparecer incluso en sujetos con CF y TGN6,18,25,26.
Los resultados de nuestra serie son similares a los publicados por Hammed et al.15, a pesar de desarrollar metodologías no completamente superponibles. En este trabajo los autores comunican que el pico máximo de glucosa se alcanzaba a los 60min en la mitad de los casos, y a los 90min en el 33%; el pico máximo de insulina también estaba retrasado, siendo a los 120min en el 42% de los casos y a los 90min en el 24%.
Por tanto, se puede deducir que el pico de máxima glucemia no se alcanzaría en la mayor parte de los pacientes con CF en el tiempo clásico de 120min, tal y como se exige para el diagnóstico de CFRD. En este sentido, sería necesario profundizar en la importancia de los valores de glucemia en los puntos intermedios del OGTT. Se ha sugerido que los sujetos con CF sin CFRD ya presentan hiperglucemia a los 30, 60 y 90min, pero niveles de glucemia similares a los controles sanos en niveles basales y a los 120min. De este modo, la glucemia a los 60 y 90min podría ser más sensible para detectar la intolerancia a la glucosa en estos pacientes14. Estos resultados podrían tener relevancia clínica, ya que recientemente se ha sugerido una asociación entre una peor función pulmonar y la presencia de hiperglucemia en los puntos intermedios del OGTT —concretamente con un valor de glucemia a los 60min por encima de 140mg/dl— sin encontrarse una correlación entre la función pulmonar y los niveles de glucemia a los 120min16. En relación con lo previo, varios trabajos estudian los sistemas de monitorización continua de glucosa como método para un diagnóstico precoz en estos pacientes, los cuales mediante el OGTT tendrían un perfil de glucemia normal14,27,28.
El AUC0-120 de glucosa obtenido en nuestra serie fue mayor en aquellos casos con alguna alteración en el metabolismo hidrocarbonado frente a los TGN, siendo estos resultados similares a los obtenidos por otros investigadores23,29,30.
Al comparar los datos de la glucemia del OGTT del año diagnóstico del grupo TGN frente a las otras categorías se objetivan diferencias significativas en los puntos intermedios, incluso a los 30min en los casos de CFRD. Al igual que sugieren Lee et al., se debería estudiar la posibilidad de usar como método de screening un test más simple. Lee et al.31 estudiaron el test de sobrecarga de glucemia con 50g de glucosa (1h-CGT) midiendo la glucemia a los 60min. Se realizó el 1h-CGT a 31 pacientes con CF y una semana más tarde el OGTT. En 9 pacientes se detectó hiperglucemia en ambos test, pero en 11 pacientes solo en el 1h-CGT (glucemia>140mg/dl), porque normalizaban los niveles de glucemia a las 2h del OGTT. Los autores concluyen que el 1h-CGT podría ser un test útil para detectar la hiperglucemia posprandial y, además, identificar a los pacientes con un 2h-OGTT alterado.
En nuestra serie, y respecto al pico máximo de insulina, la mayoría de los pacientes lo presentaban a los 90 y 120min. Diversos estudios previos han demostrado alteraciones en la primera y la segunda fase de la secreción de insulina, mediante el uso del clamp hiperglucémico y mediante la prueba intravenosa de tolerancia a la glucosa29,32–36. Nuestros resultados muestran diferencias significativas en el tiempo medio necesario para alcanzar el pico máximo de insulinemia, siendo menor en el caso de sujetos con TGN, pero no se obtuvieron diferencias en el AUC0-120 (es decir, en la secreción total de insulina). Dicho de otro modo, la característica de los pacientes con CF y alguna alteración del metabolismo hidrocarbonado sería el retraso en la secreción de insulina y no la cantidad total de insulina producida. Battezzati et al.33 objetivaron que la producción de insulina durante el OGTT alcanzaba unos niveles similares a los controles sanos, a pesar de la disfunción de la célula β y la alteración en la secreción de insulina en la fase precoz en los pacientes con CF, sugiriendo que la tasa de secreción absoluta de insulina (o el AUC0-120 de insulina) no es una medida precisa para describir los defectos en la función de la célula β, y que el retraso en la secreción de insulina y la secreción total son factores distintos que afectan a la tolerancia a la glucosa. Sin embargo, otros autores encuentran una disminución en la secreción total de insulina al comparar el AUC0-120 de los casos de CF frente a controles sanos23,37.
En nuestra serie, los casos con TGN tenían una mejor función de la célula β que aquellos pacientes con CFRD sin FPG o IGT. El grupo INDET mantenía una secreción de insulina más preservada y no hubo diferencias significativas. Yung et al.23 estudiaron en su serie a un subgrupo de 30 pacientes CF, con distintas categorías diagnósticas de alteración hidrocarbonada, y 16 controles sanos, y observaron que la función de la célula β estaba disminuida en los sujetos con CF respecto a los controles sanos (p<0,001). Además, los pacientes con CF presentaron niveles mayores de glucemia a los 90min respecto a los controles sanos de forma significativa, pero ambos grupos tuvieron niveles de glucemia similares a los 120min.
Respecto al HOMA-IR no se objetivaron valores sugerentes de resistencia insulínica en ninguno de los grupos. Este método fue descrito en primer lugar por Matthew et al. en 198521, y ha sido utilizado para estudiar la resistencia a la insulina en pacientes diabéticos tipo 2 y no diabéticos, aunque no se ha definido como un método preciso en los estados de déficit de insulina38. Los resultados obtenidos mediante este índice deben interpretarse con cautela, ya que en los pacientes con CF se han descrito estados de sensibilidad periférica a la insulina tanto normal como disminuida, una sensibilidad aumentada, pero con un descenso de la sensibilidad hepática y una sensibilidad hepática disminuida19.
En este sentido, Yung et al.23 estudiaron la implicación en el desarrollo de diabetes de la resistencia a la insulina en 68 adultos con CF sin CFRD y 46 controles sanos, y tampoco encontraron diferencias significativas entre los valores medios de HOMA-IR respecto a los controles sanos, ni entre las distintas categorías diagnósticas de alteraciones en el metabolismo hidrocarbonado. Otros autores han estudiado el clamp hiperinsulinémico-euglucémico en pacientes con CF y no han encontrado alteraciones en la sensibilidad a la insulina39,40.
Nuestra serie tiene limitaciones en su diseño. Se trata de un estudio retrospectivo, sin un grupo control de paciente sanos, y con un número de pacientes incluidos relativamente pequeño, que puede afectar a la potencia estadística, y que no ha permitido ajustar por otros valores (como el sexo o la edad). Además, parte de la serie son adolescentes, y sus características propias podrían haber influido en el análisis de las variables. Sin embargo, consideramos que los resultados obtenidos son equiparables en varios aspectos a series con un mayor número de casos analizados.
ConclusionesEn relación con las características del OGTT en más de la mitad de los casos el pico máximo de glucemia se alcanzaba en puntos intermedios y no en los tiempos clásicos de 0 y 120min, por lo que sugerimos que los puntos intermedios de la curva podrían aportar información relevante para la valoración del estado metabólico de estos pacientes. Sería necesario el diseño de estudios prospectivos que analizaran la relación de la hiperglucemia en los puntos intermedios con el deterioro clínico y de la función pulmonar en la CF.
Mediante el uso del modelo de homeostasis HOMA-IR no se objetivó un papel relevante de la resistencia insulínica en fase de estabilidad clínica en estos pacientes.
Los casos con alguna alteración diagnóstica presentaban una disfunción de la célula β pancreática, apareciendo un retraso en la fase precoz de la secreción de insulina sin diferencias en la producción total de las misma (AUC0-120).
Conflicto de interesesLos autores declaran que no hay conflicto de intereses que pueda ser percibido como perjudicial para la imparcialidad de la investigación publicada.