Las pruebas de laboratorio son cruciales en el diagnóstico y seguimiento de las disfunciones tiroideas, lo que hace necesario estudiar cuál es el patrón de su demanda y la variabilidad en la solicitud. Los objetivos del trabajo fueron comparar la variabilidad en la solicitud de pruebas de función y autoinmunidad tiroidea (tirotropina tiroxina libre [T4L], triyodotironina libre [T3L], anticuerpos frente a la tiroglobulina [TgAb] y anticuerpos antiperoxidasa [TPOAb]) por parte de los médicos de atención primaria entre diferentes departamentos de salud españoles, y calcular el potencial ahorro económico que supondría alcanzar las metas de algunos indicadores de adecuación descritos previamente en la literatura.
MétodosSe compararon el número de pruebas por 1.000 habitantes y las ratios de pruebas relacionadas (T4L/TSH, T3L/TSH, TgAb/TPOAb) entre los diferentes departamentos en función de su ubicación, tipo de gestión y la región. Se calculó el ahorro generado si cada departamento alcanzara la meta propuesta en la literatura para los indicadores T4L/TSH (0,25) y T3L/TSH (0,1).
ResultadosUn total de 76 laboratorios que atienden a una población de 17.679.195 habitantes participaron en el estudio. La solicitud de TSH fue significativamente menor en los departamentos de salud rurales-urbanos y la solicitud de T3L, la ratio T3L/TSH y la ratio TgAb/TPOAb fueron mayores en los departamentos con gestión privada. El ahorro que se generaría si se cumplieran las especificaciones para las ratios de pruebas relacionadas ascendería a 937.260,5 €.
ConclusionesLa elevada variabilidad descrita en la solicitud de pruebas de función y autoinmunidad tiroidea en España hace necesario implementar estrategias para mejorar esta solicitud.
Laboratory tests are crucial for diagnosis and monitoring of thyroid disorders. It is therefore necessary to study the pattern and variability in requests of thyroid function tests.
The study objectives were to compare the inter-regional variability in the request of laboratory thyroid tests by general practitioners (GPs) in Spain, and to investigate the potential economic savings if the goals set for some suitability indicators were reached.
MethodsTest requests per 1,000 inhabitants and test ratios (free thyroxine (FT4)/thyrotropin (TSH), free triiodothyronine (FT3)/TSH, thyroglobulin antibody (TgAb)/peroxidase antibody (TPOAb)) were compared between the different areas, according to their setting, location, and management. The resulting savings if each department achieved the goals for indicator (0.25 for FT4/TSH, 0.1 for FT3/TSH) were estimated.
ResultsSeventy-six laboratories covering a population of 17,679,195 inhabitants participated in the study. TSH was requested significantly less in urban-rural areas, and the requests for FT3/1,000 inhabitants, FT3/TSH, and TgAb/TPOAb were higher in departments with private management. The savings generated if specifications for the ratios of related tests were met would be 937,260.5 €.
ConclusionsThe high variability reported in requests for thyroid function and autoimmunity tests in Spain suggests the need for implementing strategies to improve use of such tests.
Las disfunciones tiroideas (DT) son la segunda causa de enfermedad endocrina tras la diabetes mellitus1. A estas entidades, entre otras complicaciones, se asocia un incremento de las enfermedades cardiovasculares2,3 y también trastornos psiquiátricos4; por tanto, es crucial detectar las DT tempranamente en su evolución clínica, ya que el tratamiento oportuno evita daños y complicaciones al paciente y, por tanto, mejora la evolución de la enfermedad.
En la actualidad, el diagnóstico y la monitorización de las DT se realiza en atención primaria (AP), normalmente a través de la comunicación y cooperación entre endocrinólogos y médicos de AP (MAP). Las pruebas de laboratorio son cruciales en el diagnóstico y seguimiento. De hecho, el diagnóstico de los estadios subclínicos de las DT se basa en las determinaciones bioquímicas, ya que los síntomas clínicos son muy inespecíficos5.
Los errores en la solicitud y la interpretación de resultados de pruebas de laboratorio son los principales responsables de los errores de diagnóstico de DT6, siendo crucial que en el manejo de las DT se incluya también al profesional del laboratorio7.
La tirotropina es la prueba de laboratorio clave para el diagnóstico de las DT. Sin embargo, es difícil hallar un equilibrio entre la idoneidad y la promoción de su solicitud como herramienta para la detección temprana de DT8. Distintos estudios y guías clínicas recomiendan procesar o no procesar las pruebas de hormonas tiroideas en función de los niveles de TSH a través de algoritmos consensuados2,9,10, existiendo una serie de recomendaciones para su correcta demanda11. Sin embargo, para saber en qué medida debe fomentarse la solicitud de TSH es necesario estudiar cuál es el patrón real de su demanda y la variabilidad en la solicitud de pruebas de función tiroidea en España.
El objetivo del trabajo fue, en primer lugar, comparar y analizar la variabilidad en la solicitud de pruebas de función tiroidea entre distintas regiones españolas, de acuerdo a diferentes características organizativas de los departamentos de salud, y en segundo lugar investigar el ahorro económico que supondría alcanzar las metas de algunos indicadores de adecuación descritos previamente en la literatura.
Material y métodosRecogida de datosTras los resultados obtenidos en estudios previos en la Comunidad Valenciana12 y en todo el territorio español13,14 se invitó a participar en la investigación a 141 laboratorios españoles vía correo electrónico. Se obtuvo la actividad (número de pruebas solicitadas por los MAP) en el año 2012 de laboratorios ubicados en diferentes departamentos de salud de diversas regiones españolas. Se incluyó en el estudio cualquier paciente atendido en un centro de AP de cualquiera de estos departamentos, independientemente del motivo de consulta.
Cada laboratorio participante debía proporcionar datos organizativos del departamento de salud al que pertenece (población atendida, tipo de gestión, y ubicación).
Se examinaron 5 pruebas de función tiroidea y anticuerpos antitiroideos en un estudio transversal: TSH, tiroxina libre (T4L), triyodotironina libre (T3L), anticuerpos frente a la tiroglobulina (TgAb) y anticuerpos antiperoxidasa (TPOAb).
Procesamiento de los datosTras la recogida de datos se calcularon 2 tipos de indicadores de adecuación: a) el número de pruebas por 1.000 habitantes; y b) las ratios de pruebas relacionadas (T4L/TSH, T3L/TSH y TgAb/TPOAb).
Con el fin de investigar la variabilidad interpráctica se calculó el índice de variabilidad siguiendo la fórmula: primer decil dividido por decil inferior (percentil 90/percentil 10). También se calculó la diferencia entre los indicadores en función de la ubicación del departamento de salud (rural, urbano o urbano-rural), y en función del tipo de gestión (pública o privada).
Para el estudio de la variabilidad de la solicitud entre regiones se compararon los resultados de los indicadores obtenidos en los laboratorios de las 3 comunidades autónomas con mayor número de departamentos que participaron en el estudio (Comunidad Valenciana, Andalucía y Castilla-León) entre ellas y con los resultados combinados de las regiones restantes.
Se calculó el ahorro que supondría que todos los departamentos de salud alcanzaran el estándar indicado en la bibliografía para los indicadores T4L/TSH y T3L/TSH (0,25 y 0,1 respectivamente)8,12. Este ahorro se calculó teniendo en cuenta únicamente el coste que supondría el reactivo (1,9€ por cada determinación de T4L), sin tener en cuenta otros costes de laboratorio (como personal, fungibles, etc.).
Métodos estadísticosEl tratamiento estadístico de los datos incluyó: la distribución, la media, el intervalo de confianza del 95% para la media, la desviación estándar, la mediana y rango intercuartil. El análisis de la distribución de los indicadores se llevó a cabo por medio de la prueba de Kolmogorov-Smirnov. Las diferencias entre los indicadores en función de las características organizativas del departamento y por región se calcularon mediante la prueba de Kruskal-Wallis o Mann-Whitney, según corresponda. Se utilizó un valor de p≤0,05 como criterio para rechazar la hipótesis nula.
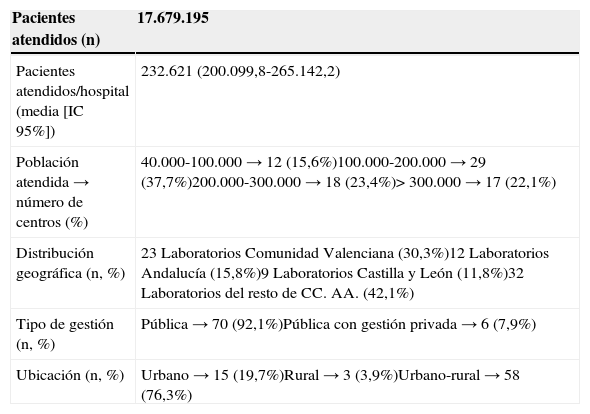
ResultadosParticiparon en el estudio 76 laboratorios de diferentes departamentos de salud de diversas regiones españolas que atendían a 17.649.195 pacientes en total. La tabla 1 muestra un resumen de los datos organizativos de los departamentos de salud que colaboraron en el estudio.
Características descriptivas de los hospitales/departamentos de salud participantes en el estudio
| Pacientes atendidos (n) | 17.679.195 |
|---|---|
| Pacientes atendidos/hospital (media [IC 95%]) | 232.621 (200.099,8-265.142,2) |
| Población atendida → número de centros (%) | 40.000-100.000 → 12 (15,6%)100.000-200.000 → 29 (37,7%)200.000-300.000 → 18 (23,4%)>300.000 → 17 (22,1%) |
| Distribución geográfica (n, %) | 23 Laboratorios Comunidad Valenciana (30,3%)12 Laboratorios Andalucía (15,8%)9 Laboratorios Castilla y León (11,8%)32 Laboratorios del resto de CC. AA. (42,1%) |
| Tipo de gestión (n, %) | Pública → 70 (92,1%)Pública con gestión privada → 6 (7,9%) |
| Ubicación (n, %) | Urbano → 15 (19,7%)Rural → 3 (3,9%)Urbano-rural → 58 (76,3%) |
IC: intervalo de confianza para la media; CC. AA.: comunidades autónomas.
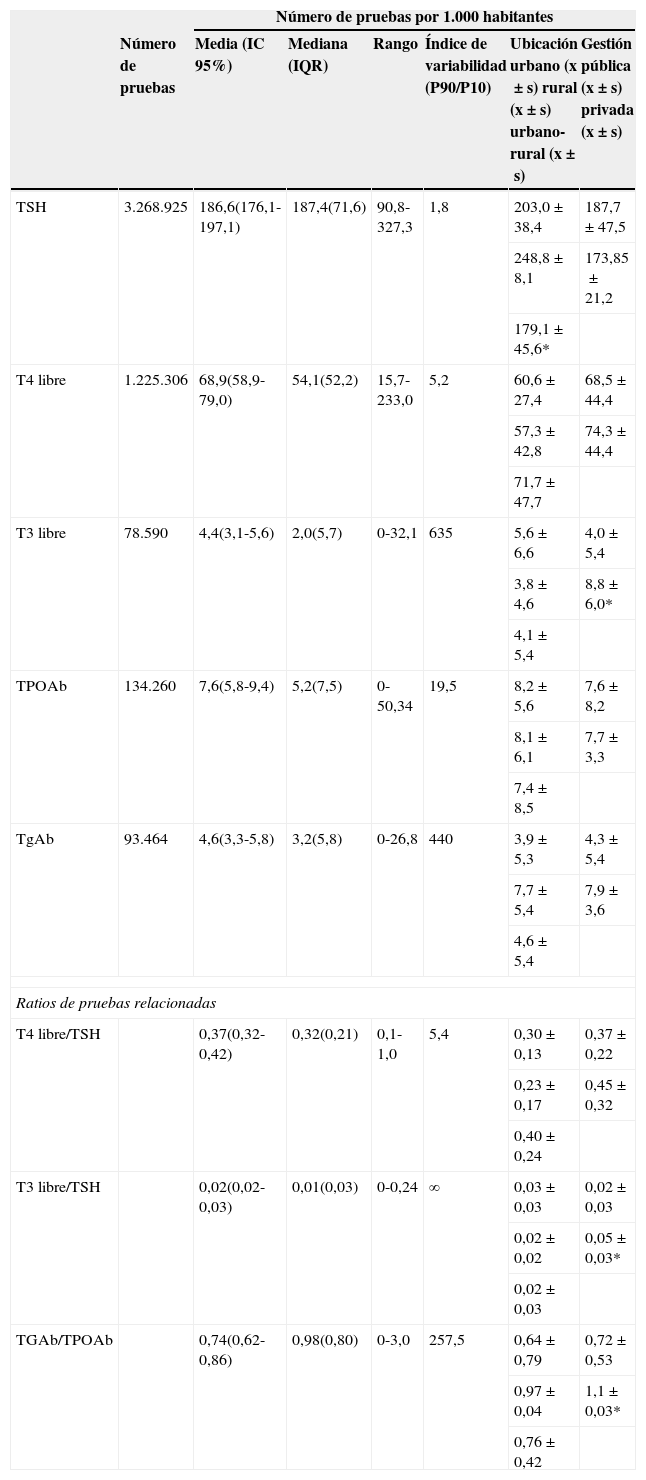
Los estadísticos descriptivos y el índice de variabilidad de los indicadores se muestran en la tabla 2. La TSH llegó a ser hasta 3 veces más solicitada en determinados departamentos de salud. La variabilidad en la solicitud de T4L también fue elevada, llegando a ser solicitada aproximadamente 14 veces más en algunos departamentos. Se muestran 7 laboratorios que no realizaban la determinación de T3L. La variabilidad en la solicitud de los anticuerpos antitiroideos (TPOAb y TGAb) fue aún mayor que para el resto de pruebas.
Estadísticos descriptivos e índice de variabilidad (percentil 90/percentil 10) de cada uno de los indicadores propuestos y su relación con las variables del estudio
| Número de pruebas por 1.000 habitantes | |||||||
|---|---|---|---|---|---|---|---|
| Número de pruebas | Media (IC 95%) | Mediana (IQR) | Rango | Índice de variabilidad (P90/P10) | Ubicación urbano (x±s) rural (x±s) urbano-rural (x±s) | Gestión pública (x±s) privada (x±s) | |
| TSH | 3.268.925 | 186,6(176,1-197,1) | 187,4(71,6) | 90,8-327,3 | 1,8 | 203,0±38,4 | 187,7±47,5 |
| 248,8±8,1 | 173,85±21,2 | ||||||
| 179,1±45,6* | |||||||
| T4 libre | 1.225.306 | 68,9(58,9-79,0) | 54,1(52,2) | 15,7-233,0 | 5,2 | 60,6±27,4 | 68,5±44,4 |
| 57,3±42,8 | 74,3±44,4 | ||||||
| 71,7±47,7 | |||||||
| T3 libre | 78.590 | 4,4(3,1-5,6) | 2,0(5,7) | 0-32,1 | 635 | 5,6±6,6 | 4,0±5,4 |
| 3,8±4,6 | 8,8±6,0* | ||||||
| 4,1±5,4 | |||||||
| TPOAb | 134.260 | 7,6(5,8-9,4) | 5,2(7,5) | 0-50,34 | 19,5 | 8,2±5,6 | 7,6±8,2 |
| 8,1±6,1 | 7,7±3,3 | ||||||
| 7,4±8,5 | |||||||
| TgAb | 93.464 | 4,6(3,3-5,8) | 3,2(5,8) | 0-26,8 | 440 | 3,9±5,3 | 4,3±5,4 |
| 7,7±5,4 | 7,9±3,6 | ||||||
| 4,6±5,4 | |||||||
| Ratios de pruebas relacionadas | |||||||
| T4 libre/TSH | 0,37(0,32-0,42) | 0,32(0,21) | 0,1-1,0 | 5,4 | 0,30±0,13 | 0,37±0,22 | |
| 0,23±0,17 | 0,45±0,32 | ||||||
| 0,40±0,24 | |||||||
| T3 libre/TSH | 0,02(0,02-0,03) | 0,01(0,03) | 0-0,24 | ∞ | 0,03±0,03 | 0,02±0,03 | |
| 0,02±0,02 | 0,05±0,03* | ||||||
| 0,02±0,03 | |||||||
| TGAb/TPOAb | 0,74(0,62-0,86) | 0,98(0,80) | 0-3,0 | 257,5 | 0,64±0,79 | 0,72±0,53 | |
| 0,97±0,04 | 1,1±0,03* | ||||||
| 0,76±0,42 | |||||||
IC: intervalo de confianza para la media; IQR: rango intercuartílico; P10: percentil 10; P90: percentil 90; TGAb: anticuerpos frente a la tiroglobulina; TPOAb: anticuerpos antiperoxidasa; x±s: media±desviación estándar.
*p≤0,05.
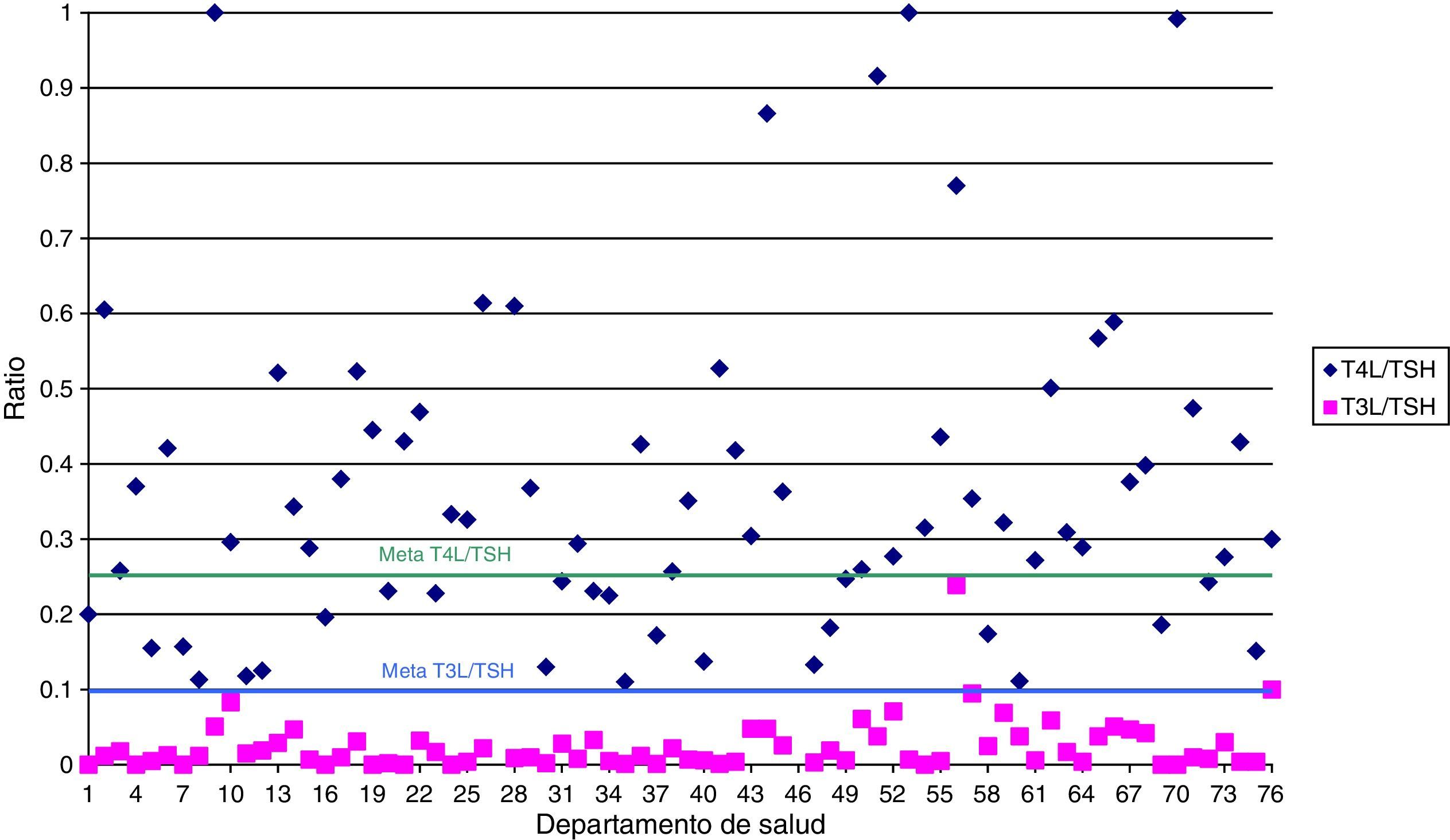
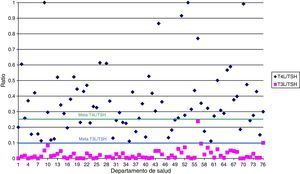
La figura 1 muestra el número de laboratorios que alcanzaron la meta establecida en las ratios T4L/TSH y T3L/TSH. Solo 24 laboratorios alcanzaron el valor deseable para el indicador T4L/TSH. Sin embargo el objetivo para T3L/TSH se alcanzó en casi todos.
Respecto a las diferencias entre los indicadores en función de la ubicación del departamento de salud, la solicitud de TSH fue significativamente menor en los departamentos urbanos-rurales que en los departamentos urbanos y rurales.
Los indicadores T3L/1.000 habitantes, T3L/TSH y TgAb/TPOAb fueron significativamente mayores en los laboratorios con gestión privada. Estos resultados también pueden observarse en la tabla 2.
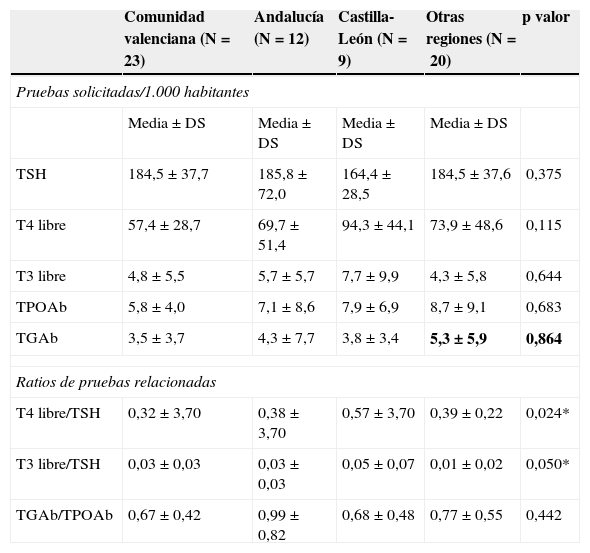
Las diferencias en los distintos indicadores de adecuación entre regiones pueden observarse en la tabla 3. Los indicadores T4L/TSH y T3L/TSH fueron significativamente mayores en la comunidad autónoma de Castilla-León.
Comparación entre las distintas regiones españolas: Comunidad Valenciana, Andalucía, Castilla-León y otras regiones
| Comunidad valenciana (N=23) | Andalucía (N=12) | Castilla-León (N=9) | Otras regiones (N=20) | p valor | |
|---|---|---|---|---|---|
| Pruebas solicitadas/1.000 habitantes | |||||
| Media±DS | Media±DS | Media±DS | Media±DS | ||
| TSH | 184,5±37,7 | 185,8±72,0 | 164,4±28,5 | 184,5±37,6 | 0,375 |
| T4 libre | 57,4±28,7 | 69,7±51,4 | 94,3±44,1 | 73,9±48,6 | 0,115 |
| T3 libre | 4,8±5,5 | 5,7±5,7 | 7,7±9,9 | 4,3±5,8 | 0,644 |
| TPOAb | 5,8±4,0 | 7,1±8,6 | 7,9±6,9 | 8,7±9,1 | 0,683 |
| TGAb | 3,5±3,7 | 4,3±7,7 | 3,8±3,4 | 5,3±5,9 | 0,864 |
| Ratios de pruebas relacionadas | |||||
| T4 libre/TSH | 0,32±3,70 | 0,38±3,70 | 0,57±3,70 | 0,39±0,22 | 0,024* |
| T3 libre/TSH | 0,03±0,03 | 0,03±0,03 | 0,05±0,07 | 0,01±0,02 | 0,050* |
| TGAb/TPOAb | 0,67±0,42 | 0,99±0,82 | 0,68±0,48 | 0,77±0,55 | 0,442 |
DS: desviación estándar; TGAb: anticuerpos frente a la tiroglobulina; TPOAb: anticuerpos antiperoxidasa.
*p≤0,05.
Si cada laboratorio alcanzara las metas indicadas en la bibliografía8,12 para el indicador T4L/TSH, se dejarían de procesar 493.295 pruebas de T4L, lo que hubiera supuesto un coste económico de 937.260,5€ en el año 2012.
DiscusiónEl estudio pone de manifiesto la gran variabilidad existente en España en la solicitud de pruebas de metabolismo tiroideo desde AP. La gran variabilidad que se observa en la solicitud de TSH sugiere que la prueba pueda estar sobreutilizada en determinados departamentos de salud e infrautilizada en otros.
Todos los laboratorios participantes en el estudio, excepto 3, realizaron menos determinaciones de T4L que de TSH. Sin embargo, solo 24 laboratorios alcanzaron la meta descrita para el indicador. También parece sobreutilizada la determinación de los TgAb. La proporción en la solicitud de TgAb parece mayor de lo esperado, aunque en algunas zonas los pacientes con cáncer de tiroides se puedan tratar en AP. Podría indicar que, en algunas regiones, los MAP probablemente estén solicitando estas pruebas inapropiadamente, o que los algoritmos consensuados no se aplican en los laboratorios a pesar de las recomendaciones11.
La variabilidad en la solicitud de pruebas podría ser explicada por diferencias regionales en la disfunción tiroidea, o causadas por diferencias en la prevalencia del déficit de yodo, no siempre uniforme en el país. De hecho, este déficit es más prevalente en algunos departamentos de salud que en otros15–17. Sin embargo, la variabilidad observada es tan elevada que probablemente se deba a razones adicionales.
La solicitud de TSH alcanza el valor de 327,3 pruebas/1.000 habitantes en uno de los departamentos de salud estudiados. Durante años, la solicitud de TSH ha sido promovida8, ya que es una prueba asequible (económica y técnicamente), y permite el diagnóstico de una enfermedad potencialmente grave. Pero, ¿hasta qué punto debe ser potenciada la solicitud? La prueba es muy útil en numerosas situaciones: mujeres mayores de 40 años con síntomas psicológicos/psiquiátricos leves18 o mujeres embarazadas19. Sin embargo, a pesar de la elevada prevalencia de DT son difíciles de entender las elevadas tasas de solicitud de TSH en algunos departamentos de salud. Por otro lado, la solicitud de TSH de 90,8 pruebas/1.000 habitantes parece insuficiente para detectar DT, especialmente en el caso de una población de edad avanzada20–22.
Históricamente, las pruebas tiroideas fueron el primer grupo de pruebas que se procesaron de acuerdo a algoritmos, dependiendo de los resultados de TSH y de T4L. La TSH es la mejor prueba para el cribado de las DT en AP7. De hecho, la mayoría de las sociedades científicas recomiendan la determinación de TSH para la detección de DT en AP, siempre que el ensayo utilizado para la determinación presente una sensibilidad funcional igual o menor a 0,02mIU/l23–25. Es la razón que explica la menor tasa de solicitud de T4L respecto a TSH en la mayoría de los departamentos de salud. Sin embargo, existen 2 departamentos donde la demanda de ambas pruebas sigue manteniendo una relación 1:1, y más de la mitad de los estudiados no alcanzan el valor de 0,25 para el indicador T4L/TSH. La solicitud de T3L fue muy baja y alcanzó el valor de 0,1 propuesto para el indicador T3L/TSH en todos los laboratorios. Esta baja frecuencia de solicitud pone de manifiesto que la determinación de T3L tiene escasa aplicación clínica, aunque en combinación con la medición de T4L puede ser útil para situaciones infrecuentes o complejas de hipertiroidismo y otras situaciones raras. La evaluación de T3L puede ser interesante en el diagnóstico de determinados hipertiroidismos por bocio multinodular, la tirotoxicosis por enfermedad de Graves-Basedow frente a otras causas de hipertiroidismo, en la evaluación de alteraciones tiroideas en el contexto de enfermedades graves, en situaciones que cursan con variaciones de las proteínas transportadoras de las hormonas tiroideas, trastornos genéticos del transporte intracelular de las hormonas tiroideas y en la monitorización de tratamientos con hipertiroidismo26.
Es difícil saber si la solicitud observada de TPOAb es adecuada. De hecho, existe controversia acerca de la utilidad de la medida de TgAb para evaluar la presencia de una enfermedad tiroidea autoinmunitaria27. La utilidad de la determinación de TgAb se restringe al seguimiento de pacientes con carcinoma diferenciado de tiroides intervenido. Si bien pueden hallarse elevaciones de los títulos de esta determinación en sujetos con tiroiditis autoinmune. Se halla presente en el 8-36% de la población, pero la determinación únicamente es relevante en el paciente con carcinoma diferenciado de tiroides intervenido28, por lo que parece que está solicitada en exceso, aunque serían necesarios más estudios. El valor del indicador TgAb/TPOAb fue 1 en el 95% de los departamentos de salud estudiados. Este resultado pone de manifiesto que los profesionales de laboratorio, en consenso con los endocrinólogos y los MAP, deben aunar esfuerzos para lograr una solicitud adecuada mediante el diseño y establecimiento de protocolos para un manejo óptimo y rentable del paciente con DT.
El estudio no muestra diferencias en las tasas de solicitud entre los departamentos de salud urbanos, rurales o urbanos-rurales, excepto en TSH que resultó significativamente menos solicitada en los urbanos-rurales. Podría explicarse por una población de mayor edad en estos departamentos de salud, hábitos de solicitud de los MAP o menor derivación a endocrinología.
Los resultados significativamente más altos en los indicadores T3L/1.000 habitantes, T3L/TSH y TgAb/TPOAb en las instituciones con gestión privada podrían evidenciar una menor eficiencia en la aplicación de los algoritmos de pruebas de función y autoinmunidad tiroidea en estas instituciones con respecto a las de gestión pública. Por otro lado, una población más envejecida podría explicar los resultados más altos de los indicadores T4L/TSH y T3L/TSH en Castilla-León cuando se compara con el resto de regiones29.
El ahorro económico que podría haberse obtenido si el indicador T4L/TSH hubiera alcanzado la meta propuesta es elevado. De acuerdo con otros autores «la colaboración entre los MAP, profesionales de laboratorio, y expertos en bioinformática podría generar herramientas electrónicas para hacer frente a los desafíos mostrados en este estudio, y así aumentar la seguridad, la eficacia, la eficiencia y la disminución del coste de las pruebas de laboratorio clínico»30.
Nuestro estudio presenta ciertas limitaciones. En primer lugar, las diferencias entre la solicitud de pruebas de laboratorio entre las diversas regiones en España pueden ser en parte explicadas por el mayor o menor manejo de la enfermedad tiroidea por los MAP en los departamentos de salud estudiados, por las variaciones de enfermedad entre regiones, e incluso por las diferencias en el déficit de yodo entre departamentos, pues no se ha analizado si hay asociación entre las variaciones de la demanda y el déficit de yodo. En segundo lugar, no ha sido posible determinar si las pruebas estudiadas fueron todas solicitadas individualmente por los MAP o si la política de solicitud del laboratorio (perfiles de solicitud o algoritmos) ha influido en los datos de forma que reflejen más las prácticas de laboratorio que el comportamiento clínico. Por último, es difícil conocer si existe sobre o infrautilización de pruebas sin tener en consideración los datos clínicos de los pacientes. Se desconoce la causa de la solicitud; si se realiza para cribado de población con otros problemas, como síntomas generales inespecíficos, amenorrea, obesidad, etc.; si por disfunción tiroidea clara o como seguimiento de la misma bajo el tratamiento correspondiente. Únicamente se puede presuponer que si las solicitudes son realizadas desde AP el motivo principal sea para el diagnóstico o seguimiento de hipotiroidismo primario. También se desconoce si los resultados obtenidos van a ser utilizados para iniciar tratamiento, derivar a un especialista o simplemente para tener los datos en la historia.
De hecho, las ratios «ideales» a alcanzar de 0,25 y 0,1 para T4L/TSH y T3L/TSH son consideradas en nuestro estudio como indicadores hipotéticos para indicar el posible ahorro económico, pero carecen realmente de justificación clínica.
Existe una gran variabilidad en la solicitud de pruebas de laboratorio de función y autoinmunidad tiroidea en España, que indica la necesidad de diseñar y establecer intervenciones para mejorar el uso del laboratorio clínico. La cooperación interdepartamental e interregional será crucial para desarrollar protocolos y directrices con el fin de optimizar el uso de las pruebas tiroideas y la decisión clínica.
AgradecimientosEsta investigación ha recibido una beca (Ayudas a la Investigación Ignacio H. de Larramendi) de la Fundación MAPFRE.
Conflicto de interesesNinguno a declarar.
Los miembros del grupo de trabajo para la adecuación en la solicitud de pruebas de laboratorio REDCONLAB son los siguientes: Alfonso Pérez-Martínez (Hospital Morales Meseguer); Amparo Miralles (Hospital de Sagunto); Ana Santo-Quiles (Hospital Virgen de la Salud, Elda); Ángeles Giménez-Marín (Hospital de Antequera); Antonio Buño-Soto (Hospital La Paz, Madrid); Antonio Gómez del Campo (Complejo Asistencial de Ávila); Antonio León-Juste (Hospital Juan Ramón Jiménez, Huelva); Antonio Moro-Ortiz (Hospital de Valme, Sevilla); Begoña Laiz (Hospital Universitario y Politécnico La Fe de Valencia); Berta González-Ponce (HospitalDa Costa, Burela); Carmen Hernando de Larramendi (Hospital Severo Ochoa de Leganés); Carmen Vinuesa (Hospital de Vinarós); Cesáreo García-García (Hospital Universitario de Salamanca); Consuelo Tormo (Hospital General Universitario de Elche); Cristina Santos-Rubio (Hospital Río Tinto, Huelva); Cristóbal Avivar (Hospital de Poniente, El Ejido); Diego Benítez Benítez (Hospital de Orihuela); Eduardo Sánchez-Fernández (Hospital del Vinalopo, Elche); Emilia Moreno-Noguero (Hospital Can Misses); Enrique Rodríguez-Borja (Hospital Clínico Universitario de Valencia); Esther Roldán-Fontana (Hospital La Merced. Área de Gestión Sanitaria Sevilla Este); Fco. Javier Martín Oncina (Hospital Virgen del Puerto de Plasencia, Cáceres); Félix Gascón (Hospital Valle de los Pedroches, Pozoblanco); Fidel Velasco Peña (Hospital Virgen de Altagracia, Manzanares); Goitzane Marcaida (Consorcio Hospital General Universitario de Valencia); Inmaculada Domínguez-Pascual (Hospital General Universitario Virgen del Rocío, Sevilla); Isidoro Herrera Contreras (Complejo Hospitalario de Jaén); José Luis Barberà (Hospital de Manises); José Luis Quilez Fernández (Hospital Universitario Reina Sofía de Murcia); José Luis Ribes-Vallés (Hospital de Manacor); José Miguel González Redondo (Hospital Santiago Apóstol de Miranda de Ebro); José Sastre (Hospital Virgen de los Lirios, Alcoy); José Antonio Ferrero (Hospital General de Castellón); José Vicente García-Lario (Hospital Virgen de las Nieves, Granada); Juan Ignacio Molinos (Hospital Sierrallana, Torrelavega); Juan Molina (Hospital Comarcal de La Marina, Villajoyosa); Julián Diaz (Hospital Francesc de Borja, Gandía); Laura Navarro Casado (Complejo Hospitalario Universitario de Albacete); Leopoldo Martín-Martín (Hospital General de La Palma); Lola Máiz Suárez (Hospital Universitario Lucus Augusti, HULA, Lugo); M. Dolores Calvo (Hospital Clínico de Valladolid); M. Amalia Andrade-Olivie (Hospital Xeral-Cíes, CHU Vigo); M. Ángeles Rodríguez-Rodríguez (Complejo Asistencial de Palencia); M. Carmen Gallego Ramírez (Hospital Rafael Méndez, Lorca); M. Mercedes Herranz-Puebla (Hospital Universitario de Getafe); M. Victoria Poncela-García (Hospital Universitario de Burgos); Mª José Baz (Hospital de Llerena, Badajoz); Mª José Martínez-Llopis (Hospital de Denia); Mabel Llovet (Hospital Verge de la Cinta, Tortosa); Mamen Lorenzo (Hospital de Puertollano); Marcos López-Hoyos (Hospital Universitario Marqués de Valdecilla); María José Zaro (Hospital Don Benito-Villanueva); Mario Ortuño (Hospital Universitario La Ribera); Marisa Graells (Hospital General Universitario de Alicante); Marta García-Collía (Hospital Ramón y Cajal, Madrid); Martín Yago (Hospital de Requena); Mercedes Muros (Hospital Nuestra Señora de la Candelaria, Tenerife); Nuria Estañ (Hospital Dr. Peset, Valencia); Nuria Fernández-García (Hospital Universitario Río Hortega, Valladolid); Pilar García-Chico Sepúlveda (Hospital General Universitario de Ciudad Real); Ruth González Tamayo (Hospital de Torrevieja); Silvia Pesudo (Hospital La Plana); Vicente Granizo-Domínguez (Hospital Universitario de Guadalajara); Vicente Villamandos-Nicás (Hospital Santos Reyes, Aranda del Duero); Vidal Pérez-Valero (Hospital Regional de Málaga). Ricardo Franquelo (Hospital Virgen de la Luz, Cuenca); Luis Rabadán (Complejo Asistencial de Soria); Concepción Magadán (Hospital Arquitecto Marcide); Fernando Rodriguez Cantalejo (Hospital Universitario Reina Sofia, Cordoba); Francisco Miralles (Hospital Lluis Alcanyis, Xativa); Ignacio Arribas (Hospital Universitario Principe de Asturias); Juan Ramon Martinez Ingles (Hospital Santa Lucia, Cartagena); Raquel Blazquez (Hospital Universitario de Mostoles); Maria Luisa Lopez Yepes (Hospital Virgen del Castillo, Yecla); Maria Teresa Avello (Hospital San Agustín-Aviles).