INTRODUCCIÓN
Dada la estrecha relación entre la malnutrición y la morbimortalidad1-3, nadie cuestiona en estos momentos la importancia de indicar un soporte nutricional en los pacientes incapaces de cubrir sus requerimientos con la alimentación convencional. Como se ha visto en el capítulo anterior, está demostrada la utilidad, en determinadas situaciones clínicas, de la administración por vía oral de suplementos nutricionales que complementan una ingesta insuficiente a través de la dieta4. Sin embargo, en múltiples circunstancias, la vía oral no puede o no debe utilizarse, y entonces se plantea la necesidad de recurrir al uso de la nutrición artificial, bien por vía enteral (NE), bien por vía parenteral (NP). La elección de una u otra vía está determinada por la posibilidad de utilizar, con seguridad y eficacia, el tracto digestivo. La decisión en muchos casos no presenta problemas: por ejemplo, NP ante una fístula intestinal de alto débito o NE en la disfagia orofaríngea grave. Sin embargo, hay situaciones en las que el concepto de "intestino utilizable" no está claro, y es en estas circunstancias cuando se plantea la controversia. Contraindicaciones consideradas como absolutas hace escasos años para indicar una NE, no parecen actualmente tan claras, como es el caso de las pancreatitis agudas graves o el postoperatorio inmediato de cirugía mayor abdominal. En ambas situaciones clínicas, y a la vista de los últimos estudios publicados5,6, la NE no sólo puede ser bien tolerada sino que, además, puede tener efectos beneficiosos en la evolución del paciente y disminuir la morbilidad en comparación con el uso de la NP.
Ha sido precisamente esa menor asociación con complicaciones, especialmente infecciosas, uno de los argumentos que se han esgrimido más frecuentemente para apoyar el uso preferente de la NE frente a la NP (tabla 1). Sin embargo, en 1998 Lipman7 publicó una revisión sistemática de la bibliografía sobre las supuestas ventajas de la NE respecto a la NP, cuyas conclusiones fueron, en cierta medida, desconcertantes: la NE no parece más eficaz ni más segura que la NP y su única ventaja sobre la NP es su menor coste.
Desde esa fecha han aparecido múltiples estudios y metaanálisis en que se compara el uso de un soporte nutricional (NE o NP) frente a medidas convencionales o la utilización de la vía enteral en comparación con la parenteral, con resultados contradictorios, dependiendo en gran medida de la enfermedad que condiciona el soporte nutricional, el momento en que se inicia ese soporte, la metodología utilizada y los objetivos establecidos, entre otros muchos factores.
OBJETIVOS
A la vista de todo lo anterior, nos propusimos hacer una revisión de los puntos más controvertidos a la hora de plantear un soporte nutricional para, posteriormente y en función de los resultados obtenidos, valorar si existen en la actualidad niveles de evidencia suficientes que permitan llevar a cabo las recomendaciones oportunas, como qué pacientes necesitan realmente un soporte nutricional, en qué momento debe iniciarse, cuáles son las verdaderas ventajas de utilizar la vía digestiva, cuáles los problemas asociados a la nutrición artificial y si pueden existir planteamientos que permitan implementar los beneficios del soporte nutricional y disminuir las complicaciones, sea cual sea la vía utilizada.
MÉTODOS
En una primera fase se ha realizado una búsqueda bibliográfica a través de PubMed y la Cochrane Library, utilizando los términos MeSH malnutrition, nutritional support, enteral nutrition, parenteral nutrition, bacterial translocation, con la única limitación de que fuesen trabajos realizados en pacientes adultos. Se seleccionaron los metaanálisis (MA) y estudios prospectivos aleatorios (EPA) que hiciesen referencia a soporte nutricional artificial (enteral o parenteral) en distintas enfermedades (surgery, burns, critically ill, trauma, head injury, cancer, gastrointestinal diseases, bone marrow transplantation) valorando su repercusión en la evolución clínica (mortalidad, morbilidad, tiempo medio de estancia hospitalaria) y excluyendo los trabajos que utilizasen fórmulas que no fueran estándar (p. ej., inmunomoduladoras o suplementadas en glutamina). También se incluyeron las revisiones y las guías de práctica clínica que hiciesen alusión a estos mismos temas. Por último, esa búsqueda se amplió de modo manual, a través fundamentalmente de las referencias bibliográficas de los artículos seleccionados.
VALORACIÓN DE LA BÚSQUEDA
Una vez revisados los artículos seleccionados, en primer lugar debemos destacar varias circunstancias que, necesariamente, influyen a la hora de obtener conclusiones con el nivel de evidencia deseado8,9. La mayoría de los EPA tienen un número insuficiente de casos, con una calidad metodológica baja en muchos de ellos. La información es incompleta tanto del procedimiento seguido para la aleatorización como de la definición de complicaciones, de los objetivos principales y secundarios o del estado de nutrición previo. Se suelen además incluir pacientes con enfermedad de base diferente y distinto grado de gravedad de la enfermedad y de la malnutrición, circunstancias todas ellas que pueden influir en la respuesta al soporte nutricional. A este respecto, nos parece muy adecuado el diseño del estudio de Bozetti et al5 en que se compara la NE con la NP exclusivamente en pacientes malnutridos poscirugía de cáncer gastrointestinal.
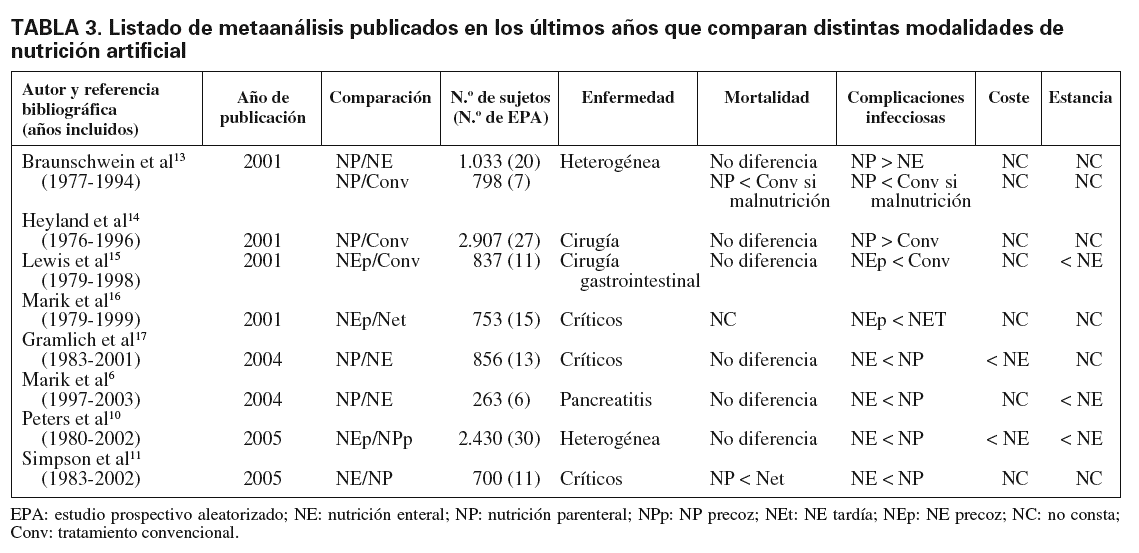
Si la interpretación de los EPA debe hacerse con cautela, obviamente las limitaciones que se presentan con los MA son aún mayores (tabla 2), y éste es un hecho unánimemente aceptado por numerosos autores10,11. Uno de los puntos que cabe destacar es que, dados los avances realizados en los últimos 15 años, fundamentalmente en el conocimiento, la tecnología y el manejo tanto de la NE como de la NP, es difícil poder comparar ensayos realizados en muy diferentes épocas del desarrollo del soporte nutricional12. Por otro lado, el concepto de NE precoz es extremadamente variable de un grupo de trabajo a otro (de 6 a 96 h desde el ingreso o la intervención), no todos los ensayos incluidos plantean los mismos objetivos principales y secundarios y, evidentemente, la enfermedad de cada uno de ellos es muy heterogénea. Los últimos metaanálisis publicados (tabla 3) siguen poniendo de manifiesto estas mismas características6,10,11,13-17, incluso en los que, aparentemente, se refieren a un grupo homogéneo de pacientes, como es el caso del realizado por Marik y Zaloga6 en la pancreatitis aguda en que se compara la NE con la NP, ya que se incluye a pacientes con diferentes grados de gravedad de la enfermedad, en muchos de los cuales el soporte nutricional no estaría indicado.
Pese a todas estas objeciones, es indudable que se pueden, y se deben, obtener conclusiones útiles para apoyar las decisiones clínicas y, sobre todo, para plantear estrategias futuras a la hora de realizar ensayos clínicos de calidad que permitan esclarecer los aspectos más conflictivos del soporte nutricional.
RESULTADOS
Indicaciones del soporte nutricional. Para quién y cuándo iniciarlo
Está unánimemente aceptado, y así queda reflejado en la mayoría de las guías de práctica clínica de las distintas sociedades internacionales de nutrición18-21, que los pacientes con buen estado de nutrición, en los que se estime que podrán reanudar una ingesta oral adecuada en el plazo de 7-10 días, no se benefician de la indicación de un soporte nutricional. Esta afirmación se basa en los resultados de los ensayos clínicos realizados en que se compara la administración de NP con los cuidados postoperatorios convencionales. En la mayoría de ellos, y como se pone de manifiesto en los distintos metaanálisis publicados12-14,21, no se aprecia disminución de la tasa de mortalidad; en cambio, el riesgo de complicaciones infecciosas es significativamente mayor. Sin embargo, el metaanálisis publicado en 2001 por Lewis et al15, en que revisaron 11 estudios prospectivos aleatorizados (837 pacientes, todos ellos sometidos a cirugía abdominal selectiva) comparando la evolución clínica según se administrase NE precoz o cuidados convencionales, parece demostrar que los beneficios de ese soporte nutricional son significativos. Este trabajo muestra un menor riesgo de infecciones y un menor tiempo de estancia hospitalaria, independientemente del estado de nutrición previo. Los autores concluyen que, a pesar de las limitaciones de este metaanálisis (escaso número de pacientes y dudosa calidad metodológica de alguno de los ensayos incluidos), la alimentación precoz de este tipo de pacientes puede ser de utilidad. Se abre, pues, la posibilidad de poder mejorar la evolución clínica de los pacientes bien nutridos al indicar un soporte nutricional por vía enteral.
Respecto a los pacientes malnutridos, el soporte nutricional perioperatorio ha demostrado disminuir la morbimortalidad en la mayoría de los estudios publicados, tanto con NE como con NP5,13,14,22.
En el grupo de pacientes en los que, debido a unos re querimientos nutricionales incrementados, el riesgo de malnutrición es importante (como es el caso de los enfermos críticos), la reciente revisión de Simpson et al11 parece demostrar que el soporte nutricional precoz, entendiendo como tal el iniciado en las primeras 24 h del ingreso del paciente en la unidad de cuidados intensivos (sea cual sea la vía utilizada), disminuye la mortalidad. Los propios autores advierten que los ensayos incluidos en este metaanálisis constituyen un nivel II de evidencia, con las limitaciones que esto implica.
Sería, pues, conveniente poder disponer de un sistema clasificatorio sencillo y fácilmente reproducible que permitiera identificar a los pacientes que puedan beneficiarse más del soporte nutricional, los malnutridos y los que presentan un riesgo elevado de malnutrición. A este respecto, nos parece muy interesante el artículo publicado por Kondrup et al en el contexto de un grupo de trabajo de la ESPEN23 en el que revisa 128 EPA, con 8.944 pacientes. Aplicando un sistema numérico en función de la presencia o no de malnutrición y del grado de gravedad de la enfermedad, la mayoría de los EPA que muestran un efecto positivo del soporte nutricional son aquellos en los que se incluyen pacientes más graves y con peor estado de nutrición.
El momento más adecuado para iniciar el soporte nutricional ha estado determinado, hasta ahora, en gran medida, por los inconvenientes atribuidos a cada una de las vías de administración (enteral o parenteral). Ya se ha comentado la mayor tasa de complicaciones infecciosas asociadas a la NP en diversas situaciones clínicas. Respecto a la NE, la presencia de un íleo postoperatorio tras la cirugía abdominal ha sido uno de los motivos esgrimidos para retrasar la utilización de la vía digestiva en el postoperatorio inmediato, ante el riesgo de incremento de las complicaciones, especialmente intolerancia digestiva y dehiscencia de las anastomosis. Sin embargo, los datos disponibles en estos momentos parecen demostrar que, al contrario, la presencia de nutrientes en la luz intestinal (dieta oral o NE) desempeñaría un papel decisivo en la recuperación de la función gastrointestinal poscirugía, estimulando mediante un mecanismo reflejo una actividad peristáltica coordinada y facilitando la secreción de hormonas gastrointestinales, con un efecto global positivo sobre la motilidad intestinal24. Dado que la repercusión clínica del íleo postoperatorio es muy variable de un paciente a otro y que su patogenia es multifactorial, se aconseja en la actualidad aplicar una estrategia multimodal para intentar controlar el íleo de la cirugía abdominal25. Para ello se recomienda una menor y más cuidadosa manipulación del intestino, evitando el uso sistemático de sondas nasogástricas de aspiración, utilizando de preferencia anestesia local o regional, limitando el uso de los analgésicos opiáceos y favoreciendo la movilización precoz de los pacientes. Esto permitiría, en un buen número de casos, utilizar la vía digestiva (oral o enteral) más precozmente, disminuyendo la morbilidad y el tiempo de estancia hospitalaria
Cuando se trata de pacientes críticamente enfermos, tampoco hay acuerdo respecto al momento idóneo de iniciar el soporte nutricional, según se deduce de las recomendaciones de las distintas sociedades científicas de nutrición26-28 y que suelen basarse en el grado de hipercatabolismo o en la previsión de días de ayuno. Sin embargo, si tenemos en cuenta los resultados de los últimos estudios publicados y si consideramos al soporte nutricional no sólo como un medio para mantener un adecuado estado de nutrición, sino como una herramienta farmacológica para controlar la respuesta a la agresión, su indicación precoz en los pacientes de la UCI podría tener efectos beneficiosos.
Ventajas de la vía enteral
Los argumentos a favor de la utilización de la NE frente a la NP han ido ligados especialmente a 3 aspectos fundamentales: la absorción y la digestión de los nutrientes se realizan de manera más fisiológica, es más barata y presenta una menor tasa de complicaciones infecciosas29-32. Este último punto ha sido, y sigue siendo, objeto de múltiples especulaciones. Una de las teorías barajadas es la de que con la NP, la falta de nutrientes en la luz intestinal produciría una alteración en la estructura y la función de la mucosa del intestino, aumentando su permeabilidad y facilitando así el paso de bacterias o de sustancias tóxicas a la circulación sistémica (translocación bacteriana), con la posible aparición de infecciones a distancia y dando lugar, en los casos más extremos, al desarrollo del fallo multiorgánico. Se ha confirmado, mediante el cultivo de ganglios linfáticos mesentéricos33, la existencia en humanos de la translocación bacteriana, aunque sin poderla relacionar, hasta el momento, con consecuencias clínicas relevantes. Por otro lado, varios estudios también han confirmado un aumento de la permeabilidad de la mucosa, medida por el cociente de excreción urinaria de lactulosa y manitol, inmediatamente después de la cirugía mayor abdominal34 y en grandes quemados35, lo que se corrige más rápidamente con la administración de nutrientes en la luz intestinal que con su administración por vía parenteral. Sin embargo, no se ha podido relacionar claramente el aumento de la permeabilidad con la aparición de traslocación bacteriana, por lo que su significado es incierto.
Ante la inconsistencia de estos datos, actualmente está adquiriendo mayor relevancia la hipótesis de que, ante una agresión grave de cualquier tipo (p. ej., quirúrgica o traumática), se produciría una alteración en la síntesis y transporte de la IgA no sólo en la mucosa intestinal, sino en todo el tejido linfático asociado a la mucosa (MALT) del organismo36. El mecanismo consistiría en un desequilibrio entre las citocinas que controlan la maduración de los linfocitos, especialmente una menor liberación de la interleucina (IL) 4, con una menor producción de CD-4, lo que facilitaría la aparición de neumonías y abscesos intraabdominales. La administración de una dieta enteral compleja mantiene, en estudios realizados con animales37, la integridad de la función inmunitaria de las mucosas, mientras que la falta de nutrientes en el tubo digestivo, como ocurre en la NP, conduce rápidamente a una alteración del tejido linfoide asociado al intestino (GALT), y predispone a la aparición de infecciones remotas y fallo multisistémico.
Además, la estimulación de la secreción de los neuropéptidos intestinales producida por la NE, fundamentalmente la colecistocinina (CCK), la neurotensina y el péptido liberador de gastrina, podrían contribuir a mantener la inmunidad de la mucosa38.
Un estudio realizado en 26 pacientes tras resección hepática masiva39, parece confirmar esta hipótesis al observar que los parámetros inmunológicos se mantienen en concentraciones significativamente más elevadas en los pacientes tratados con NE que en los tratados con NP, y en este último grupo se aprecia una tasa de complicaciones infecciosas significativamente mayor.
Complicaciones del soporte nutricional
En todos los metaanálisis revisados que hacen referencia al riesgo de infecciones dependientes de la vía de soporte utilizada, se observa que las complicaciones infecciosas son significativamente menores con la NE, sin poder concluir si este resultado es un efecto protector de la NE o, por el contrario, se trata de una complicación asociada a la NP. Desde hace años se conoce la relación existente entre la hiperglucemia y las alteraciones en la quimiotaxis y fagocitosis de los neutrófilos, lo que facilitaría la aparición de procesos infecciosos40. También es conocido que la NP se acompaña, con mayor frecuencia que la NE, de elevación de las cifras de glucemia. La publicación en 2001 de un EPA realizado en 1.548 pacientes, ingresados en una UCI quirúrgica y sometidos a ventilación mecánica, ha causado un importante impacto en la comunidad científica al objetivarse que un estricto control glucémico disminuye significativamente, en este tipo de pacientes, tanto las complicaciones infecciosas (en un 46%) como la mortalidad durante toda la estancia hospitalaria (en un 34%) en comparación con el tratamiento convencional41. Parece pues razonable, y a la espera de confirmar este resultado en otro tipo de pacientes, mantener controlados los valores de glucemia desde el mismo momento en que se inicie el soporte nutricional42.
Respecto a la NE, la complicación más grave que se ha relacionado con este tipo de soporte es el mayor riesgo de neumonía por aspiración. Se ha especulado que la administración pospilórica de los preparados enterales en comparación con la NE gástrica disminuiría la frecuencia de dicha complicación. Las 2 revisiones sistemáticas publicadas en el 2003, y referidas ambas a pacientes críticamente enfermos (médicos y quirúrgicos), no aportan datos suficientes para apoyar este supuesto. Marik y Zaloga43, valorando los resultados de 7 EPA que incluyen a 422 pacientes, no encuentran diferencias significativas en la incidencia de neumonía entre ambos grupos. Heyland et al44, en su metaanálisis de 9 estudios con 523 pacientes, hallan inicialmente una significación estadística a favor de un menor riesgo al utilizar la vía pospilórica, que desaparece al eliminar el estudio en el que dicho efecto era dominante. Otro de los factores que se han relacionado con el mayor riesgo de neumonía por aspiración ha sido la posición del paciente al administrar la NE. Sólo hemos encontrado un EPA45 en el que se aprecia una disminución significativa del riesgo de neumonía al mantener a los pacientes en posición semiincorporada en comparación con el decúbito supino.
La dificultad en el acceso al tracto gastrointestinal, sobre todo cuando se plantea una nutrición pospilórica, y la relativa frecuencia de problemas relacionados con intolerancia digestiva (vómitos, diarrea), han sido otros argumentos utilizados para desestimar la indicación de la NE en multitud de situaciones clínicas. En el primer caso, la dificultad en la colocación de la sonda suele reducirse significativamente en función de la experiencia y la habilidad del equipo responsable, seleccionando en cada caso la vía de acceso y la técnica más adecuadas46. La administración de procinéticos no mejora el vaciamiento gástrico y, por tanto, la tolerancia a la NE, según se deduce de la revisión realizada por Alpers47. Sin embargo, la aplicación de protocolos rigurosos demuestra que la intolerancia digestiva puede disminuirse significativamente48,49.
CONCLUSIONES
La interpretación de todos los estudios revisados no permite establecer ningún nivel I de evidencia, y por tanto obtener un grado de recomendación A, a la hora de plantear, de modo global, y para una población heterogénea de pacientes, cuál es el momento más adecuado y la vía más segura y eficaz del soporte nutricional. Entre todos los datos valorados parece confirmarse que la NE, sobre todo cuando se indica precozmente, disminuye significativamente las complicaciones infecciosas y mejora la evolución de los pacientes; los que están malnutridos y aquellos en riesgo de padecer malnutrición son quienes más se benefician del soporte nutricional (tabla 4).
Sin embargo, tal y como se apuntaba al justificar la valoración de la revisión de la bibliografía, es necesario mejorar la calidad de los ensayos clínicos, con objeto de poder obtener conclusiones más valorables, como queda reflejado en la publicación de Stratton et al50.