Los requerimientos de levotiroxina de los pacientes con hipotiroidismo suelen ser estables y por ello se recomienda control de la función tiroidea 1 o 2 veces al año. Las dosis de levotiroxina ocasionalmente pueden variar por interacciones farmacológicas.
Presentamos el caso de una paciente que requirió ajuste de la dosis de levotiroxina al iniciar el tratamiento con imatinib. Mujer de 59 años en tratamiento con levotiroxina por hipotiroidismo secundario a tiroidectomía subtotal con buen control clínico y analítico. Tras ser diagnosticada de leucemia mieloide crónica y ser tratada con imatinib, presentó clínica y bioquímica compatible con hipotiroidismo, que precisó un aumento de la dosis de levotiroxina para mantener la función tiroidea normal.
Recientemente se ha descrito algún caso de hipotiroidismo al añadir imatinib a pacientes en tratamiento sustitutivo con levotiroxina. Este nuevo caso avala la interacción de ambos fármacos. Por lo tanto, comentamos los posible mecanismos fisiopatológicos que contribuyen a que el imatinib induzca el hipotiroidismo en pacientes en tratamiento sustitutivo con hormona tiroidea.
Levothyroxine requirements in patients with hypothyroidism are usually stable. Consequently, thyroid function is usually monitored once or twice yearly. Occasionally, the dose of levothyroxine can be changed by pharmacological reactions.
We report the case of a 59-year-old woman who was under levothyroxine therapy for hypothyroidism secondary to subtotal thyroidectomy, with clinical and biochemical euthyroidism, who required an increased dose of levothyroxine after starting imatinib therapy. The patient was diagnosed with chronic myeloid leukemia and imatinib therapy was started. Subsequently, we observed clinical and biochemical hypothyroidism, requiring an increase in levothyroxine dose.
Some cases of hypothyroidism after initiation of imatinib therapy in patients with levothyroxine replacement therapy have recently been published. Our case provides further evidence of a reaction between the two drugs. Therefore, we discuss the most likely physiopathological mechanisms contributing to imatinib-induced hypothyroidism in patients under levothyroxine replacement therapy.
Los pacientes con hipotiroidismo primario requieren normalmente un tratamiento sustitutivo de por vida. Por esta razón, es frecuente que a lo largo de los años se añadan, por otras enfermedades, múltiples medicaciones que, potencialmente, pueden afectar a la efectividad o al buen cumplimiento de dicho tratamiento.
A medida que el desarrollo de nuevos fármacos facilita la terapia de diversas enfermedades de tratamiento complejo, la aparición de determinadas interacciones medicamentosas es cada vez más frecuente. Ya sea por su trascendencia clínica o por la elevada prevalencia de los procesos tratados, se requiere por parte del clínico de un alto grado de alerta, con el fin de poder actuar de una manera precoz en su diagnóstico y tratamiento.
Presentamos el caso de una paciente tiroidectomizada por un carcinoma diferenciado, afecta de leucemia mieloide crónica (LMC) en tratamiento con imatinib (Glivec®) que, a pesar del tratamiento sustitutivo con hormona tiroidea que recibía, desarrolló hipotiroidismo grave.
CASO CLÍNICOSe trata de una paciente de 59 años con antecedentes familiares paternos y maternos de diabetes mellitus tipo 2 y una hija con hipotiroidismo primario por tiroiditis crónica atrófica. Entre sus antecedentes personales destacaban alergia a penicilina y povidona yodada, apendicectomía, histerectomía con doble anexectomía por fibromas uterinos y tiroidectomía total hacía 3 años por bocio multinodular. El estudio preoperatorio mostraba en la ecografía tiroidea un nódulo predominante de 28 × 26 × 21 mm en el lóbulo derecho y otro más pequeño de 11 mm de diámetro máximo en el lóbulo izquierdo, cuya punción-aspiración con aguja fina resultó ser sospechosa de carcinoma papilar.
Tras una tiroidectomía total, en el estudio anatomopatológico se confirmó un carcinoma papilar de tiroides por lo que se asoció una dosis ablativa posquirúrgica de 102 mCi de yodo 131I. Se realizaron 2 rastreos corporales anuales con yodo 131I que fueron negativos. Con una dosis diaria de levotiroxina de 150 μg/día la paciente presentaba, en diversas revisiones, concentraciones de T4 de 1,4 ng/dl (valores normales, 0,58-1,64) y de tirotropina (TSH) de 0,08 μU/ml (0,34-5,60).
Ante la persistencia de concentraciones de tiroglobulina en torno a 4 y 6 ng/ml (recomendación, < 1 ng/ml), con una tomografía computarizada cérvico-torácica normal, se planteó la realización de una tomografía por emisión de positrones (PET) para descartar metástasis no captantes del carcinoma tiroideo. La PET no evidenció signos de recidiva local, pero mostró hipercatabolismo generalizado del esqueleto axial, especialmente de ambas articulaciones sacroilíacas, así como en la cabeza y la diáfisis proximal del húmero derecho y ambas cabezas y diáfisis femorales, indicativo de infiltración difusa en médula ósea. La paciente sólo refería dolores óseos generalizados y prurito cutáneo.
Se realizó un estudio analítico con los siguientes resultados: 49.000 leucocitos /ml (3.800-10.000), 900.000 plaquetas/ml (125.000-450.000); hemoglobina, 11,4 g/l (11,5-15,5); hematocrito, 35% (35-47); velocidad de sedimentación globular, 21 mm/primera hora (0-20). En el análisis bioquímico general destacaban uricemia de 6,2 mg/dl (10-50), lactato deshidrogenasa de 434 U/l y vitamina B12 de 1.090 pg/ml; los valores de glucosa, urea, creatinina, colesterol, triglicéridos, transaminasas, bilirrubina, fosfatasa alcalina, calcio y fósforo estaban dentro de la normalidad.
Ante la sospecha de síndrome mieloproliferativo crónico, se remitió a la paciente a la consulta de hematología, donde se solicitaron nuevas pruebas complementarias, incluido estudio proteínico, con proteinemia de 6,4 mg/dl (6,1-7,9); inmunoglobulina (Ig) G, 9.767 mg/dl (560-1.800); IgA, 50 mg/dl (100-400); IgM, 101 mg/dl (45-250), y beta-2-microglobulina, 2,5 μg/ml (< 2,5), con un patrón férrico normal. Una ecografía abdominal puso de manifiesto moderada hepatomegalia homogénea y esplenomegalia de 15 cm en su eje longitudinal. La biopsia ósea fue compatible con LMC, con el oncogén ABL/BCL por hibridación in situ positivo al 97%.
Con el diagnóstico de LMC se inició tratamiento con 800 mg/día de imatinib y 300 mg/día de alopurinol. La paciente presentó mejoría clínica y analítica; refirió efectos secundarios moderados, como edema facial, caída de pelo, ganancia ponderal de 2-3 kg de peso y astenia intensa, por lo cual se inició tratamiento con furosemida 20 mg/día.
A los 6 meses de tratamiento se pudo reducir la dosis de imatinib a 400 mg/día. La paciente permanece en remisión con hemograma normal y cromosoma Ph positivo al 1%.
A los 8 meses de tratamiento se midieron las concentraciones hormonales de la función tiroidea, con el siguiente resultado: tirotropina (TSH) de 62,71 mU/ml y T4L de 0,6 ng/dl, por lo que fue remitida a nuestro servicio. La paciente negaba haber omitido ninguna dosis de levotiroxina y se descartó la toma de otros fármacos que pudiesen interferir con la absorción de levotiroxina. La exploración física puso de manifiesto: peso de 68 kg y talla de 165 cm, con índice de masa corporal de 25. Presentaba presión arterial de 120/75 mmHg, frecuencia cardíaca de 65 lat/min y temperatura axilar de 36 °C. La exploración física objetivó ligero edema facial y en extremidades inferiores y sequedad de piel moderada. El resto de la exploración por aparatos y sistemas fue normal. Ante el hipotiroidismo bioquímicamente grave, estando la paciente en tratamiento con levotiroxina 150 μg/día, se pasó a tratarla con 225 μg/día.
Tras 3 meses de tratamiento con dicha dosis la paciente presentó unas concentraciones de TSH de 36,14 mU/ml y T4L de 0,76 ng/dl con anticuerpos antitiroideos (ATA) negativos y tiroglobulina (Tg) 5,44 ng/ml. Una ecografía tiroidea mostró que no había restos tiroideos y 2 pequeñas adenopatías inespecíficas en la cadena yugular derecha. La radiografía de tórax era normal, y persistía la clínica de astenia, estreñimiento ocasional, tendencia al frío, aumento de peso y edemas, sin clínica local cervical, por lo cual aumentamos la dosis a 250 μg/día.
Se solicitó un nuevo control analítico a los 45 días tras la nueva dosis de levotiroxina, en este caso la paciente presentaba: TSH de 0,24 mU/ml y T4L de 1,88 ng/dl, ATA negativos y descenso de Tg a 1,93 ng/ml. Disminuimos la dosis a 225 mg/día y el control analítico a los 30 días mostró un nuevo descenso de TSH a 0,03 mU/ml y un aumento de T4L a 2,10 ng/dl, con ATA negativos y Tg de 1,11 ng/ml; con el resto de la analítica, incluida bioquímica completa y hemograma, normal. La paciente ha requerido, por tanto, un nuevo descenso de la dosis de levotiroxina a 200 μg/día para conseguir la normofunción tiroidea.
DISCUSIÓNEl hipotiroidismo es una de las enfermedades endocrinológicas más frecuentes en la práctica clínica, y su prevalencia se estima en mujeres mayores de 60 años en torno al 10%1.
El tratamiento de elección es la levotiroxina sódica por vía oral, con el objetivo de restaurar el eutiroidismo clínico y mantener la TSH circulante en los límites de la normalidad2,3.
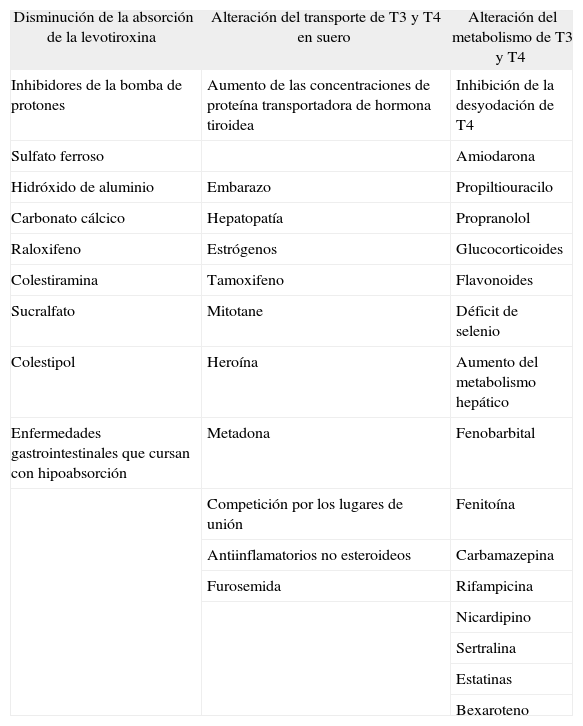
Hay diversos factores que alteran la absorción, el transporte y el metabolismo de T4 y T3, aumentando las necesidades de la hormona tiroidea exógena4. Es bien conocido que el embarazo, el aumento de peso, las hepatopatías crónicas, los síndromes de hipoabsorción y el uso de otras medicaciones pueden, en ocasiones, interferir en la biodisponibilidad de T4, con lo que el paciente precisa de un ajuste de dosis. El mecanismo5 por el cual se altera la absorción de T4 puede ser múltiple (tabla 1).
Mecanismos que puedan alterar el perfil de las hormonas tiroideas
| Disminución de la absorción de la levotiroxina | Alteración del transporte de T3 y T4 en suero | Alteración del metabolismo de T3 y T4 |
| Inhibidores de la bomba de protones | Aumento de las concentraciones de proteína transportadora de hormona tiroidea | Inhibición de la desyodación de T4 |
| Sulfato ferroso | Amiodarona | |
| Hidróxido de aluminio | Embarazo | Propiltiouracilo |
| Carbonato cálcico | Hepatopatía | Propranolol |
| Raloxifeno | Estrógenos | Glucocorticoides |
| Colestiramina | Tamoxifeno | Flavonoides |
| Sucralfato | Mitotane | Déficit de selenio |
| Colestipol | Heroína | Aumento del metabolismo hepático |
| Enfermedades gastrointestinales que cursan con hipoabsorción | Metadona | Fenobarbital |
| Competición por los lugares de unión | Fenitoína | |
| Antiinflamatorios no esteroideos | Carbamazepina | |
| Furosemida | Rifampicina | |
| Nicardipino | ||
| Sertralina | ||
| Estatinas | ||
| Bexaroteno |
La mayoría de los fármacos que afectan al tratamiento con hormona tiroidea son bien conocidos, y es fácil prever la necesidad de un ajuste de dosis. Sin embargo, el cada vez más amplio arsenal terapéutico del que disponemos los clínicos nos muestra interacciones medicamentosas cada vez más frecuentes2,5 y, en ocasiones, inesperadas, como en nuestro caso.
El imatinib es un derivado fenilpirimidínico inhibidor de la tirosincinasa relacionada con el factor de crecimiento plaquetario, el factor de células madre, el oncogén c-kit y el oncogén BCR-ABL del cromosoma Ph 1 de la leucemia mieloide crónica. Impide la transducción de señales, inhibe la proliferación e induce la apoptosis de algunas líneas celulares. Su eficacia ha sido demostrada en la LMC y en tumores de la estroma gastrointestinal, pero también se han realizado estudios en pacientes afectos de carcinoma medular de tiroides (CMT) de acuerdo con observaciones de su posible papel inhibidor in vitro de la tirosincinasa codificada por el protooncogén RET mutado en los casos asociados a CMT6,7.
Sus efectos secundarios son leves y normalmente se solucionan sin reducir la dosis ni suspender el tratamiento8. Por otro lado, se ha descrito que el imatinib podría inducir hipotiroidismo en pacientes en tratamiento sustitutivo con hormona tiroidea, aunque este hecho no está contemplado en la ficha técnica del fármaco. Se ha publicado un estudio9 basado en el tratamiento de pacientes con CMT o carcinoma de la estroma gastrointestinal, que puso de manifiesto que todos los pacientes tiroidectomizados por el CMT presentaban hipotiroidismo grave a los pocos meses de añadir imatinib, requiriendo una dosis del 200% respecto a la dosis previa de levotiroxina. En algunos casos fue preciso incluso el abandono del tratamiento con imatinib por no conseguir normalizar las concentraciones de TSH y tiroxina.
El imatinib no parece afectar a la síntesis o la secreción hormonal tiroideas, porque los individuos con la glándula tiroidea intacta permanecieron eutiroideos durante todo el seguimiento de su tratamiento. Por otro lado, es improbable que imatinib, dado su mecanismo de acción, altere la absorción intestinal de levotiroxina. En este sentido, tampoco la paciente tuvo vómitos inmediatamente después de tomar la levotiroxina y el cumplimiento terapéutico era bueno. Además, las concentraciones de TSH no se normalizaron al variar el momento de la toma del fármaco. En el estudio de De Groot et al9, en muchos casos tampoco al doblar o triplicar la dosis de T4L se normalizó la concentración sérica de TSH. Una inhibición de la desyodación periférica de T4 implicaría un aumento de la T4 sérica y tampoco explicaría lo que ocurre en estos pacientes, en los que las concentraciones permanecen bajas.
¿Cuál es, entonces, la hipótesis más probable para explicar el aumento en las necesidades de T4? El mecanismo de acción más probable para explicar la interacción debe centrarse en el aclaramiento periférico de T4 y T3 no dependiente de desyodasas10. En el metabolismo de la hormona tiroidea, la fracción de T4 que no se metaboliza por la desyodación es conjugada mediante 2 sistemas enzimáticos, el citocromo P450 y el sistema de la uridindifosfato-glucuroniltransferasa. El imatinib es un potente inhibidor de varias enzimas del citocromo P450 (CYP2C9, CYP2D6 y CYP3A4/5)6, por lo que una inducción de la uridindifosfato-glucuroniltransferasa podría ser el mecanismo de acción más probable para explicar el aumento en las necesidades de tratamiento sustitutivo, como se ha descrito con la rifampicina.
Los fármacos inductores de las enzimas hepáticas causan aumento del metabolismo de T4 y T3, hecho que puede ser compensado en pacientes con un tiroides intacto mediante un incremento de la síntesis de hormonas tiroideas. Se ha descrito que las células tirotropas hipofisarias son muy sensibles a las concentraciones hormonales cuando las variaciones en las concentraciones séricas de T3 y T4 se deben a cambios endógenos en la secreción tiroidea4, con lo que pequeños cambios tienen un efecto importante en la secreción de TSH11. Sin embargo, los pacientes tiroidectomizados y, probablemente en menor medida, los sujetos con hipotiroidismo de otra etiología, en tratamiento sustitutivo con levotiroxina, precisan de un incremento de la dosis exógena al ser su tiroides insuficiente para regular este proceso. En el estudio de De Groot et al9 los pacientes precisaron de media un aumento del 100% en la dosis sustitutiva. El caso de nuestra paciente también demuestra un mayor requerimiento de la dosis de levotiroxina al iniciar el tratamiento con imatinib, aunque sólo precisó el 75% de la dosis previa al tratamiento con imatinib para conseguir concentraciones normales de TSH y T4L.
Desafortunadamente, el efecto del imatinib en las uridindifosfato-glucuroniltransferasas no es bien conocido y se necesita más evidencia que demuestre que afecta al metabolismo de la levotiroxina a través de un mecanismo similar a la rifampicina11. Este hecho cobra especial relevancia a la vista de los prometedores resultados in vitro de imatinib en el CMT6,7.
Es difícil discriminar en esta paciente si la clínica de astenia se debe a la alteración hematológica, al hipotiroidismo, a efectos secundarios del imatinib independientes de la función tiroidea o a una mezcla de todos ellos, pero clínicamente se evidenció una mejoría al aumentar la dosis de levotiroxina. A la manera singular de diagnosticarse la alteración hematológica (diagnosticada de LMC a raíz de estudio de extensión del carcinoma papilar) se une en nuestro caso el hecho de haberse detectado una posible interacción medicamentosa entre la levotiroxina y el imatinib. La propia Food and Drug Administration solicita a los clínicos que observen efectos adversos no esperados asociados con el imatinib, dado que el seguimiento de muchos pacientes tratados con dicho fármaco ha sido breve12.
Como conclusión podemos incidir en que es importante tener en cuenta que los pacientes hipotiroideos por tiroidectomía que reciban tratamiento con imatinib requieren de una monitorización exhaustiva de la función tiroidea durante el tratamiento, dado que pueden precisar un incremento de la dosis de levotiroxina. En los pacientes hipotiroideos por causas más comunes, tales como tiroiditis de Hashimoto, se debería monitorizar igualmente la función tiroidea porque es muy probable que también en ellos aumenten los requerimientos de levotiroxina durante el tratamiento con imatinib, aunque son necesarios más estudios para determinar si la interacción de imatinib con levotiroxina es relevante también en este tipo de pacientes.