La prevalencia de la obesidad está aumentando en la mayoría de los países desarrollados debido a los cambios en el estilo de vida, y en el caso de la obesidad grave o moderada con comorbilidades, la cirugía bariátrica tiene una gran relevancia en su tratamiento, aunque implica la necesidad de un seguimiento posterior para prevenir la aparición de déficits nutricionales u otras complicaciones1.
La hipoglucemia posprandrial con hiperinsulinismo tras el bypass gástrico laparoscópico (BGL) es una complicación poco frecuente cuya prevalencia se estima en un 0,2%2. Los 2 casos presentados aquí surgen tras aproximadamente unas 928 intervenciones de cirugía bariátrica, 492 tipo BPG, en nuestro centro desde el año 2000, lo cual equivale a una prevalencia aproximada del 0,4%, ligeramente superior a lo comunicado previamente2. Se caracteriza por aparecer entre las 1-3h tras las comidas y de inicio entre 1-3 años después de la intervención quirúrgica, aunque se han descrito casos de inicio a tan solo 3 meses de la misma3. Los síntomas de neuroglucopenia severa pueden comportar coma hipoglucémico o crisis epilépticas, subrayando la gravedad potencial de este cuadro.
Una mujer de 36 años con antecedentes personales de bypass gástrico realizado en 2005, debido a obesidad grave (peso prequirúrgico 114kg, IMC 51kg/m2), acudió a nuestras consultas 2 años tras la intervención describiendo episodios de hipoglucemia 2 horas tras la ingesta. Estos episodios eran autolimitados en ocasiones o se resolvían con ingesta de azúcar en otras. En aquel momento la paciente pesaba 79,2kg, siendo este el peso mínimo alcanzado tras la cirugía. Durante los 2 años siguientes, los episodios hipoglucémicos aumentaron en gravedad y frecuencia precisando atención familiar en el domicilio debido a deterioro del nivel de conciencia en algunas ocasiones aunque no precisó acudir a urgencias. Desde el punto de vista diagnóstico, se realizó un test de ayuno de 72h hasta en 2 ocasiones, no mostrando resultados patológicos. Un test de estimulación con ACTH descartó insuficiencia suprarrenal. Se realizó una TC de abdomen que no mostró hallazgos patológicos. Se realizó también un test de tolerancia a la glucosa que mostró hipoglucemia e hiperinsulinemia. Finalmente, se realizó un cateterismo pancreático con test de estimulación selectiva con calcio, siendo sus resultados compatibles con hiperplasia de células beta pancreáticas (tabla 1). En cuanto al manejo, se inició tratamiento con acarbosa, aunque sin resultado. Posteriormente se probó con octreótide de acción prolongada (10mg al mes), que produjo tan solo una respuesta parcial y limitada en el tiempo. Finalmente se inició diazóxido a dosis ascendentes hasta alcanzar la máxima para control de las hipoglucemias y se remitió a la paciente al servicio de cirugía general para realización de pancreatectomía corporocaudal. La ecografía intraoperatoria no mostró ninguna tumoración. El resultado anátomopatológico describió hiperplasia difusa de células endocrinas en los islotes de Langerhans y en los ductos pancreáticos, compatible con nesidioblastosis. La paciente retomó tras la cirugía una dieta fraccionada y ha permanecido asintomática 18 meses tras la intervención quirúrgica con cifras de glucemia dentro de la normalidad y sin más episodios de hipoglucemia.
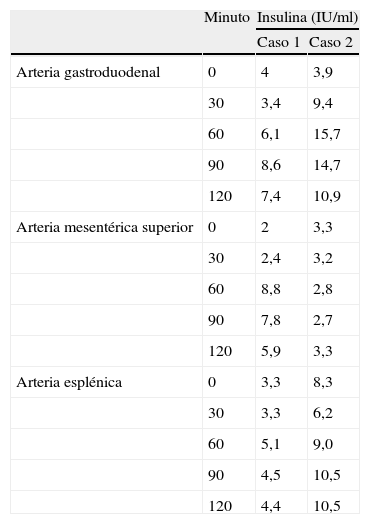
Resultados del test de estimulación selectiva con calcio
| Minuto | Insulina (IU/ml) | ||
| Caso 1 | Caso 2 | ||
| Arteria gastroduodenal | 0 | 4 | 3,9 |
| 30 | 3,4 | 9,4 | |
| 60 | 6,1 | 15,7 | |
| 90 | 8,6 | 14,7 | |
| 120 | 7,4 | 10,9 | |
| Arteria mesentérica superior | 0 | 2 | 3,3 |
| 30 | 2,4 | 3,2 | |
| 60 | 8,8 | 2,8 | |
| 90 | 7,8 | 2,7 | |
| 120 | 5,9 | 3,3 | |
| Arteria esplénica | 0 | 3,3 | 8,3 |
| 30 | 3,3 | 6,2 | |
| 60 | 5,1 | 9,0 | |
| 90 | 4,5 | 10,5 | |
| 120 | 4,4 | 10,5 | |
Se observan resultados patológicos (incremento de insulina de al menos el doble sobre su valor basal) a los 90 minutos en las muestras de arteria gastroduodenal, a partir de los 60 minutos en la mesentérica superior en el paciente 1; y a partir de los 30 minutos en la arteria gastroduodenal en el paciente 2.
El segundo caso se refiere a una mujer de 36 años intervenida de BGL en 2006 por obesidad mórbida (peso prequirúrgico 140kg, IMC 46,24). Año y medio tras la intervención y con un peso de 79kg (peso mínimo tras la intervención 77kg), la paciente presentó hipoglucemias posprandiales diarias, en ocasiones acompañadas de clínica sincopal que requirieron de intervención familiar para su resolución, no precisando tratamiento hospitalario para las mismas. Se le realizó sobrecarga con comida mixta (Ensure plus drink ® una botella de 200mL), demostrando hipoglucemia hiperinsulinémica (glucemia 28mg/dl, insulina 10,6UI/ml). Se realizaron también test de ayuno, el cual no mostró resultados patológicos (glucemia mínima 42mg/dl con insulina <0,2UI/ml), y una estimulación con ACTH que descartó insuficiencia suprarrenal. Una TC de abdomen no demostró lesiones nodulares en el páncreas. Finalmente, se realizó cateterismo pancreático con estimulación selectiva con calcio (tabla 1) sugestiva de hiperinsulinismo. Se inició dieta fraccionada, seguida de tratamiento con acarbosa siendo ambas medidas inefectivas. A continuación se inició terapia con octreótide sin objetivarse mejoría alguna. Se remitió la paciente a cirugía general, iniciándose a su vez tratamiento con diazóxido. La paciente fue sometida a una pancreatectomía corporocaudal con anatomía patológica descrita como nesidioblastosis difusa, 5 meses tras la cual mantuvo dieta fraccionada, sin tratamiento específico para las hipoglucemias y manteniéndose asintomática hasta la fecha con glucemias en rangos de normalidad.
Los casos anteriormente descritos eran sugestivos de nesidioblastosis, aunque no es sencillo llegar a esta conclusión, puesto que los mecanismos fisiopatológicos de la hipoglucemia tras bypass gástrico no están claros. El grupo de Meier analizó tejido pancreático de pacientes con hipoglucemia hiperinsulinémica tras bypass gástrico3 no encontrando alteraciones significativas y postulando que se hallaban ante la presencia de una hiperinsulinemia relativa4, donde la pérdida de peso incrementaría la sensibilidad a la insulina, causando episodios de hipoglucemia a pesar de producir la misma cantidad de insulina que antes de la operación. Rabbie et al. descubrieron niveles elevados de GLP-1 un año tras bypass y relacionaron el aumento de la secreción de insulina con un incremento de la acción de las incretinas2.
Debido al limitado conocimiento que tenemos sobre la relación entre los mecanismos antes nombrados, la hipoglucemia hiperinsulinémica es un gran desafío para el clínico. En su diagnóstico, en primer lugar se buscará la presencia fehaciente de hipoglucemia, pudiendo emplearse el test de comida mixta, e incluso la monitorización continua de glucosa, siendo esta última la mejor opción5. Una vez demostrado este hecho, se debe buscar la etiología de la misma como ya se ha comentado en otras revisiones similares6. Se debe comenzar con una minuciosa historia clínica, para descartar causas ajenas a la cirugía bariátrica, como pueden ser el uso subrepticio de insulina. Descartado lo anterior, se debe buscar el mecanismo endógeno responsable del aumento relativo de los niveles de insulina. Los test anteriormente descritos mostrarán el momento de aparición de los episodios hipoglucémicos: en ayunas o posprandiales. El primer caso sería compatible con insulinoma, el cual en principio no tendría relación con la cirugía bariátrica aunque cabría la posibilidad de que la pérdida de peso produjera una disminución de una previa resistencia a la insulina, desenmascarando en ese momento un insulinoma presente previamente. En cualquier caso, seguidamente se necesitarán pruebas de imagen funcionales para llegar a dicho diagnóstico. Exámenes radiológicos comunes se pueden combinar con el uso de 18F-DOPA- o 11C-HTP-PET, ambos válidos para este objetivo, sin tener una clara ventaja el uno sobre el otro7. También se puede emplear el test de estimulación selectiva con calcio. Un incremento de insulina de al menos el doble sobre el valor basal tras la inyección de calcio en la arteria esplénica, mesentérica superior y gastroduodenal, indica hiperfunción de células beta.
No hay un tratamiento de elección o manejo estandarizado útil para todos los pacientes. La posibilidad de que distintos mecanismos fisiopatológicos intervengan en diferentes pacientes podría explicar esta situación. Una dieta estricta debe ser el primer paso a seguir, pero debemos conocer las alternativas médicas con las que contamos si esta medida no funciona. A continuación, se debe ensayar el tratamiento médico, teniendo diferentes opciones a elegir. Los inhibidores de la alfa glucosidasa han sido usados debido a la experiencia previa en pacientes con síndrome de dumping1. Otros tratamientos empleados clásicamente para el tratamiento de las hipoglucemias son los bloqueadores de canales de calcio o el diazóxido8, más habitualmente usado en la hipoglucemia hiperinsulinémica de la infancia. Ante la falta de eficacia de las medidas antes nombradas, han surgido nuevas opciones terapéuticas. Se han empleado análogos de somatostatina, los cuales en algunos casos han demostrado ser efectivos a largo plazo por su efecto inhibitorio sobre la secreción de insulina y de GLP-1. Curiosamente, análogos de GLP-1 han sido usados exitosamente para tal efecto, postulándose su efecto estabilizador de los niveles de glucemia como mecanismo de acción9, aunque un enlentecimiento en el vaciado gástrico podría ser otro mecanismo plausible para explicar su eficacia. De todas formas, el tratamiento médico fracasa en un gran número de casos, quedando la cirugía como la única opción posible. El procedimiento de elección en estos pacientes es la pancreatectomía subtotal, con una tasa de mortalidad del 2-9%, no siendo infalible1. Otro estudio retrospectivo10 mostró mejoría en todos los pacientes sometidos a esta modalidad de tratamiento, aunque con distintos grados de éxito, presentando aproximadamente el 25% de los pacientes resolución completa de sus síntomas, otro 25% persistiendo con síntomas leves, otro 25% necesitando tratamiento médico tras cirugía y finalmente otro 25% que presentó recidiva de los síntomas, no siendo controlables con ningún tipo de tratamiento médico.
Los casos expuestos muestran una respuesta excelente al tratamiento quirúrgico tras haber fracasado múltiples tratamientos médicos. Una aproximación diagnóstica precisa, incluyendo estimulación selectiva con calcio, es necesaria para así poder seleccionar la mejor opción terapéutica ya sea médica o quirúrgica.
Responsabilidades éticasSe ha obtenido consentimiento informado escrito para la publicación de los casos clínicos incluidos en este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.