Los tumores neuroendocrinos gastroenteropancreáticos (TNE-GEP) constituyen el segundo tumor avanzado más prevalente del tracto digestivo. En los últimos años, los recursos invertidos para la investigación en esta población de pacientes se han visto aumentados exponencialmente convirtiéndose en uno de los escenarios más atractivos para la investigación oncológica. Varias proteínas proangiogénicas han sido identificadas como sobreexpresadas en los TNE-GEP, incluyendo el factor de crecimiento del endotelio vascular y sus receptores, y las vías de señalización intracelular más relacionadas como la del receptor del factor de crecimiento epidérmico, el receptor tipo i del factor de crecimiento similar a la insulina y la vía de PI3K-(PTEN)-AKT-mTOR. Los resultados recientes de los 3 estudios fase iii más importantes en TNE-GEP han permitido la aprobación de 2 terapias dirigidas, sunitinib y everolimus, para el tratamiento de los pacientes con tumores neuroendocrinos pancreáticos después de décadas de mínimos avances en esta población.
Gastroenteropancreatic neuroendocrine tumors (GEP-NETs) are the second most prevalent group of advanced gastrointestinal tract tumors. Resources invested in research on this patient population have exponentially increased in recent years, and this has become one of the most attractive fields for oncological research. Several proangiogenic proteins have been found to be overexpressed in GEP-NETs, including vascular endothelial growth factor and its receptors and the more closely related intracellular signaling pathways such as the epidermal growth factor pathway, type I insulin-like growth factor receptor, and the PI3K-(PTEN)-AKT-mTOR pathway. The recent results of the three most important Phase III studies in GEP-NETs have allowed for approval of two targeted agents, sunitinib and everolimus, for the treatment of patients with pancreatic neuroendocrine tumors after decades of minimal advances in this population.
Los tumores neuroendocrinos gastroenteropancreáticos (TNE-GEP) constituyen un grupo heterogéneo de neoplasias derivadas de las células de Kultchitzky del sistema neuroendocrino difuso localizado en el tracto gastrointestinal y en las células de los islotes pancreáticos. Aunque su incidencia global es baja, menos de un 2% de todos los tumores gastrointestinales, su prevalencia es elevada debido a su historia natural, representado el segundo tumor avanzado más frecuente del sistema digestivo tras el cáncer colorrectal1. Característicamente estos tumores tienen la capacidad de producir varios tipos de hormonas y aminas generando una variedad de síndromes hormonales, como el síndrome carcinoide.
Las posibilidades terapéuticas disponibles son asimismo amplias, incluyendo desde la cirugía curativa, a procedimientos paliativos como los tratamientos locorregionales hepáticos (embolización o radiofrecuencia), cirugías paliativas, terapias con radionúclidos o tratamientos sistémicos, incluyendo terapia hormonal, inmunológica, citotóxica o las nuevas terapias dirigidas2. Pero aún con las distintas opciones terapéuticas, existe un claro déficit de opciones de tratamiento sistémico de estos tumores. Las terapias hormonales e inmunológicas, a pesar de ofrecer un elevado porcentaje de control de los síntomas relacionados con la secreción hormonal, tienen un efecto antitumoral limitado3. Los agentes citotóxicos clásicos han demostrado una actividad limitada en los TNE-GEP4–6. Esta falta de actividad se ha relacionado con las características histológicas típicas de este tipo de tumores, como el bajo índice de proliferación, medido por el grado de diferenciación, la expresión de Ki 67 o el índice mitótico, así como con la expresión de marcadores biológicos relacionados con la resistencia a la quimioterapia (como la sobreexpresión de Akt)7. La eficacia limitada de estos fármacos clásicos ha llevado a la investigación de nuevos agentes terapéuticos que intentan explotar las características fenotípicas de los TNE-GEP. El conocimiento más detallado de los mecanismos moleculares relacionados con el crecimiento celular, la apoptosis, la angiogénesis y la invasión tumoral ha permitido el desarrollo de nuevas terapias dirigidas en el campo de la oncología. Desafortunadamente, en el campo de los tumores neuroendocrinos el desarrollo de nuevas terapias dirigidas ha sido limitado debido a varios factores, incluyendo la gran heterogeneidad de este grupo de tumores, las limitaciones de modelos in vitro e in vivo para la investigación preclínica de nuevos fármacos, y la escasez de recursos que ha impactado especialmente en aquellos grupos de tumores poco frecuentes que requieren de un esfuerzo internacional para el diseño y la implementación de estudios clínicos.
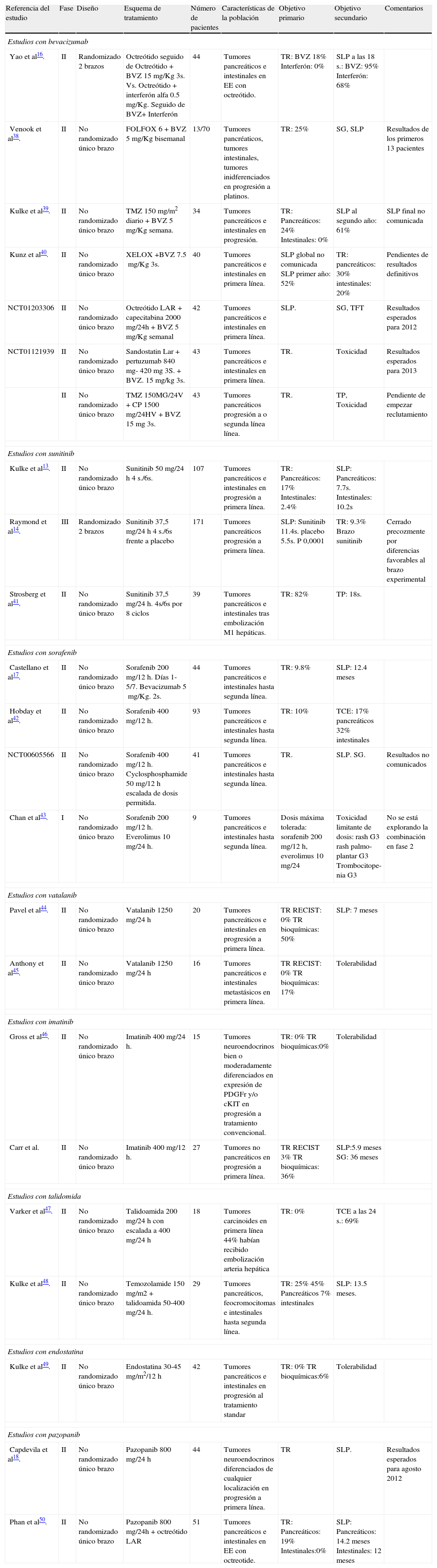
Una de las principales características de los tumores neuroendocrinos es su rica vascularización, asociada a una la elevada expresión de moléculas proangiogénicas, como el factor de crecimiento del endotelio vascular (VEGF) y sus receptores (VEGFR1-3), que ha sido la base para la investigación de múltiples terapias dirigidas contra el proceso de la angiogénesis tumoral en los TNE-GEP (tabla 1). Otra de las principales vías metabólicas involucradas en la patogénesis de los TNE-GEP es PI3K-(PTEN)-AKT-mTOR. Existen varios síndromes hereditarios que cursan con una activación constitutiva de esta vía metabólica, como la esclerosis tuberosa, la neurofibromatosis de tipo i o la neoplasia endocrina múltiple de tipo i, en los que la incidencia de TNE-GEP es significativamente más elevada que en la población general. Asimismo, se han descrito sobreexpresiones de receptores con actividad tirosina cinasa de superficie celular, como el receptor del factor de crecimiento epidérmico (EGFR) o el receptor del factor de crecimiento similar a la insulina (IGFR), cuya principal vía activadora intracelular es la vía de mTOR.
Ensayos clínicos con fármacos antiangiogénicos en tumores neuroendocrinos gastroenteropancreáticos
| Referencia del estudio | Fase | Diseño | Esquema de tratamiento | Número de pacientes | Características de la población | Objetivo primario | Objetivo secundario | Comentarios |
| Estudios con bevacizumab | ||||||||
| Yao et al16. | II | Randomizado 2 brazos | Octreótido seguido de Octreótido+BVZ 15mg/Kg 3s. Vs. Octreótido+interferón alfa 0.5mg/Kg. Seguido de BVZ+ Interferón | 44 | Tumores pancreáticos e intestinales en EE con octreótido. | TR: BVZ 18% Interferón: 0% | SLP a las 18 s.: BVZ: 95% Interferón: 68% | |
| Venook et al38. | II | No randomizado único brazo | FOLFOX 6+BVZ 5mg/Kg bisemanal | 13/70 | Tumores pancréaticos, tumores intestinales, tumores inidferenciados en progresión a platinos. | TR: 25% | SG, SLP | Resultados de los primeros 13 pacientes |
| Kulke et al39. | II | No randomizado único brazo | TMZ 150mg/m2 diario+BVZ 5mg/Kg semana. | 34 | Tumores pancreáticos e intestinales en progresión. | TR: Pancreáticos: 24% Intestinales: 0% | SLP al segundo año: 61% | SLP final no comunicada |
| Kunz et al40. | II | No randomizado único brazo | XELOX +BVZ 7.5mg/Kg 3s. | 40 | Tumores pancreáticos e intestinales en primera línea. | SLP global no comunicada SLP primer año: 52% | TR: pancreáticos: 30% intestinales: 20% | Pendientes de resultados definitivos |
| NCT01203306 | II | No randomizado único brazo | Octreótido LAR+capecitabina 2000mg/24h+BVZ 5mg/Kg semanal | 42 | Tumores pancreáticos e intestinales en primera línea. | SLP. | SG, TFT | Resultados esperados para 2012 |
| NCT01121939 | II | No randomizado único brazo | Sandostatin Lar+pertuzumab 840 mg- 420mg 3S.+BVZ. 15mg/kg 3s. | 43 | Tumores pancreáticos e intestinales en primera línea. | TR. | Toxicidad | Resultados esperados para 2013 |
| II | No randomizado único brazo | TMZ 150MG/24V+CP 1500mg/24HV+BVZ 15mg 3s. | 43 | Tumores pancreáticos progresión a o segunda línea línea. | TR. | TP, Toxicidad | Pendiente de empezar reclutamiento | |
| Estudios con sunitinib | ||||||||
| Kulke et al13. | II | No randomizado único brazo | Sunitinib 50mg/24h 4 s./6s. | 107 | Tumores pancreáticos e intestinales en progresión a primera línea. | TR: Pancreáticos: 17% Intestinales: 2.4% | SLP: Pancreáticos: 7.7s. Intestinales: 10.2s | |
| Raymond et al14. | III | Randomizado 2 brazos | Sunitinib 37,5mg/24h 4 s./6s frente a placebo | 171 | Tumores pancreáticos progresión a primera línea. | SLP: Sunitinib 11.4s. placebo 5.5s. P 0,0001 | TR: 9.3% Brazo sunitinib | Cerrado precozmente por diferencias favorables al brazo experimental |
| Strosberg et al41. | II | No randomizado único brazo | Sunitinib 37,5mg/24h. 4s/6s por 8 ciclos | 39 | Tumores pancreáticos e intestinales tras embolización M1 hepáticas. | TR: 82% | TP: 18s. | |
| Estudios con sorafenib | ||||||||
| Castellano et al17. | II | No randomizado único brazo | Sorafenib 200mg/12h. Días 1-5/7. Bevacizumab 5mg/Kg. 2s. | 44 | Tumores pancreáticos e intestinales hasta segunda línea. | TR: 9.8% | SLP: 12.4 meses | |
| Hobday et al42. | II | No randomizado único brazo | Sorafenib 400mg/12h. | 93 | Tumores pancreáticos e intestinales hasta segunda línea. | TR: 10% | TCE: 17% pancreáticos 32% intestinales | |
| NCT00605566 | II | No randomizado único brazo | Sorafenib 400mg/12h. Cyclosphosphamide 50mg/12h escalada de dosis permitida. | 41 | Tumores pancreáticos e intestinales hasta segunda línea. | TR. | SLP. SG. | Resultados no comunicados |
| Chan et al43. | I | No randomizado único brazo | Sorafenib 200mg/12h. Everolimus 10mg/24h. | 9 | Tumores pancreáticos e intestinales hasta segunda línea. | Dosis máxima tolerada: sorafenib 200mg/12h, everolimus 10mg/24 | Toxicidad limitante de dosis: rash G3 rash palmo-plantar G3 Trombocitope-nia G3 | No se está explorando la combinación en fase 2 |
| Estudios con vatalanib | ||||||||
| Pavel et al44. | II | No randomizado único brazo | Vatalanib 1250mg/24h | 20 | Tumores pancreáticos e intestinales en progresión a primera línea. | TR RECIST: 0% TR bioquímicas: 50% | SLP: 7 meses | |
| Anthony et al45. | II | No randomizado único brazo | Vatalanib 1250mg/24h | 16 | Tumores pancreáticos e intestinales metastásicos en primera línea. | TR RECIST: 0% TR bioquímicas: 17% | Tolerabilidad | |
| Estudios con imatinib | ||||||||
| Gross et al46. | II | No randomizado único brazo | Imatinib 400mg/24h. | 15 | Tumores neuroendocrinos bien o moderadamente diferenciados en expresión de PDGFr y/o cKIT en progresión a tratamiento convencional. | TR: 0% TR bioquímicas:0% | Tolerabilidad | |
| Carr et al. | II | No randomizado único brazo | Imatinib 400mg/12h. | 27 | Tumores no pancreáticos en progresión a primera línea. | TR RECIST 3% TR bioquímicas: 36% | SLP:5.9 meses SG: 36 meses | |
| Estudios con talidomida | ||||||||
| Varker et al47. | II | No randomizado único brazo | Talidoamida 200mg/24h con escalada a 400mg/24h | 18 | Tumores carcinoides en primera línea 44% habían recibido embolización arteria hepática | TR: 0% | TCE a las 24 s.: 69% | |
| Kulke et al48. | II | No randomizado único brazo | Temozolamide 150mg/m2+talidoamida 50-400mg/24h. | 29 | Tumores pancreáticos, feocromocitomas e intestinales hasta segunda línea. | TR: 25% 45% Pancreáticos 7% intestinales | SLP: 13.5 meses. | |
| Estudios con endostatina | ||||||||
| Kulke et al49. | II | No randomizado único brazo | Endostatina 30-45mg/m2/12h | 42 | Tumores pancreáticos e intestinales en progresión al tratamiento standar | TR: 0% TR bioquímicas:6% | Tolerabilidad | |
| Estudios con pazopanib | ||||||||
| Capdevila et al18. | II | No randomizado único brazo | Pazopanib 800mg/24h | 44 | Tumores neuroendocrinos diferenciados de cualquier localización en progresión a primera línea. | TR | SLP. | Resultados esperados para agosto 2012 |
| Phan et al50. | II | No randomizado único brazo | Pazopanib 800mg/24h+octreótido LAR | 51 | Tumores pancreáticos e intestinales en EE con octreotide. | TR: Pancreáticos: 19% Intestinales:0% | SLP: Pancreáticos: 14.2 meses Intestinales: 12 meses | |
BVZ: Bevacizumab; EE: Enfermedad estable; M1: metástasis; RECIST: criterios de evaluación de la respuesta en tumores sólidos; SG: Supervivencia global; S: semana; SLP: Supervivencia libre de progresión; TCE: Tasa de control de la enfermedad; TFT: Tiempo al fallo de tratamiento; TMZ: Temozolamida; TR: Tasa de respuestas
Con este racional molecular se han llevado a cabo múltiples estudios fase ii con terapias dirigidas contra estas vías metabólicas y recientemente se han publicado los primeros resultados de los 3 estudios fase iii más importantes en TNE-GEP, que han permitido la aprobación los primeros fármacos dirigidos contra dianas específicas en esta población.
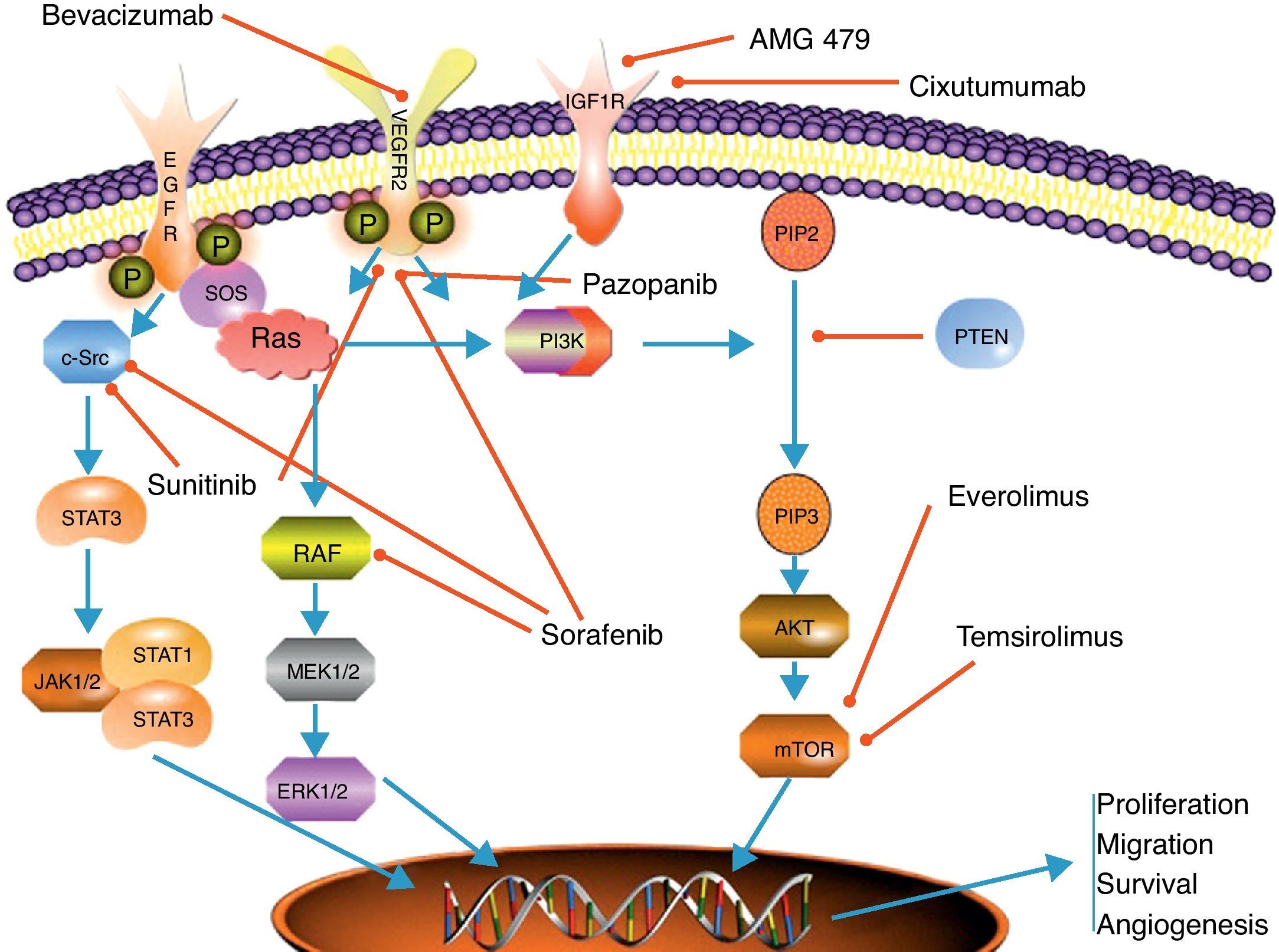
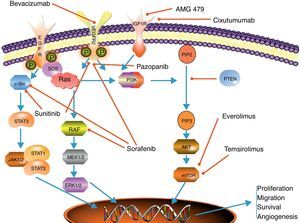
Terapia antiangiogénicaLa angiogénesis juega un papel crucial en el proceso de crecimiento tumoral y diseminación sistémica de los clones celulares tumorales. La regulación de la angiogénesis es un proceso complejo, fruto del balance dinámico entre los factores pro y antiangiogénicos8. Uno de los factores reguladores más importantes es el VEGF y sus receptores. Se ha visto que VEGF tiene un efecto múltiple en el control de la angiogénesis, estimulando la proliferación y la migración de las células endoteliales, y aumentado la permeabilidad microvascular9. Los efectos de VEGF están mediados por su unión a diferentes receptores, siendo los más importantes VEGFR-1 (también conocido como Flt-1), VEGFR-2 (o KDR/Flk-1) y VGFR-3 (o Flt-4). La señal de transducción de VEGF es mediada a través del dominio con actividad tirosina cinasa de la porción intracelular del receptor8 (fig. 1).
Esquema de las vías de señalización más relevantes en carcinomas neuroendocrinos conjuntamente con los principales mecanismos de acción de las terapias dirigidas.
EGFr: receptor de crecimiento epitelial; ERK 1/2: proteína cinasa regulada por mitógenos extracelulares; IGFr: receptor de crecimiento asociado al factor de crecimiento insulínico; JAK 1/2: cinasa de Janus 1 y 2; MEK 1/2: proteína cinasa activada por mitógenos; mTOR: sustrato de la rapamicina en mamíferos; PIP2: fosfo-inositol bifosfato; PIP3: fosfo-inositol trifosfato; PI3K: fosfotinositol 3 cinasa; PTEN: proteína homóloga de la fostatasa y la tensina; RAF: factor asociado a RAS; RAS: proteína asociada al sarcoma de la rata; SOS: hijo de Sevenles proteína; STAT 1/3: proteína transductora de señal y reguladora de la transcripción 1 y 2; VEGFr: receptor de crecimiento vásculo-endotelial.
Debido al papel central que juega VEGF en el proceso de angiogénesis, este ligando y sus receptores se han convertido en una diana muy atractiva en la investigación oncológica. Así como en la mayoría de tumores sólidos, en los TNE-GEP la sobreexpresión de VEGF se ha relacionado con un estadio más avanzado de la enfermedad y con un peor pronóstico10. En base a estos hallazgos, las terapias dirigidas contra VEGF y sus receptores están siendo ampliamente estudiadas para el tratamiento de los TNE-GEP, incluyendo anticuerpos monoclonales dirigidos contra VEGF y pequeñas moléculas capaces de inhibir los receptores con actividad tirosina cinasa de VEGF (tabla 1).
SunitinibEl malato de sunitinib (SU-11248, Sutent®) es un potente inhibidor, ATP-competitivo, de múltiples receptores de superficie celular con actividad tirosina cinasa involucrados principalmente en los procesos de proliferación celular y angiogénesis, como VEGFR1-3, PDGFRa-b, FLT-3, c-KIT y RET.
El desarrollo de sunitinib en TNE-GEP se ha llevado a cabo en los últimos 5 o 6 años, pasando de los estudios preclínicos iniciales a la aprobación final por las entidades reguladoras para el tratamiento de los TNE pancreáticos avanzados. Los efectos de la inhibición de VEGFR y PDGFR (receptor del factor de crecimiento derivado de plaquetas) en el modelo de xenotransplante RIP-TAG de carcinoma de islotes pancreáticos se demostró claramente en los primeros estudios in vivo, y se objetivó clínicamente en el estudio fase I de sunitinib, con la obtención de respuestas radiológicas tumorales en 2 pacientes con TNE-GEP11,12. El estudio fase ii con 107 pacientes, demostró que la actividad de sunitinib era superior en TNE de origen pancreático, comparado con los TNE de intestino delgado, con una tasa de respuestas radiológicas que alcanzaba el 16,7% por criterios RECIST (criterios de evaluación de la respuesta en tumores sólidos) (tabla 2) aunque el beneficio clínico llegaba al 84% de los pacientes, incluyendo estabilizaciones y respuestas menores13. Los mejores resultados obtenidos en TNE pancreáticos orientaron al objetivo del estudio fase iii, un estudio internacional, controlado con placebo, de sunitinib a 37,5mg/día en esquema continuo, en pacientes con TNE pancreáticos bien y moderadamente diferenciados, metastásicos o localmente avanzados, no curables con cirugía, en progresión durante los últimos 12 meses de seguimiento14. El estudio estaba diseñado para reclutar 340 pacientes, pero se detuvo la inclusión de pacientes a la mitad del reclutamiento tras la recomendación de un comité de monitorización independiente por haberse alcanzado ya el objetivo primario de aumento en supervivencia libre de progresión (SLP) y haber detectado un aumento de muertes en el brazo placebo. Al final el estudio aleatorizó a 169 pacientes, y obtuvo un aumento en SLP de sunitinib respecto placebo de 6 meses (5,5 frente a 11,4 meses, HR: 0.48, p=0,0001). Así mismo se observó un beneficio clínico de sunitinib en más del 70% de los pacientes, con un 9% de tasa de respuestas por criterios RECIST. El perfil de toxicidad fue similar a estudios previos con sunitinib y los test de calidad de vida no detectaron diferencias entre ambos brazos de tratamiento. Junto con la publicación de los datos del estudio fase iii de sunitinib se han notificado experiencias clínicas retrospectivas del uso del fármaco en la práctica clínica habitual, que demuestran la reproducibilidad de los datos fuera del ambiente de un ensayo clínico15.
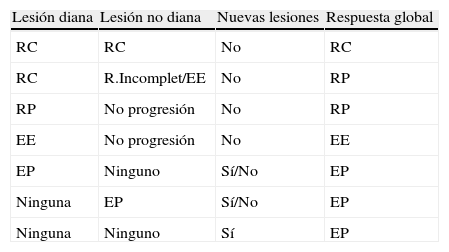
Criterios RECIST
| Lesión diana | Lesión no diana | Nuevas lesiones | Respuesta global |
| RC | RC | No | RC |
| RC | R.Incomplet/EE | No | RP |
| RP | No progresión | No | RP |
| EE | No progresión | No | EE |
| EP | Ninguno | Sí/No | EP |
| Ninguna | EP | Sí/No | EP |
| Ninguna | Ninguno | Sí | EP |
RC: respuesta completa (desaparición de lesiones diana y no diana); RECIST: criterios de evaluación de la respuesta en tumores sólidos; RP: respuesta parcial (disminución de al menos un 30% de la suma del diámetro mayor de lesiones diana con referencia al estudio basal); EP: enfermedad progresiva (aumento de al menos un 20% de la suma de los diámetros de lesiones diana del estudio con valores más bajos, aparición de nuevas lesiones o aumento de las lesiones no diana); EE: enfermedad estable (variaciones en el tamaño de las lesiones entre el concepto de RP y EP).
El desarrollo de sunitinib en TNE-GEP se focalizará en los próximos años en la evaluación de su actividad en combinación con análogos de la somatostatina (lanreotida) en pacientes con TNE originados en intestino delgado (www.clinicaltrials.gov).
BevacizumabBevacizumab es un anticuerpo monoclonal humanizado dirigido contra el ligando VEGF que ha demostrado actividad en TNE-GEP en un estudio fase ii aleatorizado comparado con interferón pegilado α-2b. Los resultados del estudio demostraron que bevacizumab obtenía una mayor tasa de respuestas (18% frente a 0%) y una menor tasa de progresión de enfermedad (5 vs 27%), mejorando la SLP a las 18 semanas (95% frente a 68%)16. Estos buenos resultados llevaron al diseño de un estudio fase iii de bevacizumab con octeótrido LAR comparado con interferón pegilado α-2b más octreótido LAR en pacientes con TNE avanzados de origen intestinal (SWOG S0518, www.clinicaltrials.gov).
Bevacizumab también está siendo investigado en combinación con otros fármacos citotóxicos, así como en combinación con otras terapias dirigidas como sorafenib o everolimus, cuyos resultados iniciales han sido recientemente notificados.
Existen otras muchas terapias dirigidas con efecto antiangiogénico en desarrollo para TNE-GEP, básicamente inhibidores de múltiples receptores con actividad tirosina cinasa, como pazopanib o sorafenib, algunos de ellos con resultados preliminares de estudios fase II, y otros estudios que empiezan a plantearse la combinación de terapias dirigidas contra dianas de distintas vías se señalización intracelular o la secuenciación de los tratamientos para obtener un control óptimo de la enfermedad17,18 (tabla 1).
Inhibidores mTORMammalian target of rapamycin (mTOR) es una cinasa serina-treonina de la vía de señalización intracelular PI3K (fosfoinositol-3-cinasa)-AKT. Esta vía de transducción de señal juega un papel primordial en la regulación del crecimiento, proliferación, motilidad y supervivencia celular, así como en la síntesis y transcripción proteica 19,20. mTOR integra la señalización de múltiples estímulos, como los factores de crecimiento similares a la insulina, o el factor de crecimiento epidérmico (IGF-1/2, EGF) y mitógenos. Así mismo, funciona como sensor de los niveles de nutrientes y energía celular y del estatus de oxidación/reducción. Además, mTOR está involucrado en el proceso de antiangiogénesis regulando la traslación y la actividad del factor inducible por la hipoxia (HIF1α), que está relacionado con la expresión de VEGF en situaciones de hipoxia celular21 (fig. 1).
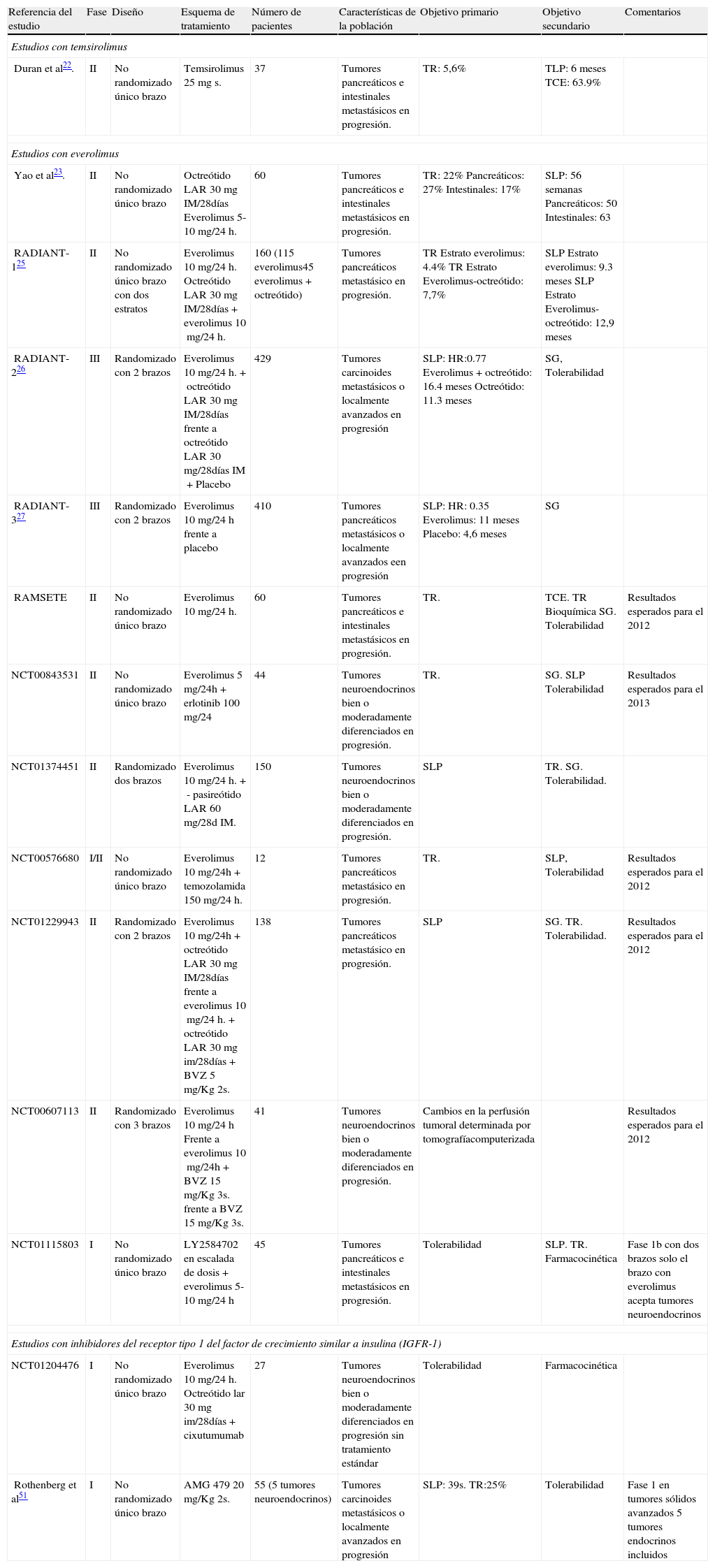
Dos inhibidores de mTOR se han desarrollado en TNE-GEP con suerte dispar: temsirolimus y everolimus (tabla 3).
Estudios con fármacos inhibidores de la vía PI3K-AKT-MTOR en tumores neuroendocrinos gastroenteropancreáticos
| Referencia del estudio | Fase | Diseño | Esquema de tratamiento | Número de pacientes | Características de la población | Objetivo primario | Objetivo secundario | Comentarios |
| Estudios con temsirolimus | ||||||||
| Duran et al22. | II | No randomizado único brazo | Temsirolimus 25mgs. | 37 | Tumores pancreáticos e intestinales metastásicos en progresión. | TR: 5,6% | TLP: 6 meses TCE: 63.9% | |
| Estudios con everolimus | ||||||||
| Yao et al23. | II | No randomizado único brazo | Octreótido LAR 30mg IM/28días Everolimus 5-10mg/24h. | 60 | Tumores pancreáticos e intestinales metastásicos en progresión. | TR: 22% Pancreáticos: 27% Intestinales: 17% | SLP: 56 semanas Pancreáticos: 50 Intestinales: 63 | |
| RADIANT-125 | II | No randomizado único brazo con dos estratos | Everolimus 10mg/24h. Octreótido LAR 30mg IM/28días+everolimus 10mg/24h. | 160 (115 everolimus45 everolimus+octreótido) | Tumores pancreáticos metastásico en progresión. | TR Estrato everolimus: 4.4% TR Estrato Everolimus-octreótido: 7,7% | SLP Estrato everolimus: 9.3 meses SLP Estrato Everolimus-octreótido: 12,9 meses | |
| RADIANT-226 | III | Randomizado con 2 brazos | Everolimus 10mg/24h.+octreótido LAR 30mg IM/28días frente a octreótido LAR 30mg/28días IM+Placebo | 429 | Tumores carcinoides metastásicos o localmente avanzados en progresión | SLP: HR:0.77 Everolimus+octreótido: 16.4 meses Octreótido: 11.3 meses | SG, Tolerabilidad | |
| RADIANT-327 | III | Randomizado con 2 brazos | Everolimus 10mg/24h frente a placebo | 410 | Tumores pancreáticos metastásicos o localmente avanzados een progresión | SLP: HR: 0.35 Everolimus: 11 meses Placebo: 4,6 meses | SG | |
| RAMSETE | II | No randomizado único brazo | Everolimus 10mg/24h. | 60 | Tumores pancreáticos e intestinales metastásicos en progresión. | TR. | TCE. TR Bioquímica SG. Tolerabilidad | Resultados esperados para el 2012 |
| NCT00843531 | II | No randomizado único brazo | Everolimus 5mg/24h+erlotinib 100mg/24 | 44 | Tumores neuroendocrinos bien o moderadamente diferenciados en progresión. | TR. | SG. SLP Tolerabilidad | Resultados esperados para el 2013 |
| NCT01374451 | II | Randomizado dos brazos | Everolimus 10mg/24h.+- pasireótido LAR 60mg/28d IM. | 150 | Tumores neuroendocrinos bien o moderadamente diferenciados en progresión. | SLP | TR. SG. Tolerabilidad. | |
| NCT00576680 | I/II | No randomizado único brazo | Everolimus 10mg/24h+temozolamida 150mg/24h. | 12 | Tumores pancreáticos metastásico en progresión. | TR. | SLP, Tolerabilidad | Resultados esperados para el 2012 |
| NCT01229943 | II | Randomizado con 2 brazos | Everolimus 10mg/24h+octreótido LAR 30mg IM/28días frente a everolimus 10mg/24h.+octreótido LAR 30mg im/28días+BVZ 5mg/Kg 2s. | 138 | Tumores pancreáticos metastásico en progresión. | SLP | SG. TR. Tolerabilidad. | Resultados esperados para el 2012 |
| NCT00607113 | II | Randomizado con 3 brazos | Everolimus 10mg/24h Frente a everolimus 10mg/24h+BVZ 15mg/Kg 3s. frente a BVZ 15mg/Kg 3s. | 41 | Tumores neuroendocrinos bien o moderadamente diferenciados en progresión. | Cambios en la perfusión tumoral determinada por tomografíacomputerizada | Resultados esperados para el 2012 | |
| NCT01115803 | I | No randomizado único brazo | LY2584702 en escalada de dosis+everolimus 5-10mg/24h | 45 | Tumores pancreáticos e intestinales metastásicos en progresión. | Tolerabilidad | SLP. TR. Farmacocinética | Fase 1b con dos brazos solo el brazo con everolimus acepta tumores neuroendocrinos |
| Estudios con inhibidores del receptor tipo 1 del factor de crecimiento similar a insulina (IGFR-1) | ||||||||
| NCT01204476 | I | No randomizado único brazo | Everolimus 10mg/24h. Octreótido lar 30mg im/28días+cixutumumab | 27 | Tumores neuroendocrinos bien o moderadamente diferenciados en progresión sin tratamiento estándar | Tolerabilidad | Farmacocinética | |
| Rothenberg et al51 | I | No randomizado único brazo | AMG 479 20mg/Kg 2s. | 55 (5 tumores neuroendocrinos) | Tumores carcinoides metastásicos o localmente avanzados en progresión | SLP: 39s. TR:25% | Tolerabilidad | Fase 1 en tumores sólidos avanzados 5 tumores endocrinos incluidos |
AMG 479: anticuerpo monoclonal dirigido contra IGFR-1; Cixutumuab: anticuerpo monoclonal dirigido contra IGFR-1; IM: intramuscular; LY2584702: Inhibidor de AKT; TCE: Tasa de control de la enfermedad; TR: Tasa de respuestas; TLP: Tiempo libre de progresión.
Temsirolimus (CCI-779) es un fármaco intravenoso que se une a la immunofilina FKBP-12 y crea un complejo que inhibe la actividad de la proteína cinasa mTOR provocando una parada del ciclo celular en fase G1. Un único estudio fase ii analizó el efecto de este fármaco en pacientes con TNE-GEP avanzados. En el estudio se incluyeron 37 pacientes y fueron tratados con 25mg semanales de temsirolimus. El objetivo principal del estudio se basaba en las respuestas radiológicas por criterios RECIST, y se consideró un estudio negativo al obtener solo 2 respuestas parciales (5,6%)22. Como sucede en la mayoría de estudios con terapias dirigidas en tumores sólidos, las respuestas tumorales radiológicas fueron escasas, aunque la mayoría de los pacientes (54%) presentaron una reducción del tamaño tumoral entre el 1-29%, considerándose por criterios RECIST como estabilizaciones. Este estudio incluyó un subestudio farmacodinámico con biopsias tumorales apareadas en 13 pacientes, observando la reducción en la fosforilación de los productos de mTOR, como S6, y un aumento en la expresión de pAKT, que reflejaba la correcta inhibición de la diana por parte de temsirolimus. Además, los niveles basales elevados de pS6 y pmTOR se correlacionaron con mejor respuesta y los niveles elevados de pAKT con mejor SLP.
Aunque el desarrollo inicial de temsirolimus en TNE-GEP se detuvo tras los considerados resultados negativos de este estudio fase II, actualmente se está retomando la iniciativa de investigar este producto en TNE, tras los buenos resultados observados con el otro inhibidor de mTOR, everolimus, que en sus fases de desarrollo inicial fase ii demostró una actividad similar a temsirolimus.
EverolimusEverolimus (RAD001) es un derivado oral de la rapamicina, que ha demostrado una potente actividad inhibitoria de mTOR en líneas celulares tumorales y linfocitos, motivo por el que el desarrollo inicial del fármaco fue como inmunosupresor.
La primera evidencia de actividad en TNE-GEP se objetivó en un estudio fase ii que incluyó 60 pacientes con TNE-GEP en 2 cohortes consecutivas y a 2 dosis distintas de everolimus (5 y 10mg). La primera cohorte de 30 pacientes recibió everolimus 10mg/d y octeotride LAR 30mg im cada 28 días. La segunda cohorte recibió everolimus en monoterapia. El estudio demostró una actividad prometedora con una tasa de respuestas del 17% en TNE de intestino delgado y del 27% en TNE de origen pancreático, con una mediana de SLP (mSLP) de 63 y 50 semanas, respectivamente23. La actividad de everolimus fue superior en la cohorte de 10mg/d, confirmando los datos farmacodinámicos del estudio fase i previo con everolimus en tumores sólidos24. El perfil de toxicidad resultó aceptable, observando como efectos secundarios más frecuentes grados 3-4 las aftas en mucosas, fatiga, diarrea, hiperglucemia e hipofosfatemia.
Dados los interesantes resultados obtenidos en el estudio inicial, se diseñaron los estudios RADIANT de desarrollo de everolimus en TNE-GEP. El RADIANT-1 fue el estudio internacional fase ii confirmatorio del estudio inicial, con 2 estratos de pacientes afectos de TNE de origen pancreático, el primero con 115 pacientes tratados con everolimus a 10mg/d, y el segundo con 45 pacientes que recibieron la combinación de everolimus a 10mg/d y octreótido LAR 30mg im cada 28 días25. Los resultados observados fueron significativamente inferiores al estudio inicial, con una tasa de respuestas global de 7,8% en el primer estrato y 4,4% en el segundo. En el mismo estudio se planteó la utilización de los niveles de cromogranina A como biomarcador de respuesta al fármaco, asociándose la reducción de dichos niveles con el beneficio de everolimus (mSLP 13,3 frente a 7,5 meses). Por último, se analizó la hipótesis de sinergismo entre los inhibidores de mTOR y los análogos de la somatostatina, observando unos mejores datos de SLP en los pacientes incluidos en la cohorte de combinación (12,9 frente a 9,3 meses).
Recientemente se han publicado los resultados de los 2 estudios reguladores de everolimus en TNE, los RADIANT 2 y 3, que son 2 estudios fase iii, internacionales, doble ciego, controlados con placebo, en pacientes con TNE extrapancreáticos clínicamente funcionantes y TNE pancreáticos, respectivamente. El RADIANT-2 evalúa la efectividad y seguridad de la combinación de everolimus 10mg/d o placebo con octreótido LAR 30mg cada 28 días en 429 pacientes con tumores carcinoides avanzados e historia de síntomas hormonales asociados. Aunque el estudio no consiguió alcanzar el objetivo primario basado en la revisión radiológica centralizada, la combinación de everolimus y octreotido LAR demostró un aumento significativo de la mSLP comparado con placebo de 5,1 meses (HR=0,77; 95% CI, 0,59-1,00; p=0,026). Tras el ajuste por los desequilibrios entre brazos de tratamiento y las inconsistencias entre la evaluación radiológica central y local, los resultados demostraron que la combinación de everolimus y octreótido LAR reducía significativamente el riesgo de progresión de enfermedad en un 40% (HR=0,60; 95% CI, 0,44-0,84; p=0,0014)26. Los resultados globales del estudio RADIANT-2 reflejan la actividad de la combinación de everolimus con octreótido, aunque las autoridades regulatorias norteamericanas y europeas (FDA y EMA) no han autorizado el uso de everolimus para TNE extrapancreáticos al no alcanzar el objetivo primario del estudio. Por este motivo, actualmente está en desarrollo el estudio fase iii RADIANT-4, que evaluará la actividad de everolimus en monoterapia comparado con placebo, en pacientes afectos de TNE avanzados de origen intestinal y pulmonar (www.clinicaltrials.gov).
El estudio RADIANT-3 reclutó 410 pacientes afectos de TNE avanzados de origen pancreático y los aleatorizó a recibir everolimus 10mg/d o placebo, junto con la mejor terapia de soporte, que permitía el uso de análogos de la somatostatina27. El tratamiento con everolimus demostró un aumento significativo de la SLP por revisión central, doblando la mediana, de 4,6 a 11 meses (HR=0.,35; 95% CI, 0,27 to 0,45; p<0,0001) alcanzando el objetivo primario del estudio. A los 18 meses, la SLP en el brazo de everolimus fue del 34%, identificando un subgrupo de pacientes con especial beneficio del tratamiento a largo plazo, con un perfil de toxicidad favorable. El aumento en SLP se observó en todos los subgrupos de pacientes, independientemente de las terapias recibidas previamente, el ECOG PS (Eastern Cooperative Oncology Group Performance Status), la edad, la carga tumoral, el tiempo desde el diagnóstico, el grado tumoral o el tratamiento combinado con análogos de la somatostatina. La tasa de respuestas observada por criterios RECIST fue relativamente baja (5%), aunque el 64,4% de los pacientes presentaron una reducción entre el 1 y el 29% del tamaño de sus lesiones diana, por lo que el mayor beneficio de everolimus se debió a su tasa de respuestas menor y sus estabilizaciones. No se observaron diferencias en supervivencia global ya que el 73% de los pacientes en el brazo placebo fueron cruzados al brazo de everolimus. El perfil de toxicidad fue el esperable para everolimus, con estomatitis, anemia e hiperglucemia como los efectos adversos grados 3 o 4 más frecuentes, aunque todos ellos en menos del 10% de los pacientes. Los resultados del estudio RADIANT-3 han permitido la aprobación, tanto por la EMA como por la FDA, de everolimus 10mg/d para el tratamiento de los pacientes afectos de TNE bien y moderadamente diferenciados avanzados de origen pancreático.
La eficacia de everolimus en TNE-GEP no se limita exclusivamente a su efecto antiproliferativo sino también a un posible efecto en la liberación hormonal y en el metabolismo glucídico. Se han notificado series de casos en los que la administración de everolimus consigue controlar el cuadro clínico relacionado con la liberación hormonal de los TNE-GEP, como la hipoglucemia del insulinoma o el síndrome carcinoide de los TNE intestinales28,29. El racional molecular tras estos efectos aún no está bien establecido, aunque se espera en un futuro próximo profundizar en el conocimiento de las consecuencias metabólicas de la inhibición de mTOR.
El desarrollo actual de everolimus se centra en los TNE de origen extrapancreático y en la combinación de la inhibición de mTOR con la inhibición de otras dianas terapéuticas para incrementar el sinergismo y evitar mecanismo de resistencia (tabla 2).
Direcciones futurasLa llegada a la práctica clínica de 2 nuevos fármacos para el tratamiento de los pacientes afectos de TNE-GEP ha permitido avanzar en el complejo manejo de este grupo de pacientes. Aún así, las preguntas generadas siguen siendo superiores a las resueltas, incluso tras los resultados de los mayores estudios jamás completados en pacientes con TNE. Uno de los principales problemas que genera el manejo de los pacientes con TNE es su clasificación. Desde la clasificación embriológica propuesta por Williams y Sandler hace más de 50 años, se han utilizado múltiples clasificaciones, en función del grado tumoral, las características histológicas, la secreción hormonal, el estadio tumoral o el sitio de origen, que han generado aún más confusión, perjudicando la interpretación de los resultados de estudios clínicos, como ha sucedido en el RADIANT-2. Actualmente se siguen sin homogeneizar los criterios, pudiendo utilizar 3 clasificaciones (AJCC TNM, ENETS TNM y OMS). El mejor conocimiento de los mecanismos moleculares involucrados en el desarrollo y progresión de los TNE debe permitir en un futuro crear clasificaciones con un mayor valor pronóstico. En este sentido, estudios recientes de perfil de expresión génica han relacionado la disminución en la expresión de genes supresores tumorales de la vía PI3K-AKT-mTOR, como PTEN y TSC2, con un peor pronóstico, así como la expresión de microRNA (miR-21) con la presencia de metástasis hepáticas y un mayor grado tumoral30–32. Otras alteraciones moleculares como la relevancia del HIF1α, la vía de p53, las alteraciones en la expresión de la menina o los niveles de AKT se han relacionado con el comportamiento de los TNE-GEP33,34. Los resultados de los estudios de perfiles de expresión génica, así como los recientes avances en secuenciación profunda permitirán en un futuro próximo no solo disponer de clasificaciones pronósticas con base molecular, sino también la selección de aquellos pacientes con más probabilidades de respuesta a las terapias dirigidas35.
Otro de los principales déficits en el estudio de fármacos dirigidos en TNE-GEP es la falta de variedad de modelos animales que permitan un desarrollo preclínico fiable y reproducible en humanos. El modelo más utilizado, el RIP-TAG, ha permitido el desarrollo de sunitinib en esta población de pacientes, reflejando la utilidad del xenotransplante como modelo de angiogénesis. Su relevancia para el estudio de otras vías metabólicas queda por demostrar, aunque estudios recientes con inhibidores de mTOR y anti-EGFR han generado una hipótesis de reversión de la resistencia a la inhibición de la vía PI3K-AKT-mTOR36.
El futuro en el tratamiento de los TNE-GEP se basará en la tipificación molecular de los distintos tumores, que permita el diseño de ensayos clínicos dirigidos a subgrupos de pacientes que compartan unas mismas características moleculares y que tengan una mayor probabilidad de beneficio del tratamiento. Las combinaciones de terapias dirigidas que permitan abortar los mecanismos de resistencia de la inhibición de una única vía metabólica, así como las combinaciones con citotóxicos clásicos o con terapias hormonales se están desarrollando actualmente y cambiaran el panorama de manejo de estos pacientes en un futuro próximo (tablas 1 y 2; www.clinicaltrials.gov). Así mismo, el desarrollo de nuevos fármacos dirigidos debe correr en paralelo a un potente programa de biomarcadores predictores de respuesta para aumentar la eficiencia de estos tratamientos37.
ConclusionesLa rápida progresión de terapias dirigidas contra dianas específicas está cambiando el manejo de los pacientes afectos de cáncer. La situación no es distinta en los TNE-GEP, donde en el último año han llegado 2 nuevas terapias que deberán ser integradas en el complejo manejo de estos pacientes. Estos avances son posibles gracias a un esfuerzo internacional que involucre a todas las especialidades implicadas en el tratamiento de estos pacientes y permita la selección de los mismos para ser incluidos en estudios que cambiarán la práctica clínica diaria. En la situación actual socioeconómica, este abordaje multidisciplinar que permita integrar todas las opciones terapéuticas disponibles, resulta imprescindible para realizar una buena práctica clínica y optimizar los escasos recursos invertidos en la investigación de enfermedades consideradas huérfanas o poco frecuentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.