Los gonadotropinomas son tumores originados en las células gonadotropas de la hipófisis anterior causales de la síntesis y la secreción de gonadotrofinas (folitropina [FSH] y lutropina [LH]). La mayoría de estos tumores tienen una producción alterada de gonadotropinas y de sus subunidades (folitropina beta, subunidad alfa y, con menos frecuencia, lutropina beta). Los gonadotropinomas pueden presentar una respuesta de la subunidad alfa de las gonadotropinas al estímulo con protirrelina (TRH) que podría diferenciar estos tumores de los no funcionantes. De igual forma, esta prueba podría ser de utilidad tras la cirugía para poder discernir los posibles restos tumorales respecto a los cambios posquirúrgicos.
Sujetos y métodoSe estudió a 24 pacientes intervenidos de macroadenoma hipofisario, de los que 14 fueron diagnosticados de gonadotropinoma en el estudio histológico. Se les practicó la prueba de la subunidad alfa tras la administración de TRH antes y después de la cirugía.
ResultadosEn el estudio prequirúrgico el 50% de los gonadotropinomas tuvieron una respuesta positiva a dicha prueba y en el posquirúrgico otro 50%. El 83% de los pacientes con gonadotropinoma presentaban signos de recidiva/persistencia tumoral y/o cambios en la resonancia magnética (RM) de control posquirúrgico; el 83% de estos pacientes (41,6% del total) tuvo una respuesta positiva de la subunidad alfa tras el estímulo con TRH. En el grupo de macroadenomas no gonadotropinomas sólo un 33% tuvo respuesta positiva antes de la cirugía y otro 33%, después. En la RM practicada después de la cirugía, todos mostraban signos radiológicos compatibles con cambios inflamatorios posquirúrgicos o signos de persistencia y/o recidiva tumoral.
ConclusionesDicha prueba podría ser de ayuda en el diagnóstico diferencial de los gonadotropinomas, así como en el seguimiento y la valoración posquirúrgica de estos tumores.
Gonadotropinomas are adenomas of the gonadotropic cells of the anterior pituitary. These cells produce and secrete gonadotropins (follicle-stimulating hormone and luteinizing hormone). Most of these tumors show altered production of gonadotropins and their subunits (the p-FSH, a and, less frequently, p-LH subunits). The thyrotropin-releasing hormone (TRH) stimulation test could differentiate these tumors from nonfunctioning tumors. Equally, this test could be able to distinguish between postsurgical changes and tumoral remnants after surgery.
Subjects and methodWe studied 24 patients with pituitary macroadenoma, 14 of who had a histological diagnosis of gonadotroph adenoma. The TRH stimulation test was performed before and after surgery.
ResultsBoth before and after surgery, a positive result to the TRH test was obtained in 50% of gonadotropinomas. Magnetic resonance imaging (MRI) performed after surgery revealed that 83% of the patients with gonadotropinoma had signs of tumoral persistence or recurrence and/or postsurgical changes. Of these patients, 83% (41.6% of the total) showed positive a subunit stimulation after the TRH test. In the group of non-gonadotropinoma macroadenomas, only 33% had a positive result before surgery and another 33% had a positive result after surgery. In the MRI performed after surgery, all showed tumoral persistence/recurrence or postsurgical inflammatory changes.
ConclusionsThis test could be useful in the differential diagnosis of gonadotropinomas as well as in the follow-upand postsurgical evaluation of these tumors.
Los gonadotropinomas son tumores originados en las células gonadotropas de la hipófisis anterior causales de la síntesis y la secreción de gonadotrofinas (folitropina [FSH] y lutropina [LH]). No hay diferencias entre sexos, y se diagnostican principalmente en la quinta década de la vida1. Según criterios clásicos de clasificación, estos tumores no representaban más que un 2-3% de todos los adenomas hipofisarios; en la mayoría de los casos se comportan como no funcionantes2,3. En la actualidad, gracias a la incorporación de nuevas técnicas (inmunohistoquímica, microscopia electrónica) se ha demostrado que son mucho más prevalentes. Constituyen un 20-30% de todos los tumores hipofisarios, con una incidencia anual de 3–5 casos nuevos por millón de habitantes4. Se considera que un alto porcentaje (mayor del 75%) de los adenomas hipofisarios no funcionantes en realidad sintetizan y secretan, in vitro e in vivo, gonadotropinas intactas o subunidades constituyentes (alfa o beta) y deben ser considerados gonadotropinomas5,6. Las gonadotropinas son heterodímeros constituidos por dos subunidades, alfa y beta, unidas de forma no covalente. La subunidad alfa es común a FSH y LH, mientras que la subunidad beta confiere a cada hormona su especificidad biológica e inmunológica. La FSH intacta es la más secretada, seguida en frecuencia por la (3-FSH, la subunidad alfa y la (3-LH. La hipersecreción aislada de LH intacta es rara7. La escasa capacidad secretora o la producción sólo de fragmentos hormonales inactivos explica su pobre repercusión clínica desde el punto de vista endocrinológico.
El diagnóstico prequirúrgico de los gonadotropinomas es difícil si se determinan sólo las concentraciones basales de gonadotropinas o sus subunidades, ya que suelen presentar una secreción ineficaz y variable de estas hormonas. Los gonadotropinomas muestran una respuesta paradójica al estímulo con protirrelina (TRH), con liberación de FSH, LH o subunidades alfa o beta. Dicha respuesta puede ser útil para diferenciar los adenomas gonadotropos de otras masas intraselares, especialmente de los adenomas verdaderamente no funcionantes2,8-10.
El objetivo del estudio fue analizar la respuesta de la subunidad alfa de las gonadotropinas al estímulo con TRH en macroadenomas productores de gonadotropinas antes y después de la intervención quirúrgica, y determinar la utilidad de estos parámetros como marcadores de recidiva y/o persistencia de enfermedad tras la cirugía.
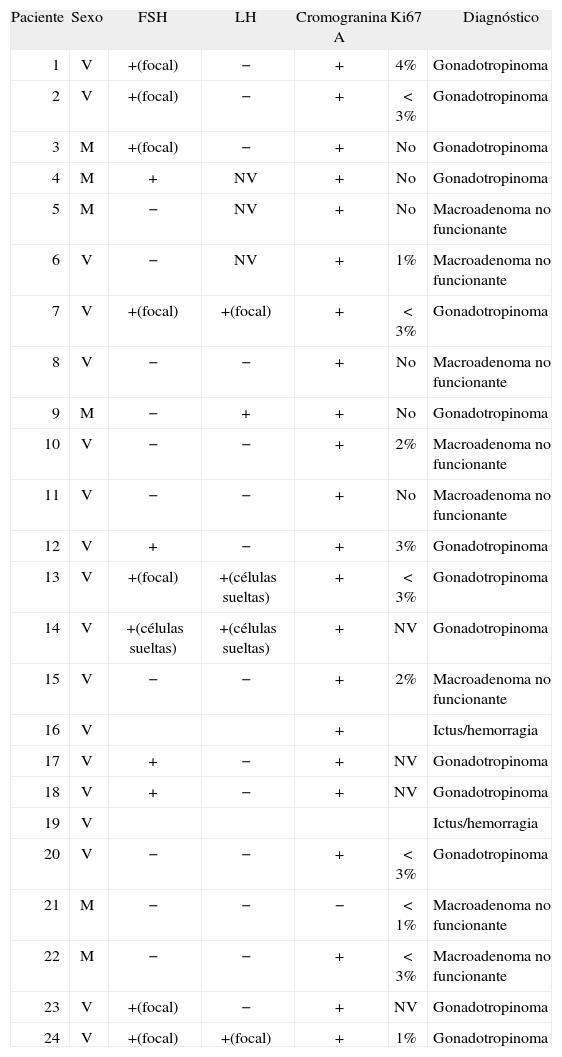
MATERIAL Y MÉTODOSe estudió a 24 pacientes intervenidos en nuestro centro, en el período 2002–2005, de macrodenoma hipofisario. Con criterios histológicos, se diagnosticó de gonadotropinoma a 14 (58,3%) pacientes; macrodenoma hipofisario no funcionante, a 8 (33,3%), y hemorragia/necrosis hipofisaria, a 2 (8,3%). Se practicaron técnicas de inmunohistoquímica de todas las hormonas hipofisarias, así como la cromogranina A, a todas las piezas quirúrgicas, al igual que en una serie previa11 (tabla 1). La distribución fue: 18 varones y 6 mujeres, con una media de edad de 56 (intervalo, 30–80) años. La clínica de presentación consistió en: pérdida visual en 11 (45,8%) pacientes, amenorrea en 1 (4,1%), impotencia en 4 (16,6%) y cefalea en 8 (33,4%), en 2 de éstos, en forma de apoplejía hipofisaria (tabla 2).
Características histológicas y diagnóstico anatomopatológico
| Paciente | Sexo | FSH | LH | Cromogranina A | Ki67 | Diagnóstico |
| 1 | V | +(focal) | − | + | 4% | Gonadotropinoma |
| 2 | V | +(focal) | − | + | < 3% | Gonadotropinoma |
| 3 | M | +(focal) | − | + | No | Gonadotropinoma |
| 4 | M | + | NV | + | No | Gonadotropinoma |
| 5 | M | − | NV | + | No | Macroadenoma no funcionante |
| 6 | V | − | NV | + | 1% | Macroadenoma no funcionante |
| 7 | V | +(focal) | +(focal) | + | < 3% | Gonadotropinoma |
| 8 | V | − | − | + | No | Macroadenoma no funcionante |
| 9 | M | − | + | + | No | Gonadotropinoma |
| 10 | V | − | − | + | 2% | Macroadenoma no funcionante |
| 11 | V | − | − | + | No | Macroadenoma no funcionante |
| 12 | V | + | − | + | 3% | Gonadotropinoma |
| 13 | V | +(focal) | +(células sueltas) | + | < 3% | Gonadotropinoma |
| 14 | V | +(células sueltas) | +(células sueltas) | + | NV | Gonadotropinoma |
| 15 | V | − | − | + | 2% | Macroadenoma no funcionante |
| 16 | V | + | Ictus/hemorragia | |||
| 17 | V | + | − | + | NV | Gonadotropinoma |
| 18 | V | + | − | + | NV | Gonadotropinoma |
| 19 | V | Ictus/hemorragia | ||||
| 20 | V | − | − | + | < 3% | Gonadotropinoma |
| 21 | M | − | − | − | < 1% | Macroadenoma no funcionante |
| 22 | M | − | − | + | < 3% | Macroadenoma no funcionante |
| 23 | V | +(focal) | − | + | NV | Gonadotropinoma |
| 24 | V | +(focal) | +(focal) | + | 1% | Gonadotropinoma |
FSH: folitropina; LH: lutropina; M: mujer; No: no valorado; NV: no valorable; V: varón.Criterios de diagnóstico histológico basados en la inmunorreactividad positiva para cromogranina A: macroadenoma no funcionante e inmunorreactividad positiva para cromogranina A y para FSH y/o LH.
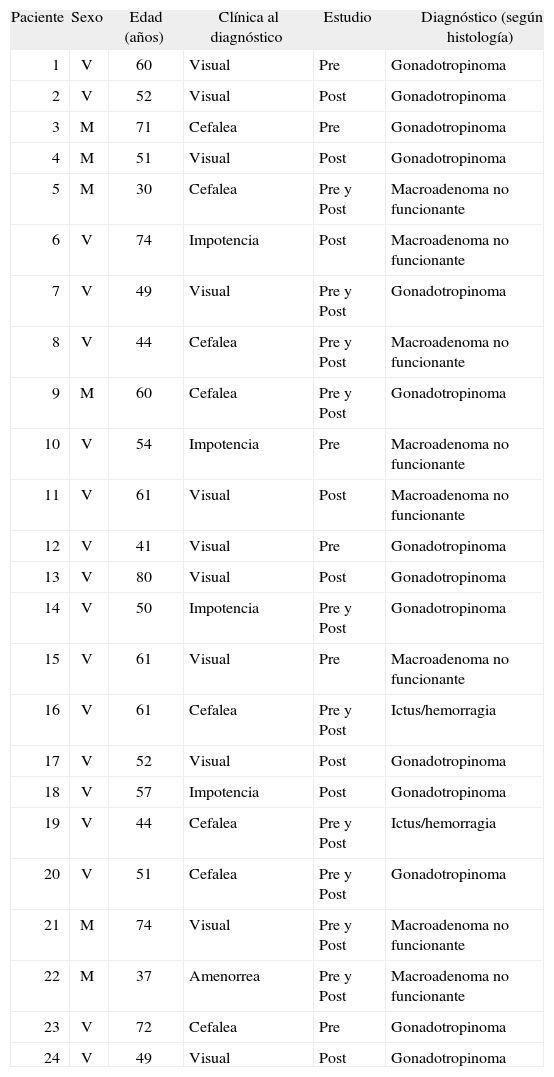
Características clínicas, diagnóstico y momento de realización del estudio
| Paciente | Sexo | Edad (años) | Clínica al diagnóstico | Estudio | Diagnóstico (según histología) |
| 1 | V | 60 | Visual | Pre | Gonadotropinoma |
| 2 | V | 52 | Visual | Post | Gonadotropinoma |
| 3 | M | 71 | Cefalea | Pre | Gonadotropinoma |
| 4 | M | 51 | Visual | Post | Gonadotropinoma |
| 5 | M | 30 | Cefalea | Pre y Post | Macroadenoma no funcionante |
| 6 | V | 74 | Impotencia | Post | Macroadenoma no funcionante |
| 7 | V | 49 | Visual | Pre y Post | Gonadotropinoma |
| 8 | V | 44 | Cefalea | Pre y Post | Macroadenoma no funcionante |
| 9 | M | 60 | Cefalea | Pre y Post | Gonadotropinoma |
| 10 | V | 54 | Impotencia | Pre | Macroadenoma no funcionante |
| 11 | V | 61 | Visual | Post | Macroadenoma no funcionante |
| 12 | V | 41 | Visual | Pre | Gonadotropinoma |
| 13 | V | 80 | Visual | Post | Gonadotropinoma |
| 14 | V | 50 | Impotencia | Pre y Post | Gonadotropinoma |
| 15 | V | 61 | Visual | Pre | Macroadenoma no funcionante |
| 16 | V | 61 | Cefalea | Pre y Post | Ictus/hemorragia |
| 17 | V | 52 | Visual | Post | Gonadotropinoma |
| 18 | V | 57 | Impotencia | Post | Gonadotropinoma |
| 19 | V | 44 | Cefalea | Pre y Post | Ictus/hemorragia |
| 20 | V | 51 | Cefalea | Pre y Post | Gonadotropinoma |
| 21 | M | 74 | Visual | Pre y Post | Macroadenoma no funcionante |
| 22 | M | 37 | Amenorrea | Pre y Post | Macroadenoma no funcionante |
| 23 | V | 72 | Cefalea | Pre | Gonadotropinoma |
| 24 | V | 49 | Visual | Post | Gonadotropinoma |
Post: posquirúrgico; Pre: prequirúrgico; M: mujer; V: varón.
A todos los pacientes se les hizo un estudio de la función hipofisaria antes de la cirugía para objetivar y tratar los déficit hormonales. Dicho estudio consistió en la determinación basal de las hormonas hipofisarias (prolactina, somatotropina [GH], factor de crecimiento similar a la insulina tipo 1 [IGF-I], tirotropina [TSH], LH, FSH y estradiol o testosterona). Se realizaron pruebas dinámicas, como la hipoglucemia insulínica, en los pacientes que no tenían contraindicación o estímulo con corticotropina (ACTH) para el estudio del cortisol sérico. Para constatar hipogonadismo se practicó la prueba de gonadorrelina (Gn-RH) y restricción hídrica si se sospechaba la posibilidad de diabetes insípida. A los pacientes que referían clínica visual o presentaban compresión quiasmática en la resonancia magnética (RM) se les realizó estudio campimétrico.
A todos los pacientes se les practicó RM antes y a los 6- 12 meses después de la intervención. Las imágenes previas a la cirugía mostraban macroadenomas con tamaños entre 13 y 45mm de diámetro máximo (mediana, 23mm). Se les sometió a cirugía vía transesfenoidal salvo a 2 en los que se realizó por craneotomía transfrontal.
A 10 pacientes (6 gonadotropinomas diagnosticados por criterios histológicos) se les realizó la prueba de TRH-subunidad alfa antes y después de la intervención quirúrgica. A 6 pacientes (4 gonadotropinomas) se les realizó la prueba sólo antes de la cirugía y a 8, sólo tras la cirugía (6 gonadotropinomas). En resumen, se realizó estímulo con TRH, tanto antes como después de la cirugía, a 6 pacientes con gonadotropinomas.
MétodoSe determinaron las concentraciones séricas de gonadotropinas y subunidad alfa en los tiempos: -90, -60, -30, basal, 30, 60 y 90min; en el momento basal se administró 400μg de TRH intravenoso (TRH-PREM, Novartis, Basel, Suiza).
Para cuantificar las concentraciones séricas de la subunidad alfa se utilizó un método de radioinmunoanálisis competitivo con anticuerpos monoclonales antisubunidad alfa. El método es trazable al material de referencia de la Organización Mundial de la Salud (OMS), IRP 75/569. El sistema de medida empleado es el contador de escintilación (radiaciones gamma) DRG Instrument, (ref. BM 1052). El límite de detección es 0,05 U/l. El intervalo de medida es 0,1-10 U/l. Los límites de referencia en varones de menos de 50 años son 0,05-0,8 U/l y en mayores de 50 años, de 0,3-1,8 U/l; los límites de referencia en mujeres son 0,05-1,1 U/l; en posmenopáusicas, 0,05-3,9 U/l.
En la determinación de las concentraciones séricas de FSH se empleó un enzimoinmunoanálisis quimioluminiscente no competitivo en fase sólida estandarizado con el patrón internacional IRP 78/549 de la OMS. El sistema de medida utilizado es el analizador Immulite 2000 ( Diagnostic Products DPC, Los Angeles, Estados Unidos). El límite de detección es 1 U/l y el intervalo de medida es entre 1 y 170 U/l. Los límites de referencia en varones son 1,9-11,3 U/l; en mujeres en fase folicular los límites son 3,0-11,6 U/l; en fase lútea, 1,7-10,6 U/l, y posmenopáusicas, 19,3-106 U/l.
Para cuantificar las concentraciones séricas de LH se utilizó un enzimoinmunoanálisis quimioluminiscente no competitivo en fase sólida estandarizado con los patrones internacionales IRP 68/40 e IS 80/552 de la OMS. El sistema de medida es el analizador Immulite 2000 (Diagnostic Products DPC, Los Angeles, Estados Unidos). El límite de detección es 1 U/l y el intervalo de medida es entre 1 y 200 U/l. Los límites de referencia en varones son 1,5-6,8 U/l; en mujeres en fase folicular los límites son 3–13 U/l; en fase lútea, 2–13 U/l, y en posmenopáusicas, 6,7-50 U/l.
Criterios de interpretaciónComo valores de referencia de la respuesta de la subunidad alfa y gonadotropinas después del estímulo con TRH se tomaron los criterios de Daneshdoost et al8: respuesta normal en varones incremento inferior al 33% del valor basal y en mujeres incremento nulo.
Respuesta en gonadotropinomas: varones incremento de la subunidad alfa≥75%; FSH, ≥ 25%, y LH, ≥ 60%; en mujeres (premenopáusicas y posmenopáusicas) incremento de la subunidad alfa, ≥ 50%; FSH, ≥ 90%, y LH, ≥ 75% respecto al valor basal.
Los resultados analíticos se expresan como media y error estándar de la media.
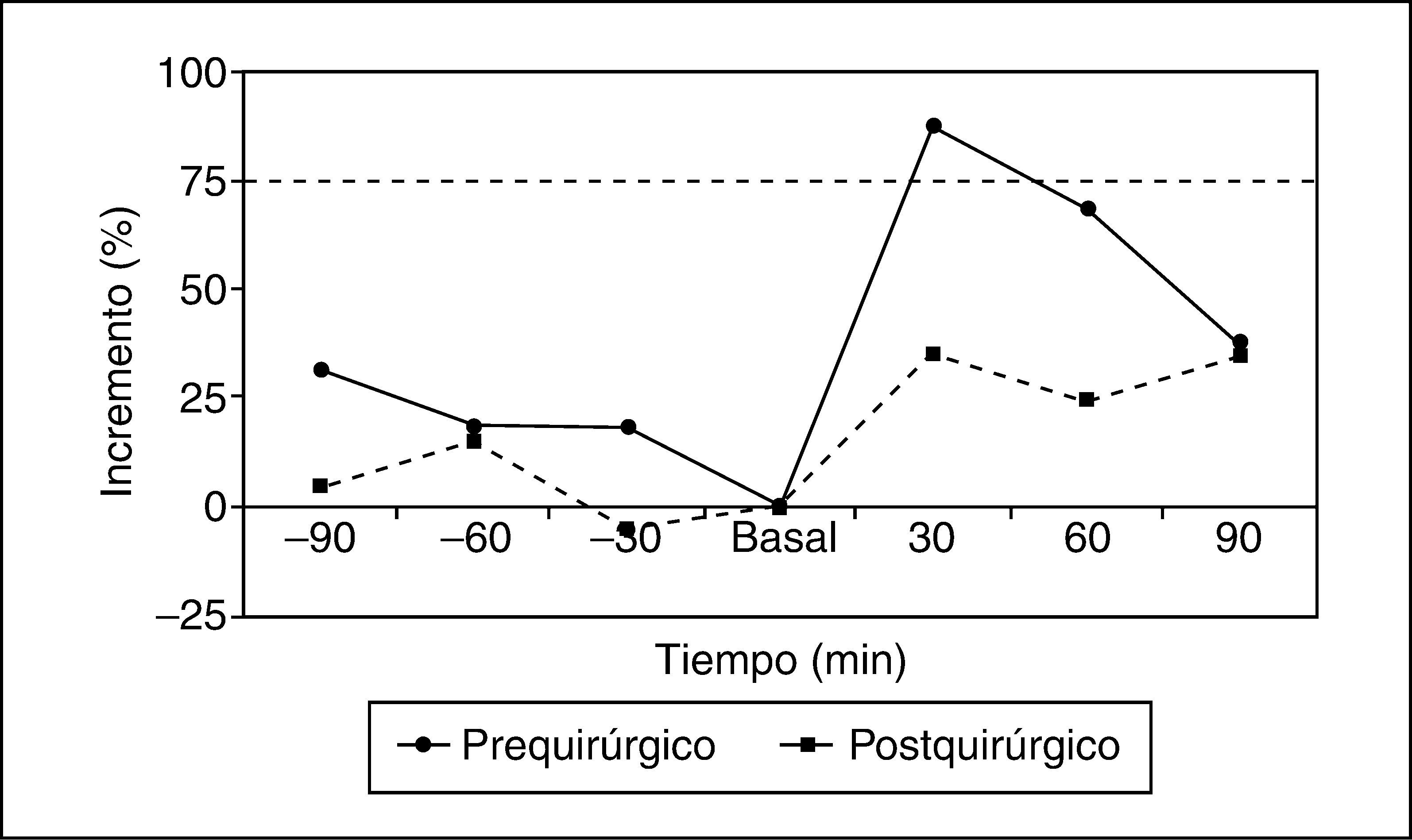
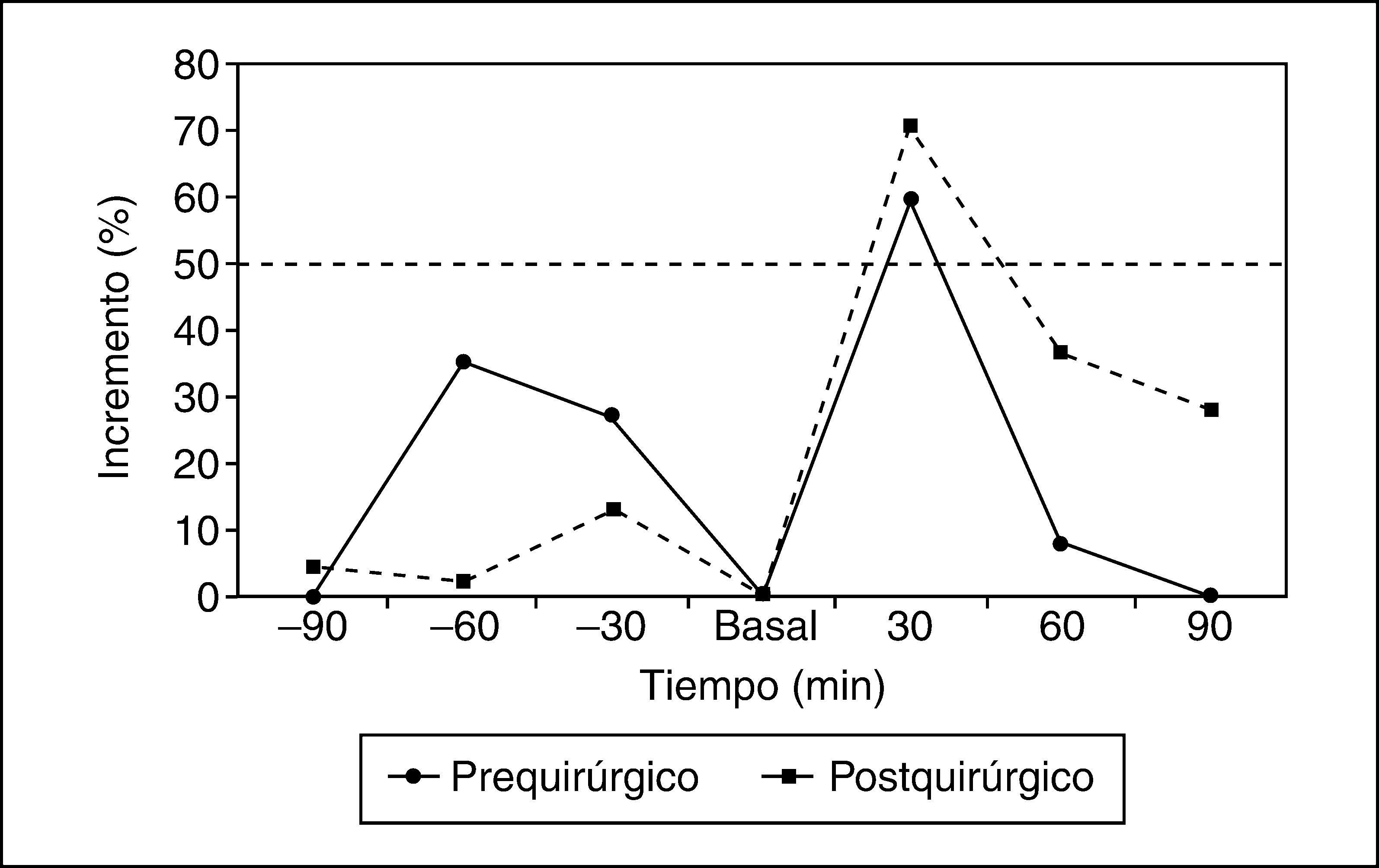
RESULTADOSEn el estudio prequirúrgico del grupo de pacientes con gonadotropinoma la respuesta de la subunidad alfa fue positiva en 5 (50%) pacientes (basal, 0,35±0,17; minuto 30, 0,60±0,33 U/l). La respuesta de la LH fue positiva en 4 (40%) y la FSH fue positiva en 2 (20%).
En el grupo de macroadenomas hipofisarios no gonadotropinomas, sólo 2 (33%) pacientes tuvieron una respuesta positiva de la subunidad alfa (basal, 0,042±0,008; minuto 30, 0,175±0,045 U/l). La respuesta de la LH fue positiva en 1 (31%) y la FSH no fue positiva en ningún paciente.
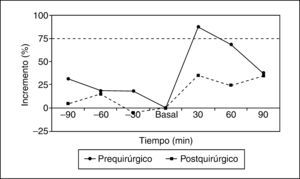
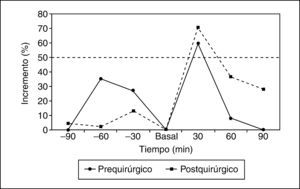
En los pacientes con gonadotropinoma evaluados después de la intervención (n=12), la respuesta de la subunidad alfa fue positiva en 6 (50%) pacientes (basal, 0,133±0,069; minuto 30, 0,260±0,113 U/l). Respecto a la LH y la FSH, la respuesta fue positiva en 5 (42%) y 1 (8%). En la RM practicada después de la cirugía a este grupo, 10 (83%) pacientes mostraban cambios posquirúrgicos y/o persistencia tumoral, de éstos, 5 (41,6%) tuvieron respuesta positiva al estímulo con TRH para la subunidad alfa (figs. 1 y 2).
Tras la cirugía, 2 (33%) pacientes del grupo de macroadenomas no gonadotropinomas tuvieron respuesta de la subunidad alfa al estímulo con TRH (basal, 0,044±0,006; minuto 30, 0,127±0,043 U/l). Respecto a la LH, la respuesta fue positiva en 2 (33%) y ninguno a la FSH. En la RM practicada después de la cirugía todos los pacientes mostraban signos radiológicos compatibles con cambios inflamatorios posquirurgicos o signos de persistencia y/o recidiva tumoral, 2 de ellos tuvieron respuesta positiva al estímulo con TRH para la subunidad alfa.
De los 6 pacientes con gonadotropinoma estudiados antes y después de la cirugía, en 2 la respuesta de la subunidad alfa fue positiva en ambos momentos, en uno la respuesta fue positiva sólo en el estudio prequirúrgico y en otros 2 la respuesta fue positiva sólo en el estudio posquirúrgico (los 2 presentaron apoplejía hipofisaria en el momento del diagnóstico lo que podría explicar la falta de respuesta en el estudio prequirúrgico), y en un paciente la respuesta fue negativa antes y después de la cirugía (tabla 3).
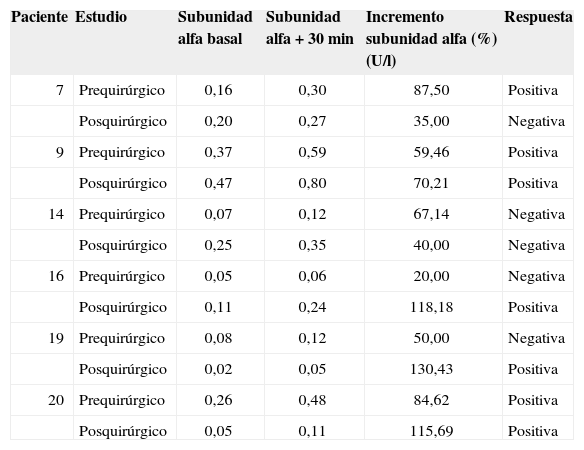
Incremento de la subunidad alfa (%) tras estímulo con TRH en los pacientes con gonadotropinoma antes y después de la cirugía
| Paciente | Estudio | Subunidad alfa basal | Subunidad alfa +30min | Incremento subunidad alfa (%) (U/l) | Respuesta |
| 7 | Prequirúrgico | 0,16 | 0,30 | 87,50 | Positiva |
| Posquirúrgico | 0,20 | 0,27 | 35,00 | Negativa | |
| 9 | Prequirúrgico | 0,37 | 0,59 | 59,46 | Positiva |
| Posquirúrgico | 0,47 | 0,80 | 70,21 | Positiva | |
| 14 | Prequirúrgico | 0,07 | 0,12 | 67,14 | Negativa |
| Posquirúrgico | 0,25 | 0,35 | 40,00 | Negativa | |
| 16 | Prequirúrgico | 0,05 | 0,06 | 20,00 | Negativa |
| Posquirúrgico | 0,11 | 0,24 | 118,18 | Positiva | |
| 19 | Prequirúrgico | 0,08 | 0,12 | 50,00 | Negativa |
| Posquirúrgico | 0,02 | 0,05 | 130,43 | Positiva | |
| 20 | Prequirúrgico | 0,26 | 0,48 | 84,62 | Positiva |
| Posquirúrgico | 0,05 | 0,11 | 115,69 | Positiva |
Las limitaciones de nuestro estudio han sido el escaso número de pacientes y no haber realizado el estudio
Los adenomas de células gonadotropas generalmente no producen síndrome clínico derivado de un exceso de gonadotropinas8. En los pocos casos de hiperproducción de FSH, hay alteraciones de la función gonadal (aumento de volumen de los testículos, amenorrea) y en los casos excepcionales que cursan con aumento de LH intacta puede ocurrir una pubertad precoz. Este hecho dificulta su reconocimiento y facilita su crecimiento y expansión extraselar. Al diagnóstico, suelen ser macroadenomas, y a menudo los pacientes presentan signos y síntomas secundarios al efecto masa, que incluyen cefalea de características inespecíficas y defectos campimétricos visuales por compresión quiasmática (hallazgo más común, hasta en un 70%)2. Menos frecuentemente presentan parálisis de nervios craneales (diplopía y oftalmoplejía), síndrome del seno cavernoso o apoplejía hipofisaria. La compresión local de otros grupos celulares adenohipofisarios puede dar lugar a hipopituitarismo parcial (déficit de GH, hipogonadismo, hipotiroidismo) o panhipopituitarismo9. La compresión y la interrupción del tallo hipofisario determinan la aparición de hiperprolactinemia que contribuye, conjuntamente con la deficiencia de gonadotropinas, al desarrollo de hipogonadismo.
En la mayor parte de los casos las manifestaciones neurológicas dominan el cuadro clínico sobre las propiamente hormonales. Ocasionalmente, se detectan microadenomas gonadotropos como incidentalomas hipofisarios en las técnicas de imagen realizadas por otras razones. Sin embargo, los estudios de seguimiento a medio plazo han demostrado su escasa tendencia a experimentar un crecimiento significativo12.
Aunque la mayoría de los gonadotropinomas son capaces de producir gonadotropinas intactas o sus subunidades in vitro, las mínimas cantidades secretadas habitualmente hacen que no sea posible detectar elevaciones de éstas en sangre periférica. Este hecho dificulta notablemente el diagnóstico preoperatorio, ya que los nuevos métodos de identificación (inmunohistoquímica, cultivo celular o estudios ultraestructurales, etc.) sólo son aplicables al tejido tumoral una vez extirpado. En general, la elevación en suero de la β-FSH es la más comúnmente detectada, seguida en frecuencia por FSH intacta y subunidad alfa13. El incremento aislado de LH o β-LH es más raro. En un reciente estudio14 realizado sobre 38 pacientes afectos de macroadenoma no funcionante la razón LH/FSH fue 0,33.
En los años setenta se objetivó la elevación de gonadotrofinas sin deberse a hipogonadismo primario en varones con macroadenomas hipofisarios15-17. Diez años después también se describió este cuadro en mujeres con macroadenoma hipofisario no menopáusicas y sin fallo ovárico precoz18.
Con el objetivo de conseguir una prueba diagnóstica prequirúrgica se realizaron distintos estímulos con hormonas hipotalámicas, como Gn-RH, e hipofisarias, como ACTH y TRH19. Fue en los años noventa cuando Daneshdoost et al6,8 comprobaron que los gonadotropinomas muestran una respuesta paradójica al estímulo con TRH, con liberación de FSH, LH o subunidades alfa o beta.
Dado que la secreción de gonadotropinas es pulsátil, y para evitar errores en la interpretación de la elevación de las concentraciones de gonadotropinas tras el estímulo, se realizaron determinaciones cada 15 o 30min durante 90–120min antes y después del estímulo. Algunos estudios, como los de Daneshdoost et al6,8, comprueban que, cuando se evalúa β-LH tras TRH, la capacidad discriminadora de la prueba es mayor en mujeres que en varones (el 68,7 frente al 36,8% de sensibilidad). La determinación de β-LH tras el estímulo con TRH resulta altamente específica, ya que no se produce en otros adenomas hipofisarios ni en individuos normales, pero la complejidad técnica y su coste limita su determinación a unos pocos laboratorios. La elevación paradójica de las concentraciones de gonadotropinas o sus subunidades tras la infusión de TRH puede ser útil para diferenciar los adenomas gonadotropos de otras masas intraselares, especialmente adenomas no funcionantes.
El tema no está totalmente esclarecido y el uso de la prueba de TRH subunidad alfa no se ha extendido de forma sistemática en la evaluación de los macroadenomas hipofisarios ya que es una prueba de larga duración y con cierta dificultad en la interpretación de los resultados en una afección poco frecuente en la práctica diaria. Además de las implicaciones diagnósticas antes de la cirugía, podría tener importancia en la evaluación y el manejo postoperatorio (diagnóstico diferencial entre restos tumorales y cambios posquirúrgicos).
Nuestro estudio, a pesar del tamaño reducido de la muestra, presenta una sensibilidad de la respuesta de la subunidad alfa del 50% en el grupo de gonadotropinomas, comparable a la obtenida en otros estudios realizados con un mayor número de pacientes y que oscila entre un 26,6 y un 52,4%20,21. La especificidad obtenida fue del 66,6%, también equiparable a la objetivada en estudios anteriores (entre un 68,1 y un 75%). Se ha descrito respuesta de la subunidad alfa tras el estímulo con TRH en controles con adenoma hipofisario productor de GH y controles con otros tumores en la región pituitaria (cordomas, craneofaringiomas, etc.)20,22-24. No está claro que la respuesta de la subunidad alfa se origine en las células gonadotropas o en otras líneas celulares. Una explicación podría ser la cosecreción con TSH, aunque no se ha demostrado relación entre ambas respuestas. Algunos autores postulan que el incremento de subunidad alfa tras el estímulo tiene valor diagnóstico de origen gonadotropo sólo en hipopituitarismo21.
prequirúrgico a un porcentaje no desdeñable de éstos, por lo que no se conoce si la respuesta paradójica al estímulo con TRH ya estaba antes de la intervención en este grupo. El seguimiento en el tiempo y la evolución, junto con la pruebas de imagen, nos ayudarán a discernir si la determinación de las concentraciones séricas de las gonadotropinas o de sus subunidades (principalmente la subunidad alfa) puede ser útil para el seguimiento posquirúrgico de los gonadotropinomas y si dicha prueba es un buen indicador de persistencia y/o recidiva tumoral cuando las pruebas de imagen no son concluyentes.